Способ оценки повышенного риска возникновения флеботромбозов у пациентов с ишемической болезнью сердца
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к кардиологии, терапии и анестезиологии, и может быть использовано для оценки повышенного риска возникновения флеботромбозов у пациентов с ишемической болезнью сердца (ИБС). Способ включает определение реологических характеристик венозной крови после венозной окклюзии, причем, определяют показатели цельной нестабилизированной венозной крови дважды - до и после однократной венозной окклюзии с помощью низкочастотной пьезоэластографии: t1 - период реакции, представляющий время от начала исследования до достижения максимального снижения амплитуды - А1, в мин; t2 - время достижения амплитуды А2, в мин; t3 - показатель, отображающий время свертывания крови, в мин, определяемый автоматически, при изменении tg угла кривой на 60%; МА максимальную амплитуду, показатель, характеризующий окончание процесса образования поперечно-сшитого фибринового сгустка, подвергнувшегося ретракции, A1-max - снижение амплитуды за время «t1» - период реакции, о.е.; А6 - значение амплитуды через 10 минут после достижения максимальной амплитуды, о.е. Далее рассчитывают константу тромбиновой активности КТА по формуле: КTA=100/(t2-t1), а также интенсивность ретракции и лизиса сгустка ИРЛС по формуле: ИРЛС=[МА-(А6-А1)/100]*100%. При повышении КТА на 20% и более, снижении t3 на 30% и более и отсутствии изменения или снижении ИРЛС, диагностируют повышенный риск возникновения флеботромбозов. Использование изобретения позволяет повысить точность и информативность при снижении травматичности исследования. 5 ил., 3 табл., 4 пр.
Реферат
Изобретение относится к области медицины, а именно к кардиологии, терапии и анестезиологии, и может быть использовано для оценки повышенного риска возникновения флеботромбозов у пациентов с ишемической болезнью сердца (ИБС).
Среди причин смертности населения лидирующую позицию занимает смертность от болезней системы кровообращения - 49,9%. Столь высокий уровень смертности, преимущественно обусловленный развитием тромботических осложнений, является показателем необходимости развития и совершенствования профилактики тромбоопасности - состояния системы свертывания крови, сопровождающегося длительной тромбинемией, при которой противосвертывающая активность крови не обеспечивает адекватную реакцию гемостатического потенциала при любой экзо-, эндо- и ятрогенной агрессии [Тютрин И.И., Удут В.В., 2004 г.]. Данное состояние приводит к развитию тромбоза, реализующегося через триаду Вирхова (состояние гиперкоагуляции, замедление или нарушение тока крови, повреждение стенки сосуда), включающую в себя основные факторы тромбогенного риска [Савельев B.C., Гологорский В.А., Кириенко А.И. и др., 2001].
Тромбофилия представляет собой патологическое состояние, вызванное комбинацией постоянных и/или временных факторов риска, реализованных развитием тромбоза (тромбозов), объективные сведения о котором (которых) могут быть получены в настоящий момент или по данным индивидуального анамнеза [Момот А.П., 2014]. По своей этиологии все тромбофилии подразделяются на две группы: первичные тромбофилии, генетически детерминированные, по сути, представляющие собой увеличение риска развития тромботических осложнений, и вторичные, являющиеся следствием течения других заболеваний или патологических состояний. Врожденные тромбофилии обусловлены нарушением тромбоцитарного гемостаза, дефицитом и/или нарушением синтеза физиологических антикоагулянтов, аномалиями плазменных факторов свертывания или дефектами фибринолитической системы (мутационные изменения: гена V фактора свертывания крови - Лейденовская мутация, генов протеинов С и S, гена протромбина G 20210А, наследственная гипергомоцистеинемия, дефицит антитромбина III) [Данилов И.П., Змачинский В.А., Цвирко Д.Г., Дашкевич Э.В., 2010]. Возникновение приобретенных форм тромбофилии связывают с проведением ятрогенных вмешательств, возникновением метаболических нарушений, активацией аутоиммунных и инфекционно-иммунных механизмов и др. Помимо этого, состояние беременности, длительная иммобилизация, инфаркты миокарда и мозговые инсульты так же приводят к возникновению временного тромбофилического состояния.
Одним из триггеров, запускающих процесс тромбообразования, является гипоксия [Биленко М.В., Ладыгина В.Г., Федосова С.В., 1999; Антонова О.А., Локтионова С.А., Романов Ю.А. и др., 2009; Хайбуллина З.Р., 2012].
Как известно, при возникновении ишемии происходит дисрегуляция работы митохондрий, обусловленная разобщением процессов окислительного фосфорилирования, результатом которой является снижение синтеза АТФ. Возникающее вследствие этого нарушение энергозависимого транспорта ионов через клеточную мембрану приводит к переходу внутриклеточных ионов кальция из депонированного состояния в свободное. В результате происходит нарастание продукции свободных радикалов и активация липопероксидации в клетках эндотелия [Чеснокова Н.П., Понукалина Е.В., Бизенкова М.Н., 2006; Попков В.М., Чеснокова Н.П., Ледванов М.Ю., 2012]. Все это приводит к повреждению эндотелиальной выстилки и запуску процессов коагуляции.
В физиологическом состоянии увеличение свертывающей активности крови сопровождается повышением активности противосвертывающей системы, по степени активности которой можно составить представление об атромбогенном потенциале эндотелия. Обеспечение данной функции происходит за счет антитромбической активности эндотелия, реализуемой за счет выработки антиагрегантов (NO, простациклин, тромбомодулин), антикоагулянтов (антитромбин III, протеины С и S). Тромбоопасность возникает при недостаточности активации эндотелием противосвертывающей и фибринолитической активности, что может быть обусловлено истощением метаболической активности эндотелиоцитов, происходящей при длительно текущем изменении гемостатического потенциала в прокоагулянтную сторону [Лупинская З.А., Зарифьян А.Г., Гурович Т.Ц., Шлейфер С.Г., 2008].
На данный момент существуют методы выявления врожденных предтромботических состояний (первичных тромбофилий). Данная группа методов основывается преимущественно на проведении генетического анализа полиморфизмов факторов свертывания и других составляющих процесса гемокоагуляции и фибринолиза. Однако данная стратификация способна обнаружить только наличие перманентного, генетически обусловленного, фактора риска, не отображая тромбоопасность, которая зачастую имеет мультифакториальное происхождение.
Так же, существует группа методов, выявляющая гиперкоагуляционную активность крови (вторичные тромбофилии), среди которых наиболее распространены клоттинговые методы (ПТВ, АЧТВ, определение уровней плазменного фибриногена и Д-димера), главным недостатком которых является сам субстрат исследования - цитратная кровь, не имеющая в своем составе форменных элементов крови. Помимо этого недостатками данной группы является отсутствие стандартизации и информативность только в отношении коагуляционного звена гемостаза, вследствие чего целостная оценка фибриногенеза не представляется возможной, так как активность эндотелия сосудов не учитывается.
Известна третья группа методов, при которой производится оценка реакции системы гемостаза на моделировании состояния тромбоопасности (триады Вирхова).
Наиболее близким к предлагаемому является способ определения тромбоопасности путем определения фибринолитической активности плазмы крови до и после проведения пробы с локальной гипоксией, поэтому он был выбран в качестве прототипа. Суть данного способа состоит в определении фибринолитической активности плазмы крови до и после обтурации вены верхней конечности, причем, обтурацию проводят в течение 5-6 мин дважды с 3-5-минутным интервалом (патент РФ №1110444, опубл 30.08.1984). Оценку проводят до и после проведения двукратной венозной окклюзии путем определения показателей тромбоэластограммы: время реакции r время образования сгустка (k), тромбоэластическую константу использования протромбина (r/k), константу коагуляции (r+k) в мин, константу свертывания крови (t), угловую константу α в градусах, максимальную амплитуду МА в мм, тромбоэластический индекс 1=r+k/MA, угол β, образованный сходящейся ветвью тромбоэластограммы и касательной к точке МА ветви ТЭГ, и при уменьшении r на 1,8±0,35 мин, k на 0,8±0,054 мин, t на 3,4±1,7 мин, j на 0,5±0,056, увеличении ∠α на 3,6±1,5°, ∠β на 17,8±2,4°, то проба оценивают как отрицательную. При изменении r на 0,25±1,1 мин., k на 0,1±1,72 мин., ∠α на 4,3±1,73°, j на 0,12±0,42, увеличении t на 6,6±1,95 мин, МА на 3,4±1,44 мм, уменьшении на ∠β 5,3±1,8°, то пробу оценивают, как положительную, а пациент считается тромбоопасным.
Однако данный способ имеет ряд недостатков, среди которых: травматизация стенки сосуда из-за неоднократного забора венозной крови, отсутствие объективных критериев проведения ишемической пробы, недостаточная информативность, отсутствие возможности оценки эндотелиального и антикоагулянтного звена гемостаза, необходимости проведения двукратной пробы с ишемией, что снижает возможность использования метода в клинической практике.
Новый технический результат - повышение точности и информативности способа при снижении травматизации.
Для получения нового технического результата в способе оценки повышенного риска возникновения флеботромбозов у пациентов с ишемической болезнью сердца, включающем определение реологических характеристик венозной крови после венозной окклюзии, причем, определяют показатели цельной нестабилизированной венозной крови дважды - до и после однократной венозной окклюзии с помощью низкочастотной пьезоэластографии: t1 - период реакции, представляющий время от начала исследования до достижения максимального снижения амплитуды – А1, в мин; t2 - время достижения амплитуды А2, в мин; t3 - показатель, отображающий время свертывания крови, в мин, определяемый автоматически, при изменении tg угла кривой на 60%; МА - максимальная амплитуда, показатель, характеризующий окончание процесса образования поперечно-сшитого фибринового сгустка, подвергнувшегося ретракции, A1-max снижение амплитуды за время «t1» - период реакции, о.е.; А6 - значение амплитуды через 10 минут после достижения максимальной амплитуды, о.е., далее, рассчитывают константу тромбиновой активности КТА по формуле:
КTA=100/(t2-t1),
а также интенсивность ретракции и лизиса сгустка ИРЛС по формуле:
ИРЛС=[МА-(А6-А1)/100]*100%
и при повышении КТА на 20% и более, снижении t3 на 30% и более, и отсутствии изменения или снижении ИРЛС, диагностируют повышенный риск возникновения флеботромбозов.
На фиг. 5 показана низкочастотная тромбоэластограмма, представляющая экстраполяцию показателей вязкостных характеристик крови в осях координат
T1 - период реакции - время от начала исследования до достижения максимального снижения амплитуды НПТЭГ – А1, в мин;
t2 - время достижения амплитуды А2 НПТЭГ, в мин;
t3 - показатель, отображающий время свертывания крови (точку желирования), в мин, определяемый автоматически, при изменении tg угла кривой на 60%;
МА - максимальная амплитуда, показатель, характеризующий окончание процесса образования поперечно-сшитого фибринового сгустка, подвергнувшегося ретракции,
А1-max - снижение амплитуды за время «t1» - период реакции, о.е.;
А6 - значение амплитуды НПТЭГ через 10 минут после достижения максимальной амплитуды, о.е.;
КТА - константа тромбиновой активности.
ИРЛС - интенсивность ретракции и лизиса сгустка, находящегося в исследуемом объеме крови.
Способ осуществляют следующим образом. У пациента из кубитальной вены, без наложения жгута, трехкомпонентным силиконированным шприцем, объемом 1 мл, производят забор цельной нестабилизированной венозной крови. В течение 10 секунд от момента забора, кровь помещают в разовую кювету, объемом 0,45 мл, находящуюся в термостате аппаратно-программного комплекса для клинико-диагностических исследований реологических свойств крови (АРП-01 М «Меднорд». Регистрационное свидетельство N ФСР 2010/09767 от 30 декабря 2010 года), и записывают низкочастотную пьезоэластограмму (НПТЭГ). С помощью программы ИКС-ГЕМО3 производят регистрацию показателей:
t1 - период реакции (время от начала исследования до достижения максимального снижения амплитуды – A1), в мин;
t2 - время достижения амплитуды А2, в мин;
t3 - показатель, отображающий время свертывания крови (точку желирования), в мин, определяемый автоматически, при изменении tg угла кривой на 60%;
МА - максимальная амплитуда, показатель характеризующий окончание процесса образования поперечно-сшитого фибринового сгустка, подвергнувшегося ретракции,
A1-max - снижение амплитуды за время «t1» - период реакции (в о.е.);
А6 - значения амплитуды через 10 минут после достижения максимальной амплитуды (в о.е.).
Далее рассчитывают КТА - константу тромбиновой активности, определяемую как время, прошедшее от конца периода реакции до увеличения значения амплитуды на 100 относительных единиц от минимального уровня амплитуды за период реакции (о.е.), по формуле КTA=100/(t2-t1);
После этого, рассчитывают ИРЛС - интенсивность ретракции и лизиса сгустка, показателя, определяемого как процент уменьшения величины амплитуды сгустка в течение 10 мин после достижения МА (%), по формуле ИРЛС=[МА-(А6-А1)/100]*100%.
Далее производят моделирование триады Вирхова при помощи пробы с локальной ишемией.
Выполнение пробы проводят путем наложения на верхнюю часть плеча манжеты сфигмоманометра, с уровнем нагнетаемого давления на 20 мм рт.ст., превышающим систолическое, в течение пяти минут. После этого производят повторный забор цельной нестабилизированной венозной крови, манжета распускается. Далее, осуществляют повторную регистрацию и расчет показателей согласно предлагаемому способу, и при повышении КТА на 20% и более, снижении t3 на 30% и более и отсутствии изменения или снижения ИРЛС, диагностируют повышенный риск возникновения флеботромбозов.
Способ основан на результатах анализа данных клинических исследований пациентов с верифицированным диагнозом ИБС (n=20) и пациентов с ИБС, имеющим в анамнезе ПТФБ (n=20) при наличии информированного согласия. Была проведена сравнительная оценка динамики изменения показателей «t3», «КТА», «ИРЛС», «РАI-1», «t-РА», «Д-димера», «sVCAM», «рН», «sO2», «O2Нb». Определение PAI-1, t-PA, Д-димера и sVCAM производилась методом ИФА на анализаторе Erba LisaScan ЕМ (Erba Lachema, Чехия) с использованием тест-систем ELISA. Определение параметров КЩС рН, sO2, O2Нb проводилось с использованием анализатора критических состояний cobas b221 (Roche, Швейцария). У пациентов обеих групп первичная запись НПТЭГ производилась до проведения функциональной пробы с ишемией. Количественные данные представлены в виде Me [LQ; UQ], где Me - медиана, LQ - нижний квартиль, UQ - верхний квартиль, р - достигнутый уровень. Была проведена сравнительная оценка динамики t3 - показателя, отображающего момент перехода крови из жидкого состояние в гелеобразное, КТА - показателя коагуляционного звена и ИРЛС - показателя фибринолитического звена гемостаза у пациентов с ИБС и пациентов с ИБС, имеющих посттромбофлебитический синдром (ПТФС), при наличии информированного согласия. В обеих группах было проведено моделирование триады Вирхова, при помощи функционального метода с локальной ишемией и регистрация и расчет показателей согласно предлагаемому способу.
Изучалась динамика изменения показателей, определенных различными методами: t3, КТА, ИРЛС, РАI-1, t-PA, Д-димер, sVCAM, рН, sO2, O2Нb.
Далее приведены примеры, иллюстрирующие сущность предлагаемого способа.
Пример №1. 22.09.14, условно здоровый доброволец З. 27 лет, после получения информированного согласия, произведена проба с локальной ишемией для оценки гемостатического потенциала (ГП) - интегративной активности сосудисто-тромбоцитарного, коагуляционного, противосвертывающего и фибринолитического звеньев системы PACК, определяющих, во временном срезе, реологические свойства крови и возможность ограничения экстравазации ее клеточного и жидкостного компонентов при повреждении сосудистой стенки [Буланов А.Ю., 2011; Удут В.В. и др., 2015].
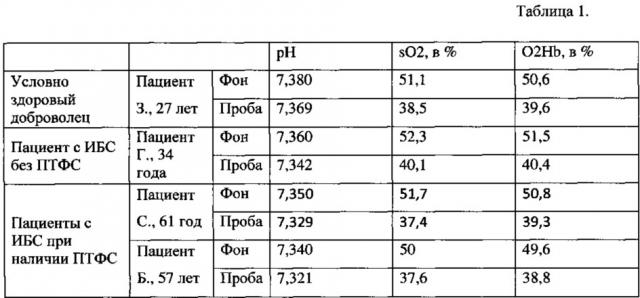
10:30. Согласно предлагаемому способу проведено обследование: уровень систолического артериального давления - 120, диастолического - 70 мм рт.ст, частота сердечных сокращений - 69/мин. Из пальца правой руки взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Результаты представлены в табл. 1.
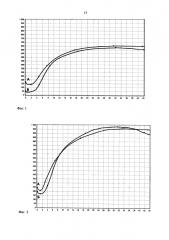
Из кубитальной вены правой руки, без наложения жгута, трехкомпонентным силиконированным шприцем, объемом 1 мл, произведен забор венозной крови. В течение 10 секунд от момента забора, цельная нестабилизированная кровь была помещена в стандартную кювету, объемом 0,45 мл, находящуюся в термостате АРП-01М «Меднорд». На фиг. 1 представлена НПТЭГ до проведения пробы.
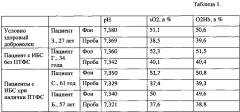
Оценка показателей произведена по методике [Тютрин И.И., Удут В.В., Шписман М.Н., 2013] и представлена в табл. 2.
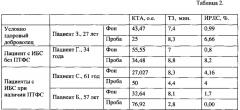
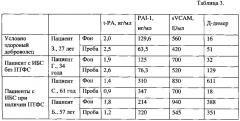
К игле, не вынимая ее из вены, подсоединялся другой шприц и производился дополнительный забор крови для оценки уровня циркулирующих маркеров эндотелия методом ИФА на анализаторе Erba LisaScan ЕМ (Erba Lachema, Чехия) с использованием тест-систем ELISA. Результаты представлены в табл. 3.
Состояние гемостатического потенциала, определяемого методом НПТГ, находится в диапазоне референтных значений условно здоровых лиц сибирской популяции [Тютрин И.И., Удут В.В., Клименкова В.Ф., 2014]. Уровень анализируемых маркеров плазмы в норме.
11:30. Проведение пробы с локальной ишемией. На верхнюю часть плеча левой руки накладывалась манжета сфигмоманометра с нагнетаемым уровнем давления на 20 мм рт.ст. превышающим систолической, на пять минут. Из пальца левой руки была взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Динамика показателей после проведения пробы отображена в табл. 3. Не распуская манжету, был произведен забор венозной крови для исследования ГП на АРП-01М «Меднорд» (Россия) по предлагаемому способу. На фиг. 1 приведена НПТЭГ после проведения пробы. Динамика показателей отображена в табл. 2. Не вынимая иглы из вены, подсоединялся другой шприц и был осуществлен повторный забор венозной крови для исследования уровня плазменных маркеров эндотелия методом ИФА при помощи тест-систем ELISA. Результаты отображены в табл. 5.
После этого манжета распускалась.
В ответ на ишемию, при смещении КЩС в кислую сторону (снижении рН на 0,011, sO2 на 12,6%, O2Нb на 11%) регистрировалось: повышение адгезивно-агрегационной активности (снижение SVCAM на 25%), снижение тромбиновой активности (увеличение t3 на 12,16%, снижение КТА на 42,49%) за счет увеличения фибринолитической активности (увеличение ИРЛС на 572,73%, t-PA на 25%, Д-димера на 218,75% и снижении РАI-1 на 51%), что соответствовало динамике гемостатического потенциала условно здоровых лиц. Реакция гемостатического потенциала нормальная, тромбоопасность - состояние системы PACК, сопровождающееся длительной тромбинемией, при которой противосвертывающая активность крови не в состоянии обеспечивать адекватную реакцию гемостатического потенциала при любой экзо-, эндо-, энтерогенной агрессии, отсутствовала.
Пример №2. 23.09.14 Пациент Г. 34 лет, диагноз: ИБС, стенокардия напряжения II ФК. ХСН II А стадии (II фк по NYHA). После получения информированного согласия, произведена проба с локальной ишемией для оценки гемостатического потенциала.
10:30. Согласно предлагаемому способу проведено обследование: уровень систолического артериального давления - 125, диастолического - 80 мм рт.ст, частота сердечных сокращений - 79/мин. Из пальца правой руки взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Результаты представлены в табл. 1. Из кубитальной вены правой руки, без наложения жгута, трехкомпонентным силиконированным шприцем, объемом 1 мл, произведен забор венозной крови. В течение 10 секунд от момента забора, цельная нестабилизированная кровь была помещена в стандартную кювету, объемом 0,45 мл, находящуюся в термостате АРП-01М «Меднорд». На фиг. 2 представлена НПТЭГ до проведения пробы.
Оценка показателей произведена по методике [Тютрин И.И., Удут В.В., Шписман М.Н., 2013] и представлена в табл. 2.
К игле, не вынимая ее из вены, подсоединялся другой шприц и производился дополнительный забор крови для оценки уровня циркулирующих маркеров эндотелия производилась методом ИФА на анализаторе Erba LisaScan ЕМ (Erba Lachema, Чехия) с использованием тест-систем ELISA. Результаты представлены в табл. 3.
11:30. Проведение пробы с локальной ишемией. На верхнюю часть плеча левой руки накладывалась манжета сфигмоманометра с нагнетаемым уровнем давления на 20 мм рт.ст., превышающим систолической, на пять минут. Из пальца левой руки была взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Динамика показателей после проведения пробы отображена в табл. 3. Не распуская манжету, был произведен забор венозной крови для исследования ГП на АРП-01М «Меднорд» (Россия) по вышеописанной методике. На фиг. 2 приведена НПТЭГ после проведения пробы. Динамика показателей отображена в табл. 2. Не вынимая иглу из вены, подсоединялся другой шприц и был осуществлен повторный забор венозной крови для исследования уровня плазменных маркеров эндотелия методом ИФА при помощи тест-систем ELISA. Результаты отображены в табл. 3. После этого манжета распускалась.
В ответ на ишемию, при смещении КЩС в кислую сторону (снижение рН на 0,018, sO2 на 12,2%, O2Нb на 11,1%) регистрируется: повышение адгезивно-агрегационной активности (снижение SVCAM на 25,71%), снижение интенсивности фибриногенеза (увеличение t3 на 25,71%, снижение КТА на 37,93%) за счет увеличения фибринолитической активности (увеличение ИРЛС на 925%, t-PA на 38,96%, Д-димера на 303,13% и снижении РАI-1 на 38,96%). Реакция гемостатического потенциала адекватна, тромбоопасность отсутствует.
Пример №3
23.09.14 Пациент С. 61 год, диагноз: ИБС: Стенокардия напряжения III ф.к. Постинфарктный кардиосклероз. Сердечная недостаточность III степени (IV ф.к. по NYHA). ПТФС, компенсация. После получения информированного согласия, произведена проба с локальной ишемией для оценки гемостатического потенциала.
10:30. Согласно предлагаемому способу проведено обследование: уровень систолического артериального давления - 138, диастолического - 90 мм рт.ст, частота сердечных сокращений - 89/мин.
Из пальца правой руки взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Результаты представлены в табл. 1.
Из кубитальной вены правой руки, без наложения жгута, трехкомпонентным силиконированным шприцем, объемом 1 мл, произведен забор венозной крови. В течение 10 секунд от момента забора, цельная нестабилизированная кровь была помещена в стандартную кювету, объемом 0,45 мл, находящуюся в термостате АРП-01М «Меднорд». На фиг. 3 представлена НПТГ до проведения пробы.
Оценка показателей произведена по методике [Тютрин И.И., Удут В.В., Шписман М.Н., 2013] и представлена в табл. 2.
К игле, не вынимая ее из вены, подсоединяли другой шприц и производили дополнительный забор крови для оценки уровня циркулирующих маркеров эндотелия методом ИФА на анализаторе Erba LisaScan ЕМ (Erba Lachema, Чехия) с использованием тест-систем ELISA. Результаты представлены в табл. 3.
11:30. Проведение пробы с локальной ишемией. На верхнюю часть плеча левой руки накладывали манжету сфигмоманометра с нагнетаемым уровнем давления на 20 мм рт.ст., превышающим систолической, на пять минут. Из пальца левой руки была взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Динамика показателей после проведения пробы отображена в табл. 1. Не распуская манжету, был произведен забор венозной крови для исследования ГП на АРП-01М «Меднорд» (Россия) по вышеописанной методике. На фиг. 3 приведена НПТЭГ после проведения пробы. Динамика показателей отображена в табл. 2. Не вынимая иглу из вены, подсоединялся другой шприц и был осуществлен повторный забор венозной крови для исследования уровня плазменных маркеров эндотелия методом ИФА при помощи тест-систем ELISA. Результаты отображены в табл. 3. После этого манжета распускалась.
В ответ на ишемию, при смещении КЩС в кислую сторону (снижение рН на 0,021, sO2 на 14,3%, O2Нb на 11,5%) регистрируется: повышение адгезивно-агрегационной активности (снижение SVCAM на 15,66%), увеличение интенсивности фибриногенеза (снижение t3 на 46,99%, увеличение КТА на 85%) и снижение фибринолитической активности (снижение ИРЛС на 3,85%, t-PA на 35,71%, Д-димера на 97,05% и увеличение РАI-1 на 11,94%).
Реакция гемостатического потенциала отличалась от таковой у условно здоровых лиц, диагностировали повышенный риск возникновения флеботромбозов.
Пример №4. 23.09.14 Пациент Б. 57 лет, диагноз: ИБС: Стенокардия напряжения II ф.к. Гипертоническая болезнь II стадии, степень артериальной гипертензии 3, риск 4. Хроническая сердечная недостаточность II А стадии (II ф.к. по NYHA). ТЭЛА от 12.10.2010. ХВН 3 ст. ПТФС глубоких вен нижних конечностей. После получения информированного согласия, произведена проба с локальной ишемией для оценки гемостатического потенциала.
10:30. Согласно предлагаемому способу проведено обследование: уровень систолического артериального давления - 138, диастолического - 90 мм рт.ст., частота сердечных сокращений - 89/мин.
Из пальца правой руки взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Результаты представлены в табл. 1.
Из кубитальной вены правой руки, без наложения жгута, трехкомпонентным силиконированным шприцем, объемом 1 мл, произведен забор венозной крови. В течение 10 секунд от момента забора, цельная нестабилизированная кровь была помещена в стандартную кювету, объемом 0,45 мл, находящуюся в термостате АРП-01М «Меднорд». На фиг. 4 представлена НПТЭГ до проведения пробы.
Оценка показателей произведена по методике [Тютрин И.И., Удут В.В., Шписман М.Н., 2013] и представлена в табл. 2.
К игле, не вынимая ее из вены, подсоединяли другой шприц и производили дополнительный забор крови для оценки уровня циркулирующих маркеров эндотелия методом ИФА на анализаторе Erba LisaScan ЕМ (Erba Lachema, Чехия) с использованием тест-систем ELISA. Результаты представлены в табл. 3.
11:30. Проведение пробы с локальной ишемией. На верхнюю часть плеча левой руки накладывали манжету сфигмоманометра с нагнетаемым уровнем давления на 20 мм рт.ст., превышающим систолической, на пять минут. Из пальца левой руки была взята кровь для определения КЩС на анализаторе критических состояний cobas b221 (Roche, Швейцария). Динамика показателей после проведения пробы отображена в табл. 1. Не распуская манжету, был произведен забор венозной крови для исследования ГП на АРП-01М «Меднорд» (Россия) по вышеописанной методике. На фиг. 4 приведена НПТЭГ после проведения пробы. Динамика показателей отображена в табл. 2. Не вынимая иглу из вены, подсоединяли другой шприц и был осуществлен повторный забор венозной крови для исследования уровня плазменных маркеров эндотелия методом ИФА при помощи тест-систем ELISA. Результаты отображены в табл. 3. После этого манжета распускалась.
В ответ на ишемию, при смещении КЩС в кислую сторону (снижение рН на 0,019, sO2 на 12,4%, O2Нb на 10,8%) регистрировали: повышение адгезивно-агрегационной активности (снижение SVCAM на 42,02%), увеличение интенсивности фибриногенеза (снижение t3 на 65,43%, увеличение КТА на 135,66%), отсутствие литической активности на фоне снижения t-PA на 33,33%, Д-димера на 9,54% и увеличения PAI-1 на 2,80%.
Реакция гемостатического потенциала отличается от таковой у условно здоровых лиц, диагностировали повышенный риск возникновения флеботромбозов.
Приложение
Таблица 1. Динамика показателей КЩС до и после проведения пробы
Таблица 2. Динамика показателей НПТГ до и после проведения пробы.
Таблица 3. Динамика уровня плазменных маркеров эндотелия до и после проведения пробы.
Фиг. 1 - пример динамики показателей НПТГ условно здорового добровольца до и после проведения ишемической пробы. А - фоновый график, Б - график после проведения пробы
Фиг. 2 - пример динамики показателей НПТГ до и после проведения ишемической пробы у пациента с ИБС.А - фоновый график, Б - график после проведения пробы.
Фиг. 3 - пример динамики показателей НПТГ до и после проведения ишемической пробы у пациента с ИБС и ПТФС: А - фоновый график, Б - график после проведения пробы.
Фиг. 4 - пример динамики показателей НПТГ до и после проведения ишемической пробы у пациента с ИБС и ПТФС: А - фоновый график, Б - график после проведения пробы.
Фиг. 5 - низкочастотная пьезоэластограмма (НЗПЭГ).
Способ оценки повышенного риска возникновения флеботромбозов у пациентов с ишемической болезнью сердца, включающий определение реологических характеристик венозной крови после венозной окклюзии, отличающийся тем, что определяют показатели цельной нестабилизированной венозной крови дважды - до и после однократной венозной окклюзии с помощью низкочастотной пьезоэластографии: t1 - период реакции, представляющий время от начала исследования до достижения максимального снижения амплитуды – А1, в мин; t2 - время достижения амплитуды А2, в мин; t3 - показатель, отображающий время свертывания крови, в мин, определяемый автоматически, при изменении tg угла кривой на 60%; МА - максимальную амплитуду, показатель, характеризующий окончание процесса образования поперечно-сшитого фибринового сгустка, подвергнувшегося ретракции, A1-max - снижение амплитуды за время «t1» - период реакции, о.е.; А6 - значение амплитуды через 10 минут после достижения максимальной амплитуды, о.е., далее, рассчитывают константу тромбиновой активности КТА по формуле:
КТА=100/(t2-t1),
а также интенсивность ретракции и лизиса сгустка ИРЛС по формуле:
ИРЛС=[МА-(А6-А1)/100]*100%,
и при повышении КТА на 20% и более, снижении t3 на 30% и более и отсутствии изменения или снижении ИРЛС, диагностируют повышенный риск возникновения флеботромбозов.