Способ получения остеопластического материала
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к способу получения остеопластического материала в виде многослойных гранул из рентгеноконтрастных β-трикальцийфосфата 20% и гидроксиапатита 80% в полилактидгликолидной матрице с добавлением во внутренний слой гиалуроновой кислоты, а во внешний слой - гидрокортизона, хлоргексидина и лидокаина. Способ получения остеопластического материала характеризуется тем, что процесс нанесения слоев осуществляют в грануляторе в псевдоожиженном слое за три этапа. Осуществление изобретения позволяет получить остеопластический материал в виде многослойных гранул, обладающих бактериостатическим и бактерицидным действием и пролонгированным выделением активных действующих веществ. 6 ил., 2 пр.
Реферат
Способ относится к области медицины, а именно стоматологии, и может быть использован для получения остеопластического материала, оптимизирующего регенерацию мягких и костных тканей в хирургической стоматологии, клинике общей и челюстно-лицевой хирургии, а также в травматологии и ортопедии для восстановления пародонтальных дефектов, десневой рецессии, а также при заполнении двух- или многостеночных внутрикостных дефектов, альвеолярной регенерации, аугментации атрофированной челюстной пазухи.
Известно, что для восстановления костной ткани используют аутогенные, аллогенные, ксеногенные и аллопластические материалы.
Недостатком аутогенных материалов является ограниченность объема материала, нанесение дополнительных травм пациенту и в некоторых случаях высокая скорость резорбции.
Наиболее значимым недостатком аллотрансплантатов является биологическая несовместимость тканей донора и реципиента, длительность сроков заготовки, возможность инфицирования вирусом гепатита, ВИЧ-инфекции, сложность юридического оформления.
Недостаток ксеногенных материалов определяется необходимостью тщательной обработки исходного сырья специальными растворителями, термообжигом или низкотемпературной заморозкой для предотвращения иммунологических реакций.
В настоящее время широко используется множество искусственно синтезированных аллопластических материалов в большинстве своем на основе фосфата кальция, главным образом, гидроксиапатита, который используют в реконструктивной костно-пластической хирургии с 20-х годов ХХ века.
Материалы на основе гидроксиапатита успешно используют в качестве компонента в пастах для пломбирования каналов корней зубов, для заполнения костных полостей после резекции верхушки корня зуба, а также в виде порошков, гранул или блоков в челюстно-лицевой и реконструктивной хирургии.
Так, например, способ получения синтетического аллопластического материала в виде гранул описан в патенте РФ №2132702 (опубликовано: 10.07.1999). Способ включает синтез стекла медицинского назначения из биоситаллов с содержанием гидроксиапатиата (ГАП) при следующем соотношении компонентов, мас.%: SiO2 26,0-33,4, P2O5 10,5-13,5, Al2O3 4,3-5,5, CaO 23,6-30,4, MgO 2,1-2,7, ZnO 3,5-4,5, гидроксиапатит (ГАП) 10,0-30,0, путем смешивания тонкодисперсионных порошков стекла и ГАП в соотношениях согласно заявляемому составу, приготовление пластической массы, изготовление гранулята, удаление связующих веществ, спекание гранул и выделение монокристаллического ГАП (в фазе даллита) в 30-60 об.%. С целью упрощения и экономичности способа стадия спекания при t=1450°C в течение 3 часов совмещена с одноступенчатым режимом направленной кристаллизации. Изобретение обеспечивает получение нового материала с повышенной механической прочностью, устойчивого к режиму термоциклирования, и изделий из него в виде гранул с оптимальной пористостью 100-120 мкм, обладающих повышенными эксплуатационными свойствами, расширяющее область использования остеозамещающих биоматериалов в стоматологии, челюстно-лицевой и реконструктивной хирургии.
Недостатком изобретения является то, что спекание гранул проводят при высокой температуре, что требует много времени и энергозатрат, влечет за собой использование дополнительного оборудования и операций в производственном технологическом цикле.
Известны резорбируемые кальций-фосфатные многослойные гранулы «Клипдент» с пролонгированным высвобождением активных действующих веществ. Основа гранулы состоит из рентгеноконтрастных β-трикальцийфосфата (20%) и гидроксиапатита (80%) в полилактидгликолидной матрице. Внутренний слой покрытия содержит гиалуронат натрия, который оказывает стимулирующее действие на рост клеток и способствует активации репаративного остеогенеза в области травмы, ускоряя процесс дифференциации новообразованной костной ткани, что выражается прежде всего в резком повышении удельного веса костной компоненты регенерата, а также в более интенсивном созревании костного вещества. Внешний слой покрытия включает в себя гидрокортизон, хлоргексидин и лидокаин, которые обладают антибактериальным действием по отношению к анаэробным простейшим и бактериям, ингибируют синтез белков в микроорганизмах, оказывая бактериостатическое и бактерицидное действие, активны в отношении широкого спектра вегетативных форм грамотрицательных и грамположительных микроорганизмов, дрожжей и липофильных вирусов. (Посохова В.Ф., Лыкова И.В., Чуев П.В., Чуев В.П. Остеопластические материалы от компании «ВладМиВа», ж. IndexDent №3, 2014 год).
Из уровня техники известно, что гранулы «Клипдент» изготавливают путем спекания синтетического сырья, не содержат веществ животного происхождения и при этом биологически совместимы с тканями организма. Высокая микро- и макропористость, а также межгранулярная пористость создают идеальные условия для восстановления кости. (Интернет-ссылка: http://www.vladmiva.ru/decatalog/product-17/)
Данный способ выбран за прототип. Недостатком указанного способа является высокая энергоемкость за счет высокой температуры спекания.
Разработка способов получения лекарственных средств с пролонгированным выделением биологически активных веществ, обеспечивающих достижение желаемого клинического результата, при наличии также желаемого равновесия между механическими свойствами, биостабильностью in vivo и применимостью в хирургии, при лечении в настоящее время является актуальной.
Задача изобретения – разработка способа получения остеопластического материала в виде многослойных гранул, обладающих бактериостатическим и бактерицидным действием и пролонгированным выделением активных действующих веществ, на основе гидроксиапатита синтетического происхождения и β-трикальцийфосфата с добавлением гиалуроната натрия.
Технический результат заключается в реализации назначения.
Задача решается предложенным способом, включающим получение остеопластического материала в виде многослойных гранул из рентгеноконтрастных β-трикальцийфосфата (20%) и гидроксиапатита (80%) в полилактидгликолидной матрице с добавлением во внутренний слой гиалуроновой кислоты, а во внешний слой - гидрокортизона, хлоргексидина и лидокаина, обладающих бактериостатическим и бактерицидным действием, в который внесены следующие новые признаки:
- процесс нанесения слоев осуществляют в грануляторе в псевдоожиженном слое, при этом:
- на первом этапе порошкообразный нанодисперсный гидроксиапатит предварительно подогревают до температуры 38-40°С и обрабатывают нагретым до 45°С очищенным воздухом в течение 30 минут, после чего через центральный канал распылительного устройства гранулятора подают 10%-ный раствор полилактидгликолида в этилацетате с t=38°C при давлении 2-3 МПа;
- на втором этапе полученный полуфабрикат обрабатывают в течение 30 минут 1% водной суспензией гиалуроната натрия с β-трикальцийфосфатом в соотношении 1:1, после чего наносят еще один слой полилактидгликолида, продолжая обработку гранул в псевдоожиженном слое до полного высушивания слоя полилактидгликолида;
- после каждого этапа гранулы обрабатывают в CO2-экстракторе диоксидом углерода в сверхкритическом состоянии при давлении 100 атм и температуре 40°С в течение 10 минут с последующим сбросом давления до атмосферного, что придает слою из полилактидгликолида пористую структуру с многочисленными отверстиями диаметром от 200 до 1000 мкм по всему объему, разделенными тонкими перегородками, в которых встречаются отверстия размером до 100 мкм. При этом после обработки на первом этапе слой полилактидгликолида содержит равномерно распределенные микрочастицы гидроксиапатита, а после обработки на втором этапе - микрочастицы β-трикальцийфосфата;
- на третьем этапе в грануляторе в псевдоожиженном слое при тех же параметрах, что на двух первых этапах, на гранулы наносят поверхностный слой путем обработки 10%-ным водным раствором поливинилпиролидона, содержащего дополнительно в сумме не более 2% гидрокортизона, хлоргексидина и лидокаина. Обработку гранул в псевдоожиженном слое проводят до полного высушивания.
Способ позволяет получать гранулы со структурой, гарантирующей постепенное и пролонгированное выделение активных действующих веществ. Готовый остеопластический материал представляет собой многослойные гранулы из рентгеноконтрастных β-трикальцийфосфата (20%) и гидроксиапатита (80%) в полилактидгликолидной матрице, содержащие слой гиалуроната натрия и внешний слой поливинилпиролидона, содержащего дополнительно гидрокортизон, хлоргексидин и лидокаин.
Поливинилпиролидон - основа внешнего слоя гранул - синтетический полимер, растворимый в воде. Используется как заменитель плазмы крови в медицине и фармацевтике.
Гидрокортизон - природное лекарственное средство широкого применения. В организме человека гидрокортизон секретируется корой надпочечников и в этом качестве обычно именуется как гормон кортизол. Фармакологическое действие - глюкокортикоидное, противошоковое, противовоспалительное, противоаллергическое, иммунодепрессивное, антиэкссудативное, противозудное. Тормозит реакции гиперчувствительности, пролиферативные и экссудативные процессы в соединительной ткани, в очаге воспаления. Уменьшает местную гиперемию и гипертермию кожи.
Хлоргексидин - антисептическое средство, активно в отношении вегетативных форм грамотрицательных и грамположительных бактерий, а также дрожжей, дерматофитов и липофильных вирусов.
Лидокаин - местный анестетик, используемый в качестве обезболивающего средства.
Таким образом, состав внешнего слоя гранул обеспечивает антибактериальное действие по отношению к анаэробным простейшим и бактериям, ингибирует синтез белков в микроорганизмах, оказывая бактериостатическое и бактерицидное действие, активность в отношении широкого спектра вегетативных форм грамотрицательных и грамположительных микроорганизмов, дрожжей и липофильных вирусов, что позволяет в начале лечения предотвратить инфицирование оперированной поверхности и снизить болевые ощущения.
После растворения внешнего слоя через пористый слой полилактидгликолида биологические жидкости организма легко проникают к слою на основе гиалуроната натрия с β-трикальцийфосфатом и далее к ядру из гидроксиапатита. Начинается процесс постепенного высвобождения гиалуроната натрия, оказывающего стимулирующее действие на рост клеток и способствующего активации репаративного остеогенеза в области травмы, ускоряя процесс дифференциации новообразованной костной ткани, что выражается прежде всего в повышении удельного веса костной компоненты регенерата, а также в более интенсивном созревании костного вещества.
Гиалуронат натрия (гиалуроновая кислота) - это присутствующий в природе водорастворимый полисахарид, который является основным компонентом внеклеточного матрикса и широко распространен в животных тканях, обладает превосходной биосовместимостью и не вызывает реакции на постороннее тело или аллергической реакции при имплантации субъекту.
β-трикальцийфосфат – разновидность фосфатов кальция, причем растворимость β-трикальцийфосфата на порядок выше, чем растворимость гидроксиапатита, что является основанием для использования именно его в слое, содержащем гиалуронат натрия.
Гидроксиапатит – фосфат кальция, являющийся основной минеральной составляющей костей (около 50% от общей массы кости) и зубов (96% в эмали), в предложенных гранулах выполняет роль наполнителя дефекта кости, при этом одновременно его остеотропные свойства активизируют дифференцировку остеогенных клеток, а его остеоинтегративное действие проявляется в образовании прочной химической связи с костью и последующей резорбцией с полным замещением костной тканью.
Полилактидгликолид – полимер, обычно используемый для производства резорбируемых нитей медицинского назначения, рассасывающихся в живом организме, в предложенном способе выполняет роль образователя гранул за счет двух физических процессов: комкования порошка гидроксиапатита при смачивании и слипания комков с последующей агломерацией, а пористая структура слоев из полилактидгликолида позволяет биологическим жидкостям организма легко проникать к слою на основе гиалуроната натрия с β-трикальцийфосфатом и далее к ядру из гидроксиапатита, что способствует постепенной резорбции гранул и обеспечивает скорость резорбции материала в соответствии со скоростью формирования естественной костной ткани.
Из уровня техники не выявлено способа получения остеопластического материала в виде многослойных гранул, обладающих бактериостатическим и бактерицидным действием на первом этапе лечения, с пролонгированным механизмом стимулирующего действия на рост клеток, что позволяет обеспечить скорость резорбции материала в соответствии со скоростью формирования естественной костной ткани.
Предложенное изобретение характеризуется следующими графическими изображениями.
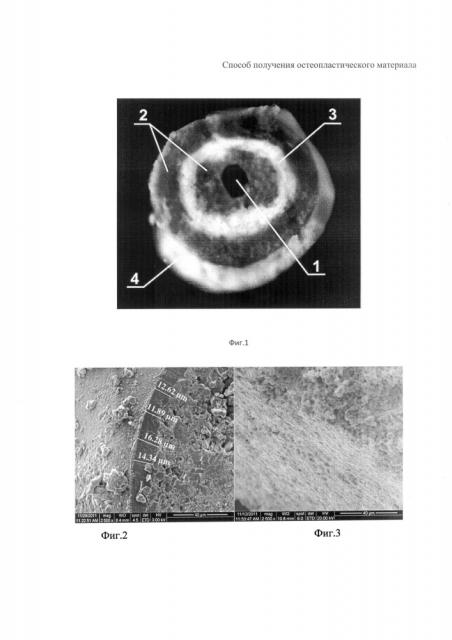
На Фиг. 1 представлено фото многослойной гранулы в разрезе, полученное на сканирующем электронном микроскопе, Ув. ×50, где 1 - гидроксиапатит, 2 - слой полилактидгликолида, 3 - слой гиалуроната натрия с β-трикальцийфосфатом, 4 - слой поливинилпиролидона, содержащий гидрокортизон и хлоргексидин и лидокаин.
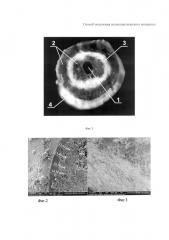
На Фиг. 2. представлено изображение слоя 2 изполилактидгликолида до обработки в CO2-экстракторе.
На Фиг. 3 - представлено изображение слоя 2 из полилактидгликолида после обработки в CO2-экстракторе.
На Фиг. 4 представлен срез слоя полилактидгликолидной матрицы, содержащей включения трикальцийфосфата.
На Фиг. 5 представлен срез слоя полилактидгликолидной матрицы, содержащей включения гидроксиапатита.
На Фиг. 6. представлена технологическая схема для осуществления предложенного способа.
Пример осуществления предложенного способа.
Для получения многослойных гранул по предлагаемому способу используют кольцевой гранулятор 1 Solilab1D, снабженный сетчатой перфорированной нижней пластиной 2 и CO2-экстрактор 3 - реактор высокого давления, находящийся в термостате. Отличительной особенностью является то, что образование и рост гранул происходит в псевдоожиженном слое, т.е. обрабатываемый материал непрерывно находится в движении.
На первом этапе в кольцевой гранулятор 1, снабженный сетчатой перфорированной нижней пластиной 2, загружают 1 кг порошкообразного нанодисперсного гидроксиапатита и подогревают до температуры 38-40°С, затем подают через клапан 4 поток воздуха, предварительно очищенный и подогретый до температуры 45°С, пропуская его через слой гидроксиапатита. Поддерживают порошок в виде кипящего слоя, активно перемешивая его потоком воздуха в течение 30 минут.
Через центральный канал распылительного устройства 5 со скоростью 100 г/час при давлении на фильтре 2-3 МПа, подают в гранулятор 1 раствор полилактидгликолида в этилацетате концентрацией 10%, нагретый до t=38°C, благодаря чему порошкообразный гидроксиапатит превращается в гранулы в виде ядра из гидроксиапатита, покрытого слоем полилактидгликолида. Образование и рост гранул в псевдоожиженном слое происходит за счет двух физических процессов: комкования при смачивании и слипания с последующей агломерацией. Процесс гранулирования в псевдоожиженном слое происходит одновременно с сушкой получаемых гранул горячим воздухом, в течение которой гранулы затвердевают. Все технологические операции происходят в одном аппарате непрерывно, в результате чего получают гранулы округлой формы с улучшенной сыпучестью, более сбалансированного фракционного состава. Высушенные гранулы высыпают в накопитель 6, из которого их перемещают в CO2-экстрактор 2, где выдерживают гранулы в течение 10 минут в среде жидкого диоксида углерода в сверхкритическом состоянии при давлении 100 атм и температуре 40°С в течение 10 минут с последующим сбросом давления до атмосферного. При этой обработке слой покрытия из полилактидгликолида приобретает пористую структуру с включениями микрочастиц гидроксиапатита (фиг. 5)
На втором этапе охлажденные гранулы из CO2-экстрактора 3 вновь помещают в гранулятор 1, где в течение 30 минут обрабатывают сначала нагретой до 38°С 1% водной суспензией гиалуроната натрия с β-трикальцийфосфатом в соотношении 1:1, после чего, так же как на первом этапе, наносят еще один слой полилактидгликолида и продолжают обработку гранул в псевдоожиженном слое до полного высушивания слоя полилактидгликолида.
Повторяют обработку гранул в CO2-экстракторе 2 для придания второму слою из полилактидгликолида пористой структуры с многочисленными отверстиями диаметром от 200 до 1000 мкм по всему объему, разделенными тонкими перегородками, в которых встречаются отверстия размером до 100 мкм. При этом после обработки в CO2-экстракторе 2 на втором этапе слой полилактидгликолида содержит равномерно распределенные микрочастицы β-трикальцийфосфата (фиг. 4).
На третьем этапе в грануляторе 1 в псевдоожиженном слое в течение 30 минут на гранулы наносят поверхностный слой путем обработки 10%-ным водным раствором поливинилпиролидона, содержащего дополнительно в сумме не более 2% гидрокортизона, хлоргексидина и лидокаина. Обработку гранул в псевдоожиженном слое проводят до полного высушивания.
Гранулы, полученные в псевдоожиженном слое, имеют ряд преимуществ перед гранулами, полученными механическим гранулированием с увлажнением: отличаются большой прочностью и лучшей сыпучестью, более правильной геометрической формой гранул, приближающейся к шарообразной. При этом образуются более мягкие и пористые агломераты, чем при получении гранул влажной грануляцией, где образуются крупные агломераты, подлежащие последующему измельчению.
Использование данного средства может быть рекомендовано при замещении значительных по протяженности костных дефектов, где уместно наличие остеопластического материала в течение длительного срока.
Пример
Больная Г., 56 лет, обратилась с жалобами на припухлость и дискомфорт в области бокового отдела верхней челюсти слева. Со слов, больна около 1,5 лет. На ортопантомограмме в проекции корней 22, 23, 24, 25 определяется очаг разрежения костной ткани с четким контуром, размер образования 30×20 мм. Локальный статус: определяется гиперемия и выбухание слизистой оболочки в проекции корней 22, 23, 24, 25. Пальпация переходной складки и перкуссия зубов 22, 23, 24, 25 безболезненна. Диагноз: Радикулярная киста верхней челюсти слева. Лечение: цистэктомия проведена по общепринятой методике. Пропитанные кровью пациента гранулы, полученные по предложенному способу, внесены в полученный костный дефект, рана изолирована двуслойной мембраной «БиопластДент», наложены глухие швы лавсаном. Течение послеоперационного периода без особенностей. Швы были сняты на 9-е сутки, пациентка была выписана с улучшением на десятые сутки послеоперационного периода. Контрольная компьютерная томография проводилась через месяц после вмешательства, через полгода и спустя год после вмешательства. Спустя шесть месяцев наблюдается уменьшение размера образования, частичная резорбция остеопластического материала. Участки повышенной плотности чередуются с участками невысокой плотности, соответствующие новообразованной кости. Спустя один год после оперативного вмешательства наблюдается полное замещение дефекта костной тканью высокой плотности. В проекции верхушки корня 24 определяется конгломерат повышенной плотности – нерезорбированный остеопластический материал. Его плотность, по данным денситометрии, близка к 2000 HU, что является очень высоким показателем. Исход данного клинического случая благоприятен: костная ткань восстановлена в полном объеме уже к шестому месяцу исследования.
Таким образом, поставленная задача – разработка способа получения остеопластического материала в виде многослойных гранул, обладающих бактериостатическим и бактерицидным действием и пролонгированным выделением активных действующих веществ, на основе гидроксиапатита синтетического происхождения и β-трикальцийфосфата с добавлением гиалуроната натрия, решена.
Способ получения остеопластического материала, включающий получение многослойных гранул из рентгеноконтрастных β-трикальцийфосфата 20% и гидроксиапатита 80% в полилактидгликолидной матрице с добавлением во внутренний слой гиалуроновой кислоты, а во внешний слой - гидрокортизона, хлоргексидина и лидокаина, отличающийся тем, что процесс нанесения слоев осуществляют в грануляторе в псевдоожиженном слое за три этапа: на первом этапе порошкообразный нанодисперсный гидроксиапатит предварительно подогревают до температуры 38-40°С и обрабатывают нагретым до 45°С очищенным воздухом в течение 30 минут, после чего через центральный канал распылительного устройства гранулятора подают 10%-ный раствор полилактидгликолида в этилацетате с t=38°C при давлении 2-3 МПа; на втором этапе полученный полуфабрикат обрабатывают в течение 30 минут 1%-ной водной суспензией гиалуроната натрия с β-трикальцийфосфатом в соотношении 1:1, после чего наносят еще один слой полилактидгликолида, продолжая обработку гранул в псевдоожиженном слое до полного высушивания слоя полилактидгликолида; после каждого этапа гранулы обрабатывают в CO2-экстракторе диоксидом углерода в сверхкритическом состоянии при давлении 100 атм и температуре 40°С в течение 10 минут с последующим сбросом давления до атмосферного, на третьем этапе в грануляторе в псевдоожиженном слое при тех же параметрах, что на двух первых этапах, на гранулы наносят поверхностный слой путем обработки 10%-ным водным раствором поливинилпиролидона, содержащего дополнительно в сумме не более 2% гидрокортизона, хлоргексидина и лидокаина, продолжая обработку гранул в псевдоожиженном слое до полного высушивания.