Иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета
Иллюстрации
Показать всеИзобретение относится к области ветеринарной микробиологии и касается иммуноферментной тест-системы для серологической диагностики анаэробной энтеротоксемии сельскохозяйственных животных, вызываемой бактериями Clostridium perfringens (Cl. perfringens), а также контроля напряженности поствакцинального иммунитета. Представленная иммуноферментная тест-система содержит специфические антигены штаммов Cl. perfringens №28 (тип А), №1 (тип В), №392 (тип С), №213 (тип D), полученные озвучиванием бактериальных клеток на ультразвуковом дезинтеграторе, последующим осаждаем эндотоксина сульфатом аммония и диализом против водопроводной воды. Антигены представляют собой специфический белок в концентрации 8-10 мкг/см3, адсорбированный на поверхности полистироловых лунок в карбонатно-бикарбонатном буфере. Также набор содержит контрольную положительную сыворотку, полученную к антигенам Clostridium perfringens типов А, В, С, D с активностью в ИФА 1:6400-1:12800, контрольную отрицательную сыворотку, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, хромоген (ортофенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа. Тест-система позволяет проводить диагностику анаэробной энтеротоксемии у животных и определить напряженность поствакцинального иммунитета. 2 табл., 5 пр.
Реферат
Изобретение относится к области ветеринарной микробиологии и биотехнологии и касается иммуноферментной тест-системы для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета.
В структуре заболеваемости сельскохозяйственных животных наибольшее экономическое значение имеют желудочно-кишечные болезни молодняка. В этиологии этих болезней многими отечественными и иностранными авторами отмечается возрастающее значение бактерий Clostridium perfringens (Cl. perfringens) и вызываемая ими токсико-инфекционная болезнь - анаэробная энтеротоксемия.
Анаэробная энтеротоксемия - остропротекающая болезнь животных различных видов (овец, телят, поросят, пушных зверей, птиц и др.), характеризующаяся общим токсикозом организма с признаками поражения нервной системы и желудочно-кишечного тракта, возникающая в результате интенсивного размножения в кишечнике различных типов Cl. perfringens и всасывания образовавшихся при этом токсинов (Куриленко А.Н. и др., 2006; Van Kruingen H.J. et al., 2009). Поражает чаще молодняк раннего возраста.
Возбудитель болезни - Cl. perfringens, который по выделению токсинов подразделяют на шесть типов: А, В, С, D, Е и F, которые отличаются друг от друга антигенной структурой вырабатываемых ими токсинов. У ягнят анаэробную энтеротоксемию вызывает возбудитель типов В, D; у телят - типы А, С, D; у поросят - в основном тип С, реже другие (Ургуев К.Р., 1987; Салимов В.А и др., 2002; Спиридонов Г.Н. и др., 2010; Ceci L. et al., 2006; Gurjar A. et al., 2010).
На сегодняшний день диагноз на инфекционную энтеротоксемию животных ставят на основании эпизоотологических, клинических, патологоанатомических данных и результатов лабораторных исследований (Методические указания по лабораторной диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят. Лабораторные исследования в ветеринарии. Бактериальные инфекции. Справочник. Под редакцией Б.И. Антонова, 1986).
Лабораторное исследование проводят в двух направлениях:
- обнаружение токсина в содержимом тонкого отдела кишечника;
- выделение культуры возбудителя из патологического материала с последующей проверкой ее токсичности.
Для обнаружения токсина фильтрат экстракта содержимого кишечника вводят внутривенно или внутрибрюшинно двум белым мышам в дозе 0,5 мл. При наличии токсина животные гибнут в течение 12 ч. Для определения типа основных летальных токсинов Cl. perfringens ставят реакцию нейтрализации на белых мышах или кроликах. Для этого в пять пробирок разливают по 1,0 мл фильтрата экстракта содержимого кишечника и добавляют по 1,0 мл диагностических антитоксических сывороток Cl. perfringens, разведенных стерильным физиологическим раствором до содержания 10АЕ в 1,0 мл: в первую пробирку - сыворотку типа А, во вторую - типа С, в третью - типа D, четвертую - типа Е. В пятую пробирку добавляют 1,0 мл физиологического раствора (контроль). Пробирки выдерживают при 37°С в течение 30 мин. Смесь из каждой пробирки вводят внутривенно или внутрибрюшинно по 0,5 мл двум белым мышам или внутрикожно по 0,2 мл морской свинке или кролику. Результат реакции нейтрализации учитывают при гибели контрольных белых мышей или образовании некроза у контрольных морских свинок (кроликов).
Белые мыши, получившие смесь токсина с гомологичной антитоксической сывороткой, остаются живы, а у морских свинок и кроликов некроз не развивается.
При обнаружении в содержимом кишечника токсинов определенного типа дальнейшую работу по выделению культуры не проводят.
Выделение культуры возбудителя.
Высевы из паренхиматозных органов делают в среду Китта-Тароцци, МПБ и на МПА, из содержимого тонкого отдела кишечника - только в среду Китта-Тароцци. Посевы инкубируют в термостате при 37-38°С в течение 20-24 ч. Для очистки культуры возбудителя от сопутствующей микрофлоры используют специальные методы: метод частых пересевов на среде Китта-Тароцци; метод прогревания культуры в водяной бане при 65°С в течение 10 мин. На среде Китта-Тароцци Cl. perfringens дает бурный рост с сильным равномерным помутнением бульона и обильным газообразованием. В мазках из культур обнаруживают грамположительные короткие толстые палочки с обрубленными концами без спор. На глюкозо-кровяном агаре Cl. perfringens образует крупные, гладкие, выпуклые колонии с ровными краями, окруженные одной или двумя зонами сильного непрозрачного (неполного) гемолиза. Типичные для возбудителя колонии отвивают на среду Китта-Тароцци. Для определения токсичности используют 8-16-часовую культуру, выращенную на среде Китта-Тароцци. Культуру вводят внутривенно или внутрибрюшинно в дозе 0,5 мл белым мышам массой 16-18 г.
При подозрении на наличие Cl. perfringens типов D и Е культуру подвергают активированию путем добавления 0,5% панкреатина или 0,25% трипсина при рН 8,0-8,2. Для этого культуру подщелачивают 10%-ным раствором едкого натра, вносят панкреатин или трипсин и выдерживают при 37-38°С в течение 2 ч, периодически взбалтывая. После активирования токсичность культур типов D и Е значительно увеличивается, а токсичность культур типа С резко снижается. Токсичность культур типа В может сохраниться на прежнем уровне за счет активации эпсилон-токсина.
Определение типа токсина проводят в реакции нейтрализации, как описано выше.
Диагноз на инфекционную энтеротоксемию животных считают установленным в случае:
- обнаружения токсина в фильтрате содержимого тонкого отдела кишечника биологическим методом и определения его типа в реакции нейтрализации с типоспецифическими сыворотками;
- выделения из содержимого тонкого отдела кишечника культуры с характерными для данного возбудителя свойствами, продуцирующей токсин, тип которого установлен в реакции нейтрализации с типоспецифическими сыворотками.
Недостатками лабораторного метода являются:
- трудоемкость и длительность исследований, требующего для постановки диагноза до 8 рабочих дней (Лабораторные исследования в ветеринарии. Бактериальные инфекции. Справочник. Под редакцией Б.И. Антонова, 1986);
- высокая себестоимость исследования (дороговизна питательных сред, реактивов, затраты на приобретение и содержание лабораторных животных).
В настоящее время для диагностики многих инфекционных заболеваний применяют серологические методы (РСК, РДП, РНГА, ИФА и др.), позволяющие по титрам специфических антител в сыворотке крови выявлять больных животных, а также определять напряженность иммунитета у вакцинированных животных.
В ФГБНУ «ФЦТРБ-ВНИВИ» разработана ассоциированная вакцина против анаэробной энтеротоксемии и эшерихиозной диареи телят на основе антигенов Cl. perfringens серотипов А, С, D и адгезивных антигенов Е. coli К99 и А20 (Патент РФ №24282002, 10.09.2011). Однако на сегодняшний день в РФ не разработан еще метод определения специфических антител к бактериям Cl. perfringens в сыворотке крови животных, что затрудняет контролировать напряженность поствакцинального иммунитета.
Технический результат, на достижение которого направлено изобретение, заключается в получении тест-системы, обладающей высокой специфичностью и чувствительностью, позволяющей одновременно определять специфические антитела к 4 серотипам Cl. perfringens (А, В, С и D) и по их тирам достоверно диагностировать анаэробную энтеротоксемию среди невакцинированного поголовья и контролировать напряженность поствакцинального иммунитета у вакцинированных животных.
Для достижения названного технического результата иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета содержит специфические антигены штаммов Cl. perfringens №28 (тип A), LD-1 (тип В), №392 (тип С), №213 (тип D), полученные путем 3-кратного отмыва их физиологическим раствором, смешиванием этих бактерий в равных соотношениях по 5 млрд м.к. в 1 см3 каждого серотипа, с последующим разрушением бактериальных клеток ультразвуком с частотой 20 мГц в течение 10-15 мин при 4°С, дальнейшим осаждением эндотоксина сульфатом аммония при 40%-ном насыщении рН 7,0 и диализом против водопроводной воды, представляющие собой специфический белок в концентрации 8-10 мкг/см3, адсорбированный на поверхности полистироловых лунок в карбонатно-бикарбонатном буфере, контрольную положительную сыворотку, полученную к антигенам Cl. perfringens серотипов А, В, С, D с активностью 1:6400-1:12800, контрольную отрицательную сыворотку, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, детергент, хромоген (ортофенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа.
Предлагаемый иммуноферментный анализ универсален, обладает высокой специфичностью и чувствительностью, не требует сложного оборудования и приемлем для проведения анализов в массовых количествах. Его можно использовать как для диагностики анаэробной энтеротоксемии животных в стационарно неблагополучных хозяйствах, так и для определения напряженности поствакцинального иммунитета и изучения иммунного статуса у вакцинированных животных. Время исследования составляет всего 4 ч, тогда как существующие в настоящее время лабораторные исследования - до 8 дней.
Согласно «Инструкции по применению иммуноферментной тест-системы для выявления специфических антител к бактериям Cl. perfringens» один комплект тест-системы рассчитан для определения на одном планшете одновременного анализа 46 исследуемых проб сывороток крови в одном разведении и 2 контрольных сывороток (в двух повторах) или 10 исследуемых и 2 контрольных проб сывороток крови в восьми разведениях.
В состав предлагаемой тест-системы ИФА входят:
1. Полистироловые 96-луночные микропланшеты для иммуноферментного анализа, адсорбированные антигеном бактерий Cl. perfringens - 2 шт.;
2. Контрольная положительная сыворотка, лиофилизированная (К+), титр в ИФА 1:6400 - 1:12800, объем 1 см3 - 1 амп., №1;
3. Контрольная отрицательная сыворотка, лиофилизированная (К-), объем 1 см3, - 1 амп., №2;
4. Антитела диагностические против иммуноглобулинов быка класса IgG, меченные пероксидазой хрена (конъюгат), объем 0,2 см3 - 1 амп. №3;
5. Фосфатно-солевой буферный раствор (ФСБР), 20-кратный концентрат, 20 см3 - 2 фл., №4;
6. Детергент (твин-80), 1,0 см3 - 1 флакон, №5;
7. Цитратно-фосфатный буферный раствор (ЦФБР), объем 10 см3 - 2 фл., №6;
8. Хромоген (ортофенилендиамин - ОФД), 5 мг - 2 фл., №7;
9. Перекись водорода (Н2О2) 3% раствор, объем 10 см3 - 1 фл., №8;
10. 1 М серная кислота (стоп-реагент), объем 10 см3 - 2 фл., №9.
Пример 1. Приготовление компонентов набора.
Приготовление антигена. В заявляемой тест-системе антиген Cl. perfringens готовится следующим образом: получают биомассу бактерий Cl. perfringens каждого серотипа по отдельности (А, В, С, D), освобождают ее от остатков питательной среды путем 3-кратного отмывания физиологическим раствором. Готовят суспензии бактерий Cl. perfringens с концентрацией по 20 млрд м.к. в 1 см3. Затем суспензии бактерий Cl. perfringens смешивают в равных соотношениях. Получается суспензия бактерий Cl. perfringens с содержанием в 1 см3 по 5 млрд м.к. каждого серотипа. Полученную суспензию (20 млрд м.к. в 1 см3) озвучивают на ультразвуковом дезинтеграторе с частотой 20 мГц в течение 10-15 мин при 4°С до полного разрушения клеток. Затем эндотоксин осаждают сульфатом аммония при 40%-ном насыщении рН 7,0, освобождаются от которого диализом против водопроводной воды.
Пример 2. Приготовление контрольных сывороток.
2.1. Изготовление контрольной положительной сыворотки к антигену бактерий Cl. perfringens осуществляют путем гипериммунизации клинически здорового молодняка крупного рогатого скота 6-7-месячного возраста. Для этой цели применяют корпускулярный антиген и анатоксины производственных штаммов бактерий Cl. perfringens серотипов А (№28), В (LD-1), С (№392) и D (№213).
Корпускулярный антиген представляет собой инактивированные формалином бактерии Cl. perfringens, содержащий по 2,5 млрд м.к. каждого серотипа в 1 см3. Для получения анатоксина бактерии Cl. perfringens выращивают в жидкой питательной среде в течение 7 ч, потом токсин инактивируют формалином при температуре 37°С в течение 10 суток. Затем анатоксин очищают путем центрифугирования и фильтрации культуральной среды через бактериальные фильтры.
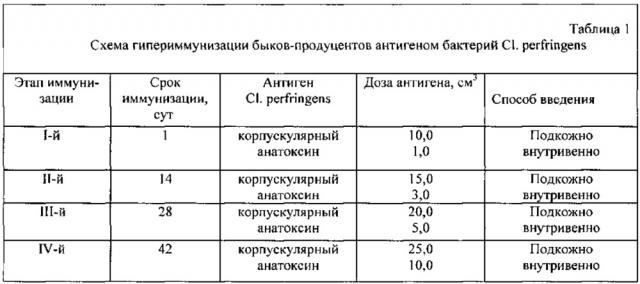
Гипериммунизацию животных проводят 4-кратно с интервалом 14 дней. При этом животным вводят одновременно корпускулярный антиген подкожно и анатоксин - внутривенно. Для предупреждения анафилактического шока, начиная со второго цикла иммунизации, животным вводят по 2 см3 антигена подкожно за 30-40 мин до введения основной дозы антигена. Схема гиперимунизации быков-продуцентов представлена в таблице 1.
Через 20 дней после последнего введения антигена у животных из яремной вены берут пробу крови для определения титра специфических антител. Производственное взятие крови разрешается при наличии антител в сыворотке крови быков-продуцентов к Cl. perfringens в титрах 1:6400-1:12800 в ИФА и при условии, если общая температура тела животных не превышает 39,5°С, а также после предварительной выдержки животных на голодной диете в течение 12 ч при неограниченном водопое.
2.2. Приготовление отрицательной контрольной сыворотки.
Контрольную отрицательную сыворотку получают от молодняка крупного рогатого скота 6-7-месячного возраста из хозяйства, свободного от клостридиозов, после выдерживания их в карантине в течение 2 месяцев. Предварительно сыворотку крови от животных исследуют в ИФА. У клинически здоровых неиммунизированных животных, не содержащих специфических антител к бактериям Cl. perfringens, проводят стерильное взятие крови из яремной вены из расчета 600 см3 крови на 100 кг массы животного. Кровь выдерживают 2 ч при температуре 20-22°С, затем обводят и отстаивают при температуре 4°С. Отстоявшуюся сыворотку отсасывают во флаконы в стерильных условиях, расфасовывают в ампулы по 1 см3 и лиофилизируют.
Пример 3. Стандартизация основных условий проведения исследований, заявляемой тест-системой ИФА.
3.1. Определение оптимального разведения антигена.
Проводят подбор концентрации антигена для адсорбции на полистироловый 96-луночный планшет. При этом оценивается интенсивность иммуноферментной реакции при следующих концентрациях антигена в растворе: 2, 2,5, 5, 8, 10 мкг/см3. В качестве тестируемых образцов используют «положительные» и «отрицательные» контрольные образцы сывороток крови животных. Проведен подбор концентрации сорбции антигена при параллельном тестировании различных разведений конъюгата. Наиболее приемлемый показатель титра сывороток крови животных при этом выявлен при разведении конъюгата 1:2500 и концентрации сорбированного антигена 5-8 мкг/см3. Таким образом, данное разведение конъюгата, при исходной концентрации сорбированного антигена 5-8 мкг/см3 было сочтено оптимальным и использовано для дальнейшей работы.
3.2. Подбор оптимальной времени экспозиции адсорбции антигена.
С этой целью испытаны режимы иммобилизации в течение 6, 18, 24 ч при температуре 4°С. Процесс адсорбции антигена оценивался по интенсивности реакции с контрольными гипериммунными положительными и негативными сыворотками в серийных разведениях. Критерием являлось достижение максимального значения ОП. Минимальные показатели оптической плотности наблюдались при инкубации при температуре 4°С в течение 18 и 24 ч. В результате проведенных исследований установлено, что эффективно использовать режим иммобилизации антигена в течение 18 часов при температуре 4°С.
3.3. Определение оптимального времени экспозиции исследуемых сывороток.
Процесс образования стабильных иммунных комплексов в тест-системе ИФА является сложным процессом и требует определенного времени, для установления которого в 3-х повторностях оценивалась интенсивность реакции в зависимости от времени инкубирования специфических и отрицательных сывороток в серийных разведениях при температуре 37°С. При этом конъюгат использовался в рабочем разведении 1:2500. Установлено, что показатели оптической плотности исследуемых сывороток в диапазоне от 15 до 60 мин возрастали, а далее стабилизировались. Наблюдаемый эффект был зафиксирован для сывороток, обладающих различным уровнем специфической активности. На этом основании 60-минутную экспозицию сывороток считалась достаточной для достижения максимальной и стабильной реакции.
3.4. Определение позитивно-негативного порога тест-системы ИФА.
Для учета и интерпретации результатов, полученных тест-системой ИФА, определен позитивно-негативный порог тест-системы, который находится в диапазоне <15% - >22%. В дальнейшем все пробы, значение Ксв которых было меньше позитивно-негативного порога, считали отрицательными, а пробы со значением Ксв, равным или превышающим этот показатель, положительными.
Пример 4. Иллюстрация применения тест-системы ИФА.
4.1. Подготовка биологического материала.
Для анализа используют сыворотку крови крупного рогатого скота. Если анализ проводят в течение 24 ч после отбора, образцы биоматериала хранят при температуре 4°С. При более длительном хранении образцы замораживают при температуре минус 20°С. Перед исследованием замороженные образцы быстро (в течение 5-10 мин) нагревают в водяной бане при температуре 37°С. В случае выпадения осадка пробы обязательно осветляют центрифугированием в течение 10 мин при 2000 g. Многократное замораживание и оттаивание образцов не допускается.
4.2. Подготовка рабочих растворов и реагентов.
Перед началом работы все реагенты выдерживают 30 мин при комнатной температуре.
4.2.1. Планшет для иммуноферментного анализа с адсорбированным в лунках антигеном бактерий Cl. perfringens готов к употреблению.
4.2.2. Рабочий раствор для разведения конъюгата - 0,01 М фосфатно-солевого буферного раствора (ФСБР). Содержимое флакона №4 доводят свежеприготовленной дистиллированной водой до объема 400 см3. Допускается хранить не более 1 мес при температуре 4±2°С.
4.2.3. Рабочий раствор для промывки планшетов (ФСБР/т). К 500 см3 фосфатно-солевой буферного раствора (ФСБР) добавляют 0,25 см3 твин-80 (флакон №5) и перемешивают до полного растворения.
4.2.4. Сыворотки крупного рогатого скота положительную (№1) и отрицательную (№2) растворяют дистиллированной водой до 1 см3.
4.2.5. Содержимое ампулы с конъюгатом (№3) растворяют фосфатно-солевым буферным раствором, не содержащего твин-80 (ФСБР) да рабочего разведения.
4.2.6. Содержимое ампулы с перекисью водорода (№8) растворяют в дистиллированной воде в объеме, указанном на этикетке ампулы.
4.2.7. Субстратно-индикаторную смесь готовят непосредственно перед использованием в реакции следующим образом: содержимое флакона №7 (хромоген) растворяют в 10 см3 цитратно-фосфатного буферного раствора (флакон №6) и вносят 0,17 см3 перекиси водорода.
4.2.8. Стоп-реагент - готов к употреблению.
4.3. Проведение анализа.
4.3.1. Во все лунки планшета с сорбированными антигенами вносят по 0,1 см3 буферного раствора ФСБР/т. Контрольные (отрицательная и положительная) и исследуемые сыворотки разводят в 40 раз буферным раствором ФСБР/т и вносят в горизонтальные лунки планшета в объеме 0,1 см3. При этом в лунку А1 вносят контрольную отрицательную сыворотку, в лунку А2 - контрольную положительную и в лунки от A3 до А12 - исследуемые сыворотки и готовят двукратные разведения их от 1:80 до 1:10240. Планшет закрывают крышкой и инкубируют при 37±0,5°С в течение 1 ч.
4.3.2. Отмывание планшета. Планшет 5 раз промывают буферным раствором ФСБР/т (доверху заполняя лунки), в каждом случае полностью удаляя жидкость постукиванием перевернутого планшета по фильтровальной бумаге.
4.3.3. Внесение иммунопероксидазного конъюгата. В каждую лунку вносят по 0,1 см3 иммунопероксидазного конъюгата в рабочем разведении. Инкубируют в течение 1 ч при 37±0,5°С.
4.3.4. Отмывание планшета.
4.3.5. Внесение субстратно-индикаторной смеси. Во все лунки планшета вносят по 0,1 см3 субстратно-индикаторную смесь. Планшет закрывают крышкой и инкубируют в темноте 20 мин при комнатной температуре.
4.3.6. Остановка реакции. Не сливая содержимое, во все лунки планшета добавляют 0,05 см3 стоп-реагент (1 М раствор серной кислоты).
4.3.7. Оценка и интерпретация результатов реакции.
Результаты ИФА учитывают после остановки реакции по показаниям оптической плотности субстратно-индикаторной смеси на спектрофотометре при длине волны 492 нм (ОП492). Реакцию считают положительной, если оптическая плотность субстратно-индикаторной смеси в лунках, в которых предварительно инкубировали положительную специфическую сыворотку и исследуемые сыворотки, в 2 и более раза превышает оптическую плотность в лунках, в которых предварительно инкубировали отрицательную (контрольную) сыворотку.
Пример 5. Испытание тест-системы ИФА в производственных условиях.
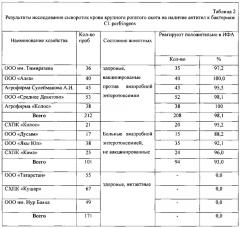
При производственном испытании эффективности набора были использованы образцы крови крупного рогатого скота, доставленных из различных в эпизоотическом отношении по клостридиозам скотоводческих хозяйств Республики Татарстан. При этом исследовались сыворотки крови от больных, не вакцинированных и здоровых, вакцинированных животных из неблагополучных по клостридиозам хозяйств, а также от интактных животных из благополучных хозяйств. Результаты исследования сывороток крови представлены в таблице 2. Из таблицы видно, что компоненты набора обладают высокой специфичностью в ИФА. Они позволяют определит специфические антитела к бактериям Cl. perfringens у 98,1% здоровых вакцинированных животных и 93,0% больных анаэробной энтеротоксемией животных.
В то же время установлено, что компоненты набора не реагируют с сыворотками крови, полученными от интактных животных из благополучных по анаэробной энтеротоксемии хозяйств.
Таким образом, предлагаемая тест-система позволяет по титрам специфических антител в сыворотке крови выявлять больных животных среди невакцинированного поголовья, а также определить напряженность иммунитета у вакцинированных животных.
Источники информации
1. Куриленко А.Н. Бактериальные и вирусные болезни молодняка сельскохозяйственных животных / А.Н. Куриленко, В.Л. Крупальник, Н.В. Пименов. - М.: КолосС, 2006. - 296 с.
2. Методические указания по лабораторной диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят. Лабораторные исследования в ветеринарии. Бактериальные инфекции. Справочник. /Под ред. Б.И. Антонова, 1986.
3. Патент РФ. Вакцина ассоциированная против анаэробной энтеротоксемии и эшерихиозной диареи телят / Г.Н. Спиридонов, А.А. Иванов, Х.Н. Макаев, М.Т. Хурамшина, А.Г. Спиридонов, Э.Р. Галиуллина; заявитель и патентообладатель ФГБУ «Федеральный центр токсикологической, радиационной и биологической безопасности». - №2428202, опубл. 10.09.2011, Бюл. №25.
4. Салимов В.А. Некоторые особенности патологоанатомической диагностики анаэробной энтеротоксемии телят, вызванной Cl. perfringens типа А / В.А. Салимов, Н.П. Салимова // Актуальные проблемы болезней молодняка в современных условиях: мат. науч. - практ. конф. - Воронеж, 2002. - С. 527-528.
5. Спиридонов Г.Н. Инфекционная энтеротоксемия молодняка сельскохозяйственных животных в регионе Среднего Поволжья и Предуралья. / Г.Н. Спиридонов, А.Ф. Махмутов, М.Т. Хурамшина, А.Г. Спиридонов // Актуальные вопросы ветеринарной медицины Сибири: мат. науч. - практ. конф. - Краснообск, 2010. - С. 134-139.
6. Ургуев К.Р. Клостридиозы животных / К.Р. Ургуев. - М.: Россельхозиздат, 1987.- 183 с.
7. Ceci L. Haemorrhagic bowel syndrome in dairy cattle: possible role of Clostridium perfringens type A in the disease complex / L. Ceci, P. Paradies, M. Sasanelly, D. de Caprariis, F. Guarda // J. Vet. Med. - 2006. - 53 - P. 518-523.
8. Gurjar A. Characterization of Toxin Plasmids in Clostridium perfringens type С isolates / A. Gurjar, J. Li, B.A. McClane // Infection and Immunity. - 2010. - 78 - 11 - P. 4860-4869.
9. Van Kruiningen H.J. Clostridial abomasal disease in Connecticut dairy calves / H.J. Van Kruiningen, C.A. Nyaoke, I.F. Sidor, J.J. Fabis, L.S. Hinckley, K.A. Lindell // CVJ. - 2009. - 50 - P. 857-860.
Иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета, отличающаяся тем, что она содержит специфические антигены штаммов Clostridium perfringens №28 (тип A), LD-1 (тип В), №392 (тип С), №213 (тип D), полученные путем 3-кратного отмыва их физиологическим раствором, смешиванием этих бактерий в равных соотношениях по 5 млрд м.к. в 1 см3 каждого серотипа, с последующим разрушением бактериальных клеток ультразвуком с частотой 20 мГц в течение 10-15 мин при 4°C, дальнейшим осаждением эндотоксина сульфатом аммония при 40%-ном насыщении рН 7,0 и диализом против водопроводной воды, представляющие собой специфический белок в концентрации 8-10 мкг/см3, адсорбированный на поверхности полистироловых лунок в карбонатно-бикарбонатном буфере, контрольную положительную сыворотку, полученную к антигенам Cl. perfringens серотипов А, В, С, D с активностью 1:6400-1:12800, контрольную отрицательную сыворотку, конъюгат антивидовой, калий фосфорнокислый однозамещенный, калий фосфорнокислый двухзамещенный, натрий хлористый, детергент, хромоген (ортофенилендиамин), перекись водорода, стоп-реагент и панели для постановки реакции иммуноферментного анализа.