Термостойкий полиариленфталид и способ его получения
Иллюстрации
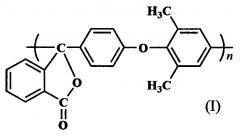
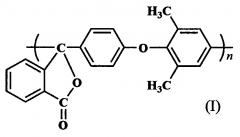
Показать всеНастоящее изобретение относится к полиариленфталидам. Описан полиариленфталид формулы I
с приведенной вязкостью 0,30; 0, 74 и 0, 80 дл/г. Также описан способ получения указанного выше полиариленфталида, включающий: взаимодействие 2-(4'-фторбензоил)бензойной кислоты с 2,6-диметилфенолом в присутствии K2CO3 при нагревании в N,N-диметилацетамиде, обработку образовавшейся 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты хлористым тионилом и самополиконденсацию полученного при этом псевдохлорангидрида в нитро- или хлорсодержащих углеводородах с использованием хлоридов элементов III, IV, V, VIII групп в качестве катализатора. Технический результат – получение термо- и теплостойкого полиариленфталида, обладающего повышенной устойчивостью к гидролизу в кислых средах. 2 н. и 1 з.п. ф-лы, 3 пр.
Реферат
Изобретение относится к химии высокомолекулярных соединений, в частности к полиариленфталидам, конкретно к полиариленфталиду формулы I на основе псевдохлорангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты и способу его получения.
Соединение по изобретению наиболее эффективно может быть использовано в качестве хемо-, тепло- и термостойкого материала для изготовления конструкционных пластиков, пленок и покрытий, а также в качестве «умного» материала для электроники.
Заявляемое соединение, его свойства и способ получения в литературе не описаны.
Известны близкие ему по структуре соединения, например полидифениленфталид II на основе псевдохлорангидрида 2-(4'-фенилбензоил)бензойной кислоты и полиариленфталид III на основе псевдохлорангидрида 2-(4'-феноксибензоил)бензойной кислоты (ближайший аналог заявляемого соединения), которые являются хемо-, тепло- и термостойкими материалами, а также проявляют особые свойства (прежде всего эффект обратимого электронного переключения при воздействии различных факторов: давления, электрического и магнитного полей и др.), делающие перспективным их использование в качестве материалов для электроники [Рафиков СР., Толстиков Г.А., Салазкин С.Н., Золотухин М.И. Ас. СССР RU 734989; Б.И., 1981, №20, 259].
Полиариленфталиды II и III получают с выходами 93-97% самополиконденсацией псевдохлорангидридов 2-(4'-фенилбензоил)- и 2-(4'-феноксибензоил)бензойных кислот в среде нитросоединений (нитробензол, нитрометан) или хлорированных углеводородов (дихлорэтан, хлористый метилен и др.) при использовании хлоридов элементов III, IV, V, VIII групп (SbCl5, АlСl3, FeCl3, InCl3 и др.) в качестве катализатора [Рафиков СР., Толстиков Г.А., Салазкин С.Н., Золотухин М.И. Ас. СССР RU 734989; Б.И., 1981, №ь 20, 259].
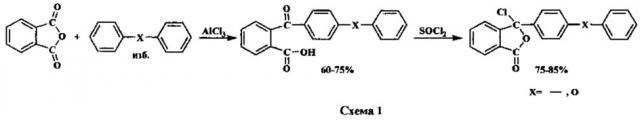
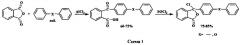
Псевдохлорангидриды, используемые в качестве мономеров для полиариленфталидов II и III, в свою очередь получают по следующей схеме: сначала ацилируют дифенил или дифенилоксид фталевым ангидридом по Фриделю-Крафтсу в присутствии хлористого алюминия, а затем образовавшиеся кислоты обрабатывают хлористым тионилом (схема 1) [Ковардаков В.А., Золотухин М.Г., Салазкин С.Н., Рафиков С.Р. Изв. АН СССР, сер. хим., 1983, №4, 941-943; Салазкин С.Н. Высокомол. соед., сер. Б, 2004, №7, 1244-1269].
Полиариленфталиды II и III растворимы во многих органических растворителях, способны к образованию из растворов прозрачных прочных пленок, покрытий и волокон, в том числе ультратонких для фильтрующих материалов Петрянова. Они также могут быть переработаны из расплава в монолитные прочные пластики.
Полиариленфталиды II и III являются термо- и теплостойкими соединениями: температура потери 1% массы составляет на воздухе 440 и 390°С, а температура начала размягчения - 420 и 310°С для полимера II и III соответственно.
Кроме того, полиариленфталиды II и III обладают высокой химической стойкостью. Однако они недостаточно устойчивы в кислых средах. Так, после прогрева в течение 10 ч при 100°С в концентрированной соляной кислоте приведенная вязкость образца полимера II понижается с 0,62 до 0,56 дл/г, а как приведенная вязкость образца полимера III понижается с 2,02 до 1,33 дл/г. Значительное понижение приведенной вязкости в случае полимера III объясняется тем, что простые эфирные связи в нем разрушаются в кислой среде вследствие протонирования их атомов кислорода.
Задачей заявляемого изобретения является создание термо- и теплостойкого полиариленфталида, обладающего повышенной устойчивостью к гидролизу в кислых средах.
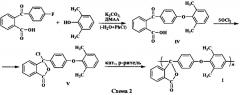
Поставленная задача решается новым полиариленфталидом формулы I на основе псевдохлорангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты и способом его получения, включающим: взаимодействие 2-(4'-фторбензоил)бензойной кислоты с 2,6-диметилфенолом в присутствии K2СO3 при нагревании в N,N-диметилацетамиде; обработку образовавшейся 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты хлористым тионилом и самополиконденсацию полученного псевдохлорангидрида в нитро- или хлорсодержащих углеводородах с использованием хлоридов элементов III, IV, V, VIII групп в качестве катализатора (схема 2).
Первые стадии способов получения заявляемого соединения I и его аналогов II, III коренным образом различаются, что обусловлено крайней проблематичностью использования реакции Фриделя-Крафтса для получения кислоты IV из-за труднодоступности необходимого при этом 2,6-диметилдифенилоксида и принципиальной невозможности осуществить его селективное (по незамещенной фенильной группе) ацилирование фталевым ангидридом.
Первая стадия заявляемого способа получения соединения по изобретению представляет собой реакцию нуклеофильного ароматического замещения фтора. В качестве субстрата выступает коммерчески доступная 2-(4'-фторбензоил)бензойная кислота, а в качестве нуклеофильного реагента - 2,6-диметилфенолят калия, получаемый in situ из коммерчески доступного 2,6-диметилфенола и K2СО3 при азеотропной отгонке образующейся при этом воды с хлорбензолом. Реакцию проводят в высококипящем N,N-диметилацетамиде и получают 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойную кислоту (IV) с выходом 77%.
На второй стадии кислоту IV обрабатывают хлористым тионилом при нагревании и получают псевдохлорангидрид V практически с количественным выходом.
На третьей стадии осуществляют самополиконденсацию фталидного мономера V, представляющую собой алкилирование по Фриделю-Крафтсу, которая протекает в нитро- или хлорсодержащих углеводородных растворителях при использовании кислот Льюиса в качестве катализатора. (Отметим, что фталидный фрагмент с С(O)O-группой, присутствующий в соединении V, в ряде случаев, например AlСl3, может связывать эквимолярное количество кислоты Льюиса; при этом, строго говоря, самополиконденсация не может рассматриваться как каталитический процесс.) При проведении самополиконденсации мономера V в нитробензоле или дихлорэтане с использованием таких кислот Льюиса, как SbCl5, FeCl3 или AlCl3, выход полиариленфталида I составляет 89-96%.
Полиариленфталид I по изобретению хорошо растворим в доступных органических растворителях, таких как метиленхлорид, хлороформ, ди- и тетрахлорэтан, N,N-диметилформамид и -ацетамид, N-метилпирролидон, нитробензол, крезол и др., из растворов которых образует прозрачные пленки. Кроме того, он может быть переработан из расплава.
В заявляемом полиариленфталиде I простые эфирные связи, в отличие от ближайшего аналога III, экранированы орто-метильными группами, которые в определенной степени защищают атомы кислорода этих групп от протонирования, что приводит к большей химической устойчивости полимера I, особенно к гидролизу в кислых средах. Действительно, после прогрева в концентрированной соляной кислоте при 100°С в течение 10 ч приведенная вязкость полиариленфталида I не изменяется, тогда как у ближайшего аналога III она значительно понижается.
Кроме того, метальные группы в заявляемом полимере I тормозят вращение по связи 2,6-Ме2С6Н3-O, что увеличивает его теплостойкость по сравнению с ближайшим аналогом III: температура начала размягчения повышается на 10-15°С.
Заявляемый полиариленфталид I обладает и лучшей термостойкостью: температура потери им 1% массы на воздухе составляет 420°С, в то время как у ближайшего аналога III - 390°С.
Несимметричность окружения фталидной группы в заявляемом полимере I (с одной стороны - ароматическое ядро с двумя метальными заместителями, а с другой - ароматическое ядро без заместителей) делает перспективным его использование для создания материалов для электроники.
Осуществление заявляемого изобретения иллюстрируется конкретными примерами.
Пример 1. Получение полиариленфталида I
(1) Получение 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты (IV)
Четырехгорлую колбу, снабженную мешалкой, термометром, трубкой для подачи инертного газа и системой для азеотропной отгонки, помещают в масляную баню, продувают аргоном и загружают 20,00 г (0,082 моль) 2-(4'-фторбензоил)бензойной кислоты, 9,99 г (0,082 моль) 2,6-диметилфенола, 14,71 г (0,106 моль) предварительно прокаленного и тщательно измельченного K2СO3, 164 мл N,N-диметилацетамида и 82 мл хлорбензола. Реакционную массу перемешивают в токе аргона при постепенном подъеме температуры масла в бане до 185°С в течение часа. После завершившейся за это время отгонки азеотропной смеси хлорбензол - вода и избытка хлорбензола продолжают перемешивание при кипячении около 16 ч. Затем реакционную массу охлаждают и фильтруют для удаления непрореагировавшего K2СO3 и образовавшегося KF. N,N-Диметилацетамид отгоняют на роторном испарителе, его остатки экстрагируют диэтиловым эфиром. Далее реакционную массу растворяют в 300 мл дистиллированной воды, добавляют активированный уголь и оставляют на час при перемешивании при комнатной температуре. Для удаления угля раствор фильтруют через складчатый фильтр и подкисляют концентрированной соляной кислотой (до рН=1-2). Выпавший продукт отфильтровывают, тщательно промывают водой, сушат при постепенном подъеме температуры от 60 до 120°С в течение 20 ч и перекристаллизовывают из бензола. Получают 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойную кислоту в виде белого твердого вещества (т.пл. 193,0-193,7°С) с выходом 77%.
Вычислено, %: С 76,30; Н 5,20. С22Н18O4. Найдено, %: С 76,39; Н 5,14.
1Н ЯМР-спектр (d6-ацетон), δ, м.д.: 2,104 (6Н, с, Н21, Н22); 6,822-6,844 (1H, м, Н18); 7,104-7,186 (4Н, м, Н11, Н13, Н17, Н19); 7,410-7,428 (1Н, д, Н4, J=7,3 Гц); 7,635-7,753 (3Н, м, Н3, Н10, Н14); 8,088-8,107 (2Н, м, Н2, Н5).
13С ЯМР-спектр (d6-ацетон), δ, м.д.: 15,435 (С21, С22); 114,26 (С11, С13); 125,69 (С18); 127,53 (С6); 129,19 (С16, С20); 129,31 (С5); 129,41 (С2); 130,09 (С17, С19); 130,84 (С4); 131,54 (С9); 131,69 (С10, С14); 132,36 (С3); 142,62 (С7); 150,51 (С15); 161,40 (С12); 166,29 (С8); 205,35 (С1).
ИК-спектр (КВr): 3436 (сл, νOH), 3065 (сл, νC-H в ароматическом кольце), 2952 (сл, νasCH3), 2853 (сл, νsCH3), 2661, 2549 (сл, колебания ОН-группы), 1688 (оч. с, νCO в карбоксильной группе), 1674 (оч. с, νCO кето-группы), 1600 (оч. с, колебания ароматического кольца), 1586 (с, колебания ароматического кольца), 1241 (оч. с, колебания простой эфирной связи) см-1.
(2) Получение псевдохлорангидрида 2-[4'-(2'',6''-диметилфенокси)бензо-ил]бензойной кислоты (V). В колбу, снабженную обратным водяным холодильником, загружают 5,00 г (0,014 моль) 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты и 2,60 мл (0,036 моль) хлористого тионила. Реакционную массу нагревают на масляной бане при 70°С в течение 4 ч, затем отгоняют в вакууме избыток хлористого тионила и получают псевдохлорангидрид V в виде бордовой стеклообразной массы, температура размягчения 146-152°С, практически с количественным выходом.
Вычислено, %: С 72,43; Н 4,66; Cl 9,74. C22H17ClO3. Найдено, %: С 72,39; Н 4,68; Cl 9,66. ИК-спектр (KВr): 3043 (сл, νC-H в ароматическом кольце), 2952 (сл, νasCH3) 2855 (сл, νsCH3), 1792, 1770 (оч. с, νCO в лактонном цикле, «кристаллическое расщепление»), 1233 (оч. с, колебания простой эфирной связи), 688 (ср, колебания С-Cl) см-1.
(3) Получение полиариленфталида I из полученного псевдохлорангидрида (V) в нитробензоле с использованием SbCl5 в качестве катализатора. В четырехгорлую колбу, снабженную мешалкой, обратным холодильником, термометром и трубкой для ввода газа, загружают 5,00 г (0,014 моль) псевдохлоргангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты, 6,86 мл нитробензола, 0,1 мл (0,78 ммоль) пятихлористой сурьмы и нагревают при перемешивании в токе аргона при 85°С в течение 10 ч. Затем реакционную массу охлаждают и растворяют в хлороформе. Продукт высаждают в метиловый спирт, отфильтровывают, промывают метиловым спиртом и ацетоном и сушат в сушильном шкафу при постепенном подъеме температуры от 60 до 180°С в течение 16 ч. Получают полиариленфталид I в виде белых волокон с выходом 96%. Приведенная вязкость его раствора в хлороформе ηпр=0,74 дл/г.
Пример 2. Получение полиариленфталида I в нитробензоле с использованием FeCl3 в качестве катализатора
Псевдохлорангидрид (V) получают так же, как описано в примере 1 (стадии 1 и 2). В четырехгорлую колбу, снабженную мешалкой, обратным холодильником, термометром и трубкой для ввода газа, загружают 5,00 г (0,014 моль) псевдохлоргангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты (V), 6,86 мл нитробензола, 0,022 г (0,14 ммоль) треххлористого железа и нагревают при перемешивании в токе аргона при 85°С в течение 10 ч. Затем реакционную массу охлаждают и растворяют в хлороформе. Продукт высаждают в метиловый спирт, отфильтровывают, промывают метиловым спиртом и ацетоном и сушат в сушильном шкафу при постепенном подъеме температуры от 60 до 180°С в течение 16 ч. Получают полиариленфталид I в виде белых волокон с выходом 93%. Приведенная вязкость его раствора в хлороформе ηпр=0,80 дл/г.
Пример 3. Получение полиариленфталида I в дихлорэтане с использованием AlCl3
Псевдохлорангидрид (V) получают так же, как описано в примере 1 (стадии 1 и 2). В четырехгорлую колбу, снабженную мешалкой, обратным холодильником, термометром и трубкой для ввода газа, загружают 5,00 г (0,014 моль) псевдохлоргангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты (V), 137 мл дихлорэтана, 2,56 г (0,019 моль) хлористого алюминия и нагревают при перемешивании в токе аргона при 85°С в течение 10 ч. Затем реакционную массу охлаждают и растворяют в хлороформе. Продукт высаждают в метиловый спирт, отфильтровывают, промывают метиловым спиртом и ацетоном и сушат в сушильном шкафу при постепенном подъеме температуры от 60 до 180°С в течение 16 ч. Получают полиариленфталид I в виде белых волокон с выходом 89%. Приведенная вязкость его раствора в хлороформе ηпр=0,30 дл/г.
Вычислено, %: С 80,49; Н 4,88. С20Н16О3. Найдено, %: С 80,25; Н 4,96.
1H ЯМР-спектр (CDCl3), δ, м.д.: 2,060 (6Н, с, Н21, Н22); 6,670-6,690 (2Н, м, Н17, Н19); 7,067 (2Н, с, Н11, Н13); 7,164-7,184 (2Н, м, Н10, Н14); 7,258 (1H, с, Н4); 7,547-7,564 (1Н, м, Н2); 7,695-7,712 (1H, м, Н3); 7,958-7,940 (1H, м, Н5).
13С ЯМР-спектр (CDCl3), δ, м.д.: 16,616 (С21, С22); 91,318 (С1); 114,56 (С11, С13); 124,08 (С2); 125,53 (С6); 126,03 (С4); 127,53 (С16, С20); 129,03 (С10, С14); 129,38 (С5); 131,55 (С17, С19); 133,70 (С18); 134,19 (С3); 137,65 (С9); 150,93 (С15); 152,23 (С7); 157,68 (С12); 169,78 (С8).
ИК-спектр (KBr): 3022 (сл, νC-H в ароматическом кольце), 2955 (сл, νasCH3), 2860 (сл, νsCH3), 1772 (оч. с, νCO в лактонном цикле), 1233 (оч. с, колебания простой эфирной связи) см-1.
Термостойкость заявляемого соединения оценивали по результатам термогравиметрического анализа. Температура потери 1% массы на воздухе и в атмосфере аргона составляет 420 и 400°С соответственно.
Теплостойкость полимера определяли термомеханическим методом. Температура начала размягчения составляет 320-325°С.
Химическую стойкость полимера к гидролизу в кислых средах оценивали по изменению значения приведенной вязкости после прогрева пленки образца полимера в концентрированной соляной кислоте при 100°С в течение 10 ч. Значения приведенной вязкости до и после испытания абсолютно идентичны.
Таким образом, из псевдохлорангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты получен полимер и подтверждена его тепло- и термостойкость, а также повышенная устойчивость к гидролизу в кислых средах.
Техническим результатом заявляемого изобретения является создание нового термо- и теплостойкого полиариленфталида, обладающего повышенной устойчивостью к гидролизу в кислых средах и перспективного в качестве хемо-, тепло- и термостойкого конструкционного материала, а также «умного» материала для электроники.
1. Полиариленфталид формулы I с приведенной вязкостью 0,30; 0,74 и 0, 80 дл/г.
2. Полиариленфталид по п. 1 в качестве термо- и теплостойкого материала, устойчивого к гидролизу в кислых средах.
3. Способ получения соединения по п. 1, включающий взаимодействие 2-(4'-фторбензоил)бензойной кислоты с 2,6-диметилфенолом в присутствии K2CO3 при нагревании в N,N-диметилацетамиде, обработку образовавшейся 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты хлористым тионилом и самополиконденсацию полученного при этом псевдохлорангидрида в нитро- или хлорсодержащих углеводородах с использованием хлоридов элементов III, IV, V, VIII групп в качестве катализатора.