Симметричный полифторалкилсодержащий аминодисульфид в качестве присадки к индустриальному маслу и способ его получения
Иллюстрации
Показать всеИзобретение относится к новым симметричным полифторалкилсодержащим аминодисульфидам формулы I:
Технический результат: получены новые симметричные полифторалкилсодержащие аминодисульфиды, используемые в качестве присадки к индустриальному маслу, а также разработан способ их получения. 2 н.п. ф-лы, 2 табл., 4 пр., 6 ил.
Реферат
Изобретение относится к химии фторорганических соединений, а именно к симметричному полифторалкилсодержащему аминодисульфиду и способу его получения. Соединение может быть использовано как присадка к индустриальным маслам.
Дисульфиды играют значительную роль в биохимических процессах, активно используются в химической технологии и органическом синтезе [Jocelyn Р.С., Biochemistry of the Thiol Group.New York, etc: American Press. 1992; Alves L. de C., Rubinger M.M.M., Tavares E. do C., Janczak J., Pacheco E.B.A.V., Visconte., L.L.Y., Oliveira M.R.L. Journal Molecular Structure. 2013, 1048, 244; A, Costa C., Rodrigues A. Chemical Engineering Science. 1987, 42, 2291; Hiskey R.G., Rao V.R., Rhodes W.G. Protective groups in organic chemistry. Protection of Thiols, etc: Plenum Publishing Company. 1973], применяются в качестве присадок к смазочным материалам [Кламанн Д. Смазки и родственные продукты. Синтез, свойства, применение, международные стандарты. - М.: Химия, 1988, 215]. Слабосвязанная форма серы в молекуле дисульфида способствует быстрой деструкции S-S связи во время трибохимической реакции. При этом на поверхности трущихся деталей образуется мономолекулярный слой, состоящий из солей металла (сульфиды, сульфаты и др.), который уменьшает вероятность сваривания поверхностей трущихся деталей, уменьшает их износ и коэффициент трения. Однако использование исключительно присадки дисульфида к смазочным материалам лишь умеренно улучшает трибологические характеристики, поэтому серосодержащие присадки, как правило, используются в комплексе с другими соединениями - азот- и фосфорсодержащими [Кламанн Д. Смазки и родственные продукты. Синтез, свойства, применение, международные стандарты.- М.: Химия, 1988, 215]. Фтор также является активным элементом, способным образовывать солевые слои на поверхности металла во время трибохимических реакций. Предполагается, что компиляция нескольких активных элементов в одной органической молекуле может в несколько раз улучшать полезные свойства присадки. Поэтому разработка и синтез различных структур, содержащих одновременно атомы фтора, азота и серы, является актуальной задачей. Примером таких соединений могут служить симметричные фторсодержащие дисульфиды, имеющие в своем составе фрагменты аминов.
Известно, что одним из основных направлений использования фторсодержащих дисульфидов является модификация поверхности частиц золота 3[Thebault P., Taffin de Givenchy Е., Guittard F., Guimon С., S. Thin Solid Films. 2008, 516, 1765; H. , G.J. Vancso, Materials Science and Engineering. 1999, 8-9, 24]. При нанесении фторсодержащего дисульфида из раствора на поверхность металла происходит образование самоорганизующегося слоя дисульфида. Модификация поверхности изменяет свойства частиц, в том числе трибологические. Авторы работы [Н. , G.J. Vancso, Materials Science and Engineering. 1999, 8-9, 243] провели сравнительные исследования, используя фторированные и нефторированные дисульфиды в качестве модификаторов поверхности и установили, что наименьшие силы трения во время проведения трибологических испытаний регистрируются при использовании симметричных дисульфидов VII (Фиг. 1).
В литературе представлено несколько подходов к синтезу симметричных фторсодержащих дисульфидов. Например, авторы работы [Mureau N., Guittard F., S. Tetrahedron Letters. 2000, 41, 2885] предлагают синтезировать фторированный дисульфид многостадийным методом. При этом исходным соединением является полифторалкилиодид RF(CH)2I, а конечным продуктом - соединение общей формулы RF(CH2)4SS(CH2)4RF. Суммарный выход целевого продукта не превышает 37% (Фиг. 2).
Другой способ получения симметричных дисульфидов продемонстрирован в работе [Anselmi Е., Blazejewski J-C., Tordeux М., Wakselman С. Journal of Fluorine Chemistry. 2000, 105, 41] (Фиг. 3). Здесь в реакции перфториодида или перфторбромида с алифатическим дитиолом получена смесь продуктов, в том числе дисульфиды. Их выход составляет не более 8%.
Описанные выше соединения не содержат фрагменты аминов, поэтому наиболее близким к предмету изобретения является соединение и способ его получения, упомянутые в статье [Thebault P., Taffin de Givenchy Е., Guittard F., Guimon С., S. Thin Solid Films. 2008, 516, 1765] - (прототип), где соединения 3а,б получают в три стадии (Фиг. 4). Первая из них подразумевает синтез перфторалкилсодержащего бромацетамида 1а,б. Реакцию проводят в безводном диэтиловом эфире в течение 12 ч в присутствии пиридина при 0°С. Мольное соотношение исходных веществ - полифторалкилэтиленамина и бромангидрида бромуксусной кислоты - составляет 1:1. Затем реакционную массу промывают раствором соляной кислоты, органические и водные фракции разделяют, водную экстрагируют эфиром. Далее органические фракции объединяют и сушат над Na2SO4, растворитель отгоняют. Целевой продукт 1а,б очищают перекристаллизацией из петролейного эфира.
На второй стадии получают N,N,N',N'-тетраметилцистамин 2а,б (Фиг. 4) путем обработки цистаминдигидрохлорида смесью муравьиной кислоты и формальдегида. Реакцию проводят в течение 3 ч при 90°С. Соотношение реагентов - цистаминдигидрохлорид: муравьиная кислота: формальдегид - составляет 1:5:3. Затем к полученной смеси приливают 10%-ный водный раствор NaOH, три раза экстрагируют диэтиловым эфиром, сушат над Na2SO4. Далее отгоняют растворитель и используют полученный продукт в реакции с 2-перфторфторалкилбромацетамидом 1а,б на третьей стадии (Фиг. 4). Реакцию ведут в течение 48 ч в среде диэтилового эфира при кипении реакционной массы. Конечный продукт 3а,б выпадает в осадок, его отфильтровывают и промывают диэтиловым эфиром. Суммарный выход по результатам трех стадий составляет 45-48%.
Недостатком данного способа является использование труднодоступных и дорогостоящих исходных соединений, низкокипящих и легковоспламеняющихся растворителей, большого избытка реагентов и длительное время всего трехстадийного процесса.
Задачей предлагаемого изобретения является синтез симметричного азотфторсодержащего дисульфида, используемого как присадка к индустриальному маслу, наиболее удобным способом.
Поставленная задача решается тем, что в способе получения симметричного дисульфида общей формулы (Фиг. 5):
- на первой стадии полифторированный спирт общей формулы H(CF2)nCH2OH (где n=2, 4) взаимодействует с эпихлоргидрином в щелочной среде, образуя фторсодержащие глицидиловые эфиры (Фиг. 6);
- на второй стадии тиомочевина реагирует с фторсодержащими глицидиловыми эфирами, результатом взаимодействия являются тиоглицидиловые эфиры;
- на третьей стадии тиоглицидиловые эфиры взаимодействуют с морфолином или N-метилпиперазином, образуя симметричный дисульфид. После каждой стадии процесса требуется выделение промежуточного продукта.
Представленные на III стадии (Фиг. 6) результирующие соединения в литературе не описаны. Их структуры отличаются от существующих аналогов из прототипа отсутствием карбонильной и четвертичной аммонийной групп.
Предлагаемый способ получения фторсодержащих дисульфидов характеризуется следующими преимуществами:
1. В настоящем изобретении использованы более простые и коммерчески доступные реагенты. Полифторированный заместитель вводится посредством теломерных спиртов, выпускаемых отечественной промышленностью. Получаемые при этом полифторированные глицидиловые эфиры 4а,б широко используются для получения различных материалов. На второй стадии образование тииранов 5а,б идет под действием тимочевины в среде метанола. Данный способ получения тииранов хорошо себя зарекомендовал для синтеза нефторированных аналогов [А.В. Фокин, А.Ф. Коломиец, Химия тиранов. М., Наука, 1978, 343 с.]. Образование дисульфида идет на третьей стадии. В процессе раскрытия тииранового цикла под действием морфолина или N-метилпиперазина образованные in situ 1,2-аминотиолы не выделяются, а сразу же окисляются в реакционной среде в присутствии кислорода воздуха до целевых симметричных дисульфидов 6а,б, 7а,б. Данный процесс позволяет осуществить два химических превращения в одну стадию.
2. Представленный способ не требует использования большого избытка реагентов по отношению к субстрату. На первой стадии мольное соотношение полифторированного спирта и эпихлоргидрина составляет 1:2, на второй стадии мольное соотношение оксиранов 4а,б и тиомочевины - 1:1,7, на третей стадии мольное соотношение тииранов 5а,б и амина - 1:2.
3. На всех стадиях использованы растворители, не требующие дополнительной подготовки (высушивания, абсолютирования, другой очистки).
4. Суммарное время реакции сокращено с 63 ч до 19-27 ч.
5. Суммарный выход по результатам трех стадий увеличен на 2-7%.
Пример 1
Первая стадия. В трехгорлую колбу, снабженную механической мешалкой и обратным холодильником, помещают 13.2 г (0.1 моль) 2,2,3,3-тетрафторпропанола, 4.0 г (0.1 моль) заранее растертого в ступке NaOH. Перемешивают в течение 15 мин, затем приливают 18.5 г (0.2 моль) эпихлогидрина. Выдерживают в течение 1 ч при температуре 70-80°С. Реакционную массу промывают водным раствором H2SO4 до рН=7. Органический слой отделяют, водный экстрагируют CHCl3 (2*20 мл.). Органические фракции объединяют и сушат над MgSO4. Растворитель отгоняют, остаток фракционируют перегонкой с использованием колонки Вигре. Получают 15.0 г (2,2,3,3-тетрафторпропилокси)метилоксирана 4а. Выход 80%, бесцветная жидкость, т.кип 175-178°С. Спектральные характеристики соответствуют данным из статьи [Соловьев Д.В., Коломенская Л.В., Родин А.А., Зенкевич И.Г., Лаврентьев А.Н. Журнал органической химии, 1991, 61, 673].
Вторая стадия. В трехгорлую колбу, снабженную механической мешалкой и обратным холодильником, помещают 100 мл метанола, 9.6 г (0.1 моль) тиомочевины, смесь перемешивают в течение 20 мин. Затем приливают 14.0 г (74.5 ммоль) (2,2,3,3-тетрафторпропилокси)метилоксирана. Выдерживают при комнатной температуре 6 ч. Далее реакционную массу промывают в 200 мл водного раствора NaCl. Слои разделяют, водный экстрагируют CHCl3 (2*20 мл). Органические фракции объединяют, сушат над MgSO4. Отгоняют растворитель, остаток фракционируют в вакууме мембранного насоса. Получают 12.2 г (2,2,3,3-тетрафторпропилокси)метилтиирана 5а. Выход 80%. Бесцветная вязкая жидкость, т. кип. 82-84°С при 12 мм рт.ст. Спектральные характеристики соответствуют данным из статьи [Налетько С.А., Первова М.Г., Горбунова Т.И., Запевалов А.Я., Топорова М.С., Салоутин В.И. М., Журнал общей химии, 2014, 84, 1823].
Третья стадия. В круглодонную колбу, снабженную обратным холодильником и магнитной мешалкой, помещают 40 мл ацетонитрила, 11.0 г (53.9 ммоль) 2,2,3,3-тетрафторпропилокси)метилтиирана 5а и 9.6 г (0.1 моль) морфолина. Реакционную массу нагревают до кипения и выдерживают в течение 20 ч, затем промывают смесь в 100 мл воды. Слои разделяют, водный экстрагируют CHCl3 (2*20 мл). Органические фракции объединяют, сушат над MgSO4, отгоняют растворитель. Получают 14.1 г бис[(1-(4-морфолино)-4-окса-6,6,7,7-тетрафтор)гепт-2-ил]дисульфида 6а. Выход 90%, вязкое, желтое масло. ИК спектр, ν, см-1: 2858, 2812 (С-Н), 1099 (C-F, С-О-С). Спектр ЯМР 1Н [500 МГц, CDCl3] δ, м.д.: 2.46 м (4Н, N(CH2)2); 2.52-2.60 м (2Н, Н1;); 3.07 т.т и 3.09 т.т (оба по 1Н, Н2, J 7.3, 5.4 Гц); 3.69 м (4Н, O(СН2)2); 3.76-3.90 м (4Н, Н3, Н1); 5.93 т.т (1Н, Н3', J 53.2, 4.8 Гц). Спектр ЯМР 19F [470 МГц, CDCl3], δF, м.д.: 22.33 д.м (2F, F3', J 53.0); 36.93 м (2F, F2'). Спектр ЯМР 13С [126 МГц, CDCl3], δС, м.д.: (эритро : трео ~ 1:1) 49.29 и 49.35 (С2); 53.89 (N(CH2)2); 59.35 и 59.39 (С1); 66.86 (O(СН2)2); 68.14 т и 68.17 т (С1', J 28.1 Гц); 72.51 (С3); 109.20 т.т (С3, J 249.5, 34.8 Гц); 114.95 т.т (С2', J250.2, 26.9 Гц). Найдено, %: С 41.13; Н 5.54; N 4.74; F 26.80; S 10.87. C20H32F8N2S2O4. Вычислено, %: С 41.37; Н 5.56; N 4.82; F 26.18; S 11.04.
Пример 2
Первая и вторая стадии аналогичны первой и второй стадиям соответственно по Примеру 1.
Третья стадия. В круглодонную колбу, снабженную обратным холодильником и магнитной мешалкой, помещают 40 мл ацетонитрила, 11.0 г (53.9 ммоль) 2,2,3,3-тетрафторпропилокси)метилтиирана 5а и 11.0 г (0.1 моль) N-метилпиперазина. Реакционную массу нагревают до кипения и выдерживают так в течение 12 ч, затем промывают смесь в 100 мл воды. Слои разделяют, водный экстрагируют CHCl3 (2*20 мл). Органические фракции объединяют, сушат над MgSO4, растворитель отгоняют. Получают 14.4 г бис[(1-(4-(N-метилпиперазино))-4-окса-6,6,7,7-тетрафтор)гепт-2-ил]дисульфида 6б. Выход 88%, вязкое желтое масло. ИК спектр, ν, см-1: 2920, 2857 (С-Н), 1166 (C-F), 1114 (С-О-С). Спектр ЯМР 1H [500 МГц, CDCl3] δ, м.д.: 2.44 м (4Н, N(CH2)2), 2.51-2.63 м (2Н, Н1), 3.09 м (1Н, Н2), 3.68 м (4Н, O(СН2)2), 3.84 м (2Н, H3), 3.98 т (2Н, H1', J 13.9), 6.06 т.т (1Н, H3', J 52.0, 5.5 Гц). Спектр ЯМР 19F [470 МГц, CDCl3], δF м.д.: 24.47 д.м (2F, F5', J 52.0 Гц), 31.53 м (2F, F4'), 36.16 м (2F, F3'), 41.97 м (2F, F2'). Спектр ЯМР 13С [126 МГц, CDCl3], δС, м.д.: (эритро : трео ~ 1:1) 49.27 и 49.42 (С2), 53.85 (N(CH2)2), 59.33 и 59.34 (С1), 66.86 (O(СН2)2), 67.95 т (C1', J 25.5 Гц), 72.93 и 72.94 (С3), 107.62 т.т (С5', J 254.1, 30.8 Гц), 110.07 т.т.т (С3'/4', J 264.5, 29.7, 26.9 Гц), 110.87 т.т.т (С4'/3', J 265.1, 33.6, 31.3 Гц), 115.40 т.т (С2', J 256.8, 30.7 Гц). Найдено, %: С 36.52; Н 4.13; N 3.59; F 38.89; S 8.04. C24H32F16N2O4. Вычислено, %: С 36.93; Н 4.13; N 3.59; F 38.94; S 8.21.
Пример 3
Первая стадия. В трехгорлую колбу, снабженную механической мешалкой и обратным холодильником, помещают 23.2 г (0.1 моль) 2,2,3,3,4,4,5,5-октафторпентанола, 4.0 г (0.1 моль), заранее растертого в ступке NaOH. Перемешивают в течение 15 мин, затем приливают 18.5 г (0.2 моль) эпихлогидрина. Выдерживают так в течение 1 ч при температуре 70-80°С. Реакционную массу промывают водным раствором H2SO4 до рН 7. Органический слой отделяют, водный экстрагируют CHCl3 (2*20 мл.). Органические фракции объединяют и сушат над MgSO4. Растворитель отгоняют, остаток фракционируют перегонкой с использованием колонки Вигре. Получают 22.5 г (2,2,3,3,4,4,5,5-октафторпентилокси)метилоксиран 4б. Выход 78%, бесцветная жидкость, т. кип. 205-209°С. Спектральные характеристики соответствуют данным из статьи [Соловьев Д.В., Коломенская Л.В., Родин А.А., Зенкевич И.Г., Лаврентьев А.Н. Журнал органической химии, 1991, 61, 673].
Вторая стадия. В трехгорлую колбу, снабженную механической мешалкой и обратным холодильником, помещают 100 мл метанола, 9.9 г (0.1 моль) тиомочевины, смесь перемешивают в течение 20 мин. Затем приливают 22.0 г (76.4 ммоль) (2,2,3,3,4,4,5,5-октафторпентилокси)метилоксирана 4б. Выдерживают так при комнатной температуре 6 ч. Далее реакционную массу промывают в 200 мл водного раствора NaCl. Слои разделяют, водный экстрагируют CHCl3 (2*20 мл). Органические фракции объединяют, сушат над MgSO4. Растворитель отгоняют, остаток фракционируют в вакууме мембранного насоса. Получают 17.4 г (2,2,3,3,4,4,5,5-октафторпентилокси)метилтииран 5б. Выход 75%, бесцветная вязкая жидкость, т.кип. 105-107°С при 12 мм рт.ст. Спектральные характеристики соответствуют данным из статьи [Налетько С.А., Первова М.Г., Горбунова Т.И., Запевалов А.Я., Топорова М.С., Салоутин В.И. Журнал общей химии, 2014, 84, 1823].
Третья стадия. В круглодонную колбу, снабженную обратным холодильником, магнитной мешалкой, помещают 40 мл ацетонитрила, 16.0 г (52.6 ммоль) 2,2,3,3,4,4,5,5-октафторпентилокси)метилтиирана 56 и 9.6 г (0.1 моль) морфолина. Затем реакционную массу нагревают до кипения и выдерживают так в течение 20 ч. Промывают смесь в 100 мл воды, слои разделяют, водный экстрагируют CHCl3 (2*20 мл). Органические фракции объединяют, сушат над MgSO4, растворитель отгоняют. Получают 18.9 г бис[(1-(4-морфолино)-4-окса-6,6,7,7,8,8,9,9-октафтор)нон-2-ил]дисульфид 7а. Выход 92%, вязкое желтое масло. ИК спектр, ν, см-1: 2920, 2857 (С-Н), 1166 (C-F), 1114 (С-О-С). Спектр ЯМР 1Н [500 МГц, CDCl3] δ, м.д.: 2.44 м (4Н, N(CH2)2), 2.51-2.63 м (2Н, Н1), 3.09 м (1Н, Н2), 3.68 м (4Н, O(СН2)2), 3.84 м (2Н, Н3), 3.98 т (2Н, Н1', J 13.9), 6.06 т.т (1Н, Н3', J 52.0, 5.5 Гц). Спектр ЯМР 19F [470 МГц, CDCl3], δF, м.д.: 24.47 д.м (2F, F5', J 52.0 Гц), 31.53 м (2F, F4'), 36.16 м (2F, F3'), 41.97 м (2F, F2'). Спектр ЯМР 13С [126 МГц, CDCl3], δС, м.д.: (эритро : трео ~ 1:1) 49.27 и 49.42 (С2), 53.85 (N(CH2)2), 59.33 и 59.34 (С1), 66.86 (O(СН2)2), 67.95 т (С1', J25.5 Гц), 72.93 и 72.94 (С3), 107.62 т.т (С5', J 254.1, 30.8 Гц), 110.07 т.т.т (C3'/4', J 264.5, 29.7, 26.9 Гц), 110.87 т.т.т (С4'/3' J 265.1, 33.6, 31.3 Гц), 115.40 т.т (С2', J 256.8, 30.7 Гц). Найдено, %: С 36.52; Н 4.13; N 3.59; F 38.89; S 8.04. C24H32F16N2O4. Вычислено, %: С 36.93; Н 4.13; N 3.59; F 38.94; S 8.21.
Пример 4
Первая и вторая стадии аналогичны первой и второй стадиям соответственно по Примеру 3.
Третья стадия. В круглодонную колбу, снабженную обратным холодильником и магнитной мешалкой, помещают 40 мл ацетонитрила, 16.0 г (52.6 ммоль) 2,2,3,3,4,4,5,5-октафторпентилокси)метилтиирана 56 и 11.0 г (0.1 моль) N-метилпиперазина. Затем реакционную массу нагревают до кипения и выдерживают так в течение 12 ч. Промывают смесь в 100 мл воды, слои разделяют, водный экстрагируют CHCl3 (2*20 мл). Органические фракции объединяют, сушат над MgSO4, растворитель отгоняют. Получают 18.2 г бис[1-(4-(N-метилпиперазино))-4-окса-6,6,7,7,8,8,9,9)нон-2-ил]дисульфид 76. Выход 86%, вязкое желтое масло. ИК спектр, ν, см-1: 2940, 2800 (С-Н), 1163 (C-F), 1121 (С-О-С). Спектр ЯМР 1Н [400 МГц, CDCl3] δ, м.д.: 2.28 с (3Н, СН3), 2.32-2.64 м (10Н, Н1, 2N(CH2)2), 3.09 м (1Н, Н2), 3.83 (2Н, Н3), 3.98 т (2Н, H1', J 14.0 Гц), 6.06 т.т (1H, H3', J 52.0, 5.4 Гц). Спектр ЯМР 19F [376 МГц, CDCl3], δF, м.д.: 24.45 д.м (2F, F5', J 52.0 Гц), 31.45 м (2F, F4'), 36.12 м (2F, F3'), 41.97 м (2F, F2'). Спектр ЯМР 13С [126 МГц, CDCl3], δС, м.д.: (эритро : трео ~ 1:1) 45.94 и 45.96 (NCH3), 49.49 и 49.58 (С2), 53.34 (N(CH2)2), 55.03 (N(CH2)2), 58.74 и 58.78 (С1), 67.97 т (C1', J 25.4 Гц), 73.04 и 73.08 (С3), 107.61 т.т (С5', J 253.8, 30.5 Гц), 110.06 т.т.т (С3'/4', J 263.8, 31.0, 26.6 Гц), 110.86 т.т.т (C4'/3', J 264.6, 32.9, 31.1 Гц), 115.41 т.т (С2', J 256.6, 30.6 Гц). Найдено, %: С 38.81; Н 4.85; N 6.93; F 37.54; S 8.09. C26H38F16N4O2S2. Вычислено, %: С 38.71; Н 4.75; N 6.94; F 37.68; S 7.95.
Использование симметричных азот- и фторсодержащих дисульфидов в качестве присадки к индустриальному маслу И-20А
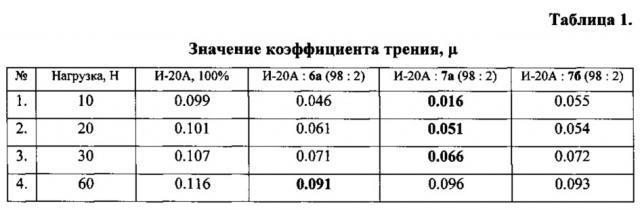
Использование фторсодержащих симметричных дисульфидов 6 и 7 как присадки к минеральным маслам в литературе найдено не было. Соединения 6а,б, 7б имеют ограниченную растворимость в индустриальном масле И-20А. В условиях ультразвукового диспергирования были приготовлены 2%-ные эмульсии дисульфидов в масле, стабильные в течение 1-1.5 ч. После указанного периода происходит частичное агрегирование и расслоение соединений 6а, 7а,б с маслом. Для полученных составов зарегистрированы коэффициенты трения с использованием трибометра CSM Instruments (Швейцария) по схеме «шар - диск». Диаметр шара и диска - 10 и 35 мм соответственно. Шар и диск изготовлены из стали марки ШХ-15 с твердостью по Роквеллу 60-63 (С-шкала). Нагрузки - 10, 20, 30 и 60 Н, количество циклов испытания - 10000, доза смазки - 100 мкл. Все измерения выполнены в 4 параллелях, погрешность измерений не превышает 0.002. Проведен их сравнительный анализ с результатами, полученными для немодифицированного индустриального масла (Таблица 1),
Все результаты испытаний для модифицированного масла оказались положительными, наблюдалось уменьшение коэффициента трения по отношению к базовому маслу (Таблица 2). Наибольший эффект достигается в области малых нагрузок (10 и 20 Н), а при ее повышении (30 и 60 Н) во всех случаях этот эффект уменьшается. Показано, что наилучший результат зарегистрирован для соединения 7а при нагрузке 10 Н.
Использование полученных дисульфидов 6а, 7а,б в качестве присадки к индустриальному маслу И-20А позволяет значительно понизить коэффициент трения по отношению к базовому маслу.
1. Симметричный полифторалкилсодержащий аминодисульфид общей формулы (I) в качестве присадки к индустриальному маслу:
где RF=H(CF2)2, H(CF2)4, при Х=О, NCH3.
2. Способ получения соединения по п. 1, состоящий из трех стадий, отличающийся тем, что на первой стадии полифторированный спирт общей формулы H(CF2)nCH2OH, где n=2, 4, взаимодействует с эпихлоргидрином в щелочной среде с получением фторсодержащего глицидилового эфира, на второй стадии тиомочевина реагирует с фторсодержащим глицидиловым эфиром с получением тиоглицидилового эфира, на третьей стадии тиоглицидиловый эфир взаимодействует с морфолином или N-метилпиперазином с получением симметричного полифторалкилсодержащего аминодисульфида (I).