Способ получения тиоацетатов (варианты)
Иллюстрации
Показать всеИзобретение относится к синтезу тиоацетатов терпеноидов, включающий ацетилирование исходного терпеноида тиоуксусной кислотой и получение целевого продукта, в качестве исходного терпеноида берут β-пинен или кариофилленоксид или бутуленон, ацетилирование терпеноидов с терминальной двойной связью проводят в одну стадию при комнатной температуре (18-27°C) путем электрофильного присоединения тиоуксусной кислоты к терпеноиду при соотношении, обеспечивающем эффективный выход целевого продукта, тиоацетилирование ведут в среде без растворителя в присутствии катализатора, при этом в качестве катализатора используют фторид тетрабутиламмония или силикагель. Тиоацетилирование в присутствии силикагеля ведут при соотношении терпеноид:тиоуксусная кислота - 1.0:1.5 соответственно. Тиоацетилирование в присутствии фторида тетрабутиламмония ведут при соотношении терпеноид:тиоуксусная кислота:фторид тетрабутиламмония - 1.0:1.5:0.05 соответственно. Полученные соединения используются в качестве прекурсоров для синтеза биологически активных веществ и в органическом синтезе для синтеза тиолов, сульфидов и дисульфидов. Технический результат - получение тиоацетатов терпеноидов, имеющих терминальную двойную связь. Способ обеспечивает повышенный выход и стереоселективность целевого продукта при снижении временных затрат. 2 н. и 2 з.п. ф-лы, 6 пр.
Реферат
Изобретение относится к синтезу тиоацетатов, которые используются в качестве прекурсоров для синтеза биологически активных веществ и в органическом синтезе для синтеза тиолов, сульфидов и дисульфидов, и методам их получения.
Согласно литературным данным, имеются несколько способов получения тиоацетатов. Для сесквитерпеновых тиоацетатов подобных способов получения нет. Так, синтез тиоацетатов, в т.ч. и моиотерпеиовых, часто является многостадийным через гидроборирование алкенов с образованием соответствующих спиртов, с последующим преобразованием в тозилаты (мезилаты, галогениды) и замещением последних на тиоацетатную группу [J.H. Chapman and L.N. Owen. Dithiols. Part IV. The Reaction of Toluene-p-sulphonates and Methawulpbnates with Potassium Thiolacetate: A New Method for the Preparation of Thiols. - J. Chem. Soc, 579-585, 1950; H.C. Brown, K.J. Murray, L.J. Murray, J.A. Snover, and G. Zweifel. - J. Am. Chem. Soc, 82, 4233, 1960; E. Beretta, M. Cynquini, S. Colonna, R. Fornasier. A Mild Synthesis of Optically Active Thiols. - Synthesis Communications, 425-426, 1974; M. Mikolajezyk, W. Perlikowska, J. Omelanezuk. Synthesis of (+)-Neomenthanethiol and Some of Its Derivates. A New Example of Asymmetric Induction in the Sulfoxide Synthesis. - Synthesis Communications, 1009-1012, 1987; A.W. Snow, E.E. Foos. Conversion of Alcohols to Thiols via Tosylate Intermediates. - Synthesis, 4, 509-512, 2003; S. Herve, R. Fabien, I. Blank. Identification and Synthesis of 2-Heptanethiol, a New Flavor Compound Found in Bell Peppers. - J. Agric. Food Chem., 52, 306-310, 2004; A. Banach, J. Scianowski, and P. Ozimek. The use of sulfides derived from carane, P-mentane, pinane, and bornane in the synthesis of optically active epoxides. - Phosphorus, Sulfur, and Silicon, 189, 274-284, 2014; O.A. Banina, D.V. Sudarikov, Yu. V. Krymskaya, L.L. Frolova, and A.V. Kuchin. Synthesis of Chiral Hydroxythiols Based on Oxygen-containing α- and β-pinene Derivatives. Chemistry of Natural Compounds, Vol. 51, No. 2, 261-265, 2015].
Известен способ получения терпеновых тиоацетатов по реакции замещения непосредственно из тиолов и уксусного ангидрида [С. Hongwei, Z. Shulen et al. Method for synthesizing cis- and trans-mentone-8-thioacetate. - Патент CN 102816094 (B). - 2012]. Однако, для получения терпеновых тиоацетатов такой способ не является удобным. К тому же для такого способа синтеза тиоацетатов необходимо первоначально получить тиол.
Еще одним способом получения тиоацетатов (в частности тиоацетата α-пинена, камфена) является радикальное присоединения тиоуксусной кислоты к алкену при облучении светом [F.G. Bordwell and W.A. Hewett. The Free Radical Addition of Thioacetic Acid to Some Cyclic Olefins. - J. Am. Chem. Soc, V. 79, 3493-3496, 1957]. Данный способ предполагает использование веществ - источников свободных радикалов, что может вызвать нежелательные перегруппировки структуры терпеноидов.
В литературе описан также способ получения гидрокситиоацетатов, образующихся при раскрытии эпоксидных циклов монотерпеноидов тиоуксусной кислотой с использованием силикагеля в качестве катализатора [М. Abbasi. One-pot tanden synthesis of β-trimethylsilyloxy thioesters from thioacids, epoxides, and HMDS catalyzed by silica gel under solvent-free conditions. - Synthetic Communications, 43, 1759-1765, 2013]. Однако, данный способ образования гидрокситиолов не работает в отношении сесквитерпеновых эпоксидов, в частности, кариофиллеиоксида. В случае последнего наблюдается присоединение тиокислоты по терминальной двойной связи терпеноида с образованием тиоацетата. Аналогичное присоединение к терминальной двойной связи наблюдается и для некоторых монотерпеноидов.
Известен синтез миртанилтиоацетата, который применяется для синтеза тиолов, сульфидов и дисульфидов (A. Banach, J. Scianowski, and P. Ozimek. The use of sulfides derived from carane, P-mentane, pinane, and bornane in the synthesis of optically active epoxides. - Phosphorus, Sulfur, and Silicon, 189, 274-284, 2014).
Недостатком является многостадийность получения монотерпенового тиоацетата, что ведет к снижению выхода целевого продукта.
Наиболее близким аналогом способа являются способ получения тиоацетатов при ацетилировании субстрата тиоуксусиой кислотой [Bodеn R.M., Mcghie J.A. S-(4-hydroxy-l-isopropyl-4-methylhexyl)thioacetate organoleptic uses thereof and process for preparing. - Патент US 4914082 (A) - 1990-04-03. 1990]. Недостатком этого способа является направленность на ациклические терпеноиды, проведение синтеза тиоацетатов при повышенной температуре (65-95°С).
Задачей изобретения является разработка способа получения тиоацетатов, синтезированных эффективным способом.
Технический результат вариантов способа состоит в получении тиоацетатов, имеющих терминальную двойную связь. Способ обеспечивает повышенный выход и стереоселективность целевого продукта при снижении временных затрат.
Технический результат способа по первому варианту достигается тем, что способ получения тиоацетатов, включающий ацетилирование исходного терпеноида тиоуксусной кислотой и получения целевого продукта, согласно изобретения, в качестве исходного терпеноида берут β-пинен, или кариофилленоксид, или бутуленон, тиоацетилирование терпеноидов с терминальной двойной связью проводят в одну стадию при комнатной температуре (18-27°С) путем электрофильного присоединения тиоуксусной кислоты к терпеноиду при соотношении, обеспечивающем эффективный выход целевого продукта, тиоацетилирование ведут в среде без растворителя в присутствии катализатора, при этом в качестве катализатора используют фторид тетрабутиламмония. Тиоацетилирование в присутствии фторида тетрабутиламмония ведут при соотношении терпеноид : тиоуксусная кислота : фторид тетрабутиламмония - 1:1.5:0.05 соответственно.
Технический результат способа по второму варианту достигается тем, что способ получения тиоацетатов, включающий апеллирование исходного терпеноида тиоуксусной кислотой и получения целевого продукта, согласно изобретения, в качестве исходного терпеноида берут β-пинен, или кариофилленоксид, или бутуленон, тиоацетилирование терпеноидов с терминальной двойной связью проводят в одну стадию при комнатной температуре (18-27°C) путем электрофильного присоединения тиоуксусной кислоты к терпеноиду при соотношении, обеспечивающем эффективный выход целевого продукта, тиоацетилирование ведут в среде без растворителя в присутствии катализатора, при этом в качестве катализатора используют силикагель. Тиоацетилирование в присутствии силикагеля ведут при соотношении терпеноид : тиоуксусная кислота - 1.0:1.5, соответственно.
Способ осуществляется следующим образом.
Новый способ позволяет получить моно- и сесквитерпеновые тиоацетаты в одну стадию с использованием в качестве катализаторов силикагеля и фторида тетрабутиламмония (TBAF⋅3H2O) без растворителя.
Использование силикагеля в качестве катализатора присоединения тиоуксусной кислоты к терпеноидам, содержащим терминальную двойную связь, приводит к повышению выхода целевого продукта до 89% (от теоретического). Реакция протекает при комнатной температуре (18-27°C) в течение короткого промежутка времени (5-10 мин). Способ может применяться для синтеза тиоацетатов моно- и сесквитерпеноидов.
Синтез тиоацетатов проводили с использованием коммерческих (-)-кариофилленоксида ( - 70, с 2.00, CHCl3) фирмы Sigma-Aldrich, β-пинена фирмы Alfa Aesar, бутуленона, синтезированного по методике [А. De Mico, R. Margarita, L. Parlanti, A. Vescovi, G. Piancatelli. A Versatile and Higly Selective Hypervalent Iodine (III)/ 2,2,6,6- Tetramethyl-1-piperidinyloxyl - Mediated Oxidation of Alcohols to Carbonyl Compounds. - J. Org. Chem., 62, 6974-6977, 1997] из бутуленола [U. Vogt, U. Eggert, A.M.Z. Slawin, D.J. Williams, H.M.R. Hoffmann. A Stereoselective к Cyclization to a Combined Bridgehead Olefin-Bridgehead Alcohol. - Angew. Chem. Int. Ed. Engl. 29, №12, 1456-1457, 1990] и тиоуксусной кислоты фирмы Alfa Aesar.
Для подбора оптимальных условий синтеза тиоацетатов моно- и сесквитерпеноидов варьировали соотношение терпеноид - тиоуксусная кислота. Было отмечено, что наилучшие результаты достигаются при соотношении субстрат: реагент, равному 1:1.0-1:1.5.
ИК-спектры регистрировали на ИК-Фурье спектрометре Shimadzu IR Prestige 21 в тонком слое или в таблетках RBr. Спектры ЯМР 1H и 13C регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1H и 75.48 МГц для 13С) в CDCl3 с использованием в качестве внутреннего стандарта сигналов хлороформа. Спектры ЯМР 13С регистрировали в режиме J-модуляции. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1Н-1Н COSY, 1Н-1Н NOESY) и гетероядерных экспериментов (1Н-13С HSQC, 1Н-13С НМВС). Хромато-масс-спектрограммы регистрировали на приборе GCMS-QP 2010 Plus фирмы Shimadzu; программа подъема температуры 80°C/мин до 300°C; температура ионного источника 200°C, диапазон сканируемых масс m/z 2-300; способ ионизации - электронный удар (70 эВ). Угол оптического вращения измеряли на автоматическом цифровом поляриметре PolAAr-3001 фирмы Shimadzu (Англия). Для тонкослойной хроматографии использовали пластины Sorbfil, растворители СН2Cl2, систему петролейиый эфир : CHCl3 - 2:1, в качестве проявителя - спиртовый раствор ванилина. Для колоночной хроматографии применяли силикагель Alfa Aesar (0.06-0.2 мм) и те же системы растворителей, что и для тонкослойной хроматографии.
Новый способ и новые соединения демонстрируются примерами.
В примерах 1 и 2 описан синтез известного соединения тиоацетата монотерненоида. В примерах 3,4,5,6 описан синтез новых химических соединений и обоснованы их свойства.
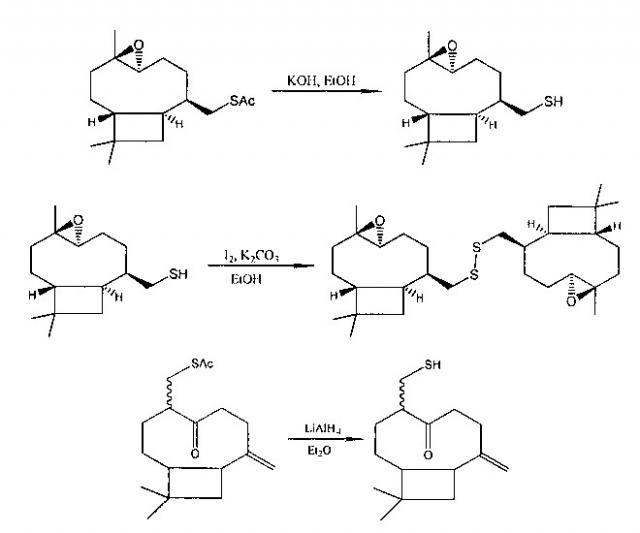
Схема 1. Получение миртанилтиоацетатов
где SAc означает CH3COS-.
Пример 1. К 200 мг (1.47 ммоль) β-пинена добавляли 168 мг (2.12 ммоль) тиоуксусной кислоты и 140 мг силикагеля. Синтез вели в отсутствие растворителя при постоянном перемешивании. Ход реакции контролировали методом ТСХ. Элюент - хлороформ, проявитель - спиртовый раствор ванилина. По окончании реакции смесь продуктов реакции экстрагировали этилацетатом, промывали насыщенным раствором Na2CO3. Органическую фракцию сушили Na2SO4, растворитель отгоняли под вауумом. Миртанилтиоацетат в виде смеси диастереомеров выделяли методом колоночной хроматографии на силикагеле при элюировании системой растворителей петролейный эфир: CHCl3 - 2:1. Выход целевого продукта - 143 мг (43%), de - 70%.
Пример 2. К 150 мг (1.10 ммоль) β-пинена добавляли 167 мг (2.20 ммоль) тиоуксусной кислоты и 5 мол. % TBAF⋅3H2O. Синтез вели в отсутствие растворителя при постоянном перемешивании. Ход реакции контролировали методом ТСХ. Элюент - хлороформ, проявитель - спиртовый раствор ванилина. По окончании реакции смесь продуктов реакции экстрагировали этилацетатом, промывали насыщенным раствором Na2CO3. Органическую фракцию сушили Na2SO4, растворитель отгоняли под вауумом. Миртанилтиоацетат в виде смеси диастереомеров выделяли методом колоночной хроматографии на силикагеле при элюировании системой растворителей петролейный эфир: CHCl3 - 2:1. Выход целевого продукта - 217 мг (90%), de - 63%.
Спектральные данные (IS,2R,5S)-миртанилтиоацетата соответствуют литературным данным [A. Banach, J. Scianowski, and P. Ozimek. The use of sulfides derived from carane, P-mentane, pinane, and bornane in the synthesis of optically active epoxides. - Phosphorus, Sulfur, and Silicon, 189, 274-284, 2014].
Схема 2. Получение тиоацетата кариофилленоксида
Пример 3. К 300 мг (1.36 ммоль) (-)-кариофилленоксида добавляли 155 мг (2.04 ммоль) тиоуксусной кислоты и 82 мг силикагеля. Синтез вели в отсутствие растворителя при постоянном перемешивании. Ход реакции контролировали методом ТСХ. Элюент - хлороформ, проявитель - спиртовый раствор ванилина. По окончании реакции смесь подвергали экстракции этилацетатом, промывали насыщенным раствором Na2CO3. Органическую фракцию сушили Na2SO4, растворитель отгоняли под вауумом. Тиоацетат кариофилленоксида выделяли перекристаллизацией из Et2O: петролейный эфир. Целевой продукт представляет собой белые кристаллы. Выход продукта - 307 мг (89%), de - 100%.
Пример 4. К 150 мг (0.68 ммоль) (-)-кариофилленоксида добавляли 76 мг (0.75 ммоль) тиоуксусной кислоты и 5 мол. % TBAF⋅3H2O. Синтез вели в отсутствие растворителя при постоянном перемешивании. Ход реакции контролировали методом ТСХ. Элюент - хлороформ, проявитель - спиртовый раствор ванилина. По окончании реакции смесь подвергали экстракции этилацетатом, промывали насыщенным раствором Na2CO3. Органическую фракцию сушили Na2SO4, растворитель отгоняли под вауумом. Тиоацетат кариофилленоксида выделяли перекристаллизацией из Et2O: петролейный эфир. Целевой продукт представляет собой белые кристаллы. Выход продукта - 139 мг (70%), de - 100%.
S-{[(1S,2R,5R,6R,9R)-6,11,11-триметил-5,6-эпоксибицикло[7.2.0]ундек-1-ил]метил}этантиоат
- 16.30 (c 0.27, CHCl3)
Найдено: [М]+296.20
Вычислено: C17H28SO2 [М]+ 296.47
ИК-спектр, см-1: 1687 (С=O), 1265 (C-O-C), 630 (C-S)
Спектр ЯМР 1Н (300 МГц, δ, м.д., J, Гц): 0.99 (6Н, д, Ме-12,13, J=6.67), 1.02-1.07 (1Н, м, Н-3), 1.24 (3Н, с, Ме-14), 1.14-1.22 (1Н, м, Н-7), 1.26-1.34 (1Н, м, Н-10), 1.35-1.58 (3Н, м, Н-2, 6, 10), 1.62-1.80 (4Н, м, H-1,2,6,8), 2.04-2.13 (1Н, м, Н-3), 2.17-2.36 (2Н, м, Н-7,9), 2.35 (3Н, с, Ме-17), 2.67-2.76 (2Н, м, Н-15), 2.90 (1Н, дд, Н-5, J1=3.57, J2=11.62).
Спектр ЯМР 13С (300 МГц, δ, м.д.): 17.40 (С-14), 21.14 (С-12), 24.16 (С-2), 27.16 (С-6), 28.94 (С-7), 29.92 (С-13), 30.17 (С-17), 34.23 (С-15), 34.54 (С-11), 35.03 (С-10), 38.38 (С-3), 39.30 (С-8), 44.95 (С-9), 46.21 (С-1), 60.19 (С-4), 65.31 (С-5), 195.95 (С-16).
Схема 3. Получение тиоацетатов на основе бутуленона
Пример 5. К 166 мг (0.75 ммоль) бутуленона добавляли 89 мг (1.17 ммоль) тиоуксусной кислоты и 46 мг силикагеля. Синтез вели в отсутствие растворителя при постоянном перемешивании. Ход реакции контролировали методом ТСХ. Элюент - хлороформ, проявитель - спиртовый раствор ванилина. По окончании реакции смесь продуктов реакции экстрагировали этилацетатом, промывали насыщенным раствором Na2CO3. Органическую фракцию сушили Na2SO4, растворитель отгоняли под вауумом. Тиоацетат бутуленона в виде смеси диастереомеров (структурной формулы, указанной на схеме), выделяли методом колоночной хроматографии на силикагеле, элюент - CH2Cl2, проявитель - спиртовый раствор ванилина. Целевой продукт - прозрачная бесцветная маслянистая жидкость. Выход продукта - 104 мг (52%), de - 61%.
Пример 6. К 150 мг (0.69 ммоль) бутуленона добавляли 105 мг (1.38 ммоль) тиоуксусной кислоты и 5 мол. % TBAF⋅3H2O. Синтез вели в отсутствие растворителя при постоянном перемешивании. Ход реакции контролировали методом ТСХ. Элюент - хлороформ, проявитель - спиртовый раствор ванилина. По окончании реакции смесь продуктов реакции экстрагировали этилацетатом, промывали насыщенным раствором Na2CO3. Органическую фракцию сушили Na2SO4, растворитель отгоняли под вауумом. Тиоацетат бутуленона в виде смеси диастереомеров выделяли методом колоночной хроматографии на силикагеле при элюировании дихлорметаном. Целевой продукт - прозрачная бесцветная маслянистая жидкость. Выход продукта - 123 мг (61%), de - 70%.
S-{[{1R,4R,9S)-11,11-диметил-8-метилен-5-оксобицикло[7.2.0]ундек-4-ил]метил}этантиоат
S-{[(1R,4S,9S)-11,11-диметил-8-метилен-5-оксо-бицикло[7.2.0]ундек-4-ил]метил}этантиоат
Найдено: [М]+ 294.20
Вычислено: C17H26SO2 [М]+ 294.45.
ИК-спектр, см-1: 1697 (С=O), 759 (C-S)
Спектр ЯМР 1Н (300 МГц, δ, м.д., J, Гц): 0.92-0.94 (1Н, с, Н-6), 0.96 (3Н, с, Me-10'), 1.06 (3Н, с, Ме-9'), 1.10 (3Н, с, Ме-9), 1.13 (3H, д, Ме-10, J=3.15), 1.21 (3H, с, Ме-8'), 1.24 (3H, с, Ме-8), 2.37 (3H, с, Me-1'), 1.80-2.14 (7Н, м, Н-1,3,4,5,1',2',3',4'), 2.35 (3H, с, Ме-12), 2.37-2.49 (3H, м, Н-6,4',6'), 2.64-2.78 (2Н, м, Н-4,5'), 4.23-4.39 (1Н, м, Н-2).
S-{[(1R,4R,9S)-11,11-диметил-8-метилен-5-оксобицикло[7.2.0]ундек-4-ил]метил}этантиоат
| Спектр ЯМР 13С (300 МГц, δ, м.д.): 21.77 (С-12), 26.72 (С-2), 29.11 (С-3), 29.69 (С-13), 29.85 (С-14), 30.55 (С-17), 31.53 (С-7), 34.33 (С-11), 38.33 (С-6), 43.51 (С-9), 43.66 (С-10), 52.88 (С-4), 111.64 (С-15), 152.06 (С-8), 195.58 (С-16), 214.36 (С-5). |
S-{[(1R,4S,9S)-11,11-диметил-8-метилен-5-оксо-бицикло[7.2.0]ундек-4-ил]метил}этантиоат
| Спектр ЯМР 13С (300 МГц, δ, м.д.): 21.95 (С-12), 24.42 (С-2), 28.31 (С-3), 29.69 (С-14), 29.72 (С-13), 30.55 (С-17), 31.55 (С-7), 34.28 (С-11), 39.57 (С-6), 42.17 (С-9), 42.58 (С-10), 52.45 (С-1), 55.63 (С-4), 111.28 (С-15), 153.64 (С-8), 195.58 (С-16), 213.18 (С-5). |
Ниже приведены примеры использования новых химических соединений в асимметрическом синтезе тиолов, сульфидов и дисульфидов.
Таким образом, для заявленных химических соединений, показано их применение в асимметрическом синтезе тиолов, сульфидов и дисульфидов.
Способ обеспечивает одностадийное осуществление синтеза тиоацетатов моно- и сесквитерпеноидов с высоким выходом целевых продуктов.
1. Способ получения тиоацетатов, включающий ацетилирование исходного терпеноида тиоуксусной кислотой и получение целевого продукта, отличающийся тем, что в качестве исходного терпеноида берут β-пинен, или кариофилленоксид, или бутуленон, тиоацетилирование терпеноидов с терминальной двойной связью проводят в одну стадию при температуре 18-27°С путем электрофильного присоединения тиоуксусной кислоты к терпеноиду при соотношении, обеспечивающем эффективный выход целевого продукта, тиоацетилирование ведут в среде без растворителя в присутствии катализатора, при этом в качестве катализатора используют фторид тетрабутиламмония.
2. Способ по п. 1, отличающийся тем, что тиоацетилирование в присутствии фторида тетрабутиламмония ведут при соотношении терпеноид:тиоуксусная кислота:фторид тетрабутиламмония - 1:1.5:0.05 соответственно.
3. Способ получения тиоацетатов, включающий ацетилирование исходного терпеноида тиоуксусной кислотой и получение целевого продукта, отличающийся тем, что в качестве исходного терпеноида берут β-пинен, или кариофилленоксид, или бутуленон, тиоацетилирование терпеноидов с терминальной двойной связью проводят в одну стадию при комнатной температуре (18-27°С) путем электрофильного присоединения тиоуксусной кислоты к терпеноиду при соотношении, обеспечивающем эффективный выход целевого продукта, тиоацетилирование ведут в среде без растворителя в присутствии катализатора, при этом в качестве катализатора используют силикагель.
4. Способ по п. 3, отличающийся тем, что тиоацетилирование в присутствии силикагеля ведут при соотношении терпеноид:тиоуксусная кислота - 1.0:1.5, соответственно.