Способ получения диалкилнорборнен-2,3-дикарбоксилатов
Иллюстрации
Показать всеИзобретение относится к способу получения диалкилнорборнен-2,3-дикарбокислатов и может быть использовано в производстве сложноэфирных пластификаторов поливинилхлорида и других полимеров. Способ получения диалкилнорборнен-2,3-дикарбоксилатов осуществляют взаимодействием диалкильных диэфиров фумаровой кислоты с циклопентадиеном (ЦПД), в качестве источника ЦПД используют С5 фракцию пиролиза в количестве, обеспечивающем мольное соотношение алкильного диэфира фумаровой кислоты и ЦПД, равное 1:1.5-3.0, при этом С5 фракцию дозируют в алкильный диэфир фумаровой кислоты при температуре реакционной массы 16-20°С, затем проводят реакцию при комнатной температуре до полного расходования диэфира фумаровой кислоты, после чего избыток фракции С5 отгоняют при температуре 30-60°С и атмосферном давлении, а кубовый остаток вакуумируют при давлении 2-10 мм рт.ст. и температуре в кубе 50-80°С. Целью изобретения является расширение сырьевых источников для получения недорогих пластификаторов алкилнорборнен-2,3-дикарбоксилатов, упрощение способа, снижение себестоимости. 1 з.п. ф-лы, 2 табл., 6 пр.
Реферат
Изобретение относится к способу получения диалкилнорборнен-2,3-дикарбокислатов и может быть использовано в производстве сложноэфирных пластификаторов поливинилхлорида (ПВХ) и других полимеров.
В качестве основных пластификаторов ПВХ и других полимеров используются сложные эфиры дикарбоновых кислот - фталевой, адипиновой, себациновой и других. Наиболее важным химическим классом пластификаторов ПВХ являются эфиры фталевой кислоты и прежде всего диоктилфталат (ДОФ) благодаря доступности сырья и оптимальному соотношению цена-качество. Однако в последнее время в связи с выявленной токсичностью фталатов наметилась тенденция по сокращению их применения для пластификации ПВХ, особенно при изготовлении игрушек, медицинского оборудования, продукции, контактирующей с пищевыми продуктами. Фталаты частично замещаются нефталатными пластификаторами - сложными эфирами терефталевой, циклогександикарбоновой, бензойной кислот, цитратами. Ведутся исследования по применению в качестве пластификаторов также сложных эфиров на основе гликолей или глицерина и карбоновых кислот С3-С9, эфиров янтарной кислоты и других соединений (Лакеев С.Н. и др. // Ж. прикл. химии. - 2016. - Т. 89. Вып. 1. - С. 3).
Перспективной альтернативой фталатным пластификаторам являются сложные эфиры циклогексанкарбоксилатов, которые обладают сходными пластифицирующими свойствами с фталатами, но при этом являются нетоксичными, биоразлагающимися, с низкими сенсибилизирующими свойствами и могут применяться в тех областях, где важна безопасность для здоровья и окружающей среды. Один из методов получения циклогександикарбокислатов заключается во взаимодействии доступных 1,3-диенов и малеинового ангидрида по реакции Дильса-Альдера с последующей этерификацией спиртами образующегося циклогексенового ангидрида и гидрированием двойной связи (патент US 7319161, 2008). Двойная связь может также эпоксидироваться (патент US 2963490, 1960).
Близкими по строению и свойствам к циклогексанкарбокислатам являются сложные эфиры 2,3-норборнендикарбоновой кислоты, доступность и дешевизна которых определяют перспективность их использования в качестве пластификаторов полимеров.
Известен способ получения сложноэфирных норборненовых пластификаторов с хорошими пластифицирующими свойствами реакцией малеинового ангидрида с ЦПД с последующей этерификацией норборненового ангидрида одноатомными спиртами С4-С13, либо реакцией ЦПД с диэфирами малеиновой кислоты, полученными этерификацией малеинового ангидрида спиртами С4-С13 (патент US 2013171385, 2013). Далее двойную связь норборненового фрагмента либо гидрируют, либо эпоксидируют, либо гидроформилируют и окисляют до карбоксильной группы с последующей этерификацией. Недостатком предложенного метода является использование в качестве сырья токсичного малеинового ангидрида и чистого ЦПД, большое тепловыделение при взаимодействии малеинового ангидрида с чистым ЦПД, необходимость использования растворителя.
Наиболее близким по технической сущности является способ получения норборненовых пластификаторов реакцией ди(2-этилгексил)- и дибутилмалеатов и ди(2-этилгексил)- и дибутилфумаратов с ЦПД в растворителе в присутствии катализатора хлорида титана (10% мас.) (Park J-S., Oh H-Ch., Park Y-S., Woo J-W. // Adv. Mater. Reserch, 2012, V. 421, P. 136). Недостатком известного способа является использование для получения диалкилнорборнен-2,3-дикарбокислатов чистого ЦПД, необходимость применения растворителя и катализатора, что удорожает процесс, затрудняет очистку конечного продукта, ограничивает промышленную применимость способа.
Целью изобретения является расширение сырьевых источников для получения недорогих пластификаторов диалкилнорборнен-2,3-дикарбоксилатов, упрощение способа, снижение себестоимости.
Технический результат достигается тем, что диалкилнорборнен-2,3-дикарбокислаты получают взаимодействием диалкильных диэфиров фумаровой кислоты с циклопентадиеном (ЦПД), при этом в качестве источника ЦПД используют С5 фракцию пиролиза, количество которой рассчитывают исходя из мольного соотношения диалкильного диэфира фумаровой кислоты и ЦПД, равного 1:1.5-3.0, при этом С5 фракцию дозируют в охлаждаемый диалкильный диэфир фумаровой кислоты при температуре реакционной массы в интервале 16-20°С, после добавления всей С5 фракции реакцию проводят при комнатной температуре до полного израсходования диалкильного диэфира фумаровой кислоты, после чего избыток С5 фракции отгоняют при температуре 30-60°С и атмосферном давлении, а кубовый остаток вакуумируют при давлении 2-10 мм рт.ст. и температуре в кубе 50-80°С.
C5 фракция пиролиза является недорогим побочным продуктом производства этилена и пропилена пиролизом углеводородов. Содержание фракции С5 в продуктах пиролиза составляет от 4 до 8-10%, а содержание ЦПД во фракции С5 колеблется от 4-5 до 20-25% в зависимости от состава исходного сырья и условий пиролиза. Остальными компонентами С5 фракции пиролиза являются изопрен, пентаны, пентены, пиперилен и различные примеси. В заявляемом способе их можно рассматривать как инертные разбавители. Содержание ЦПД в С5 фракции определяют методом ГЖХ и рассчитывают количество фракции С5 для обеспечения необходимого мольного отношения диэфира фумаровой кислоты и ЦПД. Оптимальное мольное отношение диэфира фумаровой кислоты и ЦПД находится в интервале 1:1.5-3.0, уменьшение приводит к неполному расходованию диэфира фумаровой кислоты и значительному увеличению времени реакции, увеличение - к необоснованному расходу фракции С5.
Диэфиры фумаровой кислоты получают известным методом этерификации кислот спиртами при кипячении смеси фумаровой кислоты с избытком одноатомного спирта в присутствии катализаторов этерификации. Для получения пластификаторов предпочтительно использование одноатомных спиртов С4-С13 или их смесей.
Использование в заявляемом способе в качестве источника ЦПД фракции С5 позволяет проводить реакцию без растворителя, так как роль растворителя играют остальные компоненты фракции С5. Применение разбавленного раствора ЦПД исключает резкий подъем температуры в процессе прибавления фракции С5 к диэфиру фумаровой кислоты и упрощает проведение процесса, при этом реакция проходит селективно с образованием диалкилнорборнен-2,3-дикарбоксилатов с выходом 98-99.9%. Применение диэфиров фумаровой кислоты, являющихся транс-изомерами обычно используемых диэфиров малеиновой кислоты, позволяет проводить процесс получения диалкилнорборнен-2,3-дикарбоксилатов без применения катализатора, продукт легко выделяется из реакционной массы и без дополнительных методов очистки может использоваться в качестве пластификатора. Диэфиры малеиновой кислоты в заявляемых условиях не вступают в реакцию. Важным является также то, что фумаровая кислота и ее эфиры являются нетоксичными соединениями в отличие от малеинового ангидрида и эфиров малеиновой кислоты.
Изобретение иллюстрируется следующими конкретными примерами.
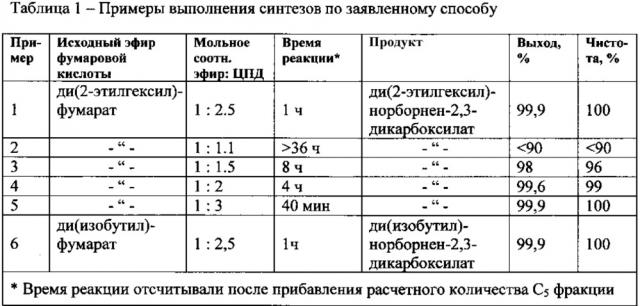
Пример 1
Получение ди(2-этилгексил)норборнен-2,3-дикарбоксилата
В колбу, снабженную мешалкой, термометром, капельной воронкой и холодильником, поместили 20.00 г (0.059 моля) ди(2-этилгексил)фумарата (ДЭГФ). Реакционную массу охладили до температуры 16-18°С в бане с ледяной водой. При этой температуре и интенсивном перемешивании добавили из капельной воронки 81.13 г (101 мл) промышленной фракции С5, содержащей 12% ЦПД (0.148 моля ЦПД), мольное соотношение ДЭГФ:ЦПД=1:2.5, регулируя скорость прикапывания так, чтобы температура реакционной массы сохранялась в пределах 16-20°С. По окончании прикапывания С5 фракции охлаждение убрали и перемешивали реакционную массу при комнатной температуре до исчезновения в реакционной массе ди(2-этилгексил)фумарата (1 ч). Контроль вели методом ТСХ (элюент - петролейный эфир-EtOAc, 20:1, проявитель анисовый). По окончании реакции избыток С5 фракции отогнали при 32-52°С, а остаток вакуумировали при 2 мм рт.ст. и 50-60°С. Получили 23.97 г ди(2-этилгексил)норборнен-2,3-дикарбоксилата в виде светло-желтой, прозрачной жидкости, выход 99.9%.
Синтезы в примерах 2-6 осуществляли аналогично примеру 1. Результаты приведены в таблице 1. Чистоту продукта определяли по данным спектров ЯМР 1Н.
Полученные диалкилнорборнен-2,3-дикарбоксилаты без дальнейшей очистки могут использоваться как пластификаторы полимеров или могут быть далее модифицированы известными реакциями по двойной связи и также использоваться в качестве пластификаторов. После дополнительной очистки полученные алкилнорборнен-2,3-дикарбоксилаты могут применяться как мономеры в реакциях метатезисной полимеризации.
В таблице 2 приведены характеристики ди(2-этилгексил)норборнен-2,3-дикарбоксилата (1), полученного по примеру 1, в сравнении с прототипом (2), полученным из ди(2-этилгексил)малеата с ЦПД, и эталонным пластификатором диоктилфталатом (ДОФ).
1. Способ получения диалкилнорборнен-2,3-дикарбоксилатов взаимодействием диалкильных диэфиров фумаровой кислоты с циклопентадиеном (ЦПД), отличающийся тем, что в качестве источника ЦПД используют С5 фракцию пиролиза в количестве, обеспечивающем мольное соотношение алкильного диэфира фумаровой кислоты и ЦПД, равное 1:1.5-3.0, при этом С5 фракцию дозируют в алкильный диэфир фумаровой кислоты при температуре реакционной массы 16-20°С, затем проводят реакцию при комнатной температуре до полного расходования диэфира фумаровой кислоты, после чего избыток фракции С5 отгоняют при температуре 30-60°С и атмосферном давлении, а кубовый остаток вакуумируют при давлении 2-10 мм рт.ст. и температуре в кубе 50-80°С.
2. Способ по п. 1, отличающийся тем, что используют алкильные диэфиры фумаровой кислоты, полученные из фумаровой кислоты и одноатомных спиртов С4-С13 или их смесей.