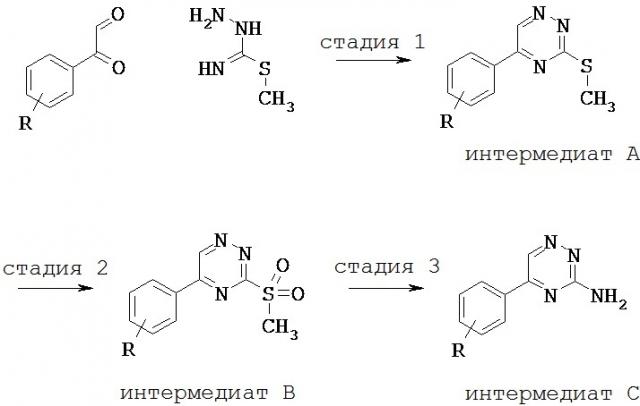
Производные 1,2,4-триазин-4-амина
Иллюстрации
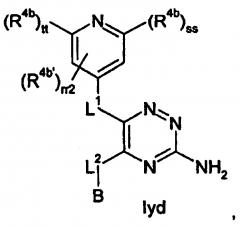
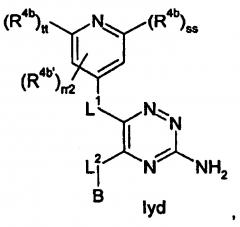
Показать всеИзобретение относится к соединению формулы Iyd или его фармацевтически приемлемым солям. Соединения формулы Iyd обладают ингибирующей активностью в отношении А1 рецептора или А2а рецептора. В формуле Iyd
В представляет собой СуВВ; СуВВ представляет собой фенил, необязательно имеющий один или более заместителей R4c; R4b, R4b' и R4c представляют собой, в каждом случае независимо, атом галогена; CN; С1-8 алкил, который необязательно имеет один или более заместителей, выбранных из атомов галогенов, OR5a; С3-8 циклоалкил; Heta; OR8; N(R9f)(R9g); =O; rr2 равен 0-1; ss и tt равны, независимо в каждом случае, 0 или 1, при условии, что ss и tt не могут одновременно быть равны 0; L1 и L2 оба представляют собой одинарные связи; R8 представляет собой, в каждом случае независимо, С1-8 алкил, который необязательно имеет один или более заместителей, выбранных из атомов галогенов; Heta представляет собой, в каждом случае независимо, 3-6-членное гетероциклическое полностью насыщенное кольцо, и которое содержит один или два гетероатома, выбранных из О и N; R5a, R9f, R9g представляют собой, независимо в каждом случае, Н; С1-10 алкил. Изобретение также относится к индивидуальным соединениям, к применению соединения, к фармацевтической композиции и к способу получения соединения формулы Iyd. Технический результат: получены новые соединения, обладающие ингибирующей активностью в отношении А1 рецептора или А2а рецептора. 5 н. и 7 з.п. ф-лы, 7 пр.
Реферат
Область техники, к которой относится изобретение
Настоящие изобретение касается, среди прочего, применения определенных соединений в лечении состояния, облегчаемого ингибированием A1 рецептора или A2a рецептора.
Уровень техники
Упоминание или обсуждение в настоящем описании ранее опубликованного документа не следует обязательно рассматривать как признание того, что документ является частью существующего уровня техники или является частью общедоступных сведений.
Болезнь Паркинсона представляет собой прогрессирующее нейродегенеративное заболевание с примерным распространением 0.3% среди населения в целом, повышаясь до 5% среди людей старше 85 лет.Заболевание характеризуется тремором, оцепенелостью и замедленностью движений, которые вызваны дегенерацией дофаминергических нейронов в черной субстанции и расщеплением дофамина в полосатом теле.
Вследствие старения населения растет частота заболеваемости болезнью Паркинсона. Однако наиболее эффективным фармакологическим лечением данного заболевания все еще является Леводопа (L-допа), даже спустя пятьдесят лет после ее открытия в качестве противопаркинсонического средства (Chemical & Engineering News 2005, 83(25)).
L-допа является предшественником дофамина и оказывает свое фармакологическое действие, усиливая дапаминергическую проводимость (т.е. повышая уровень дофамина в полосатом теле). Физиологического эффекта L-допы можно также добиться введением действующих напрямую агонистов дофамина, таких как бромкриптин или перголид. Хотя описанные выше методы терапии сначала очень эффективно контролируют некоторые симптомы болезни Паркинсона, в частности оцепенелость, продолжительное применение приводит в появлению широкого набора побочных эффектов, которые могут утомлять пациента (например, непроизвольные движения, известные как дискинезия).
Другие способы лечения включают ингибирование дофамин-метаболизирующих ферментов катехол-о-метилтрансферазы (СОМТ) или моноаминоксидаз (MAOI), или применение антихолинергических средств. Однако эти методы лечения дают эффект от низкого до умеренного и страдают наличием ряда вредных побочных эффектов.
Аденозин известен как эндогенный модулятор многих физиологических функций. Например, аденозин оказывает воздействие на сердечно-сосудистую систему и является сильным сосудорасширяющим средством и сердечным депрессором, а также известны его кардиозащитные свойства (см., например, Norton et al. Am J Physiol. 1999; 276 (2 Pt 2), H341-9; и Auchampach and Bolli Am J Physiol. 1999; 276 (3 Pt 2), H1113-6). Действие аденозина на центральную нервную систему включает седативное, успокаивающее и противоэпилептическое действие. Кроме того, аденозин действует на дыхательную систему, индуцируя бронхостеноз. В почках аденозин имеет двухфазное действие, вызывая сужение сосудов при низких концентрациях и оказывая сосудорасширяющее действие при высоких дозировках, а это означает, что аденозин может участвовать в развитии патологии при определенных типах почечной недостаточности (Costello-Boerrigter, et al. Med din North Am. 2003 Mar; 87(2), 475-91; Gottlieb, Drugs. 2001, 61(10), 1387-93). Аденозин также выступает в роли ингибитора липолиза в жировых клетках (Feoktistov, et al., Pharmacol. Rev. 1997, 49, 381-402) и антиагреганта тромбоцитов.
Аденозин действует через семейство сопряженных с G-белком рецепторов. Биохимические и фармакологические исследования, наряду с прогрессом молекулярной биологии, позволили идентифицировать по меньшей мере четыре подтипа аденозиновых рецепторов, которые классифицируют на аденозиновые A1, А2а, A2b и А3 рецепторы. A1 и А3 рецепторы подавляют действие фермента аденилатциклазы, в то время как A2a и A2b рецепторы стимулируют активность этого же фермента, тем самым модулируя уровень циклического аденозинмонофосфата в клетках.
В центральной нервной системе аденозин является мощным эндогенным нейромодулятором, который контролирует пресинаптическое высвобождение многих нейротрансмиттеров и, таким образом, участвует в механизмах моторной функции, сна, беспокойства, боли и психомоторной активности. Главными подтипами аденозиновых рецепторов в мозге являются A1 и A2a. В то время как аденозиновый рецептор подтипа A1 с высокой плотностью распространен по всему мозгу, распределение A2a рецептора более ограничено, и он имеет высокую плотность распространения в полосатом теле (caudate-putamen, nucleus accumbens, olfactory tubercule), где он локализован вместе с дофаминовым D2 рецептором на стриатопаллидальных выходных нейронах. Дискретное распределение A2a рецептора в полосатом теле и его способность оказывать функционально антагонизирующее действие на D2 рецептор привели к предположению, что антагонисты A2a рецептора потенциально могут применяться для симптоматического лечения болезни Паркинсона (см., например, Cunha et al., Curr Pharm Des. 2008, 14(15), 1512-1524).
Таким образом, Аза антагонисты могут помочь при нарушении моторной функции, вызванном нейродегенеративными заболеваниями, такими как болезнь Паркинсона, Хантингтона и Альцгеймера (Tuite P, et al., J. Expert Opin. Investig. Drugs. 2003; 12, 1335-52; Popoli P. et al. J Neurosci. 2002; 22, 1967-75; и Dall'Igna, et al., Experimental Neurology, 2007, 241-245). Кроме того, Аза антагонисты могут найти применение в лечении: нарушений внимания, таких как синдром дефицита внимания (ADD) и синдром дефицита внимания и гиперактивности (ADHD); психозы; инсульт, экстрапирамидальный синдром (например, дистония, акатизия, псевдопаркинсонизм и поздняя дискинезия (см. Jenner P. J Neurol. 2000; 247 Suppl2: 1143-50); и расстройства, сопровождающиеся нарушением движений, такие как синдром беспокойных ног (RLS) и периодические движения конечностями во время сна (PLMS) (см., например WO 02/055083, WO 05/044245, WO 06/132275 и Нарре S, et al., Neuropsychobiology. 2003, 48, 82-6). Антагонисты аденозинового A2a рецептора описаны в US 2007037033 как средства, пригодные для лечения амиотрофического бокового склероза. В WO 01/058241 описано лечение цирроза, фиброза и жировой инфильтрации печени с применением антагонистов аденозиновых A2a рецепторов. В WO 06/009698 описаны антагонисты аденозиновых Аза рецепторов как полезные средства для облегчения аддиктивного поведения человека. Недавно было продемонстрировано, что антагонисты аденозиновых A2a рецепторов могут применяться для лечения и профилактики фиброза кожи при таких заболеваниях, как склеродермия (Chan et al. Arthritis & Rheumatism, 2006, 54(8), 2632-2642).
Кроме того, Аза антагонисты могут иметь терапевтический потенциал в качестве нейропротекторов (Stone TW. et al., Drag. Dev. Res. 2001, 52, 323-330), в лечении нарушений сна (Dunwiddie TV et al., Ann. Rev. Neurosci. 2001, 24, 31- 55) и мигрени (Kurokowa et al., 2009. Program No. 714.4/B101. 2009 Neuroscience Meeting Planner. Chicago, IL: Society for Neuroscience).
Области терапевтического применения для соединений, мишенями которых являются A1 рецепторы, различны (см., например Nature Reviews Drug Discovery 5, 2006, 247-264; Journal of Pharmacology and Experimental Therapeutics 323(2), 2007, 708-719; British Journal of Pharmacology, 155, 2008, 475-486; Journal of the American College of Cardiology 50(16), 2007, 1551-1560; Pharmacology and Therapeutics 123, 2009, 105-116).
Аденозиновые A1 рецепторы экспрессированы в почках и обуславливают влияние аденозина на проксимальную канальцевую реабсорбцию и канальцевый гломерулярный ответ. Поэтому блокада A1 рецептора приводит к подавлению проксимальной канальцевой реабсорбции натрия, что может оказывать положительный эффект при таких заболеваниях, как застойная сердечная недостаточность, хроническая почечная недостаточность и цирроз (Gellai et al., 1998, J Pharmacol Exp Ther 286, 1191-1196; J Am Coil Cardiol, 2007; 50:1551-1560). Соединения, разрабатываемые в качестве антагонистов аденозинового A1 рецептора при острой почечной недостаточности, включают ролофиллин от Merck и деренофиллин от Astellas. Антагонисты аденозинового A1 рецептора могут применяться для лечения эдемы (Satoh et al., 2000. Gastroenterol. 119(3):829-36), дегенерации желтого пятна и цирроза.
Хотя соединения, имеющие заметную биологическую активность в отношении нескольких подтипов аденозиновых рецепторов, могут обладать терапевтическим потенциалом, они могут обладать нежелательным побочным действием. Например (как описано в Gessi S et al. Pharmacol. Ther. 117(1), 2008, 123-140), антагонизм в отношении аденозинового А3 рецептора вызывает различные эффекты, такие кг. к повышенная склонность к повреждению тканей после ишемии (например, ЦНС, сердца, почек, легких и глаз), усиленное реперфузионное повреждение, повышенная нейродегенерация в ответ на гипоксию, потенциально вредное воздействие на моторную функцию или болевой порог, подавление иммунитета или стимулирование иммунитета.
Несколько соединений в настоящее время разрабатываются в качестве антагонистов A2a рецептора для лечения болезни Паркинсона. Такие соединения включают KW6002 (истраддефиллин, 8-[(Е)-2-(3,4-диметоксифенил)винил]-1,3-диэтил-7-метил-3,7-дигидро-1Н-пурин-2,6-дион) от Kyowa Hakko Kogyo, SCH-420814 (преладенант, 2-(фуран-2-ил)-7-[2-[4-[4-(2-метоксиэтокси)фенил]пиперазин-1-ил]этил]-7H-пиразоло[4,3-е][1,2,4]-триазоло[1,5-с]пиримидин-5-амин) от Schering-Plough/Merck, BIIB014 от Biogen Idec, Lu AA47070 от Lundbeck, ST-1535 от Sigma-Tau Farm Riunite SpA, SYN 115 от Synosia, и ASP 5854 от Astellas.
Однако упомянутые выше соединения страдают несколькими недостатками, такими как низкая растворимость (KW6002, SCH-420814, BIIB014 и Lu AA47070), светочувствительность (KW6002), низкая селективность (Lu AA47070 и ASP 5854), потенциальная токсичность вследствие наличия известных потенциальных токсикофоров (SCH-420814 и BIIB014) и ограниченная эффективность in vivo (KW6002).
В международных патентных заявках WO 92/02513, WO 00/66568, WO 03/077921, WO 2005/117883, WO 2006/051311, WO 2006/113704 и WO 2009/090431, заявках на патент США US 2004/0102436, US 2004/0229873, US 2007/0135437, Европейской патентной заявке №1400518 и Патенте Великобритании №1,604,085 описываются 1,2,4-триазиновые соединения, обладающие различной биологической активностью. В перечисленных выше документах нет предложения или описания 1,2,4-триазиновых соединений, обладающих требуемой по настоящему изобретению схемой замещения, а также того, что какие-либо из описанных в перечисленных выше документах соединений могут выступать в роли антагонистов A1 или, особенно, A2a рецептора.
В Патенте США №4,008,232 и Патенте Франции 2,869,906 описан ряд 1,2,4-триазиновых соединений для применения в лечении воспаления и в качестве средств от загара, соответственно. В статье Doig et al., Journal of Chromatography 1991 554(1-2), 181-189 описан метаболит противосудорожного средства Lamotrigine. Ряд 1,2,4-триазиновых соединений, обладающих противосудорожной активностью, описан в статье Mallikarjuna et al. J Zhejian Univ Sci В 2007 8(7), 526-532. Ряд 1,2,4-триазиновых соединений, обладающих противовирусной активностью, описан в статье Davidson et al. Journal of Pharmaceutical Sciences 67(5), 1978, 737-739. Ряд 1,2,4-триазиновых соединений описан в статьях Bid et al., Indian Journal of Chemistry, Section В 1990 29В (5) 435-439, Zcu et al., Chinese Journal of Chemistry 1998 16(1), 58-64, Lu et al., Youji Huaxue 1992 12(6), 605-607, Lu et al.. Organic Preparations and Procedures International 1992 24(3), 358-362 и Konno et al. Heterocycles 19(10), 1982, 1865-8. Нет предложения или описания того, что какие-либо из перечисленных выше соединений могут выступать в роли антагонистов A1 или, особенно, A2a рецептора.
Раскрытие изобретения
Авторы настоящего изобретения неожиданно обнаружили, что некоторые 1,2,4-триазиновые соединения, имеющие определенные заместители, могут применяться в качестве антагонистов A1 и, особенно, A2a рецепторов.
Так, в первом аспекте настоящего изобретения описывается соединение формулы I для применения в лечении состояния или нарушения, облегчаемого ингибированием A1 или, особенно, A2a рецепторов, где соединение формулы I имеет структуру
где:
R1 представляет собой Н или C1-6 алкил, последняя из перечисленных групп может при необходимости иметь один или более заместителей, представляющих собой атомы галогена, OR2a или NR2bR2c;
L1 и L2 независимо представляют собой СН=СН, одинарную связь, О, NR3a, S(O)p, СН2 или С(O);
R2a, R2b, R2c и R3a независимо представляют собой Н или C1-6 алкил, последняя из перечисленных групп может при необходимости иметь один или более заместителей, представляющих собой атомы галогена;
А представляет собой Cy1 или HetA;
Cy1 представляет собой 5-14-членную ароматическую, полностью насыщенную или частично ненасыщенную карбоциклическую систему, содержащую один, два или три цикла, где группа Cy1 необязательно имеет один или более заместителей R4a;
HetA представляет собой 5-14-членную гетероциклическую группу, которая может быть ароматической, полностью насыщенной или частично ненасыщенной, и которая содержит один или более гетероатомов, выбранных из О, S и N, где указанная гетероциклическая группа может содержать один, два или три цикла, и указанная группа HetA необязательно имеет один или более заместителей R4b;
В представляет собой Cy2 или HetB;
Cy2 представляет собой 3-10-членную ароматическую, полностью насыщенную или частично ненасыщенную карбоциклическую систему, содержащую один или два цикла, и указанная группа Cy2 необязательно имеет один или более заместителей R4c;
HetB представляет собой 3-10-членную гетероциклическую группу, которая может быть ароматической, полностью насыщенной или частично ненасыщенной, и которая содержит один или более гетероатомов, выбранных из О, S и N, где указанная гетероциклическая группа может содержать один или два цикла, и указанная группа HetB необязательно имеет один или более заместителей R4d;
R4a-R4d представляют собой, в каждом случае независимо,
(a) атом галогена,
(b) CN,
(c) C1-12 алкил, С2-12 алкенил, C2-12 алкинил, где три последние группы необязательно имеют один или более заместителей, выбранных из атомов галогенов, нитро-группы CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы), OR5a, S(O)qR5b, S(O)2N(R5c)(R5d), N(R5e)S(O)2R5f, N(R5g)(R5h), B1-C(G1)-R5i, арила и Het1,
(d) Cy3, где указанная группа Cy3 необязательно имеет один или более заместителей выбранных из атомов галогенов, нитро-группы, CN, C1-6 алкила, C2-6 алкенила, C2-6 алкинила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы), OR6a, S(O)qR6b, S(O)2N(R6c)(R6d), N(R6e)S(O)2R6f, N(R6g)(R6h), B3-C(G1)-B4-R6i, арила и Het2,
(e) Heta, где указанная группа Heta необязательно имеет один или более заместителей, выбранных из атомов галогенов, нитро-группы, CN, C1-6 алкила, C2-6 алкенила, C2-6 алкинила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы), OR7a, S(O)qR7b, S(O)2N(R7c)(R7d), N(R7e)S(O)2R7f, N(R7g)(R7h), B5-C(G1)-B6-R7i, арила и Het3,
(f) ORa,
(g) S(O)rR9a,
(h) S(O)2N(R9b)(R9c),
(i) N(R9d)S(O)2R9e,
(j) N(R9f)(R9g),
(k) В7-C(G1)-B8-R9h,
(l) =O,
(m) =S,
или когда две группы R4a, R4b, R4c или R4d присоединены к одному и тому же атому углерода в неароматической части группы Cy1, HetA, Cy2 или HetB, они могут формировать, совместно с атомом углерода, к которому они присоединены, насыщенный или ненасыщенный 3-6-членный цикл, который может необязательно содержать 1-3 гетероатомов, выбранных из О, S и N, и который может необязательно иметь один или более заместителей R9i;
G1 представляет собой, в каждом случае независимо. О, S или NR5j;
R8 представляет собой, в каждом случае независимо,
H,
Cy3, Heta, арила C1-8 алкил, C2-8 алкенил, C2-8 алкинил, С3-8 циклоалкил, где семь последних групп необязательно имеют один или более заместителей, выбранных из атомов галогенов, -CN, С3-6 циклоалкила, арила, Het4, -C(O)OR10, -C(O)R11, -С(O)N(RN1)(RN2), S(O)rR9aa, S(O)2N(R9ba)(R9ca), N(R9da)S(O)2R9ea и N(Rfa)(R9ga);
Cy3 представляет собой, в каждом случае независимо, 3-6-членный ароматический, полностью насыщенный или частично ненасыщенный карбоцикл;
Heta представляет собой, в каждом случае независимо, 3-6-членное гетероциклическое кольцо которое может быть ароматическим, полностью насыщенным или частично ненасыщенным и которое содержит один или более гетероатомов, выбранных из О, S и N;
R10 и R11 независимо представляют собой
(a) Н,
(b) C1-6 алкил, необязательно имеющий один или более заместителей, выбранных из атомов галогенов, арила, -N(RN3)(RN4) и -ORa,
(c) арил или
(d) С3-7 циклоалкил (который необязательно имеет один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы);
B1-В8 представляют собой, независимо в каждом случае, одинарную связь, О, S или N(RN3);
каждый арила независимо представляет собой С6-14 карбоциклическую ароматическую группу, которая может содержать один, два или три цикла;
каждый арил независимо представляет собой С6-14 карбоциклическую ароматическую группу, которая может содержать один, два или три цикла и может иметь один или более заместителей, выбранных из
атома галогена,
С1-6 алкила, который может при необходимости иметь один или более заместителей, представляющих собой заместители, выбранные из атомов галогенов, -N(RN4)(RN5) и -ORa, и
-ORa;
Het1-Het4 независимо представляют собой 4-14-членные гетероциклические группы, содержащие один или более гетероатомов, выбранных из О, S и N, где указанные гетероциклические группы могут содержать один, два или три цикла и могут иметь один или более заместителей, выбранных из
атома галогена,
С1-6 алкила, который может при необходимости иметь один или более заместителей, представляющих собой заместители, выбранные из атомов галогенов, -N(RN6)(RN7) и -ORa, и
-ORa;
RN1-RN7 независимо представляют собой
Н,
С1-6 алкил или С3-6 циклоалкил, где последние две группы необязательно имеют один или более заместителей, выбранных из атомов галогенов и -ORa;
R81 представляет собой, в каждом случае независимо,
(a) Н;
(b) C1-12 алкил, С2-12 алкенил, C2-12 алкинил, С3-12 циклоалкил, C4-12 циклоалкенил, где последние пять групп необязательно имеют один или более заместителей выбранных из атомов галогенов, нитро-группы, CN, C1-6 алкила, C2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние четыре группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, С1-4 алкила и С1-4 алкокси-группы), OR12a, S(O)qR12b, S(O)2N(R12c)(R12d), N(R12e)S(O)2R12f, N(R12g)(R12h), B9-C(G2)-B10-R12i, арила1 и Hetb, и где указанные C3-12 циклоалкильные или C4-12 циклоалкенильные группы могут дополнительно иметь заместитель =O,
(c) S(O)rR13a,
(d) S(O)2N(Rl3b)(Rl3c) или
(e) С(O)-В11-R13d;
R5a-R5j, R6a-R6i, R7a-R7i, R9a-R9i, R9aa-R9ga, R12a-R12i и R13a-R13d представляют собой, независимо в каждом случае,
(a) Н,
(b) C1-10 алкил, С2-10 алкенил, С2-10 алкинил, где указанные три группы необязательно имеют один или более заместителей, выбранных из атомов галогенов, нитро-группы, CN, С1-6 алкила, С2-6 алкенила, C2-6 алкинила, С3-6 циклоалкила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы), OR5aa, S(O)qR5ab, S(O)2N(R5ac)(R5ad), N(R5ae)S(O)2R5af, N(R5ag)(R5ah), B12-C(G2)-B13-R5ai, арила1 и Hetc;
(c) С3-10 циклоалкил или C4-10 циклоалкенил (последние две группы необязательно имеют один или более заместителей, выбранных из атомов галогенов, ОН, =O, C1-6 алкила и C1-6 алкокси-группы),
(d) Hetd;
G2 представляет собой, в каждом случае независимо, О, S, или NR5aj;
R5aa-R5aj представляют собой, в каждом случае независимо,
(a) Н,
(b) С1-4 алкил, С2-4 алкенил, C2-4 алкинил, где указанные три группы необязательно имеют один или более заместителей, выбранных из атомов галогенов, нитро-группы, CN, C1-4 алкила, C2-4 алкенила, C2-4 алкинила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы),
(c) С3-6 циклоалкил или C4-6 циклоалкенил (последние две группы необязательно имеют один или более заместителей, выбранных из атомов галогенов, ОН, =O, С1-4 алкила и С1-4 алкокси-группы),
(d) Hete,
или R5ag и R5ah могут представлять собой, вместе с атомом азота, к которому они присоединены, 3-10-членное гетероциклическое кольцо, которое может быть ароматическим, полностью насыщенным или частично ненасыщенным, и которое может дополнительно содержать один или более гетероатомов, выбранных из О, S и N, где указанное гетероциклическое кольцо необязательно имеет один или более заместителей, выбранных из атомов галогенов, нитро-группы CN, C1-6 алкила, С2-6 алкенила, C2-6 алкинила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы);
В9-В13 независимо представляют собой одинарную связь, О, S или N(RN8);
арил1 представляет собой, в каждом случае независимо, С6-10 карбоциклическую ароматическую группу, которая может содержать один или два цикла и может иметь один или более заместителей, выбранных из
атома галогена,
С1-6 алкила, который может при необходимости иметь один или более заместителей, представляющих собой заместители, выбранные из атомов галогенов, -N(RN10)(RN11) и C1-6 алкокси-группы (последний заместитель из перечисленных необязательно замещен одним или более атомами галогенов), и С1-6 алкокси-группы (которая необязательно замещена одним или более атомами галогенов);
RN8, RN10 и RN11 независимо представляют собой Н,
С1-6 алкил или С3-6 циклоалкил, где последние две группы необязательно замещены одним или более атомами галогенов;
Hetb представляет собой 5- или 6-членную гетероциклическую группу, которая может быть ароматической, полностью насыщенной или частично ненасыщенной и которая содержит один или более гетероатомов, выбранных из О, S и N, где указанная гетероциклическая группа может иметь один или более заместителей, выбранных из атомов галогенов, =O и C1-6 алкила;
Hetc-Hete независимо представляют собой 3-6-членное гетероциклическое кольцо, которое может быть ароматическим, полностью насыщенным или частично ненасыщенным и которое содержит один или более гетероатомов, выбранных из О, S и N, где указанные группы Hetc-Hete необязательно имеют один или более заместителей, выбранных из атомов галогенов, нитро-группы CN, C1-6 алкила, С2-6 алкенила, С2-6 алкинила (последние три группы необязательно имеют один или более заместителей, выбранных из ОН, =O, атомов галогенов, C1-4 алкила и С1-4 алкокси-группы);
p, q и r равны, в каждом случае независимо, 0, 1 или 2; и
если не указано иное, алкил, алкенил, алкинил, циклоалкил и алкильная часть алкокси-групп могут быть замещены одним или более атомами галогенов.
Упоминание в настоящем тексте (в любом аспекте или варианте осуществления настоящего изобретения) соединений формулы I включает сами соединения как таковые, таутомеры таких соединений, а также фармацевтически приемлемые соли или сольваты, или фармацевтически функциональные производные таких соединений.
Заслуживающие упоминания фармацевтически приемлемые соли включают кислотно-аддитивные соли и соли основно-аддитивные. Такие соли можно формировать общепринятыми способами, например реакцией соединения формулы I в форме свободной кислоты или свободного основания с одним или более эквивалентами подходящей кислоты или основания, при необходимости в растворителе или в среде, в которой соль нерастворима, после чего удаляют указанный растворитель или указанную среду по стандартным методикам (например, в вакууме, лиофилизацией или фильтрованием). Соли можно также получать обменом противоиона соединения формулы I в форме соли с другим противоионом, например, с использованием подходящей ионообменной смолы.
Примеры фармацевтически приемлемых солей включают кислотно-аддитивные соли, полученные из неорганических кислот и органических кислот, и соли, полученные из металлов, таких как натрий, магний или, предпочтительно, калий и кальций.
Примеры кислотно-аддитивных солей включают соли уксусной, 2,2-дихлоруксусной, адипиновой, альгиновой, арилсульфоновых кислот (например, бензолсульфоновой, нафталин-2-сульфоновой, нафталин-1,5-дисульфоновой и п-толуолсульфоновой), аскорбиновой (например, L-аскорбиновой), L-аспарагиновой, бензойной, 4-ацетамидобензойной, бутановой, (+)-камфорной, камфорсульфоновой, (+)-(1S)-камфор-10-сульфоновой, каприновой, капроновой, каприловой, коричной, лимонной, цикламовой, додецилсерной, этан-1,2-дисульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, муравьиной, фумаровой, галактаровой, гентизиновой, глюкогептоновой, глюконовой (например, D-глюконовой), глюкуроновой (например, D-глюкуроновой), глутаминовой (например, L-глутаминовой), α-оксоглутаровой, гликолевой, гиппуровой, бромистоводородной, хлористоводородной, иодистоводородной, изетионовой, молочной (например, (+)-L-молочной и (±)-DL-молочной), лактобионовой, малеиновой, яблочной (например, (-)-L-яблочной), малоновой, (±)-DL-миндальной, метафосфорной, метансульфоновой, 1-гидрокси-2-нафтойной, никотиновой, азотной, олеиновой, оротовой, щавелевой, пальмитиновой, памоевой, фосфорной, пропионовой, L-пироглутаминовой, салициловой, 4-амино-салициловой, себациновой, стеариновой, янтарной, серной, дубильной, винной (например, (+)-L-винной), тиоциановой, ундециленовой и валериановой кислот.
Частными примерами солей являются соли неорганических кислот, таких как хлористоводородная, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислоты; органических кислот, таких как винная, уксусная, лимонная, яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная, арисульфоновые кислоты; и соли металлов, таких как натрий, магний или, предпочтительно, калий и кальций.
Как указано выше, формула I также охватывает любые сольваты описываемых соединений и их солей. Предпочтительными сольватами являются сольваты, образуемые внедрением в структуру твердых (например, в кристаллическую структуру) соединений по настоящему изобретению молекул нетоксичного фармацевтически приемлемого растворителя (именуемого ниже сольватирующим растворителем). Примеры таких растворителей включают воду, спирты (такие как этанол, изопропанол и бутанол) и диметилсульфоксид. Сольваты можно получать перекристаллизацией соединений по настоящему изобретению из растворителя или смеси растворителей, содержащих сольватирующий растворитель. Образовался сольват или нет - в каждом конкретном случае можно определить анализом кристаллов соединения по хорошо известным и стандартным методикам, таким как термогравиметрический анализ (ТГА), дифференциальная сканирующая калориметрия (ДСК) и рентгеноструктурный анализ.
Сольваты могут представлять собой стехиометрические и нестехиометрические сольваты. Особенно предпочтительными сольватами являются гидраты, и примеры гидратов включают полугидраты, моногидраты и дигидраты.
Более подробное обсуждение сольватов и способов их получения и анализа можно найти в книге Bryn et al., Solid-State Chemistry of Drugs, Second Edition, published by SSCI, Inc of West Lafayette, IN, USA, 1999, ISBN 0-967-06710-3.
Термин «фармацевтически функциональные производные» соединений формулы I, при использовании в настоящем тексте, включает сложноэфирные производные и/или производные, которые имеют или обеспечивают ту же биологическую функцию и/или активность, что и какое-либо соответствующее соединение по настоящему изобретению. Так, в терминах настоящего изобретения, данный термин также включает пролекарства соединений формулы I.
Термин «пролекарство» соответствующего соединения формулы I включает любое соединение, которое после перорального или парэнтерального введения метаболизируется in vivo с образованием этого соединения в экспериментально определяемых количествах и в течение определенного времени (например, в течение интервала дозирования между 6 и 24 часами (т.е. один или четыре раза в сутки)).
Пролекарства соединений формулы I можно получить модификацией функциональных групп, присутствующих в соединении, таким образом, что получаемые модификации расщепляются in vivo, когда такое пролекарство вводят млекопитающему. Модификации обычно получают путем синтеза материнского соединения, имеющего пролекарственный заместитель. Пролекарства включают соединения формулы I, в которых гидроксильная, амино, сульфгидрильная, карбоксильная или карбонильная группа в соединении формулы I связана с какой-либо группой, которая может отщепляться in vivo, снова давая свободную гидроксильную, амино, сульфгидрильную, карбоксильную или карбонильную группу, соответственно.
Примеры пролекарств включают (но не ограничиваются только ими) сложные эфиры и карбаматы по гидроксильным функциональным группам, сложноэфирные группы по карбоксильным функциональным группам, N-ацильные производные и N-основания Манниха. Общую информацию по пролекарствам можно найти, например, в книге Bundegaard, H. «Design of Prodrugs» p.1-92, Elsevier, New York-Oxford (1985).
Соединения формулы I, а также фармацевтически приемлемые соли, сольваты и фармацевтически функциональные производные таких соединений, для краткости далее по тексту все вместе именуются «соединения формулы I».
Соединения формулы I могут содержать двойные связи и могут, поэтому существовать в виде Е (entgegen) и Z (zusammen) геометрических изомеров по каждой отдельной двойной связи. Все такие изомеры и их смеси включены в объем настоящего изобретения.
Соединения формулы I могут существовать в виде региоизомеров и могут также проявлять таутомерию. Все таутомерные формы и их смеси включены в объем настоящего изобретения. Например, в объем настоящего изобретения включены представленные ниже таутомеры:
Соединения формулы I могут содержать один или более асимметрических атомов углерода, и поэтому могут демонстрировать оптическую и/или диастереомерию. Диастереомеры можно разделить стандартными методиками, например хроматографией или дробной кристаллизацией. Различные стереоизомеры можно выделить разделением рацемической или другой смеси соединений с использованием общеизвестных методов, например дробной кристаллизацией или ВЭЖХ. Альтернативно, желаемые оптические изомеры можно получить реакцией подходящих оптически активных исходных соединений в условиях, в которых не наблюдается рацемизации или эпимеризации (т.е. методами «хирального пула»), реакцией подходящего исходного соединения с «хиральным модификатором», который впоследствии можно удалить на подходящем этапе, дериватизацией (т.е. разделением, включая динамическое разделение), например гомохиральной кислотой, с последующим разделением диастереомерных производных общеизвестными методами, такими как хроматография, или реакцией с подходящим хиральным реагентом или хиральным катализатором, все перечисленные процессы проводят в условиях, известных квалифицированным специалистам. Все стереоизомеры и их смеси включены в объем настоящего изобретения.
Во избежание сомнений, соединения формулы I могут содержать указанные атомы в любых изотопных формах. В этом отношении, заслуживающие упоминания варианты осуществления настоящего изобретения включают такие, в которых:
(a) соединение формулы I не является изотопно обогащенным или меченым по каким-либо атомам данного соединения; и
(b) соединение формулы I является изотопно обогащенным или меченым по одному или более атомам данного соединения
Соединение, предназначенное для применения в описанном выше аспекте настоящего изобретения, можно использовать в способе медицинского лечения. Так, согласно другим аспектам настоящего изобретения, описывается:
(i) применение соединения формулы I для производства лекарственного средства для лечения состояния или нарушения, облегчаемого ингибированием A1 или, особенно, A2a рецептора; и
(ii) способ лечения состояния или нарушения, облегчаемого антагонизацией A1 или, особенно, A2a рецептора, включающий введение эффективного количества соединения формулы I пациенту, нуждающемуся в таком лечении.
Квалифицированному специалисту в данной области будет понятно, что термин «нарушение или состояние, облегчаемое ингибированием A1 или, особенно, A2a рецептора» включает: сердечную недостаточность (такую как острая декомпенсированная сердечная недостаточность и застойная сердечная недостаточность); почечную недостаточность (например, вызванную сердечной недостаточностью); эдему; рак (такой как рак предстательной железы, рак прямой кишки, рак почки, рак яичника, рак эндометрия, рак щитовидной железы, рак поджелудочной железы, в особенности рак груди, рак кишечника, рак мочевого пузыря, рак мозга, рак нервной ткани, меланома, рак эпифиза и, в особенности, рак легкого (например, карцинома легкого Льюиса)), диабет; диарею; дегенерацию желтого пятна (такую как дегенерация желтого пятна, вызванная ангиогенезом (например, ангиогенезом в сетчатке глаза)); или, в особенности, (например, для нарушений или состояний, облегчаемых ингибированием A2a рецептора) заболевания центральной нервной системы, такие как депрессия, нарушение когнитивной функции, нейродегенеративное заболевание (такое как болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, амиотрофический боковой склероз) и психозы; нарушения внимания (такие как синдром дефицита внимания (ADD) и синдром дефицита внимания и гиперактивности (ADHD)); экстрапирамидальный синдром (например, дистония, акатизия, псевдопаркинсонизм и поздняя дискинезия); расстройство, сопровождающееся нарушением движений (такое как синдром беспокойных ног (RLS) и периодические движения конечностями во время сна (PLMS)); цирроз; фиброз печени; жировая инфильтрация печени; фиброз кожи (например, при таких заболеваниях, как склеродермия); нарушения сна; инсульт; поражения мозга и нейровоспаление (например, мигрень или другое нарушение или состояние, вызванное ишемией, инсультом, травмой головы или воспалением ЦНС); поведение человека, имеющего склонность к потреблению наркотиков.
Так, другие аспекты настоящего изобретения касаются следующего. (а) Соединение формулы I, описанное в настоящем тексте, для применения в лечении состояния или нарушения, выбранного из сердечной недостаточности (такой как острая декомпенсированная сердечная недостаточность и застойная сердечная недостаточность); почечной недостаточности (например, вызванной сердечной недостаточностью); эдемы; рака (такого как рак предстательной железы, рак прямой кишки, рак почки, рак яичника, рак эндометрия, рак щитовидной железы, рак поджелудочной железы, в особенности рак груди, рак кишечника, рак мочевого пузыря, рак мозга, рак нервной ткани, меланома, рак эпифиза и, в особенности, рак легкого (например, карцинома легкого Льюиса)), диабета; диареи; дегенерации желтого пятна (такой как дегенерация желтого пятна, вызванная ангиогенезом (например, ангиогенезом в сетчатке глаза)); или, в особенности, (например, для нарушений или состояний, облегчаемых ингибированием A2a рецептора) заболеваний центральной нервной системы, таких как депрессия, нарушение когнитивной функции, нейродегенеративное заболевание (такое как болезнь Паркинсона, болезнь Хантингтона,