Сконструированные белки повторов, которые связываются с сывороточным альбумином
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению новых сконструированных белков со связывающей специфичностью для сывороточного альбумина, что может быть использовано в медицине. Рекомбинантным путем получают белки, включающие домен анкиринового повтора, а также нуклеиновые кислоты, которые кодируют такие белки и фармацевтические композиции, включающие такие белки для лечения заболеваний. Изобретение позволяет существенно увеличить период полувыведения в плазме крови по сравнению с белками, которые не связывают сывороточный альбумин. 6 н. и 12 з.п. ф-лы, 4 ил., 3 табл., 6 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к сконструированным белкам повторов со связывающей специфичностью для сывороточного альбумина, а также к нуклеиновым кислотам, кодирующим такие белки, которые связывают сывороточный альбумин, фармацевтическим композициям, включающим такие белки, применению таких белков для модификации фармакокинетических характеристик биоактивных соединений и к применению таких белков в лечении заболеваний.
Предпосылки создания изобретения
Фармацевтическая промышленность является весьма заинтересованной в повышении эффективности биоактивных соединений, таких как белковые терапевтические агенты, путем модуляции или повышения их фармакокинетических (РК) in vivo свойств. Это, в частности, является правдой для биоактивных соединений, которые быстро выводятся из системы циркуляции путем почечного клиренса. В общем случае почки отфильтровывают из системы циркуляции молекулы, которые имеют средний молекулярный вес ниже 60 кДа. Одна стратегия для улучшения фармакокинетических свойств таких малых биоактивных соединений заключается в простом повышении их среднего молекулярного размера (то есть, повышении их гидродинамического радиуса), например, посредством прибавления небелковых полимерных остатков, таких как полимеры полиэтиленгликоля или остатки сахара, или прибавления белковых полимерных остатков, таких как глобулярные белки или неструктурированные полипептиды, такие как те, что описаны в WO 2007/103515 и WO 2008/155134.
Другие стратегии используют длительный период полувыведения из системы циркуляции сывороточных белков, таких как иммуноглобулины и сывороточный альбумин. Сывороточный альбумин, который имеет молекулярный вес 67 кДа, представляет собой белок, который находится в плазме крови в избыточном количестве и присутствует при концентрации 50 мг/мл (0,6 мМ), а также имеет период полувыведения из сыворотки крови 19 дней у людей. Сывороточный альбумин помогает поддерживать значение рН в плазме крови, осуществляет свой вклад в давление коллоидной крови, функционирует как носитель для многих метаболитов и жирных кислот и служит в качестве основного транспортного белка для лекарственных агентов в плазме крови. Существует несколько основных сайтов связывания малых молекул в альбумине, которые были описаны.
Было показано, что нековалентная ассоциация с сывороточным альбумином может удлинить период полувыведения малых молекул или полипептидов с коротким периодом полураспада (WO 1991/001743). Полипептиды, являющиеся такими, которые специфически связываются с сывороточным альбумином, и которые, таким образом, могут продлевать in vivo период полувыведения других молекул, слитых с ними, включают варианты альбуминсвязывающих доменов (например, WO 2005/097202 и WO 2009/016043), малые пептиды (например, Dennis, M.S., и др., J. Biol. Chem. 277(3), 35035-43, 2002 и WO 2001/045746) и фрагменты иммуноглобулинов (например, WO 2008/043822, WO 2004/003019; WO 2008/043821; WO 2006/040153; WO 2006/122787 и WO 2004/041865). WO 2008/043822 относится к связывающим белкам, отличным от фрагментов иммуноглобулинов, таких как молекулы на основе доменов белка А, тендамистат, фибронектин, липокалин, CTLA-4, рецепторы Т-клеток, сконструированные анкириновые повторы и PDZ домены, которые могут быть получены для специфического связывания с сывороточным альбумином. Тем не менее, WO 2008/043822 не раскрывает ни селекцию доменов сконструированного анкиринового повтора со связывающей специфичностью для сывороточного альбумина (SA), ни конкретных последовательностей мотивов повторяемых доменов, которые специфически связываются с SA. Кроме того, было описано, что in vivo период полувыведения полипептидов может быть удлинен путем их генетического слияния с сывороточным альбумином (например, WO 1991/001743). Такое изменение in vivo периода полураспада лекарственных средств может позитивно изменить их фармакокинетические (РК) и/или фармакодинамические (PD) свойства. В этом заключается ключевая проблема разработки новых и эффективных терапевтических агентов и способов лечения заболеваний. Таким образом, существует потребность в области техники в новых путях изменения РК и/или PD биоактивных соединений.
Кроме антител существуют новые связывающие белки или связывающие домены, которые могут использоваться для специфического связывания с целевой молекулой (например, Binz, H.K., Amstutz, P. и Plückthun, A., Nat. Biotechnol. 23, 1257-1268, 2005). Один такой новый класс связывающих белков или связывающих доменов основывается на сконструированных белковых повторах или сконструированных повторяемых доменах (WO 2002/020565; Binz, H.K., Amstutz, P., Kohl, A., Stumpp, M.T., Briand, С., Forrer, P., Grütter, M.G., и Plückthun, A., Nat. Biotechnol. 22, 575-582, 2004; Stumpp, M.T., Binz, H.K и Amstutz, P., Drug Discov. Today 13, 695-701, 2008). WO 2002/020565 описывает, как могут быть сконструированы большие библиотеки белковых повторов и их общее применение. Тем не менее, WO 2002/020565 не раскрывает ни селекцию повторяемых доменов со связывающей специфичностью для сывороточного альбумина SA, ни конкретные последовательности мотивов повторяемых доменов, которые специфически связываются с SA. Кроме того, WO 2002/020565 не предполагает, что повторяемые домены со связывающей специфичностью для SA могут использоваться для модуляции РК или PD других молекул. Такие сконструированные повторяемые домены используют модулярную природу белковых повторов и имеют N-терминальные и С-терминальные кэппинг модули для предотвращения агрегации сконструированных повторяемых доменов путем экранирования гидрофобного ядра домена (Forrer, P., Stumpp, M.T., Binz, Н.К. и Plückthun, A., FEBS letters 539, 2-6, 2003). Эти кэппинг модули основываются на кэппирующих повторах природного гуанин-аденин-связывающего белка (GA-связывающего белка). Было показано, что термальная и термодинамическая стабильность этих доменов сконструированных анкириновых повторов может быть дополнительно повышена путем усовершенствования С-терминального кэппирующего повтора, который имеет происхождение от GA-связывающего белка (Interlandi, G., Wetzel, S.K, Settanni, G., Plückthun, А. и Caflisch, A., J. Mol. Biol. 375, 837-854, 2008; Kramer, M.A, Wetzel, S.K., Plückthun, A., Mittl, P.R.E, и Grütter, M.G., J. Mol. Biol. 404, 381-391, 2010). Авторы вводили в общей сложности восемь мутаций в этот кэппинг модуль и удлиняли его С-терминальную спираль путем прибавления трех различных аминокислот. Тем не менее, введение этих модификаций в С-терминальный кэппинг модуль приводило к тенденции нежелательной димеризации сконструированного повторяемого домена, который несет этот мутированный С-терминальный кэппинг модуль. Таким образом, существует необходимость в получении дополнительных оптимизированных С-терминальных кэппинг модулей или С-терминальных кэппирующих повторов доменов анкиринового повтора.
Нацеливание SA для модуляции РК и/или PD с помощью доступных в настоящее время подходов не всегда является эффективным. При этом также стало более отчетливо видно, что модуляция РК и/или PD молекул путем захвата SA является сложной и все еще не совсем понятной.
В общем случае, существует потребность в улучшенных связывающих белках со специфичностью для SA, способных улучшать РК и/или PD терапевтически релевантных молекул или полипептидов для лечения рака и других патологических состояний.
Техническая проблема, которая лежит в основе настоящего изобретения, заключается в идентификации новых связывающих белков, таких как повторяемые домены, со связывающей специфичностью для SA, способных к модификации РК и/или PD терапевтически релевантных молекул для улучшенного лечения рака и других патологических состояний. Решение этой технической проблемы достигается путем обеспечения воплощений, охарактеризованных в формуле изобретения.
Краткое изложение сущности изобретения
Настоящее изобретение относится к связывающим белкам, включающим, по крайней мере один домен анкиринового повтора, где указанный домен анкиринового повтора имеет связывающую специфичность для сывороточного альбумина млекопитающих и где указанный домен анкиринового повтора включает модуль анкиринового повтора, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 49, 50, 51 и 52, а также последовательностей, в которых вплоть до 9 аминокислот SEQ ID NO: 49, 50, 51 и 52 являются замененными какой-либо аминокислотой.
В дополнительном воплощении изобретение относится к связывающим белкам, включающим, по крайней мере, один домен анкиринового повтора, где указанный повторяемый домен имеет связывающую специфичность для сывороточного альбумина млекопитающих, и где указанный домен анкиринового повтора включает аминокислотную последовательность, которая имеет, по крайней мере, 70%-ную идентичность аминокислотной последовательности с одним доменом анкиринового повтора, выбранным из группы, состоящей из SEQ ID NO: 17-31 и 43-48, где G в положении 1 и/или S в положении 2 указанного домена анкиринового повтора являются необязательно отсутствующими.
В частности, изобретение относится к связывающим белкам, как определяется в данной заявке выше, где домен анкиринового повтора конкурирует за связывание с сывороточным альбумином млекопитающих с доменом анкиринового повтора, выбранным из группы, состоящей из SEQ ID NO: 17-31 и 43-48.
Кроме того, изобретение относится к таким связывающим белкам, включающим биоактивное соединение, в частности, к связывающим белкам, включающим биоактивное соединение, которое обладает, по крайней мере, в два раза более высоким конечным периодом полувыведения у млекопитающего по сравнению с конечным периодом полувыведения указанного немодифицированного биоактивного соединения.
Изобретение также относится к молекулам нуклеиновой кислоты, которые кодируют связывающие белки в соответствии с настоящим изобретением, и к фармацевтической композиции, включающей один или или более упомянутых выше связывающих белков или молекул нуклеиновой кислоты.
Изобретение также относится к способу лечения патологического состояния при использовании связывающих белков в соответствии с изобретением.
Краткое описание чертежей
Фигура 1. Анализ стабильности выбранных DARPin с помощью SEC.
Профили элюирования прогонов эксклюзионной хроматографии размеров (SEC) DARPin со специфичностью для xSA перед инкубацией (Фиг.1а), после инкубации при концентрации 30 мг/мл (~2 мМ) в PBS в течение 28 дней при 40°С (Фиг.1b) или после хранения в течение 1 месяца при -80°С (Фиг.1с), проанализированные с помощью Superdex 200 колонки 5/150 (Фиг.1а или Фиг.1b), или с помощью колонки Superdex 200 10/300GL (Фиг.1с). Все образцы подвергали экспрессии и очищали так, как описано в Примере 1. Для проведения SEC анализа образцы разводили до концентрации 500 мкМ. Стандарты молекулярной массы Апротинин (АР) 6,5 кДа, Карбоангидраза (СА) 29 кДа и Кональбумин (СО) 75 кДа обозначены стрелками.
xSA, сывороточный альбумин млекопитающих, А, поглощение при 280 нм; t, время удержания в минутах;
DARPin #19 (SEQ ID NO: 19 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #20 (SEQ ID NO: 20 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #21 (SEQ ID NO: 21 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #22 (SEQ ID NO: 22 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #27 (SEQ ID NO: 27 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #28 (SEQ ID NO: 28 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #29 (SEQ ID NO: 29 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #30 (SEQ ID NO: 30 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
DARPin #43 (SEQ ID NO: 43 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
DARPin #44 (SEQ ID NO: 44 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
DARPin #45 (SEQ ID NO: 45 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
DARPin #46 (SEQ ID NO: 46 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
DARPin #47 (SEQ ID NO: 47 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
DARPin #48 (SEQ ID NO: 48 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
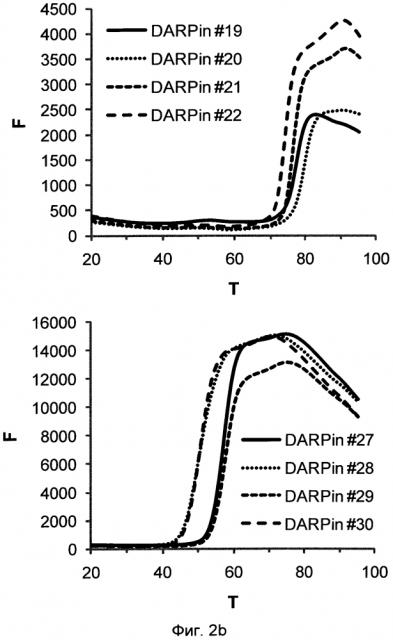
Фигура 2. Термальная стабильность выбранных DARPin.
Запись для термальной денатурации DARPin со специфичностью для xSA (которая сопровождается повышением интенсивности флуоресценции красителя SYPRO оранжевого, присутствующего в буфере) в PBS при значении рН 7,4 (Фиг.2а) и в MES буфере при значении рН 5,8 (Фиг.2b) (250 мМ (2-N-морфолино)этансульфоновая кислота рН 5,5), 150 мМ NaCl, смешанный с PBS рН 7,4 1 к 4 (об./об.) и доведенный до значения рН 5,8).
F, относительные единицы флуоресценции (RFU), возбуждение при 515-535 нм, определение при 560-580 нм; Т, температура в °С; определение DARPin смотри выше.
Фигура 3. Выведение выбранных DARPin из плазмы крови у мышей.
Выведение из плазмы крови DARPin со специфичностью для MSA (мышиный сывороточный альбумин) и контрольных DARPin оценивали у мышей.
(Фиг.3а) DARPin, включающие только один повторяемый домен со связывающей специфичностью для MSA по сравнению с DARPin #32 (смотри ниже), не имеющим связывающей специфичности для MSA.
(Фиг.3b) DARPin, включающие два белковых домена (один из которых представляет собой повторяемый домен со связывающей специфичностью для MSA) по сравнению с DARPin #32, не имеющим связывающей специфичности для MSA.
DARPin метили с помощью His-Tag при использовании соединения 99mTc-карбонил и вводили внутривенно мышам. Радиоактивность у мышей, которым делали инъекцию, измеряли в различные моменты времени после инъекции и представляли в виде соотношения инъецируемой дозы, скорректированной для радиоактивного распада 99mTc (% ID). Апроксимированные кривые нелинейных регрессий радиоактивности, измеренной в различные моменты времени - двухфазный распад (Graphpad Prism). Каждая точка данных показывает среднее значение двух мышей на группу.
% ID, процент введенной дозы, скорректированный для радиоактивного распада 99mTc; t, время в часах;
DARPin #18 (SEQ ID NO: 18 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #23 (SEQ ID NO: 23 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #25 (SEQ ID NO: 25 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #32 (негативный контроль DARPin без связывающей специфичности по отношению к xSA, SEQ ID NO: 32 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #33 (DARPin, включающий два домена повтора, один со связывающей специфичностью для xSA, SEQ ID NO: 33 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #35 (DARPin, включающий два домена повтора, один со связывающей специфичностью для xSA, SEQ ID NO: 35 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #36 (DARPin, включающий два домена повтора, один со связывающей специфичностью для xSA, SEQ ID NO: 36 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
Фигура 4. Выведение выбранных DARPin из плазмы крови у обезьян циномолгус.
Выведение DARPin со специфичностью для CSA (сывороточный альбумин обезьян циномолгус) и контрольных DARPin из плазмы крови оценивали у обезьян циномолгус.
(Фиг.4а) DARPin #26 сравнивали с DARPin #32, не имеющим связывающей специфичности по отношению к CSA.
(Фиг.4b) DARPin #24, 34 и 17 сравнивали с DARPin #32, не имеющим связывающей специфичности по отношению к CSA. Следующие DARPin внутривенно вводили обезьянам циномолгус в момент времени t=0 часов в концентрации 0,5 мг/мл (DARPin #26, DARPin #24, DARPin #17 и DARPin #32) или 1 мг/мл (DARPin #34): Концентрацию DARPin в плазме крови обезьян измеряли с помощью ELISA в различные моменты времени после инъекции. Кривые показывают результат нелинейных регрессий концентраций, измеренных в различные моменты времени - двухфазный распад (Graphpad Prism). Из второй фазы может быть определен конечный период полувыведения DARPin. Каждая единичная точка данных указывает среднее значение двух независимых измерений ELISA того же образца сыворотки.
С, концентрация DARPin в нМ; t, время в часах;
DARPin #17 (SEQ ID NO: 17 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #24 (SEQ ID NO: 24 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #26 (SEQ ID NO: 26 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #32 (негативный контроль DARPin без связывающей специфичности по отношению к xSA, SEQ ID NO: 32 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом);
DARPin #34 (DARPin, включающий два домена повтора, один со связывающей специфичностью для xSA, SEQ ID NO: 34 с гистидиновой меткой (SEQ ID NO: 15), слитой с его N-терминальным концом).
Подробное описание изобретения
Связывающий домен в соответствии с изобретением является специфическим для сывороточного альбумина млекопитающих (xSA). Предпочтительно, связывающий домен в соответствии с изобретением является специфическим для сывороточного альбумина, который имеет происхождение от мышей, крыс, собак, кролей, обезьян или человека. Более предпочтительно, связывающий домен в соответствии с изобретением является специфическим для сывороточного альбумина человеческого происхождения (HSA).
Термин "белок" относится к полипептиду, в котором, по крайней мере, часть полипептида имеет, или обладает способностью приобретать определенное пространственное расположение путем формирования вторичных, третичных или четвертичных структур в пределах полипептидного(ых) цепи(ей) и/или между ними. В том случае, если белок включает два или более полипептидов, то индивидуальные полипептидные цепи могут быть связаны нековалентно или ковалентно, например, с помощью дисульфидной связи между двумя полипептидами. Часть белка, которая индивидуально имеет или обладает способностью приобретать определенное пространственное расположение путем формирования вторичных или третичных структур, называется "белковым доменом". Такие белковые домены являются хорошо известными квалифицированному специалисту в данной области техники.
Термин "рекомбинантный", как используется в словосочетании рекомбинантный белок, рекомбинантный белковый домен, рекомбинантный связывающий белок и тому подобное, означает, что указанные полипептиды получают с помощью методик рекомбинантной ДНК, хорошо известных квалифицированному специалисту в релевантной области техники. Например, рекомбинантная молекула ДНК (например, полученная с помощью синтеза генов), которая кодирует полипептид, может быть клонирована в бактериальную экспрессионную плазмиду (например, pQE30, Qiagen), дрожжевую экспрессионную плазмиду или экспрессионную плазмиду млекопитающих. Когда, например, такая сконструированная рекомбинантная бактериальная экспрессионная плазмида встраивается в приемлемую бактерию (например, Escherichia coli), эта бактерия может продуцировать полипептид, который кодируется этой рекомбинантной ДНК. Соответствующим образом полученный полипептид называется рекомбинантным полипептидом.
В контексте настоящего изобретения термин "полипептид" относится к молекуле, которая состоит из одной или более цепей многочисленных, то есть, из двух или более, аминокислот, связанных с помощью пептидных связей. Предпочтительно, полипептид состоит из более, чем восемь аминокислот, связанных с помощью пептидных связей.
Термин "полипептидная метка" относится к аминокислотной последовательности, которая присоединяется к полипептиду/белку, где указанная аминокислотная последовательность является полезной для очистки, определения или мечения указанного полипептида/белка, или где указанная аминокислотная последовательность улучшает физико-химическое поведение полипептида/белка, или где указанная аминокислотная последовательность обладает эффекторной функцией. Индивидуальные полипептидные метки, остатки и/или домены связывающего белка могут быть связаны друг с другом непосредственно или с помощью полипептидных линкеров. Эти полипептидные метки являются хорошо известными в области техники и полностью доступны квалифицированному специалисту в данной области техники. Примеры полипептидных меток представляют собой малые полипептидные последовательности, например, His (например, His-метка последовательности SEQ ID NO: 15), myc, FLAG или Strep-метки или остатки, такие как ферменты (например, ферменты, подобные щелочной фосфатазе), которые позволяют осуществлять определение указанного полипептида/белка, или остатки, которые могут использоваться для мечения (такие как иммуноглобулины или их фрагменты) и/или в качестве эффекторных молекул.
Термин "полипептидный линкер" относится к аминокислотной последовательности, которая является способной к связыванию, например, двух белковых доменов, полипептидной метки и белкового домена, белкового домена и остатка, отличного от полипептида, такого как полиэтиленгликоль или двух последовательностей метки. Такие дополнительные домены, метки, остатки, отличные от полипептидов, и линкеры являются хорошо известными квалифицированному специалисту в релевантной области техники. Список примеров обеспечивается в описании к патентной заявке WO 2002/020565. Частные примеры таких линкеров представляют собой глицин-серин линкеры и пролин-треонин линкеры варьирующей длины; является предпочтительным, когда указанные линкеры имеют длину от 2 до 24 аминокислот; более предпочтительно, когда указанные линкеры имеют длину от 2 до 16 аминокислот. Пример глицин-серин линкера обеспечивается в SEQ ID NO: 16.
Термин "полимерный остаток" относится либо к остатку белкового полимера, либо к остатку небелкового полимера. Термин "остаток белкового полимера" предпочтительно представляет собой полипептид, который не формирует стабильной третичной структуры не более чем в 10%, предпочтительно, не более чем в 5%; также предпочтительно не более чем в 2%; даже более предпочтительно, не более чем в 1%; и наиболее предпочтительно, в неспособных к определению количествах, как определяется с помощью эксклюзионной хроматографии размеров (SEC), олигомеров или агрегатов при хранении в концентрации приблизительно 0,1 мМ в забуференном фосфатом физиологическом растворе (PBS) при комнатной температуре (RT) в течение одного месяца. Такие белковые полимерные остатки разгоняют при среднем молекулярном весе в SEC, который является выше, чем их эффективный молекулярный вес при использовании глобулярных белков в качестве стандартов молекулярного веса для SEC. Предпочтительно, когда средний молекулярный вес указанных белковых полимерных остатков, определяемый с помощью SEC, является в 1,5 раза, 2 раза или 2,5 раза выше, чем их эффективный молекулярный вес, подсчитанный из их аминокислотной последовательности. Также является предпочтительным, когда средние молекулярные массы указанных небелковых полимерных остатков, определенные с помощью SEC, являются в 2 раза, 4 раза или 8 раз выше, чем их эффективный молекулярный вес, подсчитанный из их молекулярного состава. Предпочтительно, когда более чем 50%, 70% или даже 90% аминокислот указанных остаток белкового полимера не формируют стабильных вторичных структур при концентрации приблизительно 0,1 мМ в PBS при комнатной температуре, как определяется с помощью измерений циркулярного дихроизма (CD). Наиболее предпочтительно, когда указанный белковый полимер демонстрирует типичный спектр циркулярного дихроизма вблизи УФ статистической спиральной конформации. Такие CD являются хорошо известными квалифицированному специалисту в данной области техники. Также предпочтительными являются остатки белковых полимеров, которые состоят более чем из 50, предпочтительно более чем из 100, 200, 300, 400, 500, 600, 700, или наиболее предпочтительно более чем из 800 аминокислот. Примеры белковых полимерных остатков представляют собой XTEN® (зарегистрированный товарный знак Amunix; WO 2007/103515) полипептиды или полипептиды, включающие остатки пролина, аланина и серина, как описывается в WO 2008/155134. Такие белковые полимерные остатки могут быть ковалентно присоединены, например, к связывающему домену в соответствии с изобретением, путем получения полипептидов генетическим слиянием при использовании стандартных методик клонирования ДНК, после чего осуществляют их стандартную экспрессию и очистку.
Полимерный остаток в соответствии с изобретением может варьировать в широких пределах по своей молекулярной массе (то есть, от приблизительно 1 кДа до приблизительно 150 кДа). Предпочтительно, полимерный остаток имеет молекулярный вес, по крайней мере, 2, более предпочтительно, по крайней мере, 5, 10, 20, 30, 50, 70, или наиболее предпочтительно, по крайней мере, 100 кДа. Предпочтительно, когда указанный полимерный остаток соединяется с помощью полипептидного линкера со связывающим доменом.
Примеры небелковых полимерных остатков представляют собой гидроксиэтил крахмал (HES), полиэтиленгликоль (PEG), полипропиленгликоль или полиоксиалкилен. Термин "ПЭГилированный" означает, что остаток ПЭГ является ковалентно присоединенным, например, к полипептиду в соответствии с изобретением.
В специфическом воплощении остаток ПЭГ или любого другого небелкового полимера может, например, может быть слитым с тиолом цистеина с помощью малеимидного линкера, при этом цистеин является слитым с помощью пептидного линкера с N- или С-терминальным концом связывающего домена, как описывается в данной заявке.
Термин "связывающий белок" относится к белку, включающему один или более связывающих доменов, одно или более биоактивных соединений и один или более полимерных остатков, как дополнительно объясняется ниже. Предпочтительно, когда указанный связывающий белок включает вплоть до четырех связывающих доменов. Более предпочтительно, когда указанный связывающий белок включает вплоть до двух связывающих доменов. Наиболее предпочтительно, когда указанный связывающий белок включает только один связывающий домен. Кроме того, любой такой связывающий белок может включать дополнительные белковые домены, которые не являются связывающими доменами, остатки мультимеризации, полипептидные метки, полипептидные линкеры и/или единичный остаток Cys. Примеры остатков мультимеризации представляют собой константные участки тяжелой цепи иммуноглобулина, которые спариваются с обеспечением функциональных Fc доменов иммуноглобулина, и лейциновые "застежки" или полипептиды, включающие свободный тиол, который образует межмолекулярную дисульфидную связь между двумя такими полипептидами. Единичный остаток Cys может использоваться для конъюгации других остатков к полипептиду, например, путем использования малеимидной связи, которая является хорошо известной квалифицированному специалисту в данной области техники. Предпочтительно, когда указанный связывающий белок представляет собой рекомбинантный связывающий белок. Также является предпочтительным, когда связывающие домены связывающего белка обладают различными целевыми специфичностями.
Термин "связывающий домен" означает белковый домен, который демонстрирует такую же сборку (пространственное размещение), что и белковый каркас и обладает предварительно определенным свойством, как определяется ниже. Такой связывающий домен может быть получен с помощью целесообразных, или в наиболее общем случае, комбинаторных методик конструирования белка, методов, которые являются известными в области техники (Binz и др., 2005, в приведенном выше месте). Например, связывающий домен, имеющий предварительно определенное свойство, может быть получен с помощью способа, включающего этапы (а) обеспечения разнообразной коллекции белковых доменов, которые демонстрируют такую же сборку, что и белковый каркас, как определено дополнительно ниже; и (b) скрининга указанной разнообразной коллекции и/или селекции из указанной разнообразной коллекции для получения, по крайней мере, одного белкового домена, обладающего указанным предварительно определенным свойством. Разнообразная коллекция белковых доменов может обеспечиваться с помощью нескольких способов в соответствии с используемой системой скрининга и/или селекции и может включать применение способов, хорошо известных квалифицированному специалисту в данной области техники, таких как фаговый дисплей или рибосомальный дисплей. Предпочтительно, указанный связывающий домен представляет собой рекомбинантный связывающий домен.
Термин "белковый каркас" означает белок с внешними участками, в которых аминокислотные инсерции, замены или делеции являются в высокой степени допустимыми. Примеры белковых каркасов, которые могут использоваться для получения связывающих доменов настоящего изобретения, представляют собой антитела или их фрагменты, такие как одноцепочечные Fv или Fab фрагменты, белок А из Staphylococcus aureus, связывающий билин белок из Pieris brassicae или другие липокалины, белки анкириновых повторов или другие повторяемые белки, а также человеческий фибронектин. Белковые каркасы являются хорошо известными квалифицированному специалисту в данной области техники (Binz и др., 2005, в приведенном выше месте; Binz и др., 2004, в приведенном выше месте).
Термин "предварительно определенное свойство" относится к свойству, такому как, связывание с мишенью, блокирование мишени, активация опосредованной мишенью реакции, ферментативная активность и другие близкие свойства. В зависимости от типа желаемого свойства, средний специалист в данной области техники будет способен идентифицировать формат и необходимые этапы для осуществления скрининга и/или селекции связывающего домена с желаемым свойством. Предпочтительно, указанное предварительно определенное свойство представляет собой связывание с мишенью.
Определения, приведенные в данной заявке ниже для белков повторов, основываются на таких, которые описаны в патентной заявке WO 2002/020565. Патентная заявка WO 2002/020565 дополнительно содержит общее описание характеристик белковых повторов, методик и применений.
Термин "повторяемый белок" относится к белкам, включающим один или более повторяемых доменов. Предпочтительно, каждый указанный белок повторов включает вплоть до четырех повторяемых доменов. Более предпочтительно, когда каждый указанный белок повторов включает вплоть до двух повторяемых доменов. Наиболее предпочтительно, когда каждый указанный повторяемый белок включает только один повторяемый домен. Кроме того, указанный белок повторов может включать дополнительные небелковые повторяемые домены, полипептидные метки и/или полипептидные линкеры.
Термин "повторяемый домен" относится к белковым доменам, включающим две или более последовательных повторяемых единиц (модулей) в качестве структурных единиц, где указанные структурные единицы имеют такую же сборку и плотно упаковываются с образованием, например, сферической структуры, имеющей соединительное гидрофобное ядро. Предпочтительно, повторяемый домен дополнительно включает N-терминальную и/или С-терминальную кэппирующую единицу (или модуль). Даже более предпочтительно, когда указанные N-терминальные и/или С-терминальные кэппирующие единицы (или модули) представляют собой кэппирующие повторы.
Термин "сконструированные повторяемый белок" и "сконструированный повторяемый домен" относится к повторяемому белку или повторяемому домену, соответственно, полученному в результате изобретательской процедуры, которая объясняется в патентной заявке WO 2002/020565. Сконструированные повторяемые белки и сконструированные повторяемые домены являются синтетическими, а не природными. Они могут представлять собой созданные человеком белки или домены, соответственно, полученные путем экспрессии соответственным образом сконструированных нуклеиновых кислот. Предпочтительно, экспрессию осуществляют в прокариотических или эукариотических клетках, таких как бактериальные клетки, или путем использования бесклеточной экспрессионной системы in vitro. В соответствии с этим, сконструированный белок с анкириновым повтором (то есть, DARPin) соответствует связывающему белку в соответствии с изобретением, включающему, по крайней мере, один домен анкиринового повтора.
Термин "структурная единица" относится к локально упорядоченной части полипептида, образованной пространственными взаимодействиями между двумя или более сегментами вторичной структуры, которые находятся рядом друг с другом в полипептидной цепи. Такая структурная единица демонстрирует структурный мотив. Термин "структурный мотив" относится к пространственному расположению элементов вторичной структуры, присутствующих, по крайней мере, в одной структурной единице. Структурные мотивы являются хорошо известными квалифицированному специалисту в данной области техники. Структурные единицы, взятые отдельно, не являются способными приобретать определенное пространственное расположение; однако их последовательное расположение, например, в виде повторяемых модулей в повторяемом домене, приводит к взаимной стабилизации соседних единиц, что вызывает образование сферической структуры.
Термин "повторяемая единица" относится к аминокислотной последовательности, включающей мотивы повторяемой последовательности одного или более существующих в природе повторяемых белков, где указанные "повторяемые единицы" обнаруживаются во множественных копиях, и которые демонстрируют определенную топологию сборки, общую для всех указанных мотивов, определяющих сборку этого белка. Такие повторяемые единицы соответствуют "повторяемым структурным единицам (повторам)" повторяемых белков, как описывается Forrer и др., 2003, в приведенном выше месте, или "последовательным структурным единицам (повторам)" повторяемых белков, как описывается Binz и др., 2004, в приведенном выше месте. Такие повторяемые единицы включают каркасные остатки и остатки взаимодействия. Примеры таких повторяемых единиц представляют собой повторяемые единицы армадилло, обогащенные лейцином повторяемые единицы, единицы анкиринового повтора, повторяемые единицы тетратрикопептида, повторяемые единицы HEAT и вариантные повторяемые единицы, обогащенные лейцином. Существующие в природе белки, содержащие две или более таких повторяемых единиц, называются "существующими в природе повторяемыми белками". Аминокислотные последовательности индивидуальных повторяемых единиц повторяемых белков могут иметь значительное количество мутаций, замен, инсерций и/или делеций по сравнению с каждым другим, в то время как все еще существенно сохраняют общую модель, или мотив повторяемой единицы.
Термин "единица анкиринового повтора" будет означать повторяемую единицу, которая представляет собой анкириновый повтор, как описывается, например, Forrer и др., 2003, в приведенном выше месте. Анкириновые повторы являются хорошо известными квалифицированному специалисту в данной области техники.
Термин "каркасные участки" относится к аминокислотным остаткам повторяемой единицы, или соответствующим аминокислотным остаткам повторяемых модулей, которые осуществляют свой вклад в топологию сборки, то есть те, которые осуществляют свой вклад в сборку указанной повторяемой единицы (или модуля), или те, которые осуществляют свой вклад во взаимодействие с соседней единицей (или модулем). Такой вклад может представлять собой взаимодействие с другими остатками в повторяемой единице (или модуле), или влияние на конформацию полипептидного скелета, как обнаруживается в α-спиралях или β-складках, или аминокислотных цепочках, которые формируют линейные полипептиды или петли.
Термин "целевые остатки взаимодействия" относится к аминокислотным остаткам повторяемой единицы, или к соответствующим аминокислотным остаткам повторяемых модулей, которые осуществляют свой вклад во взаимодействие с целевыми веществами. Такой вклад может представлять собой непосредственное взаимодействие с целевыми веществами, или влияние на другие непосредственно взаимодействующие остатки, например, путем стабилизации конформации полипептида повторяемой единицы (или модуля) для того, чтобы позволить осуществить или улучшить взаимодействие непосредственно взаимодействующих остатков с указанной целью. Такие каркасные остатки и целевые остатки взаимодействия могут быть идентифицированы с помощью анализа структурных данных, полученных с помощью физико-химических методов, таких как рентгеноструктурная кристаллография, ЯМР и/или спектроскопия циркулярного дихроизма, или путем сравнения с известной и близкой структурной информацией, которая является хорошо известной практикующим специалистам в структурной биологии и/или биоинформатике.
Предпочтительно, когда повторяемые единицы, используемые для дедукции мотива повторяемой последователь