Способ получения 2,4-дигидроксимасляной кислоты
Иллюстрации
Показать всеГруппа изобретений относится к получению 2,4-дигидроксимасляной кислоты (2,4-ДГМ). Предложен способ получения 2,4-ДГМ, включающий первую стадию превращения малата в 4-фосфомалат с использованием фермента, способного осуществить подобное превращение, вторую стадию превращения 4-фосфомалата в малат-4-полуальдегид с использованием фермента, способного осуществить подобное превращение, и третью стадию превращения малат-4-полуальдегида в 2,4-ДГМ с использованием фермента, способного осуществить подобное превращение. При этом на первой стадии используют фермент, который имеет последовательность, выбранную из группы, состоящей из SEQ ID No. 12, SEQ ID No. 14, SEQ ID No. 16, SEQ ID No. 18, SEQ ID No. 20, SEQ ID No. 22, SEQ ID No. 24, SEQ ID No. 26, SEQ ID No. 39, SEQ ID No. 41, SEQ ID No. 43 и SEQ ID No. 45. На второй стадии используют фермент, который имеет последовательность, выбранную из группы, состоящей из SEQ ID No. 54, SEQ ID No. 56, SEQ ID No. 58, SEQ ID No. 60, SEQ ID No. 62, SEQ ID No. 64, SEQ ID No. 66 и SEQ ID No. 231. На третьей стадии используют фермент, который имеет последовательность, выбранную из группы, состоящей из SEQ ID No. 74, SEQ ID No. 76, SEQ ID No. 81, SEQ ID No. 225 и SEQ ID No. 227. Предложены также варианты ферментов, используемых в способе, варианты нуклеиновых кислот, кодирующих соответствующие ферменты, варианты химерных генов для трансформации микроорганизма-хозяина и экспрессии в этом микроорганизме соответствующего фермента, варианты вектора экспрессии, варианты микроорганизма-хозяина, экспрессирующего соответствующий фермент. 19 н. и 12 з.п. ф-лы, 5 ил., 16 табл.,12 пр.
Реферат
Настоящее изобретение относится к новому способу получения 2,4-дигидроксимасляной кислоты из малата при помощи синтетического пути, который включает ферменты, обладающие, соответственно, малаткиназной, малат полуальдегиддегидрогеназной и 2,4-дигидроксибутиратдегидрогеназной активностью.
Карбоновые кислоты, цитированные в настоящей заявке на изобретение, в равной степени названы в соответствии со своей солевой (например, 2,4-дигидроксибутират) или кислотной формой (например, 2,4-дигидроксимасляная кислота).
2,4-Дигидроксимасляная кислота (в равной степени 2,4-ДГМ или ДГМ) представляет собой соединение, представляющее значительный экономический интерес. ДГМ может быть легко превращен в α-гидрокси-γ-бутиролактон в водных средах путем поддержания подходящего рН. α-Гидрокси-γ-бутиролактон представляет собой значимый предшественник для продукции метионинового заместителя 2-гидрокси-4-(метилтио)-бутирата (ГМТБ) (Deck et al., 2008), который занимает значительный рынок в кормлении животных. В настоящее время, α-гидрокси-γ-бутиролактон происходит из γ-бутиролактона при помощи многостадийного способа, который обеспечивает галогенирование γ-бутиролактона в позиции α, и последующее замещение атома галогена гидроксильной группой в щелочной среде (Deck et al., 2008).
Вследствие растущих цен на масло возрастает потребность в продукции ДГМ из возобновляемых источников. Микроорганизмы способны превращать происходящий из биомассы сырьевой материал, например сахара или органические кислоты, в огромное разнообразие различных химических соединений (Werpy & Petersen, 2004). Параллельно с растущей массой биохимической и генетической информации возможно модифицировать микроорганизмы, такие что они сверхпродуцируют встречающиеся в природе метаболические промежуточные соединения с высоким выходом и продуктивностью (Bailey, 1991). Оптимизация продукции микроорганизмов часто требует рационального конструирования метаболических сетей, которые обеспечивают, кроме того, сверхэкспрессию ферментов, требующихся для биосинтеза интересующего метаболита, и устранение ингибирования продукта по механизму обратной связи. Еще одна возможность заключается в применении новых ферментативных систем, которые катализируют продукцию интересующего метаболита.
Подходы метаболической инженерии и ферментативные катализы требуют подробного знания биохимии и регуляции метаболического пути, приводящего к интересуемому метаболиту. В случае продукции ДГМ данная информация отсутствует. Только в нескольких исследованиях сообщается о появлении ДГМ у пациентов, страдающих от дефицита дегидрогеназы янтарного полуальдегида (Shinka et al., 2002), тем не менее без идентификации ферментативных реакций, вовлеченных в продукцию ДГМ. Таким образом, для ферментативной продукции ДГМ требуется (1) идентификация термодинамически реализуемого пути, который превращает доступный предшественник в ДГМ, (2) идентификация или конструирование ферментов, которые способны катализировать отдельные реакционные стадии в пути и (3) функциональная экспрессия ферментов в пути в соответствующем продуцирующем организме.
Задача настоящего изобретения заключается в том, чтобы удовлетворять этим потребностям.
Соответственно, одной из задач настоящего изобретения является способ получения 2,4-ДГМ, при котором осуществляют первую стадию превращения малата в 4-фосфомалат с использованием малаткиназы, вторую стадию превращения 4-фосфомалата в малат-4-полуальдегид с использованием малат полуальдегид дегидрогеназы, третью стадию превращения малат-4-полуальдегида в 2,4-ДГМ с использованием ДГМ дегидрогеназы.
В первой реакции (смотри фиг.1 (i)) малат (1) превращается в 4-фосфомалат (2) путем действия фермента, который обладает малаткиназной активностью (А). Во второй реакции (В) 4-фосфомалат превращается в малат-4-полуальдегид (3) путем действия фермента, который обладает малат полуальдегид дегидрогеназной активностью. Точнее, реакцию (В) катализируют при помощи фермента, обладающего дефосфорилирующей 4-фосфомалат редуктазной активностью в биосинтетическом пути. В третьей реакции (С) малат-4-полуальдегид превращается в ДГМ (4) путем действия фермента, который обладает ДГМ дегидрогеназной активностью. Точнее реакцию (С) катализируют при помощи фермента, обладающего малат-4-полуальдегид редуктазной активностью в биосинтетическом пути.
Ни один из вышеописанных ферментов и промежуточных продуктов не был описан и идентифицирован в живых клетках. Сами малаткиназа, малат полуальдегид дегидрогеназа, ДГМ дегидрогеназа и 4-фосфомалат представляют собой дополнительные задачи изобретения.
В еще одном из аспектов изобретения первая стадия в способе получения 2,4-ДГМ включает малаткиназу, которая характеризуется тем, что превращает малат в 4-фосфомалат. Указанный фермент получают при помощи по меньшей мере одной мутации фермента, где указанная(ые) мутация(и) улучшает(ют) активность и/или субстратную аффинность мутантного фермента в отношении малата.
В настоящем изобретении выражение "улучшают активность и/или субстратную аффинность" означает, что фермент до мутации был или не способен использовать субстрат (малат, 4-фосфомалат или малат-4-полуальдегид) и/или синтезировал продукт реакции (4-фосфомалат или малат-4-полуальдегид или ДГМ) с максимальной специфической скоростью, которая была по меньшей мере в три раза меньше, и/или
обладал аффинностью в отношении малата, 4-фосфомалата или малат-4-полуальдегида, которая была по меньшей мере в три раза меньше, и/или
обладал аффинностью в отношении природного субстрата (аспартат, 4-фосфо-аспартат, аспартат-4-полуальдегид), которая была по меньшей мере в 3 раза выше.
В еще одном из своих аспектов изобретение относится к применению малаткиназы для превращения малата в 4-фосфомалат.
Малаткиназная активность может быть измерена при помощи ферментативного теста, описанного в примере 1 (смотри "Ферментативный анализ").
В соответствии с еще одним аспектом изобретения малаткиназа может быть получена путем мутации аспартаткиназы.
Фиг.2 демонстрирует совмещение аминокислотных последовательностей аспартаткиназ различного биологического происхождения. Все ссылки на позицию аминокислот сделаны на основе аминокислотной последовательности аспартаткиназы, кодируемой геном LysC E.coli (представленной в SEQ ID No. 4). Относительные позиции соответствующих консервативных областей в других аспартаткиназах из различных организмов легко могут быть найдены специалистом в данной области техники путем простого совмещения последовательности, как представлено на Фиг.2, с ферментами, перечисленными ниже:
- AKIN - аспартаткиназа III из E. Coli (SEQ ID No. 4),
- AKI (SEQ ID No. 87) аспартаткиназа I из E.coli,,
- AKII (SEQ ID No. 88) - аспартаткиназа II из E.coli,
- MJ - Methanococcus jannaschii (SEQ ID No. 89),
- TT - Thermus thermophilus (SEQ ID No. 90),
- CG - Corynebacterium glutamicum (SEQ ID No. 91),
- AT - Arabidopsis thaliana (SEQ ID No. 92),
- SC - Saccharomyces cerevisiae. (SEQ ID No. 93).
Указанное совмещение может быть осуществлено при помощи программного обеспечения ClustaIW2. Например, остаток Е119 аспартаткиназы, представленной в SEQ ID No. 4, соответствует остатку Е207 аспартаткиназы А.thaliana (SEQ ID No. 50) или остатку Е147 аспартаткиназы S.cerevisiae (SEQ ID No. 51).
Мутантная аспартаткиназа в соответствии с изобретением содержит по меньшей мере одну мутацию по сравнению с ферментом дикого типа в по меньшей мере одной из следующих позиций: S39, Т45, V115, Е119, F184 и/или S201, где встречающаяся в природе аминокислота в указанных позициях заменена на любую из других 19 существующих в природе белокобразующих аминокислот, то есть на аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин.
В неисключительном примере конструирование малаткиназы путем сайтнаправленного мутагенеза продемонстрировано с использованием аспартаткиназы Lys С из Escherichia coli в качестве матрицы. В соответствии с одним из аспектов изобретения субстратная специфичность LysC меняется в сторону малата путем замены глутаминовой кислоты в позиции 119 на аспарагин, глутамин, цистеин, пролин, серин, треонин, валин или глицин.
В еще одном аспекте изобретения малаткиназа представлена в SEQ ID No. 9 и конкретней в SEQ ID No. 12, SEQ ID No. 14, SEQ ID No. 16, SEQ ID No. 18, SEQ ID No. 20, SEQ ID No. 22, SEQ ID No. 24 или SEQ ID No. 26.
Аспартаткиназы типично ингибируются метионином, треонином или лизином. Таким образом, малаткиназы, конструируемые путем случайного или сайтнаправленного мутагенеза аспартаткиназ также могут ингибироваться указанными аминокислотами. В еще одном аспекте изобретения ингибирование малаткиназы метионином, лизином или треонином уменьшается путем мутагенеза малаткиназы.
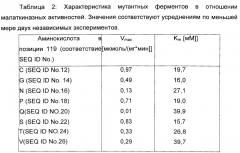
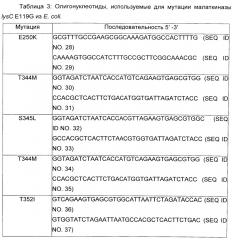
В специфическом аспекте изобретения вышеописанная мутантная LysC (малаткиназа) становится нечувствительной к ингибированию лизином путем мутации по меньшей мере по одной из следующих аминокислот Е250, М318, S321, V339, S338, F324, L.325, V339, S345, Е346, D340, Т344 и/или Т352 (смотри пример 3).
Настоящее изобретение также охватывает такие модифицированные ферменты и конкретней ферменты, представленные в SEQ ID No. 39, SEQ ID No. 41, SEQ ID No. 43 или SEQ ID No. 45.
В еще одном аспекте вторая стадия способа получения 2,4-ДГМ в соответствии с изобретением включает малат полуальдегид дегидрогеназу, отличающуюся тем, что она превращает 4-фосфомалат в малат-4-полуальдегид, где указанный фермент обладает активностью, дефосфорилирующей 4-фосфомалат редуктазу, в пути биосинтеза.
Малат полуальдегид дегидрогеназная активность может быть измерена при помощи ферментативного теста, описанного в примере 4 (смотри "Ферментативный анализ"),
Указанный фермент получают при помощи по меньшей мере одной мутации фермента, где указанная(ые) мутация(и) улучшает(ют) активность и/или субстратную аффинность мутантного фермента в отношении 4-фосфомалата.
В соответствии с еще одним аспектом малат полуальдегид дегидрогеназа по изобретению может быть получена путем мутации фермента, обладающего известной полуальдегид дегидрогеназной активностью, конкретней обладающего дефосфорилирующей активностью в восстановительном аспекте реакции, конкретней действующего на органические молекулы, которые состоят из 3, 4 или 5 углеродных молекул. В конкретном аспекте изобретения указанную малат полуальдегид дегидрогеназу получают путем мутации аспартат полуальдегид дегидрогеназы.
Аспартат полуальдегид дегидрогеназа, Asd из Е.coli и Hom2 из Saccharomyces cerevisiae в природе демонстрируют дегидрогеназную активность в отношении 4-фосфомалата 2.
В соответствии с еще одним аспектом изобретения малат полуальдегид дегидрогеназа может быть улучшена путем мутации аспартат полуальдегид дегидрогеназы.
Фиг.3 демонстрирует совмещение аминокислотных последовательностей аспартат полуальдегид дегидрогеназ различного биологического происхождения. Все ссылки на аминокислоты сделаны на основе аспартат полуальдегид дегидрогеназы, кодируемой геном Asd из Е.coli (как представлено в SEQ ID No. 20). Относительные позиции соответствующих консервативных областей в других аспартат полуальдегид дегидрогеназ из различных организмов легко могут быть найдены специалистом в данной области техники путем простого совмещения последовательностей, представленных на Фиг.4, с ферментами, перечисленными ниже:
- ЕС - Е.Coli (SEQ ID No. 49),
- MJ - Methanococcus jannaschii (SEQ ID No. 94),
- TT - Thermus thermophilus (SEQ ID No. 95),
- BS - Bacillus subtilis (SEQ ID No. 96),
- CG - Corynebacterium glutamicum (SEQ ID No. 97),
- AT - Arabidopsis thaliana (SEQ ID No. 98),
- SC - Saccharomyces cerevisiae. (SEQ ID No. 99)
Указанное совмещение легко может быть осуществлено с использованием программного обеспечения ClustaIW2.
Конструирование ферментов, обладающих улучшенной малат полуальдегид дегидрогеназной активностью, может быть осуществлено следующим образом.
Малат полуальдегид дегидрогеназа в соответствии с изобретением соответствует в специфическом аспекте аспартат полуальдегид дегидрогеназе, содержащей, по меньшей мере, одну мутацию по сравнению с ферментом дикого типа в по меньшей мере одной из позиций Т136, Q162, I230, Е241 и/или Н274, где встречающаяся в природе аминокислота в указанных позициях заменена на любую из других 19 существующих в природе белокобразующих аминокислот, то есть на аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин.
Как продемонстрировано в примере 5, сайтнаправленный мутагенез asd из Е.coli может улучшить активность и субстратную аффинность мутантного фермента в отношении 4-фосфомалата, в то же самое время уменьшая предпочтение фермента в отношении своего природного субстрата 4-фосфо-аспартата.
Для улучшения активности Asd в отношении 4-фосфомалата, и в соответствии с одним из аспектов изобретения Е241 заменен на остаток глутамина, аланина, цистеина, глицина, гистидина, изолейцина или метионина путем сайтнаправленного мутагенеза (Пример 5).
В еще одном аспекте изобретения малат полуальдегид дегидрогеназа представлена в SEQ ID No. 68 и конкретней в SEQ ID No. 54, SEQ ID No. 56, SEQ ID No. 58, SEQ ID No. 60, SEQ ID No. 62, SEQ ID No. 64 или SEQ ID No. 66.
В еще одном аспекте изобретение относится к применению малат полуальдегид дегидрогеназы для превращения 4-фосфомалата в малат-4-полуальдегид.
В еще одном аспекте третья стадия способа получения 2,4-ДГМ в соответствии с изобретением включает ДГМ дегидрогеназу, отличающуюся тем, что она превращает малат-4-полуальдегид в 2,4-ДГМ, где указанный фермент обладает малат-4-полуальдегид редуктазной активностью в биосинтетическом пути.
Ферменты-кандидаты ДГМ дегидрогеназы, которые потенциально уже обладают ДГМ дегидрогеназной активностью, могут быть выбраны из класса β-гидроксикислот дегидрогеназ, которые действуют на С3, С4 или С5 соединения.
В соответствии с еще одним аспектом изобретения указанные ферменты ДГМ дегидрогеназы могут быть структурно и механистически отнесены к гидроксикислот дегидрогеназам, таким как редуктазы тартронат полуальдегида, редуктазы янтарного полуальдегида, редуктазы малонат полуальдегида, редуктазы метилбутиральдегида, алкогольдегидрогеназы цинкового типа, L-треонин-3-дегидрогеназы или редуктазы гомосерина.
Настоящее изобретение также относится к применению редуктазы метилбутиральдегида или редуктазы янтарного полуальдегида для превращения малат-4-полуальдегида в 2,4-ДГМ.В конкретных воплощениях указанная редуктаза метилбутиральдегида представлена в SEQ ID No. 74 и указанная редуктаза янтарного полуальдегида представлена в SEQ ID No. 76. ДГМ дегидрогеназная активность может быть измерена при помощи ферментативного теста, описанного в примере 6 (смотри "Ферментативный анализ").
Аффинность ДГМ дегидрогеназы в отношении малат-4-полуальдегида может быть увеличена при помощи по меньшей мере одной мутации фермента, где указанная(ые) мутация(и) увеличивают активность и/или субстратную аффинность мутантного фермента в отношении малат-4-полуальдегида и/или уменьшает(ют) активность или аффинность в отношении своего природного субстрата по меньшей мере вдвое.
ДГМ дегидрогеназа в соответствии с изобретением соответствует в специфическом аспекте редуктазе янтарного полуальдегида М.sedula (SEQ ID No 76), содержащей по меньшей мере одну мутацию по сравнению с ферментом дикого типа в по меньшей мере одной из позиций S40, N43, Н39 Т49, F85, Q108, L281 и N305, где встречающаяся в природе аминокислота в указанных позициях заменена на любую из других 19 существующих в природе белокобразующих аминокислот, то есть на аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин.
Как продемонстрировано в неисключительном примере аффинность редуктазы янтарного полуальдегида М sedula в отношении (L)-малат-4-полуальдегида увеличивалась путем введения двойной мутации H39R N43H путем сайтнаправленного мутагенеза, как представлено в SEQ ID No. 81. Простые мутанты H39R (SEQ ID No. 225) и N43H (SEQ ID No. 227) также охвачены настоящим изобретением (Пример 7).
ДГМ дегидрогеназа может быть использована для превращения малат-4-полуальдегида в 2,4-ДГМ, который составляет еще один аспект изобретения.
Последовательность нуклеиновой кислоты генов может быть адаптирована использованию кодонов организмом хозяином, таким образом, увеличивая продукцию гетерогенно экспрессируемых белков. Последнее составляет еще один аспект изобретения.
Синтез синтетического гена, кодирующего редуктазу янтарного полуальдегида М.sedula H39R N43H, нуклеотидная последовательность которого оптимизирована для экспрессии указанного фермента в Е.Coli, как представлено в SEQ ID No. 228, составляет еще один аспект изобретения.
В еще одном аспекте настоящее изобретение также относится к нуклеиновым кислотам, и конкретней к последовательностям выделенной нуклеиновой кислоты, кодирующим малаткиназу, как описано выше.
В еще одном аспекте указанная нуклеиновая кислота представлена в SEQ ID No. 13, SEQ ID No. 15, SEQ ID No. 17, SEQ ID No. 19, SEQ ID No. 21, SEQ ID No. 23, SEQ ID No. 25, SEQ ID No. 27, SEQ ID No. 38, SEQ ID No. 40, SEQ ID No. 42 или SEQ ID No. 44.
В еще одном аспекте настоящее изобретение также относится к последовательностям выделенной нуклеиновой кислоты, кодирующим малат полуальдегид дегидрогеназу, как описано выше.
Конкретней, указанная нуклеиновая кислота предпочтительно представлена в SEQ ID No. 55, SEQ ID No. 57, SEQ ID No. 59, SEQ ID No. 61, SEQ ID No. 63, SEQ ID No. 65 или SEQ ID No. 67.
В еще одном аспекте настоящее изобретение также относится к последовательностям выделенной нуклеиновой кислоты, кодирующим ДГМ дегидрогеназу, как описано выше.
В еще одном аспекте указанная нуклеиновая кислота представлена в SEQ ID No. 73 или SEQ ID No. 75, SEQ ID No. 224, SEQ ID No. 226 или SEQ ID No. 82
В соответствии с изобретением "последовательность нуклеиновой кислоты" относится к молекуле ДНК или РНК в одно- или двухцепочечной форме, предпочтительно молекуле ДНК. Использованный здесь термин "выделенная ДНК" относится к ДНК, которая не встречается в природе или больше не встречается в природном окружении, в котором она представлена исходно, например кодирующая последовательность ДНК, ассоциирующаяся с другими регуляторными элементами в химерном гене, ДНК, переносимая в другую клетку-хозяин, или искусственная синтетическая последовательность ДНК, имеющая нуклеотидную последовательность, отличающуюся от любой встречающейся в природе последовательности ДНК.
Настоящее изобретение также относится к химерному гену, содержащему, функционально связанные друг с другом, по меньшей мере один промотор, который является функциональным в организме хозяина, полинуклеотид, кодирующий любую из малаткиназы, малатполуальдегиддегидрогеназы или ДГМ дегидрогеназы в соответствии с изобретением, и терминаторный элемент, который является функциональным в том же самом организме хозяина. Различные элементы, которые может содержать химерный ген, представляют собой прежде всего элементы, регулирующие транскрипцию, трансляцию и созревание белков, таких как промотор, последовательность, кодирующую сигнальный пептид или транспортный пептид, или терминаторный элемент, составляющий сигнал полиаденилирования и, во вторых, полинуклеотид, кодирующий белок. Выражение "функционально связанные друг с другом" означает, что указанные элементы химерного гена связаны друг с другом таким образом, что на функцию одного из этих элементов влияет функция другого. В качестве примера промотор функционально связан с кодирующей последовательностью, где он способен влиять на экспрессию указанной кодирующей последовательности. Конструирование химерного гена в соответствии с изобретением и сборка его различных элементов может быть осуществлена с использованием способов, хорошо известных специалистам в данной области техники. Выбор регуляторных элементов, составляющих химерный ген, зависит по существу от организма-хозяина, в котором они должны функционировать, и специалисты в данной области техники способны выбирать регуляторные элементы, которые являются функциональными в заданном организме хозяина. Подразумевается, что термин "функциональный" обозначает способность функционировать в заданном организме хозяине.
Промоторы, которые может содержать химерный ген в соответствии с изобретением, являются конститутивными или индуцируемыми. В качестве примера, промоторы, используемые для экспрессии в бактериях, могут быть выбраны из промоторов, упомянутых ниже. Для экспрессии в Escherichia coli можно упомянуть lac, trp, Ipp, phoA, recA, araBAD, prou, cst-I, tetA, cadA, nar, tac, trc, Ipp-lac, Psyn, cspA, PL, PL-9G-50, PR-PL, T7, [lambda]PL-PT7, T3-lac, T5-lac, T4 ген 32, nprM-lac, VHb и промоторы белка А или еще промотор Ptrp (WO 99/64607). Для экспрессии в грамположительных бактериях, таких как Corynebacteria или Streptomyces, можно упомянуть промоторы PtipA или PS1 и PS2 (FR91/09870) или промоторы, описанные в заявке на изобретение ЕР 0629699А2. Для экспрессии в дрожжах и грибах можно упомянуть промоторы PLAC4 К.lactis или промотор Ppgk К.lactis (заявка на патент FR 91/05294), промотор tefl или cbhl Trichoderma (WO 94/04673), промотор his, csl или apf Penicillium (WO 00/68401) и промотор gla Aspergillus.
В соответствии с изобретением химерный ген может также содержать другие регуляторные последовательности, которые располагаются между промотором и кодирующей последовательностью, такие как активаторы транскрипции (энхансеры).
Сам по себе химерный ген по изобретению содержит в конкретном воплощении по меньшей мере в направлении транскрипции функционально связанные промоторную регуляторную последовательность, которая является функциональной в организме-хозяине, последовательность нуклеиновой кислоты, кодирующую малаткиназу малатполуальдегиддегидрогеназы по изобретению и терминаторную регуляторную последовательность, которая является функциональной в указанном организме-хозяине.
Настоящее изобретение также относится к клонированию и/или экспрессирующемуся вектору, содержащему химерный ген в соответствии с изобретением или последовательность нуклеиновой кислоты по изобретению. Вектор в соответствии с изобретением используют для трансформации организма-хозяина и экспрессии в этом организме любого из малаткиназы, малатполуальдегиддегидрогеназы и/или ДГМ дегидрогеназа. Этот вектор может представлять собой плазмиду, космиду, бактериофаг или вирус. Предпочтительно, трансформирующий вектор в соответствии с изобретением представляет собой плазмиду. Как правило, основные количества этого вектора должны обладать способностью поддерживать себя и реплицировать себя в клетках организма-хозяина, в частности за счет присутствия ориджина репликации, и для экспрессии в них любой из малаткиназы, малатполуальдегиддегидрогеназы и/или ДГМ дегидрогеназы. Для задачи стабильной трансформации организма-хозяина вектор также может интегрироваться в геном. Выбор такого вектора и также способов встраивания химерного гена в соответствии с изобретением в этот вектор и представляют собой часть общего знания специалистов в данной области техники. Благоприятно, вектор, используемый в настоящем изобретении, также содержит дополнительно к химерному гену в соответствии с изобретением химерный ген, кодирующий селективный маркер. Этот селективный маркер дает возможность отобрать организмы-хозяева, которые эффективно трансформируются, т.е. хозяева, которые включают вектор. В соответствии с конкретным воплощением изобретения организм-хозяин, который подвергают трансформации, представляет собой бактерию, дрожжи, гриб. Среди селективных маркеров, которые могут быть использованы, могут быть упомянуты маркеры, содержащие гены резистентности к антибиотикам, такие как, например ген гигромицин фосфотрансферазы. Другие маркеры могут представлять собой гены для дополнения ауксотрофности, такие как гены pyrA, pyrB, pyrG, pyr4, arg4, argB и trpC, ген молибдоптерин синтетазы или ген ацетамидазы. Также можно упомянуть гены, кодирующие легко идентифицируемые ферменты, такие как фермент GUS, или гены, кодирующие пигменты или ферменты, регулирующие продукцию пигментов в трансформированных клетках. Такие селективные маркерные гены в частности описаны в заявках на патенты WO 91/02071, WO 95/06128, WO 96/38567 и WO 97/04103.
Настоящее изобретение также относится к трансформированным организмам-хозяевам, содержащим по меньшей мере один химерный ген в соответствии с изобретением, интегрированный в их геном, или располагающийся на экстрахромосомальном генетическом элементе, например плазмиде. В более специфическом аспекте изобретения трансформированный организм-хозяин содержит нуклеиновую кислоту по изобретению, кодирующую малаткиназу, или химерный ген, содержащий нуклеиновую кислоту, кодирующую малаткиназу, или экспрессирующийся вектор, содержащий нуклеиновую кислоту, кодирующую малаткиназу, и/или нуклеиновую кислоту, кодирующую малатполуальдегиддегидрогеназу, или химерный ген, содержащий нуклеиновую кислоту, кодирующую малат полуальдегиддегидрогеназу, или экспрессирующийся вектор, содержащий нуклеиновую кислоту, кодирующую малатполуальдегиддегидрогеназу, и/или нуклеиновую кислоту, кодирующую ДГМ дегидрогеназу, химерный ген, содержащий нуклеиновую кислоту, кодирующую ДГМ дегидрогеназу, или экспрессирующийся вектор, содержащий нуклеиновую кислоту, кодирующую ДГМ дегидрогеназу.
В специфическом аспекте изобретения нуклеиновая кислота, кодирующая малаткиназу, представлена в SEQ ID No. 13, SEQ ID No. 15, SEQ ID No. 17, SEQ ID No. 19, SEQ ID No. 21, SEQ ID No. 23, SEQ ID No. 25, SEQ ID No. 27, SEQ ID No. 38, SEQ ID No. 40, SEQ ID No. 42 или SEQ ID No. 44, нуклеиновая кислота, кодирующая малат полуальдегид дегидрогеназу, представлена в SEQ ID 55, SEQ ID No. 57, SEQ ID No. 59, SEQ ID No. 61, SEQ ID No. 63, SEQ ID No. 65 или SEQ ID No. 67, и нуклеиновая кислота, кодирующая ДГМ дегидрогеназу, представлена в SEQ ID No. 73, SEQ ID No. 75, SEQ ID No. 224, SEQ ID No. 226 или SEQ ID No. 82.
Предполагается, что термин "организм-хозяин" обозначает любой низший одноклеточный организм, в который химерный(е) ген(ы), нуклеиновая(ые) кислота(ы) или вектор(ы) в соответствии с изобретением может(гут) быть введен(ы) для продукции 2,4-ДГМ.Предпочтительно, организм-хозяин представляет собой микроорганизм, в частности гриб, например рода Penicillium, Aspergillus и конкретней Aspergillus flavus, Chrysosporium или Trichoderma genus, дрожжи, в частности рода Saccharomyces, Kluyveromyces или Pichia, и конкретней Zygosaccharomyces rouxii, бактерию, например рода Escherichia, в частности Е.coli, или рода Corynebacterium, конкретней Corynebactenum glutamicum, или рода Streptomyces или бакуловируса.
Организм-хозяин может представлять собой организм-хозяин, который в природе сверхпродуцирует малат или сукцинат из сахаров, таких как глюкоза, или организм-хозяин, который сконструирован таким образом, чтобы сверхпродуцировать малат или сукцинат из сахаров, таких как глюкоза, и из которого удалены все потенциальные мембранные переносчики, которые облегчают экспорт органических кислот, таких как малат, пируват, сукцинат и фумарат. Организм-хозяин может представлять собой организм, который сконструирован для того, чтобы сверхпродуцировать ДГМ, и из которого удалены все мембранные переносчики, которые облегчают экспорт органических кислот, таких как малат, пируват, сукцинат и фумарат. Примеры пермеаз, которые облегчают экспорт малата и других органических кислот, представляют собой Мае1 из Schizosaccharomyces pombe (Camarasa et al., 2001; Grobler et al, 1995), DctA из Bacillus subtilis (Groeneveld et al., 2010), Dct 1-4 из Е.Coli, Jen1 из S.cerevisiae (Akita et al., 2000). Эксперт может идентифицировать кандидаты пермеаз в других микроорганизмах на основе гомологии последовательности. Эти конструкции служат для поддержания малата и других органических кислот внутри клетки для того, чтобы они были доступны для продукции ДГМ.
Подразумевается, что выражение "трансформированный организм-хозяин" обозначает организм-хозяин, который включает в свой геном или во внехромосомальный генетический элемент, например плазмиду, по меньшей мере один химерный ген в соответствии с изобретением и следовательно продуцирует любую из малаткиназы, малат полуальдегид дегидрогеназы и/или ДГМ дегидрогеназы в своих тканях, или в культуральной среде. Для получения организмов-хозяев в соответствии с изобретением специалисты в данной области техники могут использовать один из множества известных способов трансформации.
Один из этих способов заключается в том, чтобы привезти клетки организмов-хозяев, которые необходимо трансформировать, в контакт с полиэтиленгликолем (PEG) и с векторами в соответствии с изобретением. Электропорация представляет собой еще один способ, который заключается в том, чтобы подвергнуть клетки, которые необходимо трансформировать, и векторы по изобретению действию электрического поля. Еще один способ заключается в том, чтобы непосредственно инъецировать векторы в клетки или ткани путем микроинъекции. Может быть использован "биолистический" способ. Он состоит в бомбардировании клеток или тканей частицами, на которых адсорбированы векторы по изобретению (патент США No. 4945050).
Несколько способов трансформации бактерий описаны в литературе для Escherichia coli и других грамотрицательных бактерий. Также может быть использована конъюгация. Для грамположительных бактерий может быть использована электропорация и также трансформация протопластов, в частности для бактерий рода Streptomyces.
Несколько способов трансформации грибов также описаны в литературе. Трансформация протопластов с использованием PEG описана для Aspergillus в ЕР 0260762, и адаптация этого способа для видов Penicillium funiculosum описана в WO 00/36120. Также известна трансформация путем интеграции, опосредованной рестрикционным ферментом, или REMI, как трансформация протопласта с использованием бактерий рода Agrobacterium. В литературе также описаны способы трансформации дрожжей.
В еще одном аспекте изобретение относится к способу продукции 2,4-ДГМ, при котором осуществляют стадию выращивания трансформированного микроорганизма по изобретению.
Для продукции ДГМ различные углеводы могут быть использованы индивидуально или в виде смеси, такие как глюкоза, фруктоза, сахароза, мелассы, мальтоза, тростниковые мелассы, крахмальный гидролизат (глюкоза, олигосахариды), лактоза, мальтоза, крахмал и крахмальные гидролизаты, целлюлоза, целлюлозный гидролизат, глицерин и определенные углеводороды, масла и жиры, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, а также жирные кислоты, такие как, например пальмитиновая кислота, стеариновая кислота и линолевая кислота. Эти вещества могут быть использованы индивидуально или в виде смесей.
Различные источники азота могут быть использованы индивидуально или в виде смесей для коммерческого и полупромышленного производства, включающие неорганические соединения, такие как газообразный и водный аммиак, аммониевые соли неорганических или органических кислот, такие как сульфат аммония, нитрат аммония, фосфат аммония, хлорид аммония, ацетат аммония и карбонат аммония. Альтернативно, также могут быть использованы природные азотсодержащие органические материалы, такие как соевый гидролизат, HCl-гидролизат соевого белка (общее содержание азота составляет приблизительно 7%), соевая мука, гидролизат соевого жмыха, жидкий кукурузный экстракт, казеиновый гидролизат, дрожжевой экстракт, мясной экстракт, солодовый экстракт, мочевина, пептоны и аминокислоты.
Производственный процесс может быть осуществлен в аэробных, анаэробных условиях и условиях с ограниченным содержанием кислорода. Он может быть осуществлен в виде подпитываемого процесса или периодического процесса.
Указанная продукция 2,4-ДГМ может быть осуществлена путем выращивания организма-хозяина в средах, в которые малат (или другую органическую кислоту, такую как пируват, сукцинат или фумарат) добавлены сами по себе или вместе с другим источником углерода, который обеспечивает рост. Малат (и другие органические кислоты) могут быть добавлены непосредственно или путем разработки двухстадийного способа ферментации, где малат (или другие органические кислоты) продуцирует на первой стадии способа микроорганизм, сверхпродуцирующий малат, а продукцию 2,4-ДГМ осуществляют на следующей стадии с использованием организма-хозяина по изобретению.
Разделение и очистка продукта представляет собой очень важный фактор, значительно влияющий на эффективность всего способа и стоимость продукта. Способы выделения продукта в общем содержат стадии отделения клеток, а также очистки, концентрирования и сушки продукта, соответственно.
Отделение клеток
Ультрафильтрация и центрифугирование могут быть использованы для отделения клеток из ферментационной среды. Отделение клеток от ферментационных сред часто осложняется высокой вязкостью среды. Таким образом, можно добавить добавки, такие как неорганическую кислоту или соли щелочных металлов, или нагревание культуральной среды для оптимизации клеточного разделения.
Выделение продукта
Различные способы ионообменной хроматографии могут быть применены для выделения ДГМ до или после удаления биомассы. Они включают применение первичных катионообменных смол, которые облегчают разделение продуктов в соответствии с их изоэлектрической точкой. Как правило, смола заряжается раствором, и оставшийся продукт элюируется отдельно в соответствии с увеличением рН (например, путем добавления гидроксида аммония) в элюенте. Еще одна возможность представляет собой применение ионообменной хроматографии с использованием смол с фиксированным или условным подвижным слоем. Различные хроматографические стадии могут быть комбинированы для достижения необходимой чистоты продукта. Эти способы очистки являются более экономными по сравнению с дорогостоящей стадией кристаллизации, также обеспечивая дополнительные преимущества и гибкость в отношении формы конечного продукта.
Концентрирование и сушка продукта
Способ очистки также может содержать стадию сушки, которая может включать любые подходящие средства сушки, такие как распылительный гранулятор, распылительная сушилка, барабанная сушилка, роторная сушилка и туннельная сушилка. Концентрированные растворы ДГМ могут быть приготовлены путем нагревания ферментационных бульонов при пониженном давлении паром при 130°С с использованием многофункционального концентратора или тонкослойного испарителя.
Эффективная продукция ДГМ может обеспечиваться путем оптимизации перераспределения углеродного потока в метаболической схеме организма-хозяина и путем обеспечения достаточного поступления НАДФН (восстановленный никотинамидадениндинуклеотидфосфат) и АТФ (аденозинтрифосфат) для трех ферментов в пути ДГМ.Направление углеродного потока в желаемом метаболическом пути и поступление кофактора NAD(P)H как правило облегчают путем устранения или уменьшения интенсивности конкурирующих природных ферментативных путей. Неисключительные примеры представляют собой
- оптимизацию продукции малата в S.cerevisiae путем блокирования образования этанола (путем устранения пируват декарбоксилаз (Zelle et al., 2008; Zelle et al., 2010).
- оптимизацию продукции сукцината или малата в Е.coli путем блокирования образования лактата (например, делеция ldhA), образования ацетата (например, делеция pta, ackA), образования этанола (например делеция adhE), образования формиата (например делеция pflB, focA), окисления пирувата (например делеция рохВ), разрушения малата (делеция maeB и scfA), образования сукцината (например делеция frdBC), образования метилглиоксаля (делеция mgsA) (Jantama et al., 2008a; Jantama et al., 2008b; Lin et al., 2005; Sanchez et al., 2005a; Zhang et al., 2011).
Еще одна возможность увеличения потока углерода и поступления АТФ для продукции органических кислот представляет собой конструирование фосфоенолпируват (РЕР)/пируват/оксалоацетатного пути (обзор в (Sauer & Eikmanns, 2005)). Неисключительные примеры метаболических сконструированных стратегий, которые обеспечивают увеличение потока углерода из фосфоенолпирувата в оксалоацетат, представляют собой
- оптимизацию продукции малата в S.cerevisiae путем блокирования функции пируваткиназы и увеличения активности PEP карбоксикиназы (Zelle et al., 2010).
- оптимизацию продукции сукцината в Е.coli путем увеличения активности природной или гетерологически экспрессируемой PEP карбоксилазы, PEP карбоксикиназы или пируват карбоксилазы (Millard et al., 1996; Sanchez et al., 2005b; Zhang et al., 2009).
Еще одна возможность для увеличения потока углерода и поступления АТФ для продукции органических кислот в Е.coli и другие бакт