Синтетические происходящие из brassica транзитные пептиды хлоропластов
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к конструкции нуклеиновой кислоты и химерному белку для локализации полипептида в хлоропласт, а также к конструкции для экспрессии нацеливающего хлоропласты полипептида в клетке растения. Также раскрыты клетка трансгенного растения, трансгенное растение, часть трансгенного растения, семя трансгенного растения, а также культура клеток трансгенного растения, содержащие вышеуказанный химерный белок. Изобретение также относится к способу получения трансгенного растительного материала, который экспрессирует полипептид в хлоропластах, который предусматривает трансформацию растительного материала вышеуказанной конструкцией нуклеиновой кислоты для локализации полипептида в хлоропласт. Изобретение позволяет эффективно локализовать полипептид в хлоропласт. 9 н. и 17 з.п. ф-лы, 19 ил., 35 табл., 6 пр.
Реферат
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет по временной патентной заявке США с серийным номером № 61/593555, поданной 1 февраля 2012 года, а также по временной патентной заявке США с серийным номером № 61/625222, поданной 17 апреля 2012 года.
ПОЛОЖЕНИЕ В СООТВЕТСТВИИ С 37 C.F.R. § 1.821(c) или (e) - СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДОСТАВЛЕННЫЙ В КАЧЕСТВЕ ТЕКСТОВОГО ФАЙЛА ASCII
В соответствии с 37 C.F.R. § 1.821(c) или (e), файл, содержащий текстовую версию ASCII списка последовательностей, предоставлен совместно с настоящей заявкой.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам генетического кодирования и экспрессии полипептидов, которые нацеливаются в пластиды содержащих пластиды клеток. В определенных вариантах осуществления изобретение относится к аминокислотным последовательностям, которые нацеливают полипептиды в хлоропласты (например, высших растений), и/или к молекулам нуклеиновых кислот, кодирующим их. В определенных вариантах осуществления изобретение относится к химерным полипептидам, содержащим аминокислотную последовательность, которая контролирует транспорт химерных полипептидов в пластиды, и/или к молекулам нуклеиновых кислот, кодирующим их.
УРОВЕНЬ ТЕХНИКИ
Клетки растений содержат различные субклеточные органеллы, в общем называемые "пластидами", которые ограничены характерными мембранными системами и выполняют специализированные функции в клетке. Конкретные пластиды ответственны за фотосинтез, а также за синтез и запасание определенных химических соединений. Все пластиды происходят из пропластид, которые присутствуют в меристематических областях растения. Пропластиды могут развиваться, например, в: хлоропласты, этиопласты, хромопласты, геронтопласты, лейкопласты, амилопласты, элайопласты и протеинопласты. Пластиды существуют полуавтономным образом в клетке, они включают их собственную генетическую систему и аппарат синтеза белков, однако они зависят от тесного взаимодействия с ядерно-цитоплазматической системой в их развитии и биосинтетической активности.
В фотосинтезирующих клетках листьев высших растений наиболее заметными пластидами являются хлоропласты. Наиболее важной функцией хлоропластов является проведение запускаемых светом реакций фотосинтеза. Однако хлоропласты также осуществляют многие другие важные для клетки растения биосинтетические процессы. Например, все жирные кислоты клетки производятся ферментами в строме хлоропластов с использованием ATP, NAOPH и углеводов, которые свободно доступны в них. Более того, восстанавливающая мощность активируемых светом электронов обеспечивает восстановление нитрита (NO2-) в аммиак (NH3) в хлоропластах; этот аммиак обеспечивает растение азотом, требуемым для синтеза аминокислот и нуклеотидов.
Хлоропласт также принимает участие в процессах, имеющих особое значение для агрохимической промышленности. Например, известно, что многие гербициды действуют, блокируя функции, которые выполняют хлоропласты. В недавних исследованиях была идентифицирована конкретная мишень нескольких гербицидов. Например, происходящие из триазинов гербициды ингибируют фотосинтез путем вытеснения молекулы пластохинона из его участка связывания в полипептиде массой 32 кДа фотосистемы II. Этот полипептид массой 32 кДа кодируется в геноме хлоропластов и синтезируется аппаратом органелл. Также были получены мутантные растения, которые являются устойчивыми к триазиновым гербицидам. Эти растения содержит мутантный полипептид массой 32 кДа, из которого пластохинон более не вытесняется триазиновыми гербицидами. Сульфонилмочевины ингибируют ацетолактатсинтазу в хлоропласте. Ацетолактатсинтаза вовлечена в синтез изолейцина и валина. Глифосат ингибирует функцию 5-енолпирувил-3-фосфошикиматсинтазы (EPSPS), которая представляет собой фермент, вовлеченный в синтез ароматических аминокислот. Все эти ферменты кодируются ядерным геномом, однако они перемещаются в хлоропласт, где происходит фактический синтез аминокислот.
Большинство белков хлоропластов кодируются в ядре клетки растения, синтезируются в качестве более крупных белков-предшественников в цитозоле и посттрансляционно импортируются в хлоропласт. Импорт через наружную и внутреннюю мембраны оболочки в строму является основным путем вхождения в белки, предназначенные для поступления в строму, мембрану тилакоида и просвет тилакоида. Локализация импортированных белков-предшественников в мембране тилакоида и просвете тилакоида осуществляется четырьмя различными механизмами, включая два из них, которые гомологичны системам транспорта бактериальных белков. Таким образом, механизмы локализации белка в хлоропластах частично происходят из прокариотического эндосимбионта. Cline and Henry (1996), Annu. Rev. Cell. Dev. Biol. 12:1-26.
Белки-предшественники, предназначенные для экспрессии в хлоропластах, содержат N-концевые удлинения, известные как транзитные пептиды хлоропластов (CTP). Транзитный пептид является инструментом для специфического распознавания поверхности хлоропластов и для опосредования посттрансляционного перемещения пребелков через оболочку хлоропластов, и, таким образом, в различные субкомпартменты в хлоропласте (например, строма, тилакоид и мембрана тилакоида). Эти N-концевые транзитные пептидные последовательности содержат всю информацию, необходимую для импорта белка хлоропластов в пластиды; транзитные пептидные последовательности необходимы и достаточны для импорта в пластиду.
Гены растений, содержащие, согласно сообщениям, естественным образом кодируемые транзитные пептидные последовательности на их N-конце, включают малую хлоропластную субъединицу рибулозо-1,5-бисфосфаткарбоксилазы (RuBisCo) (de Castro Silva-Filho et al. (1996), Plant Mol. Biol. 30:769-80; Schnell et al. (1991), J. Biol. Chem. 266:3335-42); EPSPS (см., например, Archer et al. (1990), J. Bioenerg. and Biomemb. 22:789-810 и патенты США 6867293, 7045684 и Re. 36449); триптофансинтазы (Zhao et al. (1995), J. Biol. Chem. 270:6081-7); пластоцианина (Lawrence et al. (1997), J. Biol. Chem. 272:20357-63); хоризматсинтазы (Schmidt et al. (1993), J. Biol. Chem. 268:27447-57); аккумулирующий световую энергию белок, связывающий хлорофилл a/b, (LHBP) (Lamppa et al. (1988), J. Biol. Chem. 263:14996-14999); и белок хлоропластов Arabidopsis thaliana (Lee et al. (2008), Plant Cell 20:1603-22). В публикации заявки на патент США № US 2010/0071090 описаны определенные нацеливающие хлоропласты пептиды из Chlamydomonas sp.
Однако структурные требования к информации, кодируемой нацеливающими в хлоропласты пептидами, остаются неясными вследствие их высокого уровня разнообразия последовательности и отсутствия общих или консенсусных мотивов последовательности, хотя возможно, что они являются отдельными подгруппами нацеливающих в хлоропласты пептидов с независимыми структурными мотивами. Lee et al. (2008), выше. Кроме того, не все из этих последовательностей пригодны для гетерологичной экспрессии нацеленных в хлоропласты белков в высших растениях.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании описаны композиции и способы для нацеливания полипептидов в растении в пластиды. В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica транзитный пептид хлоропластов (например, пептид TraP12 или TraP13), функционально связанный с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть полезными для экспрессии и нацеливания полипептида, кодируемого представляющей интерес нуклеотидной последовательностью, в однодольном и двудольном растении. Кроме того, описаны векторы, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica транзитный пептид хлоропластов, функционально связанный с представляющей интерес нуклеотидной последовательностью.
В некоторых вариантах осуществления, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой нуклеотидную последовательность, которая происходит из эталонной нуклеотидной последовательности, полученной из гена Brassica sp. (например, B. napus, B. rapa, B. juncea и B. carinata), или ее функциональный вариант. В некоторых вариантах осуществления, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой химерную нуклеотидную последовательность, содержащую неполную кодирующую CTP нуклеотидную последовательность из гена Brassica sp., или ее функциональный вариант. В конкретных вариантах осуществления нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может содержать непрерывные нуклеотидные последовательности, полученные из каждого из эталонных CTP Brassica sp., и CTP из отличающегося гена Brassica sp., отличающегося Brassica sp. или отличающегося организма (например, растение, прокариотический организм и низший фотосинтезирующий эукариотический организм), или функциональные варианты любого из указанных выше. В конкретных вариантах осуществления непрерывная нуклеотидная последовательность может быть получена из ортологичной нуклеотидной последовательности эталонного CTP Brassica, которая получена из ортолога эталонного гена Brassica sp. из другого организма (например, из отличающегося генома Brassica sp.). В этих и других вариантах осуществления, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой химерную нуклеотидную последовательность, содержащую более одной кодирующей CTP нуклеотидной последовательности.
В некоторых примерах нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой химерную нуклеотидную последовательность, содержащую неполную нуклеотидную последовательность CTP из B. napus, или ее функциональные варианты. В конкретных примерах нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может содержать непрерывные нуклеотидные последовательности, полученные из B. napus, или их функциональные варианты. В следующих примерах нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может содержать непрерывную нуклеотидную последовательность, полученную из гена Brassica sp., или ее функциональный вариант, и непрерывную нуклеотидную последовательность, полученную из гена Arabidopsis sp., или ее функциональный вариант.
В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одно происходящее из Brassica средство для нацеливания полипептида в хлоропласт. Кроме того, описаны молекулы нуклеиновой кислоты, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одно происходящее из Brassica средство для нацеливания полипептида в хлоропласт, функционально связанную с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть пригодными для экспрессии и нацеливания полипептида, кодируемого представляющей интерес нуклеотидной последовательностью, в однодольном или двудольном растении. Для целей настоящего описания, происходящее из Brassica средство для нацеливания полипептида в хлоропласт относится к конкретным синтетическим нуклеотидным последовательностям. В конкретных вариантах осуществления происходящее из Brassica средство для нацеливания полипептида в хлоропласт выбрано из группы, состоящей из нуклеотидных последовательностей, обозначаемых в настоящем описании как TraP12 и TraP13.
Также в настоящем описании описаны растительные материалы (например, но не ограничиваясь ими, растения, ткани растений и клетки растений), содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал может иметь такую молекулу нуклеиновой кислоты, стабильно встроенную в ее геном. В некоторых вариантах осуществления, растительный материал может временно экспрессировать продукт молекулы нуклеиновой кислоты, содержащий по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью.
Также описаны способы экспрессии нуклеотидной последовательности в содержащей пластиду клетке (например, растении) в пластиде (например, хлоропласт) содержащей пластиду клетки. В конкретных вариантах осуществления, молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью, можно использовать для трансформации клетки растения, так чтобы в цитоплазме клетки растения продуцировался слитый полипептид-предшественник, содержащий синтетический происходящий из Brassica CTP, слитый с продуктом экспрессии представляющей интерес нуклеотидной последовательности, в цитоплазме клетки растений, а затем слитый полипептид транспортировался in vivo в хлоропласт клетки растения.
Кроме того, описаны способы получения трансгенного растения, содержащего молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью. Также описаны растительные продукты (например, семена), полученные из таких трансгенных растений.
Указанные выше и другие признаки станут более понятными из представленного ниже описания нескольких вариантов осуществления, которые предоставлены с учетом прилагаемых фигур.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 проиллюстрированы молекулы мРНК, которые являются репрезентативными для конкретных примеров синтетической происходящей из Brassica кодирующей CTP нуклеотидной последовательности (например, TraP12 и TraP13), функционально связанной с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления молекула мРНК (такая как представленные молекулы мРНК) может транскрибироваться с молекулы ДНК, содержащей открытую рамку считывания, включающую синтетическую происходящую из Brassica кодирующую CTP последовательность, функционально связанную с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления представляющая интерес нуклеотидная последовательность может представлять собой последовательность, кодирующую представляющий интерес пептид, например, но не ограничиваясь ими, продукт маркерного гена или пептид, нацеливаемый в пластиду.
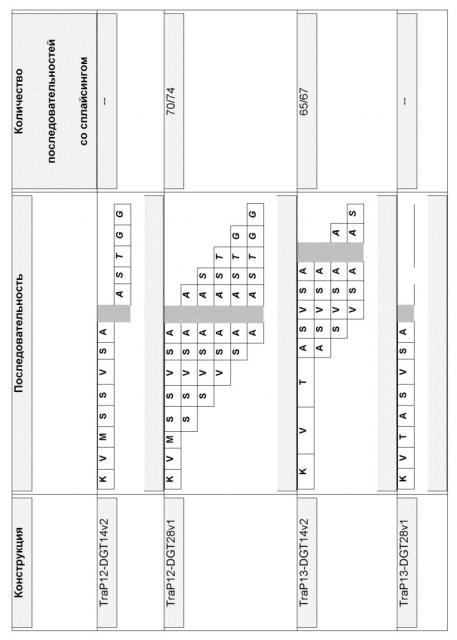
На фиг. 2 представлено выравнивание предсказанных транзитных пептидов хлоропластов белка EPSPS из Brassica napus (SEQ ID NO: 2) и Arabidopsis thaliana (SEQ ID NO: 4). Звездочкой указано, где последовательности расщеплялись и рекомбинировали с образованием TraP12 и Trap13.
На фиг. 3 проиллюстрирована карта плазмиды pDAB101981.
На фиг. 4 проиллюстрирована карта плазмиды pDAB101989.
На фиг. 5 проиллюстрирована карта плазмиды pDAB101908.
На фиг. 6 представлено микроскопическое изображение TraP12-YFP, инфильтрировавшего ткань листьев табака, который был перенесен в хлоропласты ткани листьев табака.
На фиг. 7 представлено микроскопическое изображение TraP13-YFP, инфильтрировавшего ткань листьев табака, который был перенесен в хлоропласты ткани листьев табака.
На фиг. 8 представлено микроскопическое изображение ненацеленных контролей YFP, которые инфильтрировали листья табака, и не включались в хлоропласты ткани листьев табака.
На фиг. 9 представлено микроскопическое изображение TraP12-YFP, трансформированного в протопласты кукурузы, который был перенесен в хлоропласты протопласта кукурузы.
На фиг. 10 проиллюстрирована карта плазмиды pDAB105528.
На фиг. 11 проиллюстрирована карта плазмиды pDAB105529.
На фиг. 12 проиллюстрирована карта плазмиды pDAB107686.
На фиг. 13 проиллюстрирована карта плазмиды pDAB107687.
На фиг. 14 проиллюстрирована карта плазмиды pDAB112711.
На фиг. 15 проиллюстрирована карта плазмиды pDAB11479.
На фиг. 16 проиллюстрирована карта плазмиды pDAB112712.
На фиг. 17 проиллюстрирована карта плазмиды pDAB112710.
На фиг. 18 проиллюстрирована карта плазмиды pDAB017540.
На фиг. 19 проиллюстрирована карта плазмиды pDAB107617.
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор нескольких вариантов осуществления
Транзитный пептид хлоропластов (CTP) (или транзитный пептид пластид) функционирует во время или после трансляции, направляя полипептид, содержащий CTP, в пластиду (например, хлоропласт). В некоторых вариантах осуществления изобретения либо эндогенные белки, либо гетерологичные белки, хлоропластов можно направлять в хлоропласт путем экспрессии такого белка в качестве более крупного полипептида-предшественника, содержащего CTP. В конкретных вариантах осуществления CTP может происходить из нуклеотидной последовательности, полученной из гена Brassica sp., например, но не ограничиваясь этим, путем включения по меньшей мере одной непрерывной последовательности из ортологичного гена, полученного из другого организма, или ее функционального варианта.
В иллюстративных вариантах осуществления последовательности нуклеиновой кислоты, каждая из которых кодирует CTP, выделяли из последовательностей гена EPSPS, полученных из Brassica napus (номер доступа в базе данных NCBI № P17688). Кодирующие CTP последовательности нуклеиновых кислот выделяли путем анализа последовательности гена EPSPS с помощью сервера для прогнозирования ChloroP. Emanuelsson et al. (1999), Protein Science 8:978-84 (доступный на cbs.dtu.dk/services/ChloroP). Предсказанные белковые продукты выделенных кодирующих CTP последовательностей представляют собой транзитные пептиды длиной приблизительно 60-70 аминокислот. Кодирующие CTP последовательности нуклеиновой кислоты выделяли из ортологичных генов EPSPS, полученных из Arabidopsis thaliana (номер доступа NCBI № NP_182055). В этом примере нативный CTP B. napus использовали в качестве эталонной последовательности для конструирования иллюстративных синтетических происходящих из Brassica CTP путем слияния последовательно расположенных последовательностей из CTP Arabidopsis в конкретном положении в CTP B. napus. Этот процесс конструирования иллюстрирует разработку нового синтетического CTP, в соответствии с некоторыми аспектами, из последовательности нуклеиновой кислоты Brassica и Arabidopsis sp. Эти иллюстративные синтетические происходящие из Brassica CTP обозначаются в настоящем описании как TraPs12 и 13. Эти иллюстративные синтетические TraP исследовали в отношении функции нацеливания в пластиду и было выявлено, что они проявляют нацеливание в пластиду, которое является по меньшей мере настолько же эффективным, как наблюдали для нативных последовательностей Brassica по отдельности.
В следующем иллюстративном варианте осуществления последовательности нуклеиновой кислоты, каждая из которых кодирует синтетический пептид TraP по изобретению, синтезировали независимо и функционально связанными с последовательностью нуклеиновой кислоты, кодирующей желтый флуоресцентный белок (YFP), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодировала химерный слитый полипептид TraP:YFP. Каждую из таких молекул нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:YFP, встраивали в бинарный вектор так, чтобы каждая кодирующая TraP:YFP последовательность нуклеиновой кислоты была функционально связана с промотором AtUbi 10.
В другом иллюстративном варианте осуществления бинарные векторы, содержавшие каждую кодирующую TraP:YFP последовательность нуклеиновой кислоты, функционально связанную с промотором AtUbi10, независимо временно трансформировали в табак (Nicotiana benthamiana) посредством опосредуемой Agrobacterium трансформации. Конфокальная микроскопия и анализ с использованием вестерн-блоттинга подтвердили, что каждый TraP успешно нацеливал YFP в хлоропласты табака.
В следующем иллюстративном варианте осуществления последовательности нуклеиновой кислоты, каждая из которых кодировала синтетический пептид TraP по изобретению, синтезировали независимо и функционально связанными с последовательностью нуклеиновой кислоты, кодирующей агрономически важную последовательность гена. Последовательности TraP подвергали слиянию с признаками устойчивости к гербициду (например, dgt-28 и dgt-14) с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодировала химерный слитый полипептид TraP:DGT-28 или TraP:DGT-14. Такие молекулы нуклеиновой кислоты, каждая из которых кодировала химерный полипептид TraP:DGT-28 или TraP:DGT-14, встраивали в бинарный вектор, так чтобы каждая кодирующая TraP:dgt-28 или TraP:dgt-14 последовательность нуклеиновой кислоты была функционально связанной с промотором и другими регуляторными элементами генов. Бинарный вектор, содержащий кодирующую TraP:dgt-28 или TraP:dgt-14 последовательность нуклеиновой кислоты, использовали для трансформации различных видов растений. Трансгенные растения анализировали в отношении устойчивости к гербициду в результате сверхэкспрессии и перемещения ферментов DGT-28 или DGT-14 в хлоропласт.
В следующем иллюстративном варианте осуществления последовательности нуклеиновой кислоты, каждая из которых кодирует синтетический пептид TraP по изобретению, синтезировали независимо и функционально связанными с последовательностью нуклеиновой кислоты, кодирующей агрономически важную последовательность гена. Последовательности TraP подвергали слиянию с признаками устойчивости к насекомым (например, cry2Aa, vip3ab1, cry1F, cry1Ac и cry1Ca) с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:Cry2Aa, TraP:Vip3Ab1, TraP:Cry1F, TraP:Cry1Ac или TraP:Cry1Ca. Каждую из таких молекул нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:cry2Aa, TraP:vip3ab1, TraP:cry1F, TraP:cry1Ac или TraP:cry1Ca, встраивали в бинарный вектор, так чтобы каждая последовательность нуклеиновой кислоты, кодирующая TraP:cry2Aa, TraP:vip3ab1, TraP:cry1F, TraP:cry1Ac или TraP:cry1Ca, была функционально связана с промотором и другими регуляторными элементами генов. Бинарный вектор, содержащий последовательность нуклеиновой кислоты, кодирующую TraP:cry2Aa, TraP:vip3ab1, TraP:cry1F, TraP:cry1Ac или TraP:cry1Ca, использовали для трансформации различных видов растений. Трансгенные растения подвергали биоанализу в отношении устойчивости к насекомым в результате экспрессии и перемещения ферментов Cry2Aa, Vip3Ab1, Cry1F, Cry1Ac или Cry1Ca в хлоропласт.
Ввиду представленного выше подробного описания иллюстративных примеров, синтетические происходящие из Brassica последовательности CTP по изобретению и нуклеиновые кислоты, кодирующие их, можно использовать для направления любого полипептида в пластиду широкого диапазона содержащих пластиды клеток. Например, с помощью способов, которые стали доступными специалистам в данной области с учетом настоящего изобретения, химерный полипептид, содержащий синтетическую происходящую из Brassica последовательность CTP, слитую с N-концом любой второй пептидной последовательности, можно вводить в (или экспрессировать в) содержащую пластиду клетку-хозяина для нацеливания в пластиду второй пептидной последовательности. Таким образом, в конкретных вариантах осуществления пептид TraP может обеспечить увеличенную эффективность импорта и процессинга пептида, для которого является желательной экспрессия в пластиде, по сравнению с нативным CTP.
II. Сокращения
| CTP | транзитный пептид хлоропластов |
| Bt | bacillus thuringiensis |
| EPSPS | 3-енолпирувилшикимат-5-фосфатсинтетаза |
| YFP | желтый флуоресцентный белок |
| Ti | индуцирующий опухоль (плазмиды, происходящие из A. tumefaciens) |
| T-ДНК | трансферная ДНК |
III. Термины
Чтобы упростить обзор различных вариантов осуществления изобретения, предоставлены следующие пояснения конкретных терминов:
Транзитный пептид хлоропластов: как используют в рамках изобретения, термин "транзитный пептид хлоропластов" (CTP) (или "транзитный пептид пластид") может относиться к аминокислотной последовательности, которая, когда она присутствует на N-конце полипептида, направляет импорт полипептида в пластиду содержащей пластиду клетки (например, клетка растения, такая как в целом растении или в культуре клеток растения). CTP обычно необходим и достаточен для направления импорта белка в пластиду (например, первичная, вторичная или третичная пластида, такая как хлоропласт) клетки-хозяина. Предполагаемый транзитный пептид хлоропластов может быть идентифицирован с помощью одного из нескольких доступных алгоритмов (например, PSORT и ChloroP (доступные на cbs.dtu.dk/services/ChloroP)). ChloroP может особенно хорошо предсказывать CTP. Emanuelsson et al. (1999), Protein Science 8:978-84. Однако ни один из существующих алгоритмов не обеспечивает предсказание функциональных CTP со 100% эффективностью. Таким образом, важно подтвердить, что идентифицированный предполагаемый CTP действительно функционирует, например, как предусматривается в методологии in vitro или in vivo.
Транзитные пептиды хлоропластов могут быть расположены на N-конце полипептида, который импортируется в пластиду. CTP может облегчать транспорт во время трансляции или после трансляции полипептида, содержащего CTP, в пластиду. Транзитные пептиды хлоропластов, как правило, содержат от приблизительно 40 до приблизительно 100 аминокислот, и выявлено, что такие CTP содержат определенные общие характеристики. Например, CTP содержат очень мало, или даже не содержат, отрицательно заряженных аминокислот (таких как аспарагиновая кислота, глутаминовая кислота, аспарагин или глутамин); N-концевые области CTP лишены заряженных аминокислот, глицина и пролина; центральная область CTP также, вероятно, имеет высокое содержание основных или гидроксилированных аминокислот (таких как серин и треонин); и C-концевая область CTP, вероятно, обогащена аргинином и может содержать амфипатическую структуру бета-слоя. Протеазы пластид могут отщеплять CTP от оставшейся части полипептида, содержащей CTP, после импорта полипептида в пластиду.
Контакт: как используют в рамках изобретения, термин "контакт с" или "захват" клеткой, тканью или организмом (например, клеткой растения; тканью растения и растением), в отношении молекулы нуклеиновой кислоты, включает интернализацию молекулы нуклеиновой кислоты в организм, например, но не ограничиваясь этим: контактирование организма с композицией, содержащей молекулу нуклеиновой кислоты; и пропитывание организмов раствором, содержащим молекулу нуклеиновой кислоты.
Эндогенный: как используют в рамках изобретения, термин "эндогенный" относится к веществам (например, молекулы нуклеиновой кислоты и полипептиды), которые происходят из конкретного организма, ткани или клетки. Например, "эндогенный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно экспрессируется в клетках того же типа из не модифицированных способами генной инженерии растений того же вида. В некоторых примерах эндогенный ген (например, ген EPSPS) из Brassica sp. можно использовать для получения эталонной последовательности CTP Brassica.
Экспрессия: как используют в рамках изобретения, "экспрессия" кодирующей последовательности (например, гена или трансгена) относится к процессу, посредством которого кодируемая информация транскрипционного элемента нуклеиновой кислоты (включая, например, геномную ДНК или кДНК) преобразуется в функциональную, нефункциональную или структурную часть клетки, часто включающему синтез белка. На экспрессию генов могут влиять внешние сигналы; например, воздействие на клетку, ткань или организм агента, который увеличивает или снижает экспрессию гена. Экспрессия гена также может регулироваться на любом этапе в каскаде от ДНК к РНК к белку. Регуляция экспрессии гена происходить, например, путем контроля, действующего на транскрипцию, трансляцию, транспорт и процессинг РНК, деградацию промежуточных молекул, таких как мРНК, или путем активации, инактивации, компартментализации или деградации конкретных молекул белков после их получения, или путем любой их комбинации. Экспрессию гена можно измерять на уровне РНК или на уровне белка любым способом, известным в данной области, например, но не ограничиваясь этим, нозерн-блоттинг, ОТ-ПЦР, вестерн-блоттинг или анализ(ы) активности белка in vitro, in situ и in vivo.
Генетический материал: как используют в рамках изобретения, термин "генетический материал" включает все гены и молекулы нуклеиновых кислот, такие как ДНК и РНК.
Гетерологичный: как используют в рамках изобретения, термин "гетерологичный" относится к веществам (например, молекулы нуклеиновой кислоты и полипептиды), которые не происходят из конкретного организма, ткани или клетки. Например, "гетерологичный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно не экспрессируется в клетках того же типа из не модифицированных способами генной инженерии растений того же вида (например, полипептид, который экспрессируется в других клетках того же организма или в клетках другого организма).
Выделенный: как используют в рамках изобретения, термин "выделенный" относится к молекулам (например, молекулы нуклеиновой кислоты и полипептиды), которые по существу отделены или очищены от других молекул того же типа (например, другие молекулы нуклеиновой кислоты и другие полипептиды), с которыми молекула обычно ассоциирована в клетке организма, в котором молекула встречается естественным образом. Например, выделенная молекула нуклеиновой кислоты может быть по существу отделена или очищена от хромосомной ДНК или внехромосомной ДНК в клетке организма, в которой молекула нуклеиновой кислоты встречается естественным образом. Таким образом, термин включает рекомбинантные молекулы нуклеиновой кислоты и полипептиды, которые биохимически очищены так, чтобы другие молекулы нуклеиновой кислоты, полипептиды и клеточные компоненты, были удалены. Также термин включает рекомбинантные молекулы нуклеиновой кислоты, химически синтезированные молекулы нуклеиновой кислоты и рекомбинантно продуцированные полипептиды.
Термин "по существу очищенный", как используют в рамках изобретения, относится к молекуле, которая отделена от других молекул, обычно ассоциированных с ней в ее нативном состоянии. По существу очищенная молекула может быть преобладающим видом, присутствующим в композиции. По существу очищенная молекула может быть, например, по меньшей мере на 60% свободной, по меньшей мере на 75% свободной, или по меньшей мере на 90% свободной от других молекул, помимо растворителя, присутствующего в природной смеси. Термин "по существу очищенный" не относится к молекулам, присутствующим в их нативном состоянии.
Молекула нуклеиновой кислоты: как используют в рамках изобретения, термин "молекула нуклеиновой кислоты" может относиться к полимерной форме нуклеотидов, которая может включать как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК, и их синтетические формы и смешанные полимеры. Нуклеотид может относиться к рибонуклеотиду, дезоксирибонуклеотиду или модифицированной форме любого типа нуклеотида. "Молекула нуклеиновой кислоты", как используют в рамках изобретения, является синонимом "нуклеиновой кислоты" и "полинуклеотида". Молекула нуклеиновой кислоты обычно имеет по меньшей мере 10 оснований в длину, если нет иных указаний. Термин включает одноцепочечные и двухцепочечные формы ДНК. Молекулы нуклеиновой кислоты включают димерные (так называемые тандемные) формы, и продукты транскрипции молекул нуклеиновой кислоты. Молекула нуклеиновой кислоты может включать либо модифицированные нуклеотиды, либо и те, и другие, связанные вместе встречающимися в природе и/или не встречающимися в природе нуклеотидными связями.
Молекулы нуклеиновых кислот могут быть модифицированными химически или биохимически, или могут содержать неприродные или преобразованные нуклеотидные основания, как хорошо понятно специалистам в данной области. Такие модификации включают, например, метки, метилирование, замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации (например, незаряженные связи: например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.; заряженные связи: например, фосфоротиоаты, фосфородитиоаты и т.д.; выступающие части: например, пептиды; интеркалирующие агенты: например, акридин, псорален и т.д.; хелаторы; алкилаторы и модифицированные связи: например, альфа-аномерные нуклеиновые кислоты и т.д.). Термин "молекула нуклеиновой кислоты" также включает любую топологическую конформацию, включая одноцепочечную, двухцепочечную, частично дуплексную, триплексную, шпилечную, кольцеобразную конформации и конформацию висячего замка.
Как используют в рамках изобретения в отношении ДНК, термин "кодирующая последовательность", "структурная нуклеотидная последовательность" или "структурная молекула нуклеиновой кислоты" относится к нуклеотидной последовательности, которая в конечном итоге транслируется в полипептид через транскрипцию и мРНК, когда она находится под контролем соответствующих регуляторных последовательностей. Что касается РНК, термин "кодирующая последовательность" относится к нуклеотидной последовательности, которая транслируется в пептид, полипептид или белок. Границы кодирующей последовательности определяются путем трансляции инициирующего кодона на 5'-конце и стоп-кодона на 3'-конце. Кодирующие последовательности включают, но не ограничиваются ими: геномную ДНК; кДНК; EST и рекомбинантные нуклеотидные последовательности.
В некоторых вариантах осуществления изобретение относится к нуклеотидным последовательностям, которые могут быть выделенными, очищенными или частично очищенными, например, с использованием способов разделения, например, таких как ионообменная хроматография; способов исключения по молекулярному размеру или по аффинности; способов фракционирования на основе растворимости в различных растворителях; и способов генетической инженерии, такие как амплификация, клонирование и субклонирование.
Идентичность последовательностей: термин "идентичность последовательностей" или "идентичность", как используют в рамках изобретения в контексте двух последовательностей нуклеиновых кислот или полипептидов, может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие на протяжении указанного окна сравнения.
Как используют в рамках изобретения, термин "процент идентичности последовательностей" может относиться к величине, определяемой путем сравнения двух оптимально выровненных последовательностей (например, последовательностей нуклеиновых кислот и аминокислотных последовательностей) на протяжении окна сравнения, где часть последовательности в окне сравнения может содержать вставки или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит вставок или делеций) для оптимального выравнивания двух последовательностей. Процент вычисляют путем определения количества положений, в которых идентичный нуклеотидный или аминокислотный остаток встречается в обеих последовательностях, с получением количества совпавших положений, деления количества совпавших положений на общее количество положений в окне сравнения, и умножения результата на 100 с получением процента идентичности последовательностей.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в: Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet