Генетическая конструкция для экспрессии генов в клетках насекомого polypedilum vanderplanki
Иллюстрации
Показать всеИзобретение относится к области биохимии и генной инженерии и касается генетической конструкции для экспрессии генов в клетках насекомого Polypedilum vanderplanki. Представленная конструкция включает помимо стандартных элементов для получения и функционирования представленной генетической конструкции промотор Р121 с нуклеотидной последовательностью SEQ ID: 1 или SEQ ID: 2. Решение можно реализовать в промышленном производстве биотехнологических продуктов, научной, медицинской и производственной деятельности посредством использования известных стандартных технических устройств и оборудования и может быть использовано для получения инактивируемых обезвоживанием биологических компонентов. 1 з.п. ф-лы, 13 ил., 1 табл., 3 пр.
Реферат
Предлагаемое изобретение относится к области биохимии и генной инженерии, а именно к области создания новой технологии хранения биоматериалов, и представляет собой основополагающий элемент этой технологии.
Более детально, предлагаемое изобретение относится к области создания генетической конструкция для экспрессии генов в клетках насекомого Polypedilum vanderplanki, которая в составе разрабатываемой биотехнологии будет использована для консервации биоматериалов с целью их (биоматериалов) длительного хранения и транспортировки, например для консервации инактивируемых обезвоживанием ферментов.
В настоящее время существует насущная проблема в области хранения биоматериалов - существующие технологии, например криохранение, использование консервантов на стадии предоставления настоящего технического решения, исчерпали возможности улучшения и не удовлетворяют потребностям общества по ряду причин, например по сложности, дороговизне и низкой эффективности хранения биоматериалов, применяемых для широкого круга решения проблем здравоохранения и биотехнологий. Разработанное техническое решение в целом нацелено на создание нового метода хранения биоматериала посредством сохранения рекомбинантных белков в составе культуры клеток насекомого Polypedilum vanderplanki, способных к выживанию без воды (ангидробиозу). Разрабатываемая на указанном явлении ангидробиоза биотехнология предполагает резкое удешевление хранения биоматериала (например, белков) и независимость от глубокой заморозки. Основой предлагаемого подхода является (I) генетическая конструкция (экспрессионный вектор), содержащая в своем составе сильный промотор и (II) культуру клеток насекомого Polypedilum vanderplanki.
Из исследованного уровня техники, а именно из научной литературы, известно, что наиболее крупным и сложно устроенным живым организмом, способным восстанавливать жизнедеятельность после полного высыхания (обезвоживания на воздухе до влажности менее 2%), является насекомое Polypedilum vanderplanki [1]. Выделенные из Polypedilum vanderplanki культуры клеток также способны переносить обезвоживание [2]. Данная способность Polypedilum vanderplanki и выделенных из него культур клеток обусловлена свойственным этому насекомому сложным сочетанием молекулярных факторов, защищающих структуру и активность клеточных компонентов при обезвоживании. В обезвоженном состоянии Polypedilum vanderplanki характеризуется высокой устойчивостью к неблагоприятным воздействиям. В частности, обезвоженные личинки насекомого сохраняют жизнеспособность при действии температуры плюс 102°C в течение 2 мин, получении дозы γ-радиации 3000 Гр [грэй] - более чем на два порядка выше летальных для млекопитающих доз гамма-излучения [1]. Кроме того, в обезвоженном состоянии личинки Polypedilum vanderplanki могут длительно (10 лет и более), храниться с сохранением жизнеспособности [3]. Культуры клеток Polypedilum vanderplanki являются единственными известными культурами клеток насекомых, которые обладают природной способностью сохранять жизнеспособность при обезвоживании. Способность сохранять жизнеспособность при обезвоживании сочетается в них (культурах клеток Polypedilum vanderplanki) с эволюционно развитой системой экспрессии (реализации генетической информации последовательности ДНК в функциональный продукт - нуклеиновые кислоты или белки). Развитая система экспрессии клеток Polypedilum vanderplanki способна обеспечить полное созревание белков эукариот. В клетках Polypedilum vanderplanki могут быть получены и законсервированы путем обезвоживания биотехнологические продукты, в том числе инактивируемые обезвоживанием (сушкой) ферменты. По свойствам и особенностям клетки Polypedilum vanderplanki являются наиболее пригодной средой для получения инактивируемых обезвоживанием биотехнологических продуктов (например, ферментов). С учетом вышесказанного разработка и использование генетических конструкций для экспрессии чужеродных генов и получения биотехнологических продуктов в клетках Polypedilum vanderplanki является основой для создания нового способа их (биотехнологических продуктов) консервации, хранения и транспортировки. Основное требование к генетическим конструкциям, предназначенным для использования в клетках Polypedilum vanderplanki - обеспечение экспрессии чужеродных генов. Экспрессия генов обеспечивается особыми участками ДНК - промоторами, которые не являются универсальными, т.к. функционируют в определенных клетках или нескольких типах клеток [4].
Из исследованного заявителем уровня техники выявлено техническое решение под названием «Полученные из насекомых промоторы для экспрессии чужеродных белков в клетках насекомых» [5], сущность которого заключается в выделении полинуклеотидных последовательностей (в том числе регуляторных), расположенных в ДНК перед генами, кодирующими белки-гексамерины (запасающие белки насекомых), в том числе полинуклеотидных последовательностей, принадлежащих личинкам насекомых, в том числе личинкам бабочки Trichoplusia ni. По [5], указанные полинуклеотидные последовательности могут быть использованы в сочетании с другими регуляторными последовательностями, включая регуляторную последовательность промотора белка полиэдрина (структурного белка бакуловирусов насекомых) или промотора белка OOP («OmpA-OmpF porine»). По [5], указанные нуклеотидные последовательности могут быть использованы для получения векторов экспрессии (генетических конструкций), в том числе векторов в виде плазмиды или векторов на основе вирусов (в том числе баукловирусов). По [5], указанные векторы экспрессии могут быть дополнены последовательностью, кодирующей белок. Указанные в [5] векторы предлагается использовать для трансфекции или трансформации клеток, в том числе клеток насекомых (в том числе клеточных культур Sf9 или Sf21), а также для трансфекции, инфекции или трансформации личинок насекомых. Решение [5] содержит также описание способа получения рекомбинантных белков в клетках насекомых или личинках насекомых с использованием указанных в [5] векторов, в том числе с использованием личинок насекомых в качестве биофабрик для получения рекомбинантных белков.
Недостатком [5] является низкая активность описанных в [5] промоторов в клетках Polypedilum vanderplanki. Промоторы генов, кодирующих белки – гексамерины, не способны обеспечить достаточную, например для практического применения, экспрессию чужеродных генов в клетках Polypedilum vanderplanki вследствие того, что совокупный вклад кодирующих белки-гексамерины генов в общую экспрессию генов Polypedilum vanderplanki составляет весьма малую величину - не более 0,05% [1]. Следствием указанного недостатка является невозможность использования [5] для экспрессии чужеродных генов в клетках Polypedilum vanderplanki, что существенно ограничивает область применения известного способа [5].
Из исследованного заявителем уровня техники выявлено также техническое решение под названием «Вектор для переноса и вакцина против туберкулеза» [6]. Сущность данного технического решения заключается в векторе, в который встроен сдвоенный промотор, содержащий промотор полиэдрина - структурного белка бакуловирусов насекомых, и промотор CMV (цитомегаловируса). Решение [6] аналогично заявленному техническому решению в части использования промотора бакуловирусов насекомых.
Кроме описания указанного промотора, решение [6] содержит описание иных элементов вектора. Так, вектор по [6] содержит «слитую» (совмещающую различные фрагменты) ДНК, содержащую (А) фрагмент ДНК кодирующий белок-антиген Mycobacterium tuberculosis и (В) фрагмент ДНК гена, кодирующего аминокислотную последовательность, указанную в [6]. По [6], указанный вектор может содержать указанную «слитую» ДНК, полученную из геномной ДНК штамма М. tuberculosis H37Rv. По [6], указанный вектор может содержать также вышеуказанный фрагмент ДНК (А), полученный посредством ПЦР с геномной ДНК, выделенной из штамма M. tuberculosis H37Rv и вышеуказанный фрагмент ДНК (В), представляющий собой фрагмент, полученный посредством ПЦР с pBACsurf-1 в качестве матрицы (оба фрагмента должны быть расщеплены после ПЦР). В решении [6] описана также вакцина против туберкулеза, содержащая рекомбинантный вирус ядерного полиэдроза Autographa californica (AcNPV), содержащего указанные «слитую» ДНК и сдвоенный промотор. По [6], рекомбинантый вирус также может содержать «слитую» ДНК, полученную вышеуказанными способами с использованием геномной ДНК штамма М. tuberculosis H37Rv.
По [6], вышеуказанный бакуловирусный промотор может быть выбран из промотора полиэдрина, промотора p10, промотора IE1, промотора IE2, промотора р35, промотора р39 и промотора gр64. Недостатком [6] является отсутствие достоверного сходства (подобия) указанных в [6] промоторов к последовательности ДНК Polypedilum vanderplanki. Следствием приведенного недостатка является низкая, например недостаточная для практического применения, активность указанных в [6] промоторов в клетках Polypedilum vanderplanki. Таким образом, указанные в [6] промоторы не могут быть применены в клетках Polypedilum vanderplanki, что ограничивает область применения [6].
Из исследованного заявителем уровня техники выявлено также техническое решение под названием «Векторы экспрессии насекомых» [7], сущность которого заключается в челночном векторе для трансформации клеток насекомых (челночный вектор - вектор, функциональный в клетках не менее чем двух различных организмов). Вектор по способу [7] предназначен для экспрессии исключительно в клетках насекомых. По совокупности совпадающих признаков способ [7] наиболее близок к заявленному техническому решению и выбран заявителем в качестве прототипа. Вектор по [7] состоит из 1) прокариотической (бактериальной) точки начала репликации; 2) промотора насекомых, гомологичного (сходного) промотору «immediate early baculovirus promoter» (незамедлительный ранний промотор бакуловируса) и способного функционировать в качестве указанного промотора; 3) прокариотного (бактериального) промотора; 4) селективного генетического маркера, способного обеспечить устойчивость к антибиотику блеомицинового (флеомицинового) типа. По [7] вектор может быть представлен в следующих вариантах: 1) вектор, содержащий последовательность прокариотного промотора в виде скрытого (криптического) промотора в промоторе насекомых; 2) вектор, обеспечивающий устойчивость к антибиотику блеомицинового (флеомицинового) ряда, а именно к антибиотику зеоцин; 3) вектор, содержащий участок вставки гетерологичной (чужеродной) ДНК, в том числе под контролем второго промотора насекомых, в том числе со встроенной гетерологичной ДНК. В техническом решении [7] описаны варианты нуклеотидных последовательностей промотора насекомых, в том числе элемента IE2B, пары элементов GATA-IE2B, и других. По [7], указанный вектор может быть дополнен элементами, определяемыми как транспозон (участок ДНК, способный к передвижению и размножению в пределах генома), в том числе вектор может быть дополнен транспозонами, содержащими селективный генетический маркер, участок вставки гетерологичной ДНК и индуцируемый ген транспозазы (фермента, который связывает одноцепочечную ДНК и встраивает ее в геномную ДНК). Решение [7] описывает также трансформированные указанным вектором клетки насекомых (в том числе трансформированные стабильно), метод трансформации клеток насекомых, варианты метода увеличения числа копий гетерологичной ДНК в клетках. По [7], трансформированные указанным вектором клетки используются для производства, в том числе 1) гетерологичных белков из группы металлотрансферинов и их биологически активных производных; 2) гормонов насекомых, а именно белков ионного транспорта.
Недостатком прототипа [7] является отсутствие промотора с достоверным сходством (подобием) к последовательности ДНК Polypedilum vanderplanki. Последствием недостатка прототипа является подтвержденная экспериментально (см. Пример первый) низкая, недостаточная для практического применения, активность его (прототипа) промотора в клетках Polypedilum vanderplanki. Низкая активность промотора прототипа [7] делает его неприменимым для экспрессии генов в клетках Polypedilum vanderplanki, существенно ограничивает область его (прототипа) применения, например, для получения биотехнологических продуктов, например инактивируемых обезвоживанием ферментов.
Целью заявленного технического решения является создание генетической конструкции, обеспечивающей экспрессию чужеродных генов в культуре клеток насекомого Polypedilum vanderplanki, расширение возможностей консервации инактивируемых обезвоживанием биотехнологических продуктов.
Сущностью заявленного технического решения является генетическая конструкция, обеспечивающая экспрессию чужеродных генов в культуре клеток насекомого Polypedilum vanderplanki.
Заявленные цели достигаются тем, что создают генетическую конструкцию, включающую выделенный из последовательности ДНК Polypedilum vanderplanki промотор Р121 с нуклеотидной последовательностью SEQ ID: 1. Промотор Р121 может быть заменен на промотор Р-II с нуклеотидной последовательностью SEQ ID: 2.
Заявленное техническое решение иллюстрируется следующими материалами, оформленными в соответствии со стандартами ВОИС.
Фиг. 1 - Нуклеотидная последовательность промотора Р121.
Фиг. 2 - Нуклеотидные последовательности праймеров для получения промотора Р121.
Фиг. 3 - Нуклеотидные последовательности праймеров для получения фрагмента ДНК с геном GFP.
Фиг. 4 - Нуклеотидные последовательности праймеров для замены гена устойчивости к антибиотику зеоцин на ген устойчивости к антибиотику канамицин в конструкции plZ/V5-His.
Фиг. 5 - Физическая карта генетической конструкции pP121topo2K-GFP, где: 1 - промотор Р121; 2…4 - сайты распознавания ферментов рестрикции Bgl II, Pst I и BamH I соответственно; 5 - ген GFP; 6 - сайт распознавания фермента рестрикции Xba I; 7 - точка начала репликации PUC; 8 - бактериальный промотор Т7; 9 - сайт распознавания фермента рестрикции Pst I; 10 - ген устойчивости к антибиотику канамицину; 11…13 - сайты распознавания ферментов рестрикции Sma I, Sa II, EcoR I соответственно.
Фиг. 6 - Нуклеотидные последовательности праймеров, используемых для ПЦР клонов E. coli.
Фиг. 7 - Фотография флюоресценции культуры клеток Pv11, экспрессирующих ген GFP после трансфекции конструкцией pP121topo2K-GFP.
Фиг. 8 - Нуклеотидные последовательности праймеров для получения промотора Р-II.
Фиг. 9 - Сравнение нуклеотидных последовательностей промотора Р-II и промотора Р121; отличающиеся нуклеотиды выделены серым цветом, отсутствующие в одной из последовательностей нуклеотиды обозначены дефисами.
Фиг. 10 - Фотография флюоресценции культуры клеток Pv11, экспрессирующих ген GFP после трансфекции конструкцией рР121-II (выделены стрелками).
Фиг. 11 - Нуклеотидные последовательности праймеров для получения фрагментов ДНК с промотором Р121 (праймеры I, II), геном RFP (праймеры III, IV), участка генетической конструкции pcDNA5-FRT (праймеры V, VI).
Фиг. 12 - физическая карта генетической конструкции pcDNA-P121-RFP, где: 1 - промотор Р121; 7 - точка начала репликации PUC, 14 - ген RFP; 15 - ген устойчивости к антибиотику гигромицину; 16 - ген устойчивости к антибиотику ампициллину; 17 - бактериальный промотор bla
Фиг. 13 - фотография флюоресценции культуры клеток Pv11, экспрессирующих ген RFP после трансфекции конструкцией pcDNA-P121-RFP
Нуклеотдиные последовательности промоторов Р121 и PII на электронном носителе (SEQ ID: 1 и SEQ ID: 2 соответственно).
Осуществление заявленного технического решения демонстрируется следующими примерами:
ПРИМЕР ПЕРВЫЙ, демонстрирующий процесс получения генетической конструкции, включающей промотор Р121
Промотор Р121 выбран на основе экспериментальных данных об экспрессии генов в Polypedilum vanderplanki [1], как обеспечивающий наиболее высокий уровень конститутивной (постоянной) экспрессии генов: находящийся под управлением Р121 ген Pv.00443 является наиболее высокоэкспрессируемым геном в личинках Polypedilum vanderplanki [1]. Из современного уровня техники не выявлено промоторов и иных известных нуклеотидных последовательностей с достоверным сходством к промотору Р121.
Получают экземпляры насекомого Polypedilum vanderplanki, например, путем культивирования в лабораторных условиях. Из Polypedilum vanderplanki (например, из личинок) выделяют общую ДНК, например, с использованием специализированного коммерческого набора Nucleospin tissue kit (производства фирмы Macherey Nagel, Германия). Нуклеотидная последовательность промотора Р121 приведена на Фиг. 1. Специфический фрагмент ДНК, содержащий нуклеотидную последовательность промотора Р121, получают в полимеразной цепной реакции (ПЦР) с использованием общей ДНК Polypedilum vanderplanki в качестве матрицы. Для ПЦР (здесь и далее в тексте) используют высокоточную полимеразу, например полимеразу Q5 производства фирмы New England Biolabs, США, и праймеры с последовательностью по Фиг. 2 (I, II). На Фиг. 2 приведены нуклеотидные последовательности используемых для получения промотора Р121 праймеров.
Для проверки (доказательства) наличия экспрессии чужеродного гена в клетках Polypedilum vanderplanki в качестве модели используют ген, кодирующий зеленый флуоресцентный белок (известный ген GFP). Получают фрагмент ДНК с геном GFP, например, путем ПЦР, используя в качестве матрицы ДНК, содержащую ген GFP (например, плазмиду plZT/V5-His производства фирмы Thermo Fisher Scientific, США) и праймеры, например, по Фиг. 3 (I, II). На Фиг. 3 приведены нуклеотидные последовательности используемых для получения фрагмента ДНК с геном GFP праймеров.
Получают несущий элемент заявляемой генетической конструкции, а именно модифицированную генетическую конструкцию plZ/V5-His (производства фирмы Thermo Fisher Scientific, США). Модификацию генетической конструкции plZ/V5-His выполняют путем замены гена устойчивости к антибиотику зеоцин на ген устойчивости к антибиотику канамицин. Замену гена устойчивости проводят известным путем ПЦР генетических конструкций plZ/V5-His и pTagRFP-N (производства фирмы «Евроген», Россия) с использованием праймеров по Фиг. 4 (I, II) и соединения полученных фрагментов ДНК методом Гибсона [8], например с использованием коммерческого набора Gibson Assembly (производства фирмы New England Biolabs, США) в стандартных условиях, в соответствии с рекомендациями производителя. На Фиг. 4 приведены нуклеотидные последовательности праймеров, используемых для замены гена устойчивости к антибиотику зеоцин на ген устойчивости к антибиотику канамицин в конструкции plZ/V5-His. Таким образом, заменой гена устойчивости получают промежуточную генетическую конструкцию, являющуюся несущим элементом заявляемой генетической конструкции.
Полученную промежуточную генетическую конструкцию обрабатывают ферментами рестрикции EcoRI и XbaI в стандартных условиях в соответствии с рекомендациями производителя (фирмы New England Biolabs, США). Непосредственно после обработки ферментами рестрикции в конструкцию встраивают ранее полученные фрагменты ДНК, содержащие промотор Р121 и ген GFP.
Встраивание выполняют методом Гибсона [8], например, с использованием коммерческого набора Gibson Assembly (производства фирмы New England Biolabs, США) в стандартных условиях в соответствии с рекомендациями производителя. По завершении описанных действий получают генетическую конструкцию pP121topo2K-GFP, Фиг. 5. На Фиг. 5 приведена физическая карта генетической конструкции pP121topo2K-GFP, где: 1 - промотор Р121; 2…4 - сайты распознавания ферментов рестрикции Bgl II, Pst I и BamH I соответственно; 5 - ген GFP; 6 - сайт распознавания фермента рестрикции Xba I; 7 - точка начала репликации PUC; 8 - бактериальный промотор Т7; 9 - сайт распознавания фермента рестрикции Pst I; 10 - ген устойчивости к антибиотику канамицину; 11…13 - сайты распознавания ферментов рестрикции Sma I, Sa II, EcoR I соответственно.
На Фиг. 5 основным элементом конструкции pP121topo2K-GFP является промотор Р121, обеспечивающий экспрессию встроенных в конструкцию генов (в приведенном ПРИМЕРЕ ПЕРВОМ - гена GFP). Конструкция pP121topo2K-GFP содержит также дополнительные элементы, которые известны из существующего уровня техники и не являются обязательными: 10 - ген, обеспечивающий устойчивость клеток к антибиотику канамицину для селекции несущих генетическую конструкцию клеток стандартным способом [9] (см. далее в тексте ПРИМЕРА ПЕРВОГО); 7 - точка начала репликации (копирования) в клетках E. coli (PUC-точку); 8 - промотор Т7. Элементы 7 и 8 обеспечивают копирование конструкции pP121topo2K-GFP в клетках E. coli и облегчают ее получение [9] (см. далее в тексте ПРИМЕРА ПЕРВОГО); 2…4, 6, 9, 11…13 - сайты распознавания ферментов рестрикции для манипуляций с генетической конструкцией [10].
Полученную генетическую конструкцию pP121topo2K-GFP вводят в клетки E. coli (выполняют трансфекцию), например, с использованием известного способа теплового шока, например при температуре плюс 42°С, в течение 45 сек. После завершения трансфекции клетки E. coli рассевают на чашке Петри, например, с известной питательной средой LB, с добавлением агара и антибиотика, например канамицина (50 мкг/мл). Посев культивируют, например, в течение 24 ч при температуре плюс 37°С. После культивации отбирают и сохраняют несколько клонов E. coli. Убеждаются в наличии конструкции pP121topo2K-GFP в клонах E. coli. Для этого проводят ПЦР отобранных клонов E. coli, используя праймеры в соответствии с Фиг. 6. На Фиг. 6: Нуклеотидные последовательности праймеров, используемых для ПЦР клонов E. coli. Наличие конструкции pP121topo2K-GFP в клоне E. coli определяют по наличию продуктов ПЦР, визуально подтвержденному при электрофорезе в агарозном геле с окрашиванием ДНК специфическим красителем, например красителем этидиум бромид.
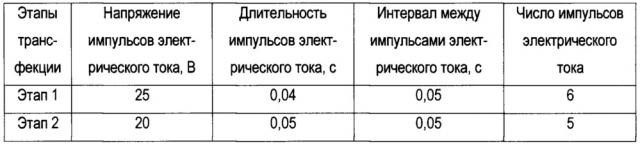
Один из содержащих конструкцию pP121topo2K-GFP клонов E. coli (любой) вносят в 50 мл известной жидкой питательной среды LB и культивируют 24 часа на качалке, например, при плюс 37,0°С. Из полученной жидкой культуры E. coli выделяют генетическую конструкцию pP121topo2K-GFP с помощью коммерческого набора Nucleospin plasmid Kit (производства фирмы Macherey Nagel, Германия). Выделенную генетическую конструкцию используют для трансфекции (введения ДНК в клетки) ранее выделенной из насекомого Polypedilum vanderplanki [2] культуры клеток Pv11. Жизнеспособность культуры клеток Pv11 должна составлять не менее 90% при определении окраской трипановым синим - это условие обеспечивают использованием культуры клеток Pv11 в логарифмической фазе роста. Трансфекцию осуществляют, например, с использованием прибора NEPA21 (фирмы NepaGene, Япония) стандартным методом электропорации [11], основанном на подаче импульсов электрического тока на суспензию клеток с внесенной генетической конструкцией. Оптимальная плотность суспензии клеток Pv11 при трансфекции составляет 10 млн клеток/мл, концентрация генетической конструкции в суспензии клеток 1 мкг/мл. Параметры импульсов электрического тока устанавливают, например, в соответствии с Таблицей; работу с прибором осуществляют в соответствии с рекомендациями производителя.
Таблица. Параметры импульсов электрического тока для трансфекции культуры клеток Pv11 конструкцией pP121topo2K-GFP
В контрольном варианте трансфекцию культуры клеток Pv11 осуществляют описанным выше путем с использованием вместо заявляемой конструкции pP121topo2K-GFP ее прототипа [7] - стандартной конструкции plZT/V5-His (производства фирмы Thermo Fisher Scientific, США). Конструкция plZT/V5-His (прототип) содержит ген GFP под управлением промотора le2 бакуловируса OpMNPV.
После трансфекции клетки Pv11 культивируют в стандартных условиях: питательная среда IPL, температура от +24 до +25°С, при плотности клеточной суспензии от 2×104 до 1×106 клеток/мл [2]. Наличие экспрессии гена GFP в клетках Pv11 проверяют через 24 часа после трансфекции, например, осуществляя микроскопию клеток Pv11 методами фазового контраста и флюоресценции при длине волны λвозбуждения = 489 нм, длине волны λэмиссии = 525 нм. Наличие флюоресценции клеток Pv11 свидетельствует о наличии в них белка GFP, Фиг. 7, где приведена фотография флюоресценции культуры клеток Pv11, экспрессирующих ген GFP после трансфекции конструкцией pP121topo2K-GFP. Наличие флюоресценции подтверждает факт состоявшейся экспрессии кодирующего белок GFP гена.
Состоявшаяся и установленная экспрессия гена GFP подтверждает достижение цели заявляемого изобретения - сконструированная в соответствии с описанием предлагаемого изобретения, содержащая промотор Р121, генетическая конструкция pP121topo2K-GFP обеспечивает экспрессию чужеродного гена GFP в выделенной из насекомого Polypedilum vanderplanki культуре клеток Pv11.
В контрольном варианте, в клетках Pv11 после трансфекции конструкцией plZT/V5-His, флюоресценция белка GFP не наблюдается, что свидетельствует об отсутствии экспрессии гена GFP.
Сравнение результатов осуществления заявляемого способа и контрольного варианта показывает и доказывает, что успешно обеспечиваемая заявленным техническим решением экспрессия чужеродного гена GFP в выделенной из насекомого Polypedilum vanderplanki культуре клеток Pv11 не осуществима по прототипу [6] (генетической конструкцией plZT7V5-His с промотором le2).
ПРИМЕР ВТОРОЙ, показывающий конструирование генетической конструкции, включающей аналог промотора Р121 со сходством нуклеотидной последовательности не менее 86% (промотор PII с нуклеотидной последовательностью SEQ ID: 2)
Описанным в ПРИМЕРЕ ПЕРВОМ путем получают генетическую конструкцию рР121-II, при этом праймеры для получения промотора Р121 (Фиг. 2, I, II) заменяют на иные праймеры, например на праймеры, нуклеотидная последовательность которых приведена на Фиг. 8 (I-IV). На Фиг. 8 - нуклеотидные последовательности праймеров для получения промотора Р-II, отличающегося от приведенного в ПРИМЕРЕ ПЕРВОМ промотора. Заменой праймеров и осуществлением описанных в ПРИМЕРЕ ПЕРВОМ действий получают генетическую конструкцию рР121-II.
Конструкция рР121-II идентична описанной в ПРИМЕРЕ ПЕРВОМ конструкции pP121topo2K-GFP, где промотор Р121 заменен на промотор Р-II. Промотор Р-II является аналогом промотора Р121, в котором фрагмент из последних 398 нуклеотидов заменен на сходный по своей последовательности фрагмент ДНК Polypedilum vanderplanki (сходство оценивали с помощью стандартной программы BLAST [12]). Сравнение нуклеотидных последовательностей промотора Р-II и промотора Р121 приведено на Фиг. 9, на которой отличающиеся между последовательностями нуклеотиды выделены серым цветом, отсутствующие в одной из последовательностей нуклеотиды обозначены дефисами. Гомология (сходство) нуклеотидных последовательностей промотора Р-II и промотора Р121 составляет 86% при анализе с помощью стандартной программы Needle [13]. То есть промотор Р-II является аналогом промотора Р121 (описан в ПРИМЕРЕ ПЕРВОМ) с не менее чем 86%-ным подобием (сходством) нуклеотидной последовательности.
Действия с генетической конструкцией рР121-II полностью идентичны описанным в ПРИМЕРЕ ПЕРВОМ, показывающем экспрессию чужеродного гена в выделенной из насекомого Polypedilum vanderplanki культуре клеток Pv11.
На завершающем этапе, аналогично ПРИМЕРУ ПЕРВОМУ, путем использования фазово-контрастной и флюоресцентной микроскопии клеток Pv11 устанавливают (выявляют) наличие флюоресценции клеток Pv11, Фиг. 10, где приведена фотография флюоресценции культуры клеток Pv11, экспрессирующих ген GFP после трансфекции конструкцией рР121-II. Установленная флюоресценция свидетельствует о наличии зеленого флуоресцентного белка (GFP) в клетках Pv11, и соответственно - об успешной экспрессии гена GFP с использованием иной, отличной от приведенной в ПРИМЕРЕ ПЕРВОМ, генетической конструкции.
Таким образом, генетическая конструкция, содержащая аналог промотора Р121 с более чем 86%-ным подобием (сходством) нуклеотидной последовательности (в приведенном ПРИМЕРЕ ВТОРОМ - генетическая конструкция рР121-II с промотором Р-II) тоже обеспечивает экспрессию чужеродного гена GFP в выделенной из насекомого Polypedilum vanderplanki культуре клеток Pv11.
ПРИМЕР ТРЕТИЙ, демонстрирующий процесс получения генетической конструкции с промотором Р121 на основе генетической конструкции pcDNA5-FRT
Получают генетическую конструкцию pcDNA-P121-RFP. Для этого методом ПЦР, в соответствии с описанием в примере первом, получают фрагменты ДНК, содержащие ген красного флуоресцентного белка (ген RFP), промотор Р121 и участок генетической конструкции pcDNA5-FRT. При проведении ПЦР используют праймеры, нуклеотидная последовательность которых приведена на Фиг. 11. На Фиг. 11 - нуклеотидные последовательности праймеров для получения фрагментов ДНК с промотором Р121 (праймеры I, II), геном RFP (праймеры III, IV), участка генетической конструкции pcDNA5-FRT (праймеры V, VI). При получении участка генетической конструкции pcDNA5-FRT в качестве матрицы для ПЦР используют соответствующую генетическую конструкцию производства фирмы Thermo Fisher Scientific, США. При получении фрагмента ДНК с геном RFP в качестве матрицы для ПЦР используют генетическую конструкцию, содержащую данный ген, например генетическую конструкцию pTagRFP-N производства фирмы Евроген, Россия.
Полученные в ПЦР фрагмент ДНК с промотором Р121 и фрагмент генетической конструкции pcDNA5-FRT объединяют с использованием метода Гибсона [8], получая промежуточную генетическую конструкцию pcDNA-P121. Промежуточную генетическую конструкцию pcDNA-P121 обрабатывают ферментами рестрикции HindIII и XhoI и встраивают в нее фрагмент ДНК с геном RFP методом Гибсона [8], в соответствии с описанием в ПРИМЕРЕ ПЕРВОМ. Тем самым получают генетическую конструкцию pcDNA-P121-RFP, Фиг. 12. На Фиг. 12 приведена физическая карта генетической конструкции pcDNA-P121-RFP, где: 1 - промотор Р121; 7 - точка начала репликации PUC, 14 - ген RFP; 15 - ген устойчивости к антибиотику гигромицину; 16 - ген устойчивости к антибиотику ампициллину; 17 - бактериальный промотор bla.
Конструкция pcDNA-P121-RFP содержит промотор Р121 аналогично конструкции pP121topo2K-RFP, описанной в ПРИМЕРЕ ПЕРВОМ. При этом остальные конструктивные элементы генетической конструкции pcDNA-P121-RFP, необходимые для ее получения и функционирования, отличаются от таковых в конструкции pP121topo2K-RFP.
Действия с генетической конструкцией pcDNA-P121-RFP полностью идентичны описанным в ПРИМЕРЕ ПЕРВОМ, показывающим экспрессию чужеродного гена в выделенной из насекомого Polypedilum vanderplanki культуре клеток Pv11. На завершающем этапе, аналогично ПРИМЕРУ ПЕРВОМУ, путем использования фазово-контрастной и флюоресцентной микроскопии клеток Pv11 устанавливают (выявляют) наличие флюоресценции клеток Pv11, Фиг. 13, где приведена фотография флюоресценции культуры клеток Pv11, экспрессирующих ген RFP после трансфекции конструкцией pcDNA-P121-RFP. Установленная флюоресценция свидетельствует о наличии красного флуоресцентного белка (RFP) и соответственно об успешной экспрессии чужеродного гена RFP в клетках Polypedilum vanderplanki (культуре клеток Pv11) с использованием иной, отличной от приведенной в ПРИМЕРЕ ПЕРВОМ, генетической конструкции pcDNA-P121-RFP.
Сущностным признаком генетических конструкций pcDNA-P121-RFP и pP121topo2K-RFP является наличие промотора Р121. Помимо промотора Р121, генетические конструкции pcDNA-P121-RFP и pP121topo2K-RFP содержат также иные конструктивные элементы, необходимые для их получения и функционирования, такие как ген резистентности к антибиотику, бактериальный промотор и точка начала репликации (копирования). При этом все конструктивные элементы у генетических конструкций pcDNA-P121-RFP и pP121topo2K-RFP отличаются, за исключением промотора Р121 и точки начала репликации (копирования) генетической конструкции (точка PUC, Фиг. 5, поз. 7 и Фиг. 12, поз. 7). Из уровня техники известно, что точка PUC в генетических конструкциях может быть заменена на иные варианты данного конструктивного элемента. Так, рекомендации базы данных генетических конструкций Addgene (расположенные в сети интернет по адресу URL: http://blog.addgene.org/plasmid-101-origin-of-replication [14]) включают список из 10 вариантов точек начала репликации, успешно обеспечивающих копирование и получение генетических конструкций известным способом с использованием бактерий [9]. Таким образом, общий элемент генетических конструкций pcDNA-P121-RFP и pP121topo2K-RFP точка PUC не является существенным и может быть заменен на иные варианты точки начала репликации, известные из уровня техники.
Таким образом, для достижения заявленной цели (экспрессии чужеродных генов в клетках насекомого Polypedilum vanderplanki), генетические конструкции должны содержать промотор Р121 (SEQ ID:1) или его аналог со сходством нуклеотидной последовательности более 86%, а именно промотор PII (SEQ ID: 2). Остальные конструктивные элементы генетических конструкций для экспрессии генов в клетках Polypedilum vanderplanki могут быть использованы в различных вариантах, обеспечивающих получение и функционирование генетических конструкций, в соответствии с известным уровнем техники.
Осуществление предлагаемого изобретения не ограничивается приведенными ПРИМЕРАМИ.
Приведенные примеры осуществления предлагаемого изобретения показывают его осуществимость с использованием стандартного оборудования и материалов, полезность для применения в биотехнологиях, например для получения используемых в аналитической деятельности и диагностике инактивируемых обезвоживанием ферментов.
В заявленном техническом решении заявителем реализована поставленная цель: создана генетическая конструкция, обеспечивающая экспрессию чужеродных генов в культуре клеток насекомого Polypedilum vanderplanki; доказательством служат Фиг. 7, Фиг. 10, на которых продемонстрирована флюоресценция культуры клеток Pv11, обусловленная экспрессией чужеродного белка GFP за счет применения заявляемой конструкции. Экспрессия чужеродных генов путем применения заявляемой конструкции позволяет получать в клетках Polypedilum vanderplanki биотехнологические продукты, например белки, в том числе инактивируемые обезвоживанием ферменты. Клетки Polypedilum vanderplanki способны сохранять жизнеспособность и, соответственно, активность внутриклеточных компонентов при обезвоживании [1]. В связи с вышесказанным использование заявляемой генетической конструкции для получения биотехнологических продуктов в клетках Polypedilum vanderplanki является основой для нового способа консервации, хранения и транспортировки биотехнологических продуктов. Указанный способ основан на обезвоживании клеток Polypedilum vanderplanki, содержащих полученный биотехнологический продукт. Тем самым применение заявляемой генетической конструкции обеспечивает существенное расширение возможностей консервации инактивируемых обезвоживанием биотехнологических продуктов.
Заявленное техническое решение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как при определении уровня техники не обнаружены средства, которым присущи признаки, идентичные (то есть совпадающие по исполняемой ими функции и форме выполнения этих признаков) всем признакам, перечисленным в формуле предлагаемого изобретения, включая характеристику назначения.
Заявленное техническое решение удовлетворяет критерию «изобретательский уровень», т.к. не является очевидным для специалиста в данной области техники и из исследованного уровня техники, заявителем не выявлены технические решения, совпадающие по технической сущности предлагаемым решением, и не установлена известность влияния отличительных признаков на полученный технический результат.
Заявляемое техническое решение можно реализовать в промышленном производстве биотехнологических продуктов, используемых в биотехнологиях, научной, медицинской и производственной деятельности посредством использования известных стандартных технических устройств и оборудования. Это соответствует критерию «промышленная применимость», предъявляемому к изобретениям.
Источники информации
1. Gusev О. et al. Comparative genome sequencing reveals genomic signature of extreme desiccation tolerance in the anhydrobiotic midge // Nat. Commun. Nature Publishing Group, 2014. Vol. 5. P. 4784.
2. Nakahara Y. et al. Cells from an anhydrobiotic chironomid survive almost complete desiccation // Cryobiology. Elsevier Inc., 2010. Vol. 60, №2. P. 138-146.
3. Cornette R., Kikawada T. The induction of anhydrobiosis in the sleeping chironomid: current status of our knowledge // IUBMB Life. 2011. Vol. 63, №6. P. 419-429.
4. Nakabachi A. Horizontal gene transfers in insects // Curr. Opin. Insect Sci., 2015. Vol. 7. P. 24-29.
5. Патент WO/2010/025764 A1. МПК 2006.01 C12N 15/85, C12N 15/866, A01K 67/033. Приоритет от 02.09.2008. Опубл. 11.03.2010. Описание изобретения.
6. Патент RU 2453603 С2, МПК 2006.01 C12N 15/63, A61K 39/04. Приоритет от 08.02.2007. Опубл. 20.06.2012. Описание изобретения.
7. Патент WO/1998/044141. МПК 2006.01 C07K 14/575, C07K 14/79, C12N 15/69, C12N 15/85, C12N 9/64. Приоритет от 26.03.1998. Опубл. 08.10.1998. Описание изобретения.
8. Altschul S.F. et al. Basic local alignment search tool. // J. Mol. Biol. 1990. Vol. 215, №3. P. 403-410.
9. Gibson D.G. et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. // Nat. Methods. 2009. Vol. 6, №5. P. 343-345.
10. Sambrook J., W Russell D. Molecular Cloning: A Laboratory Manual // Cold Spring Harb. NY. 2001. P. 999.
11. Cohen S.N. et al. Construction of biologically functional bacterial plasmids in vitro. // Proc. Natl. Acad. Sci. U.S.A. 1973. Vol. 70, №11. P. 3240-3244.
12. Neumann E. et al. Gene transfer into mouse lyoma cells by electroporation in high electric fields. // EMBO J. 1982. Vol. 1, №7. P. 841-845.
13. Rice P.