Способ определения риска возникновения рецидива онкологических заболеваний молочной железы
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к онкологии и молекулярной биологии, и предназначено для определения риска возникновения рецидива онкологических заболеваний молочной железы. В образце опухолевой ткани пациента измеряют уровень экспрессии генов-маркеров ELOVL5, IGFBP6, TXNDC9. Оценку риска рецидива проводят путем сравнения уровней экспрессии генов-маркеров с предопределенными пороговыми значениями. Изобретение обеспечивает простой, чувствительный, надежный способ прогноза безрецидивной выживаемости. 13 з.п. ф-лы, 6 ил., 8 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности, к онкологии и молекулярной биологии, и может быть использовано для оценки риска рецидива рака молочной железы после хирургического удаления опухоли.
Изобретение основано на оценке уровня экспрессии 3 генов, мРНК которых могут быть получены из образца опухолевой ткани пациента. При этом уровень экспрессии может быть измерен как известными способами, так и способом, описанным в настоящем изобретении.
Уровень техники
Рак молочной железы (РМЖ) - это злокачественная опухоль железистой ткани молочной железы. В мире это наиболее частая форма рака среди женщин, поражающая в течение жизни от 1:13 до 1:9 женщин в возрасте от 13 до 90 лет. Это также второе по частоте после рака легких онкологическое заболевание в популяции в целом (считая и мужское население). Количество случаев рака молочной железы в развитых странах резко увеличилось после 1970-х годов. За этот феномен считают частично ответственным изменившийся стиль жизни населения развитых стран (в частности то, что в семьях стало меньше детей и сроки грудного вскармливания сократились) [Мерабишвили В.М. (2011). Рак молочной железы: заболеваемость, смертность, выживаемость (популяционное исследование). Вопросы онкологии, 5, 609-615].
Новым шагом в лечении онкологических заболеваний является так называемый «индивидуальный подбор лечения». Известно, что важное место в схеме лечения больных РМЖ занимает химиотерапия. Ранее пациентки со схожими по клеточному строению типами опухолей проходили химиотерапию по одной и той же схеме. Детальные исследования транскриптома РМЖ позволили установить, что каждая опухоль обладает собственными, присущими только ей характеристиками. То есть при схожих клинических проявлениях и клеточном строении разные опухоли могут проявлять себя различным образом, в том числе, по-разному реагировать на проводимую медикаментозную терапию. Это определяется молекулярно-генетическими особенностями опухоли, в том числе, особенностями экспрессии определенных генов в опухолевых клетках.
В настоящее время выделяют несколько молекулярно-генетических классов РМЖ. Данная классификация предполагает деление первичных опухолей и метастазов в зависимости от наличия и плотности на поверхности раковых клеток рецепторов к биологически активным веществам-регуляторам (гормонам). Иммуногистохимическое типирование позволяет выделить группу пациентов, которым показано лечение противоопухолевыми эндокринными препаратами (препаратами, блокирующими определенные рецепторы раковых клеток, что приводит к снижению их пролиферативного потенциала).
Проблемы метастазирования и рецидива рака молочной железы являются одними из сложнейших в плане прогнозирования в онкологической практике и требующими разработки комплексного подхода для раннего выявления риска появления метастаз.
Из уровня техники известны различные методы построения подобных прогнозов, в том числе основанных на оценке уровня экспрессии мРНК генов. В частности, при построении прогнозов известно использование метода, основанного на полимеразной цепной реакции в реальном времени (ПЦР-РВ), который отличается от традиционных качественных и полуколичественных методов тем, что позволяет быстро и точно определить количество копий ДНК или кДНК в широком диапазоне концентраций [Aerts, J., Wynendaele, W., Paridaens, R., Christiaens, M.R., Van Den Bogaert, W., Van Oosterom, A.Т., & Vandekerckhove, F. (2001). A real-time quantitative reverse transcriptase polymerase chain reaction (RT-PCR) to detect breast carcinoma cells in peripheral blood. Annals of oncology official journal of the European Society for Medical Oncology ESMO (Vol. 12, pp. 39-46)]. Метод широко используют в мире, как для научных, так и клинических целей, благодаря высокой производительности: обычно проводят 96 реакций в одном опыте, а в последних моделях приборов - 384 реакции. В отличие от обычной полимеразной цепной реакции, когда количество продуктов определяют на конечной стадии реакции, ПЦР-РВ позволяет следить за накоплением продуктов в экспоненциальной фазе реакции. В этой системе наряду с праймерами используют зонд (пробу), меченный флуоресцентным красителем. Зонд является олигонуклеотидом, который гибридизуется с последовательностью ДНК/кДНК между двумя фланкирующими праймерами. ПЦР-РВ состоит из двух основных этапов: 1) гибридизации исследуемой матрицы с зондом и 2) ПЦР, катализируемой TaqДHK-пoлимepaзoй, обладающей 5'-экзонуклеазной активностью, расщепляющей зонд, что приводит к появлению и нарастанию флуоресцентного сигнала. Обычно реакция продолжается около 2 часов (40 циклов), в приборах нового поколения - всего 40 мин. Результаты анализа становятся доступными сразу после завершения реакции.
Существующие тест-системы позволяют уточнить диагноз, предсказать риск метастазирования и рецидива и эффективность разных видов терапии. Однако в работе Thomassen et al. (Thomassen M, Tan Q, Eiriksdottir F, Bak M, Cold S, Kruse ТА. Prediction of metastasis from low-malignant breast cancer by gene expression profiling. Int J Cancer. 2007 Mar 1; 120(5): 1070-5) показано, что наборы генов в профилях практически не пересекаются. Кроме того, они применимы для анализа определенных разновидностей рака молочной железы (LNN, чувствительных к эстроген-рецептору (ER+)) или для прогнозирования развития заболевания у пациентов, принимающих адъювантную терапию.
Группа van't Veer et al. (van't Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AAM, Mao M, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature [Internet]. Nature Publishing Group; 2002 Jan 31; 415(6871):530-6) использовала чип Rosetta с 60-мерными олигонуклеотидами и разработала 70-генный профиль, с помощью которого можно предсказывать образование метастаз в течение пяти лет у пациентов с РМЖ типа LNN (lymph node-negative) с большей точностью, чем с помощью классического клинико-патологического подхода. Предложенный генный профиль описан в патенте US 7514209 B2 (MammaPrint).
В заявке на патент US 2011/0145176 A1 (РАМ50) описан метод, набор реагентов и микрочипов для диагностики заболевания РМЖ и прогнозирования эффективности терапии на основании измерений уровней экспрессии 50 генов-маркеров.
Набор из праймеров к 14 генам и реагенты для определения их экспрессии методом ПЦР-РВ, а также алгоритм интерпретации экспрессии этих генов, предложены в патенте US 7695915 B2 для прогнозирования образования метастазов при люминальной форме РМЖ.
Метод и набор реагентов для прогнозирования развития заболевания РМЖ с помощью шести наборов генов-маркеров описаны в заявке на патент US 2010/0035240 A1. Метод основан на оценке уровня экспрессии 135 генов методом количественной полимеразной цепной реакции в реальном времени в свежезамороженных образцах РМЖ. Метод позволяет оценить общую десятилетнюю выживаемость, вероятность появления отдаленных метастазов и поражения лимфатических узлов.
В патенте US 7622251 B2 (Oncotype DX™) предложены численные молекулярные индикаторы для предсказания вероятности успешного отклика на антиэстрогенный агент (тамоксифен) и химиотерапию пациентов с заболеванием РМЖ (ER+, LNN) без адъювантной терапии.
Наиболее близким по достигаемому техническому результату является диагностический тест Oncotype DX Breast Cancer Assay, применяемый для оценки риска возникновения рецидива рака молочной железы. С помощью данного теста можно получать дополнительную информацию и принимать решение о дальнейшем лечении. По результатам исследования определяется агрессивность опухоли, а также оценивается риск возникновения рецидива и необходимость химиотерапевтического лечения. Исследуя экспрессию 21-го гена (16 генов-маркеров - Ki-67, STK15, Survivin, Cyclin B1, MYBL2, Stromelysin 3, Cathepsin L2, ER, PR, Bcl-2, SCUBE2, GRB7, HER2, GSTM1, Cd68, BAG1, и 5 нормировочных генов - Beta-actin, GAPDH, RPLPO, GUS, TFRC), специалисты устанавливают вероятность рецидива в течение 10 лет. Сам показатель выражен числом от 0 до 100. При этом для проведения теста используются фрагменты опухолевой ткани, стабилизированные в формалине и зафиксированные в парафине. Дополнительная стадия подготовки пробы приводит к увеличению времени проведения теста и дополнительным затратам. Также к недостаткам можно отнести необходимость в осуществлении микродиссекции образца опухолевой ткани, что требует привлечения высококвалифицированных специалистов.
Анализ патентной документации свидетельствует о том, что поиск эффективных решений, направленных на построение прогнозов общей и безрецидивной выживаемости с учетом индивидуальных молекулярно-генетических особенностей рака молочной железы, является крайне актуальной задачей.
Раскрытие изобретения
Задачей предлагаемого технического решения является разработка новых диагностических маркеров РМЖ, позволяющих достоверно оценить риск развития рецидива после хирургического лечения, а также разработка на их основе простого, чувствительного, надежного, применимого в условиях клинических или поликлинических медицинских учреждений способа оценки риска рецидива РМЖ.
Заявляемое изобретение расширяет арсенал диагностических тестов посредством получения новых диагностических маркеров РМЖ, позволяющих при сопоставимой достоверности и специфичности оценить риск развития рецидива после хирургического лечения.
Поставленная задача решается способом определения риска возникновения рецидива онкологических заболеваний молочной железы у пациента, включающий измерение уровня экспрессии (количественной оценки представленности) генов-маркеров ELOVL5, IGFBP6, TXNDC9 в образце опухолевой ткани пациента с получением коэффициента риска рецидива SR и последующей оценкой риска рецидива онкологических заболеваний молочной железы путем сравнения полученного коэффициента с предопределенными пороговыми значениями.
Настоящее изобретение в своем первом аспекте относится к способу определения риска возникновения рецидива онкологических заболеваний молочной железы у человека, включающему:
- получение образца опухолевой ткани;
- выделение и очистку мРНК из образца;
- синтез одноцепочечных кДНК на мРНК с использованием олигонуклеотидных неспецифических праймеров со случайной последовательностью нуклеотидов;
- проведение ПЦР одноцепочечных кДНК с прямыми и обратными геноспецифическими праймерами и зондами, специфичными по отношению к исследуемым генам (генам-маркерам) - ELOVL5, IGFBP6, TXNDC9, и с парами геноспецифических праймеров и зондами для нормирования результатов ПЦР, специфичным по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1 с получением для каждого из перечисленных генов-маркеров их ненормированных количественных оценок представленности Q(g), последующим их нормированием и получением нормированных количественных оценок представленности Qnorm(g), вычислением коэффициента риска рецидива (SR) по формуле
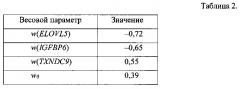
SR=w0+w(ELOVL5)Qnorm(ELOVL5)+w(IGFBP6)Qnorm(IGFBP6)+w(TXNDC9)Qnorm(TXNDC9), где w(ELOVL5)=-0,72, w(IGFBP6)=- 0,65, w(TXNDC9)=0,55, w0=0,39; Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9) - нормированные количественные оценки представленности генов, и оценкой уровня риска путем сравнения коэффициента риска рецидива с предустановленными порогами:
при получении значения SR больше 0,2 - делают вывод о высоком риске возникновения рецидива, при значении SR меньше -0,2 - делают вывод и низком риске возникновения рецидива, при получении значения SR в интервале от -0,2 до 0,2 - считают риск неопределенным.
Предпочтительно для проведения ПЦР использовать прямые и обратные геноспецифические праймеры с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6 соответственно, и зондами с последовательностями SEQ ID NO: 7-9.
Предпочтительно нормирование результатов ПЦР осуществлять с использованием пар геноспецифических праймеров с последовательностями SEQ ID NO: 10-19 и зондами с последовательностями SEQ ID NO: 20-24.
В другом аспекте изобретение относится к набору реагентов для оценки экспрессии генов-маркеров при проведении ПЦР, включающему, по крайней мере, 3 пары праймеров к генам с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6 - прямые и обратные, соответственно, и зондами с последовательностями SEQ ID NO: 7-9, специфичными по отношению к генам-маркерам ELOVL5, IGFBP6, TXNDC9, представленных в лиофилизированном виде или водном растворе.
Изобретение также относится к планшету с набором реагентов для проведения ПЦР реакции при определении риска возникновения рецидива онкологических заболеваний молочной железы у человека, содержащему нанесенные на лунки микропланшета геноспецифические олигонуклеотидные праймеры прямые и обратные с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 4-6 соответственно, в лиофилизированном виде (прямой и обратный) и флуоресцентные зонды с последовательностями SEQ ID NO: 7-9.
Предпочтительно, что праймеры содержатся в концентрации 250 нМоль.
Предпочтительно, что флуоресцентный зонд содержит краситель FAM с параметрами возбуждения на длине волны 485 нм и эмиссии на длине волны 520 нм, взятый в концентрации 250 нМ.
В другом аспекте изобретение относится к набору реагентов для определения риска возникновения рецидива онкологических заболеваний молочной железы у человека, включающем реагенты для выделения и очистки РНК из образца опухолевой ткани; реагенты для синтеза одноцепочечной кДНК на мРНК с использованием олигонуклеотидных праймеров; реагенты для оценки экспрессии генов; буферы для проведения ПЦР, при этом в качестве реагентов для оценки экспрессии генов-маркеров используют набор или планшет.
Изобретение также относится к способу оценки уровня экспрессии (количественной оценки представленности) генов-маркеров ELOVL5, IGFBP6, TXNDC9, полученной при проведении ПЦР для определения риска возникновения рецидива онкологических заболеваний молочной железы у человека, характеризующемуся тем, что измеряют пороговые циклы для генов-маркеров и нормировочных генов, по ним получают ненормированные количественные оценки представленности генов-маркеров Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) и затем вычисляют нормированные количественные оценки представленности Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9), и получения на основе этих оценок риска рецидива SR с последующим построением прогноза риска рецидива R, осуществляемым путем сравнения коэффициента риска SR с предопределенными пороговыми значениями. При этом ПЦР проводят с использованием праймеров и зондов, специфичных по отношению к генам-маркерам, праймеров с последовательностями SEQ ID NO: 1-3 и SEQ ID NO: 3-6, и зондов с последовательностями SEQ ID NO: 7-9, соответственно, а также праймеров и зондов, специфичных по отношению к генам FBXO42, GUSB, HCFC1, RPLP0 и ТРТ1 для нормирования результатов ПЦР, праймеров с последовательностями SEQ ID NO: 10-19 и зондов с последовательностями SEQ ID NO: 20-24, соответственно, коэффициент SR определяют по формуле:
SR=w0+w(ELOVL5)Qnorm(ELOVL5)+w(IGFBP6)Qnorm(IGFBP6)+w(TXNDC9)Qnorm(TXNDC9), где w(ELOVL5)=-0,72, w(IGFBP6)=-0,65, w(TXNDC9)=0,55, w0=0,39; Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9) - нормированные количественные оценки представленности генов-маркеров;
при этом в качестве пороговых значений для построения риска рецидива РМЖ используют два значения (0,2 и -0,2), и при получении значения SR больше 0,2 - делают вывод о высоком риске рецидива, при значении SR меньше -0,2 - делают вывод и низком риске рецидива, при получении значения SR в интервале от -0,2 до 0,2 - считают риск неопределенным.
В другом аспекте изобретение относится к способу оценки экспресии (количественной оценки представленности) генов-маркеров ELOVL5, IGFBP6, TXNDC9 методом микрочипового анализа для определения риска возникновения рецидива онкологических заболеваний молочной железы у пациента, характеризующийся тем, что на основе микрочипового анализа опухолевой ткани получают ненормированную количественную оценку представленности генов-маркеров Q(ELOVL5), Q(IGFBP6), Q(TXNDC9), затем вычисляют нормированные количественные оценки представленности генов маркеров Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9), на основе которых определяют значение коэффициента риска рецидива SR, по которому строят прогноз риска рецидива R путем сравнения полученного коэффициента риска рецидива SR с предопределенными пороговыми значениями. При этом при использовании микрочипового анализа осуществляется предобработка полученных данных с использованием метода RMA совместно с нормировочным набором или с использованием метода fRMA, а коэффициент SR определяют по формуле:
SR=w0+w(ELOVL5)Qnorm(ELOVL5)+w(IGFBP6)Qnorm(IGFBP6)+w(TXNDC9)Qnorm(TXNDC9), где w(ELOVL5)=-0,72, w(IGFBP6)=-0,65, w(TXNDC9)=0,55, w0=0,39; Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9) - нормированные количественные оценки представленности генов-маркеров;
при этом в качестве пороговых значений для построения риска рецидива РМЖ используют два значения (0,2 и -0,2), и при получении значения SR больше 0,2 - делают вывод о высоком риске рецидива, при значении SR меньше -0,2 - делают вывод и низком риске рецидива, при получении значения SR в интервале от -0,2 до 0,2 - считают риск неопределенным.
В другом аспекте изобретение относится к носителям информации, содержащим записанные на них программы, реализующие способы количественной оценки представленности генов-маркеров ELOVL5, IGFBP6, TXNDC9 методом ПЦР-РВ и методом микрочипового анализа.
Краткое описание чертежей
На фиг. 1 представлены последовательности прямых и обратных геноспецифических праймеров (последовательности SEQ ID NO: 1-3 и SEQ ID NO: 4-6).
На фиг. 2 представлены последовательности зондов (SEQ ID NO: 7-9).
На фиг. 3 представлены последовательности геноспецифических праймеров для нормирования результатов ПЦР (SEQ ID NO: 10-19) и зондами (SEQ ID NO: 20-24).
На фиг. 4 представлена схема лунок Планшета.
На фиг. 5 представлены а) кривые Каплана-Мейера и б) ROC-кривая, построенные по валидационной выборке и подтверждающие работоспособность заявленного метода.
Осуществление изобретения
В изобретении представлены новые молекулярно-генетические маркеры для прогноза безрецидивной выживаемости после хирургического удаления первичной опухоли люминальной формы рака молочной железы, основанного на определении количественных оценок представленности мРНК 3 генов: ELOVL5, IGFBP6, TXNDC9. Это простой, надежный способ прогноза безрецидивной выживаемости на разных стадиях развития злокачественной трансформации, включая начальные. Функционал экспрессии 3 генов позволяет с высокой степенью достоверности оценить риск развития рецидива в первые пять лет после хирургического удаления первичной опухоли люминальной формы РМЖ.
В качестве образцов для проведения анализа могут быть использованы биоптаты, в том числе материал, полученный при игольчатой биопсии опухоли молочной железы.
Способы выделения суммарной РНК из образцов тканей млекопитающих хорошо известны специалистам и, как правило, включают следующие стадии: измельчение в жидком азоте образцов опухолевых и нормальных тканей, лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия или в денатурирующем полиакриламидном геле, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков тканей проводят вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например, Omni Mixer или Micro-Dismembrator U фирмы Sartorius (Германия). Для выделения РНК используют различные протоколы, широко известные специалистам в данной области. В классических методах выделения РНК используют сильные хаотропные агенты, такие как гуанидинхлорид и гуанидинизотиоцианат, растворяющие белки, и последовательные экстракции фенолом и хлороформом для денатурации и удаления белков [Sambrook J., Fritsch E.F., Maniatis Т., Molecular Cloning. A laboratory Manual 2nd Edition ed. 1989, Cold Spring Harbour: CSHL Press]. Широко используют также метод с применением реагента Trizol [GIBCO/Life Technologies]. Для предотвращения разрушения РНК РНКазами используют ингибиторы, такие как игибитор RNAsin плацентарного или рекомбинантного происхождения, или, например, ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Быстрое и качественное выделение РНК проводят с использованием ряда коммерчески доступных наборов (Клоноген, Санкт-Петербург; RNeasy kits (Qiagen); SV Total RNA Isolation System, Promega (США) и т.д.). Использование различных приборов, например, QuickGene-810 (Life Science, Япония), позволяет исключить работу с агрессивными агентами, ускорить и упростить выделение РНК. Для экстракции РНК в этом приборе используют 80 мкм пористую мембрану, которая в 12,5 раз тоньше обычно используемого в таких приборах стеклянного фильтра (1000 мкм), что позволяет уменьшить деградацию РНК и увеличить ее выход.
Реакцию обратной транскрипции, в результате которой на РНК-матрице синтезируют одноцепочечную цепь ДНК, проводят с использованием коммерчески доступных препаратов обратных транскриптаз, таких как обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), С.Therm Polymerase и др., с помощью которых можно получать продукты амплификации длиною до нескольких тысяч и даже несколько десятков тысяч пар нуклеотидов (т.п.н.). Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Для обратной транскрипции использованы различные праймеры, например:
1) Олиго(dT)-содержащие праймеры связываются с эндогенным полиА-хвостом на 3'-конце мРНК. Эти праймеры наиболее часто используют для получения полноразмерных кДНК. К олиго(dT)-последовательности часто добавляют на 3'-конце нуклеотиды A, C или G, чтобы «заякорить» праймер на границу транскрипта и поли-A тракта;
2) Случайные гексануклеотидные праймеры (статистические затравки) гибридизуются с РНК в многочисленных участках. При обратной транскрипции с этими праймерами получают короткие кДНК. Случайные гексамеры используют для преодоления трудностей, связанных со вторичной структурой РНК, они более эффективны при обратной транскрипции 5'-областей мРНК;
3) Гексамеры или другие короткие олигонуклеотиды (10-12 нуклеотидов) случайного состава могут быть также использованы в комбинации с олигоГГ-содержащими праймерами;
4) Специфические олигонуклеотидные праймеры используют для транскрипции участка мРНК, представляющего интерес для исследования. Эти праймеры успешно применяют для диагностических целей.
Выбор специфических праймеров и зондов осуществляют способом, хорошо известным специалистам в данной области, для чего используют имеющиеся программы, многие из которых находятся в свободном доступе в Интернете, например, Genome Browser Gateway, BLAST, Primer3 и др.
Высокая специфичность ПЦР-РВ обеспечивается за счет использования зонда, содержащего на 5'-конце флуорофор или флуоресцентный краситель (в данном случае, FAM-6-carboxy-fluoroscein), а на 3'-конце - т.н. гаситель (в данном случае - RTQ1). В процессе ПЦР их взаимодействие нарушается за счет расщепления зонда Taq ДНК полимеразой благодаря ее 5'-экзонуклеазной активности, при этом происходит эмиссия флуоресценции. Подбор зондов для проведения ПЦР-РВ осуществляется в соответствии со стандартными рекомендациями и требованиями метода.
В предпочтительном варианте осуществления изобретения могут быть использованы праймеры и зонды SEQ ID NO: 1-24 (фиг. 1, 2 и 3).
При оценке уровня мРНК генов на вход поступает соответствующий результатам одного ПЦР-исследования биологического образца набор значений пороговых циклов Cp (p=1, 2, …, 24), где значение порогового цикла Cp соответствует пробе (лунке Планшета) p, пробы 1-3 соответствуют гену ELOVL5, пробы 4-6 - гену IGFBP6, пробы 7-9 - гену TXNDC9, пробы 10-12 - гену FBXO42, пробы 13-15 - гену GUSB, пробы 16-18 - гену HCFC1, пробы 19-21 - гену RPLP0 и пробы 22-24 - гену ТРТ1. При этом известными считаются соответствующие используемым праймерам эффективности ПЦР: E(ELOVL5), E(IGFBP6), E(TXNDC9), E(FBXO42), E(GUSB), E(HCFC1), E(RPLP0) и E(TPT1). Для праймеров SEQ ID NO: 1-6, 10-19 эти значения эффективностей ПЦР равны соответственно 1,842, 1,914, 1,807, 1,885, 1,870, 1,904, 1,889 и 1,765.
Сначала по значениям пороговых циклов определяют количество соответствующих транкриптов в отдельности по каждой пробе, соответствующей одному из генов-маркеров ELOVL5, IGFBP6, TXNDC9. Для этого для каждой из проб p=1, 2, 3 вычисляют величину пропорциональную количеству мРНК ELOVL5 в исследуемом образце, по формуле
Аналогичным образом для каждой из проб p=4, 5, 6 вычисляют величину пропорциональную количеству мРНК IGFBP6 в исследуемом образце по формуле
а для каждой из проб p=7, 8, 9 вычисляют величину пропорциональную количеству мРНК TXNDC9 в исследуемом образце по формуле
В приведенных формулах нормировка основывается на подходе, связанном с усреднением, использующим среднее геометрическое [Д.В. Ребриков, Г.А. Саматов, Д.Ю. Трофимов, П.А. Семенов, A.M. Савилова, И.А. Кофиади, Д.Д. Абрамов ПЦР «в реальном времени» - Москва: БИНОМ. Лаборатория знаний, 2009, п. 8.4; J. Vandesompele, K. De Preter, F. Pattyn, В. Poppe, N. Van Roy, A. De Paepe, F. Speleman Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes // Genome Biol., 2002, 3 (7): RESEARCH0034]. При этом для нормировки проб, ассоциированных с каждым из генов-маркеров, используется поднабор нормировочных генов с количеством мРНК по порядку наиболее близким к среднему количеству мРНК соответствующего гена-маркера.
Повторно используя усреднение, основывающееся на среднем геометрическом, в качестве ненормированной количественной оценки представленности гена-маркера ELOVL5 в образце биологического материала, берут среднее геометрическое по всем пробам, соответствующим этому гену:
Аналогично в качестве ненормированной количественной оценки представленности гена-маркера IGFBP6 в образце биологического материала, берут среднее геометрическое по всем пробам, соответствующим этому гену:
в качестве ненормированной количественной оценки представленности гена-маркера TXNDC9 в образце биологического материала, берут среднее геометрическое по всем пробам, соответствующим этому гену:
Для уменьшения вычислительных погрешностей вычисления и Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) могут осуществляться с использованием перехода в логарифмическую шкалу.
После того как в рамках исследования образца биологического материала вычислены значения ненормированных количественных оценок представленности Q(ELOVL5), Q(IGFBP6), Q(TXNDC9), прогнозирование риска рецидива осуществляется применением линейного классификатора. На первом шаге осуществляется переход в логарифмическую шкалу и линейная нормировка: вычисляются нормированные количественные оценки представленности
Qnorm(ELOVL5)=(log2Q(ELOVL5)-bELOVL5)/aELOVL5;
Qnorm(IGFBP6)=(log2Q(IGFBP6)-bIGFBP6)/aIGFBP6;
Qnorm(TXNDC9)=(log2Q(TXNDC9)-bTXNDC9)/aTXNDC9.
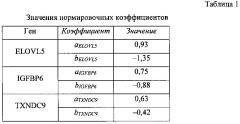
Нормировочные коэффициенты a и b выбираются на стадии калибровки системы таким образом, что для каждого гена-маркера ELOVL5, IGFBP6, TXNDC9 эмпирическое среднее величины Qnorm равно нулю, а эмпирическое среднеквадратическое отклонение - единице. Значения нормировочных коэффициентов могут зависеть от оборудования, используемого при проведении ПЦР-РВ, и коллекции образцов, по которой вычислялись эмпирические среднее и среднеквадратичное отклонения. Возможные значения нормировочных коэффициентов приведены в табл. 1.
Далее осуществляется вычисление коэффициента риска рецидива РМЖ SR:
SR=w0+w(ELOVL5)Qnorm(ELOVL5)+w(IGFBP6)Qnorm(IGFBP6)+w(TXNDC9)Qnorm(TXNDC9).
Значения весовых параметров w0, w(ELOVL5), w(IGFBP6), w(TXNDC9) приведены в табл. 2.
По значению SR осуществляется окончательное построение прогноза риска рецидива R: при значении больше 0,2 делают вывод о высоком риске рецидива, при значении меньше -0,2 делают вывод о низком риске рецидива, при значении между -0,2 и 0,2 считают риск неопределенным.
Формально, оба шага, осуществляемых при переходе от ненормированных количественных оценок представленности Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) к коэффициенту риска рецидива SR, могут быть объединены в один, заключающийся в вычислении линейной комбинации логарифмов этих величин. Однако разбиение на два шага позволяет в рамках рассматриваемой системы при изменении используемого оборудования или даже используемого метода оценки количественной представленности генов-маркеров осуществлять пересчет только нормировочных параметров ag и bg, сохраняя значения весовых параметров w0 и w(ELOVL5), w(IGFBP6), w(TXNDC9).
Это актуально, в частности, при оценке количественной представленности генов-маркеров с помощью микрочипового анализа. В этом случае изменяется только способ вычисления нормированной количественной оценки представленности Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9), а переход от этих оценок к коэффициенту риска рецидива SR и последующее построение прогноза риска R осуществляются в точности способом, описанным выше.
При оценке количества транскриптов, соответствующих генам-маркерам, с помощью микрочипового анализа, сначала осуществляется предобработка микрочипа, совместная со стандартным нормирующим набором микрочипов. Предобработка осуществляется с использованием метода RMA (Irizarry R.A. и др. Exploration, normalization, and summaries of high density oligonucleotide array probe level data // Biostatistics. 2003. T. 4 C. 249-264). В случае применения микрочипов Affymetrix Human Genome U133A Array в качестве стандартного нормирующего набора микрочипов может использоваться коллекция GSE17705 (Symmans W.F. et al. Genomic index of sensitivity to endocrine therapy for breast cancer // J. Clin. Oncol. 2010. T, 28, №27. C. 4111-4119. Использование стандартного нормирующего набора необходимо для приведения результатов предобработки разных микрочипов в единую шкалу. Альтернативой использования стандартного нормирующего набора микрочипов является использование для предобработки метода fRMA (McCall M.N., Bolstad В.М., Irizarry R.A. Frozen robust multiarray analysis (fRMA) // Biostatistics. 2010. Т. 11, №2. C. 242-253.).
После предобработки в качестве ненормированных оценок количественной представленности транскриптов Q(ELOVL5), Q(IGFBP6), Q(TXNDC9) берут полученные в результате предобработки значения, ассоциированные с соответствующими генам-маркерам наборами проб микрочипа. Значения берутся в стандартной (нелогарифмической) шкале. Далее осуществляется переход к нормированным количественным оценкам представленности генов-маркеров Qnorm(ELOVL5), Qnorm(IGFBP6), Qnorm(TXNDC9). Схема этого перехода аналогична описанной выше, отличие заключается в используемых для нормировки коэффициентах:
Значения нормировочных коэффициентов, соответствующие микрочиповой технологии Affymetrix Human Genome U133A Array и нормировочному набору GSE17705, приведены в табл. 3.
Следует отметить, что отбор транскриптов, используемых непосредственно для формирования прогноза, осуществлялся на основе анализа данных о полногеномном транскриптоме более чем 400 пациентов, для которых имелась информация о возникновении и времени диагностирования рецидива (наборы данных GSE6532, GSE12093, GSE17705), а также собственных данных полногеномного транскриптомного анализа более чем 250 образцов тканей, пораженных РМЖ. В основе отбора лежало построение бинарного (двухклассового) классификатора, различающего пациентов, у которых был диагностирован рецидив, и пациентов, у которых рецидив диагностирован не был. При этом при построении обучающей выборки из рассмотрения была исключена так называемая «серая зона»: в первый класс были включены лишь пациенты, у которых рецидив был диагностирован в течение первых пяти лет после оперативного лечения, а во второй пациенты, у которых продолжительность безрецидивного периода составляла не менее семи лет.
При фиксированном наборе транскриптов для автоматизированного построения классификатора, использующего в точности этот набор транскриптов, применялся метод опорных векторов (SVM Supprot Vector Machine, см. С. Cortes, V. Vapnik Support-vector networks // Machine Learning, Vol. 20 (1995), 273-297) с линейным ядром и различными штрафами за ошибки разного рода.
Формирование итогового набора транскриптов осуществлялось автоматизированно с использованием полного перебора пар транскиптов и последующего достроения наиболее информативных пар до троек; достроение проводилось с использованием так называемого «жадного подхода», включающего добавление одного транскрипта к паре и последующей покомпонентной оптимизации (Galatenko V.V. и др. Highly informative marker sets consisting of genes with low individual degree of differential expression // Sci. Rep. 2015. T. 5. C. 14967; Галатенко В.В. и др. О построении медицинских тест-систем с использованием жадного алгоритма и метода опорных векторов // Бюллетень экспериментальной биологии и медицины. 2013. Т. 156. №11. С. 654-60).
Валидация итогового набора транскриптов и соответствующего этому набору классификатора осуществлялась на валидационной выборке, образцы которой не использовались ни при отборе транскриптов, ни при настройке классификатора: обучающие и валидационная выборки не пересекались не только по пациентам, но и по клиникам, в которых осуществлялся забор биоматериала, и по лабораториям, в которых проводились исследования этого биоматериала.
Осуществление изобретения
Изобретение поясняется следующими примерами осуществления.
Пример 1.
В примере представлена реализация способа оценки риска возникновения рецидива рака молочной железы у пациентки Инны У. на основе ПЦР-РВ.
Выделение РНК:
а) брали образец биопсии опухолевой ткани молочной железы, законсервированный Реагентом для стабилизации мРНК;
б) анализируемый фрагмент биопсии опухолевой ткани молочной железы извлекали пинцетом из Реагента для стабилизации мРНК в предварительно подготовленную охлажденную фарфоровую ступку. Повторно охлаждали ступку и пестик жидким азотом до состояния, когда азот уже почти не испаряется;
в) осуществляли механическое дробление/перетирание образца в ступке;
г) добавляли в ступку 700 мкл Буфера А и 20 мл жидкого азота. Перетирали до получения однородной розоватой пудры. По завершению давали возможность ступке нагреться до комнатной температуры, а образцу растаять;
д) переносили все содержимое ступки в чистую пробирку на 1,5 мл и доводили объем гомогената до 1 мл, добавив 300 мкл Буфера А.
е) проводили стадию дополнительной гомогенизации. Для этого переносили 500 мкл гомогената на колонку QIAAshredder (Qiagen) или аналогичную. Центрифугировали 2 минуты при скорости >10000 об/мин. Раствор, прошедший через колонку, аккуратно отбирали в чистую пробирку. Повторяли процедуру для оставшегося образца. Объединяли гомогенизированные фракции;
ж) добавляли к образцу 200 мкл хлороформа и тщательно перемешивали на вортексе 15 сек. Инкубировали при комнатной температуре 2-3 мин;
и) центрифугировали при 4°C в течение 15 минут при 12000 об/мин;
к) переносили водную фазу (верхняя, неокрашенная) в чистую пробирку на 1.5-2 мл и определяли ее объем;
л) добавляли 1,5 объема от перенесенной водной фазы 100% этанола. Хорошо перемешивали с помощью пипетки;
м) переносили 500 мкл образца, включая осадок, если он выпал, на колонку RNeasy mini spin или аналогичную. Центрифугировали 15 сек при скорости >10000 об/мин. Удаляли раствор, прошедший через колонку;
н) повторяли предыдущий шаг для оставшегося раствора (с использованием той же самой колонки);
п) наносили на колонку 350 мкл Буфера В и центрифугировали 15 сек при скорости >10000 об/мин. Удаляли раствор, прошедший через колонку;
р) обрабатывали DNaseI. Переносили 80 мкл приготовленного раствора DNaseI на колонку RNeasy mini spin или аналогичную и инкубировали 15 мин при 20-30°C;
с) повторяли пункт п);
т) наносили на колонку 500 мкл Буфера Б, центрифугировали 15 сек при скорости >10000 об/мин. Удаляли раствор, прошедший через колонку;
у) добавляли 500 мкл Буфера Б на колонку и центрифугировали 2 мин при скорости >10000 об/мин;
ф) осторожно переносили колонку в чистую про