Неорганический пирофосфат и его применение
Иллюстрации
Показать всеИзобретение относится к области медицины и ветеринарии. Добавка для стимулирования спермы содержит неорганический пирофосфат (PPi) в количестве примерно между 1 мкМ и примерно 200 мкМ. Добавление PPi в среды для оплодотворения in vitro людей/животных (IVF) улучшает долю оплодотворения; добавление PPi в разбавитель семени для искусственного осеменения (AI) сельскохозяйственных животных может улучшить долю забеременевших; кроме того, ооциты млекопитающих, созревающие in vitro в среде, содержащей PPi, приобретают улучшенный потенциал оплодотворения и развития, в то время как эмбрионы, культивируемые в среде, дополненной PPi, имеют улучшенное развитие до бластоцистов. 9 н. и 11 з.п. ф-лы, 25 ил., 10 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет временной заявки на патент США, серийный № 61/630345, поданной 9 декабря 2011 года, полное описание которой включается в настоящий документ посредством ссылки.
ИНФОРМАЦИЯ ОТНОСИТЕЛЬНО ИССЛЕДОВАНИЙ, СПОНСИРУЕМЫХ
ФЕДЕРАЛЬНЫМ ПРАВИТЕЛЬСТВОМ
Настоящее изобретение осуществлено при правительственной поддержке согласно грантам №№ 2007-35203-18274 и 2011-67015-20025 от USDA National Institute of Food and Agriculture (USDA-NIFA). Правительство имеет определенные права на настоящее изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композиции и к способу ее применения для искусственного осеменения. Более конкретно, настоящее изобретение относится к добавке для стимуляции спермы для использования при искусственном осеменении сельскохозяйственных животных и при оплодотворении in vitro и в эмбриональной культуре в клиниках для лечения бесплодия у людей.
УРОВЕНЬ ТЕХНИКИ
Искусственное осеменение (AI) представляет собой распространенную технологию при разведении свиней и крупного рогатого скота. Семя борова непосредственно после эйакуляции должно храниться в растворе разбавителя для консервации при 15- 18°C или 4-5°C, а семя быка должно разбавляться перед криоконсервированием и хранением в жидком азоте. Разработаны разнообразные типы растворов разбавителей и соединений для уменьшения метаболической активности спермы и для создания возможности для консервации в разбавленном виде. Однако необходимы новые и улучшенные среды для культивирования и/или разбавители спермы для улучшения искусственного осеменения у животных и для оплодотворения in vitro и эмбриональной культуры у людей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из аспектов, настоящее изобретение предлагает среды для консервации спермы, содержащие неорганический пирофосфат (PPi). В одном из вариантов осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 200 мкМ. В другом варианте осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 20 мкМ. В другом варианте осуществления, концентрация PPi составляет примерно 10 мкМ. Еще в одном варианте осуществления, среда для консервации используется для консервации спермы свиней.
В другом аспекте, настоящее изобретение предлагает среды для переноса спермы, содержащей неорганический пирофосфат (PPi). В одном из вариантов осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 200 мкМ. В другом варианте осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 20 мкМ.
Другой аспект настоящего изобретения предлагает среды для оплодотворения in vitro (IVF) или искусственного осеменения (AI), содержащие неорганический пирофосфат (PPi). В одном из вариантов осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 200 мкМ. В другом варианте осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 20 мкМ.
В другом аспекте, настоящее изобретение предлагает способ сексинга спермы, включающий: (a) разделение смешанной суспензии спермы в первой среде для культивирования на популяцию спермы, несущей x-хромосому или несущей y-хромосому, с помощью элюирующей среды; (b) консервацию спермы, несущей x-хромосому или несущей y-хромосому, во второй среде для культивирования, где неорганический пирофосфат (PPi) добавляют в первую среду для культивирования, элюирующую среду или вторую среду для культивирования.
Еще в одном аспекте, настоящее изобретение предлагает способ консервации спермы, включающий хранение сперма в средах, содержащих неорганический пирофосфат (PPi). В одном из вариантов осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 200 мкМ. В других вариантах осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 20 мкМ или концентрация PPi составляет примерно 10 мкМ. Еще в одном варианте осуществления, сперму хранят в средах, содержащих PPi, в течение до 10 дней.
Другой аспект настоящего изобретения предлагает способ оплодотворения in vitro (IVF), включающий приведение в контакт ооцита со спермой в присутствии неорганического пирофосфата (PPi). В одном из вариантов осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 200 мкМ. В другом варианте осуществления, концентрация PPi находится в пределах примерно между 1 мкМ и примерно 20 мкМ. В другом варианте осуществления, сперму хранят в присутствии PPi.
В другом аспекте, настоящее изобретение предлагает способ культивирования эмбрионов, включающий культивирование эмбриона в средах, содержащих неорганический пирофосфат.
Еще в одном аспекте, настоящее изобретение предлагает способ искусственного осеменения, включающий доставку спермы и неорганического пирофосфата (PPi) в половые пути самки. В вариант осуществления, PPi постепенно высвобождается в половых путях самки.
Другой аспект настоящего изобретения предлагает способ созревания ооцита in vitro, включающий культивирование ооцитов в средах, содержащих неорганический пирофосфат.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
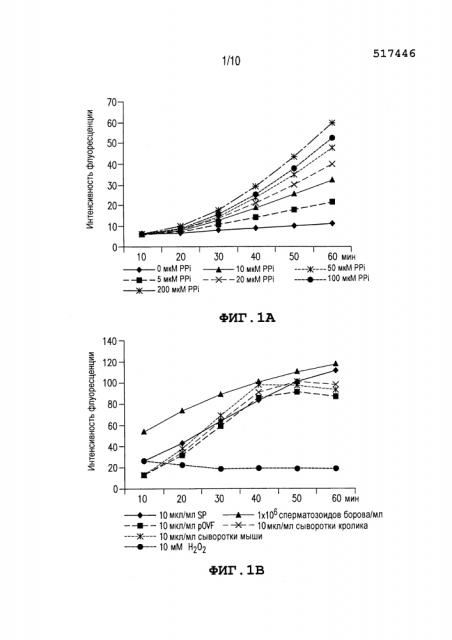
Фиг. 1: Показывает измерение содержания пирофосфата (PPi) с помощью флуорометрического анализа. (A) Интенсивность флуоресценции стандартов PPi (конечная концентрация 0-200 мкМ PPi). (B) Анализ PPi с помощью семенной плазмы борова (SP), овидуктальных жидкостей свиней (pOVF), сыворотки кролика, сыворотки мыши (конечная концентрация 10 мкг/мл), сперматозоидов борова (1×106 сперматозоидов/мл) и 10 мМ рабочего раствора Η2O2 (отрицательный контроль). Интенсивности флуоресценции измеряют во множестве временных точек для отслеживания кинетики реакции (возбуждение на 530 нм; испускание на 590 нм). Эксперименты повторяют три раза. Значения выражают как среднее значение интенсивности флуоресценции.
Фиг. 2: Показывает генерирование PPi. PPi получается посредством гидролиза ATP до AMP в клетках. Неорганическая пирофосфатаза (PPA1) катализирует гидролиз PPi с образованием 2 ортофосфатов (2Pi), с получением в результате высвобождения энергии.
Фиг. 3: Показывает детектирование неорганической пирофосфатаазы (PPA1) с помощью вестерн-блоттинга. Семенную плазму борова (SP; 20 мкг/мл), овидуктальную жидкость свиней (pOVF; 100 мкг/мл) и сперматозоиды борова, быка, мыши и человека (все при 1×106 сперматозоидов/мл) экстрагируют для осуществления анализа белка. Используют одинаковые нагрузки белка. Отдельную полосу при ~32 кДа детектируют с помощью поликлонального антитела кролика анти-PPA1. Очищенную PPA1 (крайняя правая полоса; 1 мкг/мл; Sigma 11643) от S. cerevisiae используют в качестве контрольного белка.
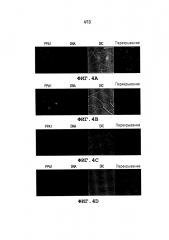
Фиг. 4: Показывает локализацию неорганической пирофосфатаазы (PPA1; красный) в сперматозоидах с помощью иммунофлуоресценции. (A, B) Иммунофлуоресценция от цельного препарата сперматозоидов борова. Наиболее заметное присутствие метки наблюдают в соединительной части хвоста сперматозоида и в постакросомальной оболочке головки сперматозоида. (C) Идентичное присутствие метки наблюдают в сперматозоиде, прикрепившемся к вителлиновому слою ооцита, через 30 мин после гаметического смешивания во время IVF. (D) Отрицательный контроль с помощью антитела анти-PPA1, иммунологически насыщенного с помощью полноразмерного белка PPA1. ДНК контрастно окрашивают с помощью DAPI (голубой). Фотографии эпифлуоресценции перекрываются с фотографиями в парфокальном проходящем свете, полученными с помощью оптики с DIC.
Фиг. 5: Показывает жизнеспособность спермы и митохондриальный мембранный потенциал во время хранения спермы с/без PPi. (A) Проценты жизнеспособных сперматозоидов на основе мечения SYBR14 (живая сперма) и PI (мертвая сперма). (B) Проценты сперматозоидов с поляризованными (живые), деполяризующимися (умирающие) и деполяризованными (мертвые) митохондриальными мембранами. Эксперименты повторяют три раза. Значения выражают как средний процент ± SEM. Различные верхние индексы a и b в каждой группе столбцов означают значимое различие при p≤0,05.
Фиг. 6: Показывает воздействие PPi на протеасомальные ферментные активности хранящихся сперматозоидов борова. Свежие сперматозоиды борова хранят в BTS с 10 мкМ PPi и без него в течение 3 или 10 дней (не обработанные/PPi+BTS). Протеасомальные протеолитические и деубиквитинирующие активности измеряют с использованием специфичных флуорометрических субстратов Z-LLE-AMC (A), Z-LLVY-AMC (B), Z-LLL-AMC (C) и убиквитин-AMC (D). При отдельной обработке, добавляют PPi перед измерением к сперматозоидам, консервируемым без PPi (Добавление PPi). В качестве отрицательного контроля, добавляют 10 мкМ MG132 (протеасомальный ингибитор) к сперматозоидам ʺбез обработкиʺ и ʺPPi+BTSʺ в день 3. Эксперименты повторяют три раза. Значения выражают как среднее значение интенсивности флуоресценции.
Фиг. 7: Показывает воздействие PPi на полное и полиспермное оплодотворение во время IVF свиней. Значения выражают как средние проценты ± SEM. % моноспермные и % полиспермные ооциты. Различные верхние индексы a-c в каждой группе столбцов обозначают значимое различие при p<0,05. Количества не осемененных яйцеклеток указаны в круглых скобках. (A) Ооциты свиней, созревающие in vitro, осеменяют при стандартной концентрации 1×106 сперматозоидов/мл, в присутствии увеличивающихся концентраций PPi. Эксперименты повторяют пять раз. (B) Доли полиспермии, отражающие способность спермы к оплодотворению in vitro (также панель A), кардинально повышаются в присутствии PPi. (C) Доли оплодотворения ооцитов свиньи, осемененных с помощью различных концентраций сперматозоидов в присутствии/отсутствии 10 мкМ PPi. Эксперименты повторяют три раза. (D) Доли оплодотворения ооцитов, осемененных сперматозоидами борова, консервируемыми в течение 3 дней в BTS с/без 10 мкМ PPi. Другие ооциты свиньи осеменяют (концентрация сперматозоидов 5×105 сперматозоидов/мл) с присутствием 10 мкМ PPi и без него, сперматозоидами, хранящимися с PPi и без него. Эксперименты повторяют три раза. (E) Воздействие постороннего фермента PPA1 на IVF свиньи. Ооциты осеменяют при различных концентрациях очищенного белка PPA1. Эксперименты повторяют дважды. (F) Ооциты свиньи осеменяют в присутствии поликлонального антитела кролика анти-PPA1 или неиммунной сыворотки кролика (контроль для антитела PPA1). Эксперименты повторяют дважды.
Фиг. 8: (A) Показывает воздействие PPi на связывание сперматозоид - вителлиновый слой. Ооциты свиньи осеменяют (концентрация сперматозоидов 5×105 сперматозоидов/мл) при различных концентрациях PPi в течение 30 мин, фиксируют и окрашивают с помощью красителя DAPI для ДНК. Количества сперматозоидов, связанных с вителлиновым слоем (ZP), считают под эпифлуоресцентным микроскопом. Значения выражают как среднее значение × SEM. Различные верхние индексы a-c в каждой группе столбцов обозначают значимое различие при p×0,05. Количества не осемененных яйцеклеток показаны в круглых скобках. (B) Процент сперматозоидов панели A с прореагировавшей акросомой (PNA с окрашиванием FITC). Значения выражают как средние проценты × SEM. Различные верхние индексы a и b в каждой группе столбцов обозначают значимое различие при p×0,05. (C) Воздействие дополнения PPi на жизнеспособность сперматозоидов, хранящихся в коммерческих и приготовленных в лаборатории разбавителях на основе BTS. Сперматозоиды борова консервируют в BTS-IMV (Technologies IMV, France) или BTS-HM (приготовлен в лаборатории) с 10 мкМ PPi и без него в течение 7 дней при комнатной температуре. Подвижности сперматозоидов оценивают с помощью наблюдения под световым микроскопом при 37,5°C. Наблюдается подвижность сперматозоидов в BTS-IMV с PPi в день 6, более высокая, чем в любой другой группе. Эксперименты повторяют дважды. Различные верхние индексы a, b в каждой группе столбцов обозначают значимое различие при p<0,05. (D) Добавление избыточных концентраций PPi в среду для IVF. Доли оплодотворения уменьшаются при высоких концентрациях PPi. Эксперименты повторяют дважды. Значения выражают как средние проценты ± SEM. % моноспермные и % полиспермные ооциты. Количества не осемененных яйцеклеток указаны в круглых скобках. (E) Воздействие PPi на оплодотворение с помощью сперматозоидов, хранящихся в коммерческом разбавителе BTS-IMV. Достигается почти 100% оплодотворение с использованием сперматозоидов, консервируемых в BTS-IMV с 10 мкМ PPi (день 3). Эксперименты повторяют дважды. Значения выражают как средние проценты ± SEM. % моноспермные и % полиспермные ооциты. Количества неосемененных яйцеклеток указаны в круглых скобках.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает новые среды и способы консервации спермы, эмбриональной культуры, оплодотворения in vitro (IVF), искусственного осеменения (AI). В частности, настоящее изобретение представляет собой прогресс в данной области в том, что оно сообщает и подтверждает, что неорганический пирофосфат (PPi) существует в сперматозоидах, семенной плазме (SP) и овидуктальных жидкостях (OVF) некоторых видов млекопитающих, хотя предыдущие исследования показали, что концентрация цитозольных PPi прецизионно регулируется в клетках млекопитающих (Baykov et al., Prog Mol Subcell Biol 23: 127-150, 1999; Sivula et al, FEBS Lett 454:75-80, 1999). В одном из аспектов настоящего изобретения, PPi мог бы, следовательно, использоваться в качестве источника энергии для жизнеспособности сперматозоидов.
В одном из вариантов осуществления, настоящее изобретение предлагает новые и улучшенные среды для консервации спермы, также упоминаемые как разбавители спермы, которые могут продлить период хранения семени и поддержать жизнеспособность сперматозоидов и таким образом улучшить AI у животных. Настоящее изобретение также предлагает новые и улучшенные среды для культивирования, для переноса эмбрионов у животных.
В другом варианте осуществления настоящее изобретение предлагает новый и улучшенный способ IVF и AI, а также среды для культивирования для эмбрионов в клинике животных и человека.
Еще в одном аспекте настоящего изобретения описывается новый и улучшенный способ сексинга спермы, использующий PPi. Настоящий способ сексинга спермы включают стадию добавления определенного количества PPi в среды в течение процедуры сексинга спермы для повышения продолжительности жизни и жизнеспособности спермы. Например, в соответствии с определенными вариантами осуществления настоящего изобретения, настоящий способ сексинга спермы может включать стадию добавления PPi в среды для начальной обработки спермы (со сперматозоидами, несущими как x-, так и y-хромосому; перед обычной стадией разделения/сортировки), в элюирующие среды или в среды со спермой, разделенной с помощью сексинга.
Как правило, оттаивающий раствор Белтсвилля (BTS) добавляют к замороженной оттаянной сперме в качестве оттаивающего раствора, и его используют также для хранения в жидком виде в течение 3-5 дней (Johnson et al., Zuchthygiene 23:49-55, 1988). Жидкое семя, разбавленное BTS, обычно используют для AI благодаря его простой композиции и разработанной системе транспортировки. Однако подвижность спермы, консервируемой в разбавителе, последовательно уменьшается во время хранения из-за естественного старения, потери ATP и cAMP, а также из-за пониженного потребления кальция (Johnson et al., Anim Reprod Sci 62 143-172, 2000). Разбавленное семя, хранимое в течение 5 дней после сбора, показывает уменьшение долей опороса приблизительно 50% по сравнению с семенем, консервируемым в течение 2 дней после сбора, которое показывает уменьшение долей опороса приблизительно 65-70% (Johnson et al., Anim Reprod Sci 62 143-172; Johnson et al., Zuchthygiene 23:49-55, 1988; Johnson and Rath, (Eds), Proc. 2nd Int. Conf. Deep Freezing Boar Semen. Reprod. Domest. Anim., Suppl. 1, p. 402, 1991; Rath et al., (Eds) Proc. Int. Conf. Deep Freezing of Boar Semen. Reprod. Domest. Anim. Suppl. 1, p. 342, 1996; Johnson, Proc. 15th Int. Pig Vet. Sci. Congress 1, 225-229, 1998). В последнее время, Yeste et al. (Anim Reprod Sci 108: 180-195, 2008) сообщили, что добавление простагландина F2α (PGF2α) к сперме, разбавленной в BTS, поддерживает лучшую жизнеспособность и подвижность спермы после 6 дней охлаждения.
Неорганический пирофосфат (PPi) представляет собой сильнодействующий, связывающий минеральные вещества низкомолекулярный ингибитор нуклеации и роста кристаллов (Fleisch et al, Nature 212:901-903, 1966) и присутствует во внеклеточном матриксе большинства тканей и телесных жидкостей, включая плазму (Fleisch et al, Am J Physiol 203:671-675, 1962; Russell et al, J Clin Invest 50:961-969, 1971). Метаболизм PPi наблюдают в культивируемых гепатоцитах и хондроцитах (Davidson et al., Biochem J 254:379-384, 1988; Johnson et al., 1999; Rosen et al., Arthritis Rheum 40: 1275-1281, 1997; Rosenthal et al., Calcif Tissue Int 59: 128-133, 1996; Rosenthal et al., J Rheumatol 26:395-401, 1999; Ryan et al., Arthritis Rheum 42:555-560, 1999). Внутриклеточный PPi генерируется в митохондриях, и внутри- и внеклеточные концентрации PPi регулируются с помощью митохондриального метаболизма энергии (Davidson et al., Biochem J 254:379-384, 1988; Johnson et al., Arthritis Rheum 43: 1560-1570, 2000). В прокариотах PPi обеспечивает "высокоэнергетическое" соединение, и он способен замещать ATP в реакциях, родственных гликолизу, при ослабленном дыхании (Chi et al., J Biol Chem 275:35677-35679, 2000). Кроме того, PPi создает митохондриальный мембранный потенциал с помощью PPA (Pereira-da-Silva et al., Arch Biochem Biophys 304:310-313, 1993), и PPi, полученный из ATP, служит в качестве донора фосфатов при фосфорилировании белков в митохондриях дрожжей, а также в клетках млекопитающих (da Silva et al., Biochem Biophys Res Commun 178: 1359-1364, 1991; Terkeltaub et al., Am J Physiol Cell Physiol 281:C1-C11, 2001). Как следствие, PPi может использоваться в качестве источника энергии для жизнеспособности.
Клеточный PPi получается с помощью различных процессов биосинтеза и гидролизуется до двух неорганических фосфатов (Pi) с помощью неорганической пирофосфатазы (PPA1). PPA1 представляет собой распространенный металлзависимый фермент, обеспечивающий термодинамический пул для многих реакций биологического синтеза, таких как синтез ДНК, РНК, белков, полисахаридов, и для жизни клетки (Chen et al., 1990, Lundin et al., 1991, Sonnewald 1992, Lahti 1983, Peller 1976). PPA1 детектируется в бактериях (Chen et al., 1990) и дрожжах (Lundin et al., 1991), и растворимая PPA1 идентифицирована и характеризована в Mycoplasma suis, которые принадлежат к хемотропным бактериям, которые прикрепляются к поверхности эритроцитов-хозяев (Hoelzle et al.). Однако PPi не использовался в каких-либо средах, относящихся к консервации спермы или к процедурам AI или IVF.
Настоящее изобретение идентифицирует путь PPi как важный компонент физиологии сперматозоидов млекопитающих. Обращаясь к Фиг. 2, здесь PPi (P2O74-) образуется посредством гидролиза ATP до AMP в клетках, затем гидролизуется с помощью неорганической пирофосфатазы (PPA1) до двух молекул неорганического ортофосфата (Pi). PPA1, важный фермент для метаболизма энергии (Chen et al., J Bacteriol 172:5686-5689, 1990; Lundin et al., J Biol Chem 266: 12168-12172, 1991), участвует в регуляции метаболизма, роста и развития в растениях (Sonnewald, Plant J 2:571-581, 1992), и даже в развитии и линьке у паразитных круглых червей Ascaris (Islam et al., Infect Immun 73: 1995-2004, 2005). Во время деления клеток S. cerevisiae, PPA1 является самым важным веществом для репликации генома митохондрии (Lundin et al., Biochim Biophys Acta 1098; 217-223, 1992).
В то время как PPA1 детектируется в соединительной части хвоста сперматозоида, в области удерживания центриоли сперматозоида и при фиксации флагеллярных внешних плотных волокон и дублетов микротрубочек, настоящее изобретение говорит, что из этих областей, путь метаболизма PPi может переносить энергию для флагеллярного движения и для акросомальной функции во время проникновения сперматозоида в вителлиновый слой. В добавление к этому, настоящее изобретение также говорит, что путь PPi в головке и жгутике сперматозоида могут поддерживать фосфорилирование белков во время капацитации сперматозоидов, что наблюдается как in vitro, так и in vivo, в овидуктальном резервуаре спермы.
Кроме того, настоящее изобретение описывает способность сперматозоидов млекопитающих к использованию PPi в качестве источника энергии во время переноса сперматозоидов и взаимодействий сперматозоид - яйцеклетка, когда сперматозоиды подвергаются воздействию капацитации, реакции акросомы и проникновения сперматозоида в вителлиновый слой. В настоящее время описано, что PPi можно использовать в качестве стабильного, недорогого источника энергии для улучшения жизнеспособности сперматозоидов во время хранения и переноса семени для биотехнологии больших животных и для повышения доли проникновения сперматозоидов и повышения долей оплодотворения для вспомогательной репродуктивной терапии у некоторых видов млекопитающих (включая людей). Кроме того, настоящее изобретение дополнительно предлагает добавление PPi в среды для культивирования, в разбавитель спермы, в среды для IVF или в среды, используемые при сексинге спермы, с целью обеспечения полезных воздействий при консервации спермы и оплодотворении, таких как увеличение продолжительности жизни и жизнеспособность сперматозоидов, во время консервации и переноса спермы и поддержания и улучшения жизнеспособности, проникновения сперматозоидов и долей оплодотворения во время процедур оплодотворения.
Следовательно, среды по настоящему изобретению могут содержать PPi, концентрация которого может изменяться в зависимости от видов животных. В определенных вариантах осуществления, среда по настоящему изобретению может содержать примерно 1-200 мкМ PPi. В другом варианте осуществления, среда по настоящему изобретению может содержать примерно 1-20 мкМ PPi. Настоящее изобретение можно использовать для различных млекопитающих, включая сельскохозяйственных животных, таких как боров и бык.
Для IVF или AI, PPi можно непосредственно добавлять или постепенно высвобождать в среды. При необходимости, высвобождение PPi может точно контролироваться/модулироваться во время AI, особенно, когда гель для замедленного высвобождения, содержащий PPi, используют в качестве части катетера для AI, для постепенного высвобождения PPi в половых путях самки.
Если не определено иного, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, как обычно понимается специалистами в области, к которой принадлежит настоящее изобретение. Все публикации, заявки на патенты, патенты и другие ссылки, рассмотренные в настоящем документе, включаются в качестве ссылок во всей их полноте.
ПРИМЕРЫ
Следующие далее описанные варианты осуществления являются всего лишь иллюстрациями настоящего изобретения, которое может быть воплощено в различных формах. Таким образом, конкретные структурные, функциональные и процедурные детали, описанные в следующих далее примерах, не должны интерпретироваться в качестве ограничивающих.
Пример 1
Сбор и обработки семени
Семя собирают от проверенных способных к зачатию взрослых боровов Дьюрок в возрасте 15-22 месяцев согласно инструкциям одобренных протоколов Animal Care and Use Committee (ACUC) of University of Missouri-Columbia (UM-C). Для боровов осуществляют рутинную процедуру сбора, по одному сбору в неделю. Обогащенная сперматозоидами фракция эйакулята собирается в изолированную вакуумную емкость. Используют обогащенную сперматозоидами фракцию эйакулятов с более чем 85% подвижных сперматозоидов. Объемы семени определяют с помощью градуированного цилиндра. Концентрации сперматозоидов оценивают с помощью гемоцитометра (Fisher Scientific, Houston, TX). Процент подвижных сперматозоидов оценивают при 38,5° с помощью световой спектроскопии при увеличении 250°. Семя медленно охлаждают до комнатной температуры (20-23°C) за 2 час после сбора и разбавляют разбавителем на основе оттаивающего раствора Белтсвилля (BTS; 3,71 г глюкозы, 0,60 г тринатрия цитрата, 1,25 г этилендиаминтетрауксусной кислоты, 1,25 г бикарбоната натрия, 0,75 г хлорида калия, 0,06 г пенициллина G и 0,10 г стрептомицина в 100,0 мл дистиллированной воды) (Pursel and Johnson, 1975) до конечной концентрации 35×106 сперматозоидов/мл в 100 мл разбавителя BTS. Разбавленное семя хранят в боксах Styrofoam™ при комнатной температуре в течение 10 дней. Если не указано иного, все химикалии, используемые в этом исследовании, покупают от Sigma Chemical Co. (St. Louis, MO).
Пример 2
Сбор и созревание in vitro (IVM) ооцитов свиней
Яичники собирают у препуберантных подсвинков на местной бойне и переносят в лабораторию в теплом боксе (25-30°C). Комплексы кумулюс-ооцит (COCs) освобождают с отсосом от антральных фолликул (диаметром 3-6 мм), промывают три раза в среде HEPES-лактатный буфер Тироде (TL-HEPES-PVA), содержащей 0,01% (масс/объем) поливинилового спирта (PVA), и затем промывают три раза средой для созревания (Abeydeera et al., Biol Reprod 58: 1316-1320, 1998). Каждый раз, 50 в целом COC переносят в 4-луночный планшет (Nunc, Roskilde, Denmark), содержащий 500 мкл среды для созревания, который покрывают сверху минеральным маслом и уравновешивают при 38,5°C с 5% CO2 на воздухе. Среда, используемая для созревания ооцитов, представляет собой среду для культивирования тканей (TCM) 199 (Gibco, Grand Island, NY), дополненную 0,1% PVA, 3,05 мМ D-глюкозы, 0,91 мМ пирувата натрия, 0,57 мМ цистеина, 0,5 мкг/мл LH (L5269, Sigma), 0,5 мкг/мл FSH (F2293, Sigma), 10 нг/мл эпидермального фактора роста (E4127, Sigma), 10% фоликуллярной жидкости свиней, 75 мкг/мл пенициллина G и 50 мкг/мл стрептомицина. После 22 час культивирования ооциты промывают дважды и культивируют в TCM 199 без LH и FSH в течение 22 час при 38,5°C, 5% CO2.
Пример 3
Оплодотворение in vitro (IVF) и культивирование ооцитов свиней
После созревания ооцитов, кумулюсные клетки удаляют с помощью 0,1% гиалуронидазы в среде TL-HEPES-PVA и промывают три раза средой TL-HEPES-PVA и средой с Tris буфером (mTBM) (Abeydeera et al., Biol Reprod 58: 1316-1320, 1998), содержащей 0,2% BSA (A7888, Sigma), соответственно. Затем, 25-30 ооцитов помещают в каждую из четырех 50-мкл капель среды mTBM, которые покрывают минеральным маслом в 35-мм полистироловой чашке для культивирования. Чашкам позволяют уравновеситься в инкубаторе в течение 30 мин, пока не добавляют сперматозоиды для оплодотворения. Один мл жидкого семени, консервируемого в разбавителе BTS, промывают дважды в PBS, содержащем 0,1% PVA (PBS-PVA), при 800 г в течение 5 мин. В конце процедуры промывки, сперматозоиды повторно суспендируют в среде mTBM. После соответствующего разбавления, 50 мкл этой суспензии сперматозоидов добавляют в 50 мкл среды, которая содержит ооциты, с получением конечной концентрации сперматозоидов 1-10×105 сперматозоидов/мл. К каплям для оплодотворения (конечные концентрации: 0-20 мкМ) добавляют различные концентрации неорганического пирофосфата (PPi; S6422, Sigma) во время добавления сперматозоидов. Ооциты инкубируют вместе со сперматозоидами в течение 6 час при 38,5°C, 5% CO2. Через 6 час после IVF, ооциты переносят в 100 мкл NCSU23, содержащего 0,4% BSA (A6003, Sigma), для дальнейшего культивирования в течение 16-20 час.
Пример 4
Иммунофлуоресценция и оценка долей оплодотворения
Сперматозоиды/ооциты фиксируют в 2% формальдегида в течение 40 мин при комнатной температуре, промывают, пермеабилизируют в PBS с помощью 0,1% Triton-X-100 (PBS-TX) и блокируют в течение 25 мин в PBS-TX, содержащем 5% нормальную сыворотку козы. Сперматозоиды/ооциты инкубируют с помощью поликлонального антитела кролика анти-пирофосфатаза 1 (PPA1) (разбавление 1:200; #ab96099, Abeam, San Francisco, CA) или с поликлональным антителом кролика анти-ANKH (разбавление 1:200; #SAB1102581, Sigma) в течение 40 мин, затем инкубируют вместе с антителом козы-анти-кролик (GAR)-IgG-TRITC (разбавление 1/80; Zymed Inc., San Francisco, CA). Для оценки оплодотворения, ооциты/зиготы фиксируют в 2% формальдегиде в течение 40 мин при комнатной температуре, промывают три раза PBS, пермеабилизируют с помощью PBS-TX в течение 40 мин при комнатной температуре и окрашивают с помощью 2,5 мкг/мл DAPI (Molecular Probes, Eugene, OR) в течение 40 мин. Ооциты с двумя или более пронуклеусами и, по меньшей мере, с одним хвостом сперматозоидов в ооплазме регистрируются как оплодотворенные. Для подсчета количества сперматозоидов, связанных с вителлиновым слоем, или сперматозоидов с прореагировавшей акросомой, ооциты фиксируют и окрашивают с помощью DAPI и PNA-FITC с лектином, связывающимся с акросомой (Molecular Probes), через 30 мин после IVF (5×105 сперматозоидов/мл). Регистрацию изображений осуществляют на микроскопе Nikon Eclipse 800 (Nikon Instruments Inc., Melville, NY) с камерой Cool Snap (Roper Scientific, Tucson, AZ) и с программным обеспечением MetaMorph (Universal Imaging Corp., Downington, PA).
Как показано на Фиг. 4, иммунофлуоресценция детектирует четкое мечение PPA1 в соединительной части хвоста сперматозоида и в постакросомальной оболочке сперматозоидов борова. Идентичное мечение обнаруживается в сперматозоидах, прикрепившихся к вителлиновому слою ооцита, через 30 мин оплодотворения in vitro, в то время как отрицательный контроль с антителом анти-PPA1, иммунонасыщенным полноразмерным рекомбинантным белком PPA1, показывает отсутствие такой флуоресценции и никакого мечения непермеабилизированных сперматозоидов.
Пример 5
Вестерн-блоттинг и ииммунофлуоресценция
Для вестерн-блоттинга, экстракты 1×106 сперматозоидов/мл нагружают на полосу. Сперматозоиды промывают в PBS и кипятят вместе с буфером для загрузки (50 мМ Tris [pH 6,8], 150 мМ NaCl, 2% SDS, 20% глицерола, 5% β-меркаптоэтанола, 0,02% бромфенола голубого). Гель-электрофорез осуществляют на гелях с градиентом 4-20% (PAGEr® Precast gels, Lonza Rockland Inc., Rockland, ME), с последующим переносом на PVDF мембраны (Millipore) с использованием системы мокрого переноса Owl (Fisher Scientific) при постоянном напряжении 50 В в течение 4 час. Мембраны последовательно инкубируют вместе с 10% нежирным молоком в течение 1 час, затем с антителами анти-PPA1 или анти-ANKH (разбавление 1:2000) в течение ночи. Затем мембраны инкубируют вместе с HRP-конъюгированным IgG козы анти-кролик (GAR-IgG-HRP; разбавление 1:10000) в течение 1 час. Мембраны взаимодействуют с хемилюминесцентным субстратом (SuperSignal, Pierce, Rockford, IL) и визуализируются посредством экспонирования для пленки Kodak BioMax Light (Kodak, Rochester, NY).
PPA1 детектируют в семенной плазме млекопитающих, в овидуктальной жидкости и в сперме. Как показано на Фиг. 3, полоса белка, соответствующая вычисленной массе PPA1 (32 кДа), детектируется в семенной плазме борова, в овидуктальной жидкости свиней и в сперматозоидах борова, быка, мыши и человека с помощью вестерн-блоттинга с использованием поликлонального антитела кролика анти-PPA1. Малые полосы для более высокой (~51 и 75 кДа) или более низкой массы (~13 кДа у борова и ~18 кДа у быка) наблюдают в каждом образце спермы, вероятно, они соответствуют продуктам посттрансляционной модификации и деградации белков продуктов PPA1. Очищенная PPA1 из пекарских дрожжей (S. cerevisiae), используемая в качестве белка положительного контроля, также показывает дополнительные полосы при 32 и 13 кДа.
Пример 6
Анализ пирофосфата
Измерение пирофосфата (PPi) осуществляют с использованием PiPerТМ Pyrophosphate Assay Kit (Cat. No. P22062, Molecular Probes), следуя протоколу производителя. Образцы приготавливают с использованием реакционного буфера IX (Kit) с семенной плазмой борова (SP), овидуктальными жидкостями свиней (OVF), с сывороткой кролика, сывороткой мыши (конечная концентрация 10 мкг/мл), сперматозоидами борова (1×106 сперматозоидов/мл) и 10 мМ рабочего раствора H2O2 (отрицательный контроль). Стандарт PPi приготавливают посредством разбавления 50 мМ стандартного раствора PPi (конечная концентрация 0-200 мкМ PPi). Рабочий раствор 100 мкМ реагента Amplex® Red содержит 0,02 Ед/мл неорганической пирофосфатазы (PPA1), 4 Ед/мл мальтоза фосфорилазы, 0,4 мМ мальтозы, 2 Ед/мл глюкоза оксидазы и 0,4 Ед/мл HRP. В этой реакции, PPA1 гидролизирует PPi на два неорганических фосфата (Pi). В присутствии Pi, мальтоза фосфорилаза преобразует мальтозу в глюкозу 1-фосфат и глюкозу. Затем глюкоза оксидаза преобразует глюкозу в глюконолактон и H2O2. В присутствии пероксидазы хрена (HRP), H2O2 взаимодействует с реагентом Amplex®Red (10-ацетил-3,7-дигидроксифеноксазин) с генерированием резоруфина, который детектируется с помощью флуоресценции. Пятьдесятимикролитровые образцы загружают в черный 96-луночный планшет (Coster-Corning, Corning, NY), а затем к каждому образцу добавляют 50 мкл рабочих растворов, соответственно. 96-луночный планшет инкубируют при 37,5°C в течение 30 мин, и измеряют флуоресценцию во множестве временных точек для отслеживания кинетики реакции. Интенсивность флуоресценции измеряют с помощью Thermo Fluoroskan Ascent (ThermoFisher Scientific) с использованием длин волн 530 нм для возбуждения и 590 нм для испускания.
Результаты измерения содержания PPi в SP борова, pOVF и сперме борова с помощью флуорометрического анализа показаны на Фиг. 1A и 1B. В качестве стандартов измеряют различные концентрации PPi (0-200 мкМ PPi) и интенсивность флуоресценции повышается в соответствии с повышением концентрации PPi (Фиг. 1A). Интенсивность флуоресценции также повышается в pOVF, SP, сперме, сыворотке мыши и сыворотке кролика. Как показано на Фиг. 1B, сперма борова, сыворотка мыши и сыворотка кролика показывают более высокие интенсивности флуоресценции, чем SP или pOVF, через 40 мин регистрации (98,2-101,1 по сравнению с 83,8 и 85,5). Однако, интенсивности для pOVF, сыворотки мыши и сыворотки кролика постепенно уменьшаются. Только SP и сперма показывают непрерывное увеличение интенсивности флуоресценции во время измерения (интенсивности флуоресценции: 111,5 и 117,7 при 60 мин, p<0,05). Отрицательный контроль, 10 мМ H2O2, показывает уменьшающуюся картину, вероятнее всего, из-за гашения флуоресценции.
Пример 7
Проточный цитометрический анализ жизнеспособности сперматозоидов и митохондриального мембранного потенциала
Сперму борова промывают дважды PBS-PVA, и концентрацию сперматозоидов доводят до 1×106 сперматозоидов/мл в PBS-PVA. Жизнеспособность сперматозоидов оценивают с помощью LIVE/DEAD® Sperm Viability Kit (L-7011, Molecular Probes), который содержит красители ДНК SYBR14 и пропидий йодид (PI), следуя протоколу производителя. Образцы спермы (198 мкл) загружают в 96-луночный планшет. SYBR14 (1 мкл; конечная концентрация 100 нм) и PI (1 мкл; конечная концентрация 12 мкМ) добавляют в образцы спермы и инкубируют в течение 10 мин при 37,5°C в темноте. Проточный цитометрический анализ осуществляют с использованием проточного цитометра Guava EasyCyteTM Plus (Guava Technologies, IMV Technologies, L’Aigle, France). Для каждого образца анализируют 5000 событий с помощью программы Guava ExpressPro Assay с использованием стандартных настроек производителя. Для оценки митопотенциала сперматозоидов, сперматозоиды борова окрашивают JC-1 (Cat. No. 4500-0250, MitoPotential Kit, IMV) и измеряют с использованием настроек производителя. Для отрицательных контролей, добавляют в образцы спермы DMSO или окрашивающий раствор.
Следуя промышленной практике для хранения семени борова, свежее семя борова разбавляют в разбавителе BTS и хранят при комнатной температуре (15-17°C) в течение 10 дней. Основной разбавитель подбирается для кратковременного хранения (3-5 дней); однако период хранения пролонгируется до 10 дней для сравнения жизнеспособности сперматозоидов и митохондриального мембранного потенциала между днями хранения 3 и 10 в присутствии/в отсутствие 10 мкМ PPi. Как описано выше, жизнеспособность сперматозоидов оценивается с помощью проточной цитометрии с использованием набора для оценки жизнеспособности SYBR14/PI, и митопотенциал измеряют с использованием красителя JC-1. Дополнение PPi изменяет гистограммы и вносит разброс в диаграммы флуоресценции, получаемые с помощью указанных выше зондов, и контрольный носитель, DMSO не дает флуоресценции.
Фиг. 5A и 5B сравнивают жизнеспособность сперматозоидов и митохондриальные мембранные потенциалы во время хранения спермы с PPi и без него. Как показано на Фиг. 5A, процент живых сперматозоидов выше в день 3, чем в день 10 (p<0,05), но нет значимого различия между контрольными сперматозоидами и теми, которые дополнены 10 мкМ PPi. В противоположность жизнеспособности, дополнение PPi уменьшает содержание метаболически активных сперматозоидов с поляризованными митохондриальными мембранами в день 3 (Фиг. 5B). Сходная тенденция наблюдается для сперматозоидов, консервируемых с помощью 10 мкМ PPi в течение 10 дней (Фиг. 5B).
Пример 8
Измерение протеасомальной-протеолитической активности
Протеасомальные-протеолитические и деубиквитинирующие активности, которые являются главными для оплодотворения, анализируют с использованием специфичных флуорометрических субстратов Z-LLL-AMC, Z-LLVY-AMC, Z-LLE-AMC и убиквитин-AMC в сперматозоидах, хранящихся в течение 3 и 10 дней, с PPi или без него. Альтернативно, 10 мкМ PPi+BTS добавляют в семя, консервируемое без PPi, во время анализа (обработка ʺдобавление PPiʺ). В качестве отрицательного контроля, к образцам спермы перед анализом добавляют 10 мкМ MG132 (протеасомального ингибитора).
Сперматозоиды, консервируемые в BTS с 10 мкМ PPi и без него, загружают в 96-луночный черный планшет (конечная концентрация сперматозоидов 1×10