Штамм бактерий lactobacillus rhamnosus, обладающий широким спектром антагонистической активности по отношению к патогенным и условно-патогенным микроорганизмам
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Штамм бактерий Lactobacillus rhamnosus 24 дс, обладающий антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам, в том числе по отношению к дрожжевым грибам рода Candida, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационным номером ВКПМ В-12596 и может быть использован в производстве пробиотических бактерийных препаратов, биологически активных добавок к пище, кисломолочных ферментированных и неферментированных пищевых продуктов. 1 ил., 7 табл., 2 пр.
Реферат
Изобретение относится к биотехнологии, пищевой и медицинской промышленности и может быть использовано в производстве препаратов, содержащих живые бактерии, биологически активных добавок к пище, кисломолочных ферментированных и неферментированных пищевых продуктов.
В настоящее время актуальной и важной задачей является разработка новых антимикробных препаратов пробиотиков, содержащих новые, нетоксичные, биодоступные штаммы микроорганизмов, которые можно в виде моно- и смешанных культур использовать в составе пробиотических препаратов и пищевых продуктов. Пробиотические культуры различаются между собой по спектру и по силе действия, адгезивности, чувствительности к антимикробным препаратам, устойчивости к действию желчи, пищеварительным ферментам, особенностям роста на питательных средах, способности сквашивать молоко и т.д.
При долечивании различных острых кишечных инфекций и при дисбактериозах различной этиологии широкое применение находит пробиотический препарат Лактобактерин, в основе которого лежит штамм Lactobacillus plantarum 8А-Р3 [Журн. микробиол. 2004. №1. С. 84-92] Однако при лечении острых кишечных заболеваний данный препарат недостаточно эффективен.
Известен ряд пробиотических штаммов Lactobacillus salivarius (RU 2302458). Данные штаммы выделены из резецированного и промытого ЖКТ человека и обладают антагонизмом по отношению к L.innocua, L.fermentum KLD, P.fluorescens, E.coli V 157. Штаммы характеризуются чувствительностью к ряду антибактериальных препаратов (ампициллин, амоксациллин, цефтаксим, цефтриаксон, ципрофлоксацин, цефрадин, рифампицин, хлорамфе-никол), резистентны к физиологическим концентрациям соляной кислоты и желчи, обладают способностью адгезироваться к эпителиальным клеткам ЖКТ. Однако спектр их антагонистической активности не включает дрожжеподобные грибы рода Candida, что является актуальным на сегодняшний день.
Задачей изобретения является расширение номенклатуры штаммов, обладающих антагонистической активностью.
Поставленная задача решена тем, что получен штамм Lactobacillus rhamnosus , отличающийся высокой антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам, в том числе по отношению к дрожжевым грибам рода Candida.
Штамм Lactobacillus rhamnosus выделен из ротовой жидкости здоровой школьницы Елисеевой Ани в возрасте 7 лет, г. Твери, которая на момент обследования была клинически здорова, не имела в анамнезе инфекционных и соматических заболеваний желудочно-кишечного тракта и других систем органов, в октябре 2006 г. на базе бактериологической лаборатории кафедры микробиологии, вирусологии и иммунологии ГБОУ ВПО Тверской ГМУ Минздрава РФ. Штамм получен путем выделения чистой культуры в результате раститровки исследуемого материала и посева на оптимальные питательные среды (MRS агар, лакто-агар, MRS бульон). Культивирование осуществляли без использования методов генетической модификации при температуре 37°C 24 часа в эксикаторе со свечой при повышенном содержании CO2.
Полученный штамм депонирован во Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИгенетика (Москва, 1-ый Дорожный пр., д. 1) и имеет регистрационный номер ВКПМ В-12596.
Полученный штамм характеризуется следующими признаками.
Культурально-морфологические признаки.
Выросшие колонии имели следующие культуральные свойства: колонии S-формы 1-2 мм, выпуклые, гладкие, светло-желтого или белого цвета с ровными краями. Морфологические и тинкториальные свойства: грамположительные неподвижные палочки короткие и длинные с закругленными концами, некоторые расположены в цепочку.
Размеры клеток варьируют при росте на различных питательных средах в интервале 0,5-1,2×1,0-10 мкм.
При выращивании на MRS агаре (Difco™ Lactobacilli MRS Agar, BD) и лакто-агаре (ФГУН Государственный научный центр прикладной микробиологии и биотехнологии г. Оболенск) при 37±1°C в анаэробных условиях с использованием микроанаэростата и системы GasPak+, в эксикаторе со свечой при повышенном содержании CO2, так и в аэробном режиме в течение 24-48 часов колонии S-формы 1-2 мм, выпуклые, гладкие, белого или светло-желтого цвета с ровными краями.
При выращивании на MRS бульоне (Difco™ Lactobacilli MRS Broth) при температуре 37±1°C в течение 24-48 часов в аэробных условиях рост - в виде помутнения бульона и выпадения бело-серого осадка на дне.
На белковых средах (МПА, МПБ, молоке) рост отсутствует (иногда наблюдается очень слабое развитие). Крахмал не гидролизует. Желатин не разжижает.
Физиолого-биохимические признаки
Мезофил, рост возможен в интервале 20-40°C, оптимальная для роста температура 37±1°C.
Факультативный анаэроб. При глубинной ферментации на жидкой питательной среде оптимальный режим аэрации-перемешивания 1 объем воздуха / 1 объем питательной среды, что соответствует сульфитному числу 1.
Оптимально для роста рН 6,5±0,2.
Отношение к источникам углеводов.
Хорошо растет на: D-Arabinose+, D-Ribose+, D-Galactose+, D-Glucose+, D-Fructose+, D-Mannose+, L-Sorbose+, L-Rhamnose+, Dulcitol+, D-Mannitol+, D-Sorbitol+, N-AcetylGlucosamine+, Amygdaline+, Arbutine+, Esculine citrate Fe+, Salicine+, D-Cellobiose+, D-Maltose+, D-Lactose+, D-Melibiose+, D-Saccharose+, D-Trehalose+, D-Melezitose+, D-Raffinose+, D-Turanose+, D-Tgatose+, L-Fucose+, K Gluconate+,
He растет на: Glycerol -, Erythritol -, L-Arabinose -, D-Xylose -, L-Xylose -, D-Adonitol -, Methyl-вD-Xylopyranoside -, Inositol -, Methyl-бD-Mannopyranoside -, Methyl-бD-Glucopyranoside -, Inuline -, Amidon -, Glyco-gene -, Xylitol -, Gentiobiose -, D-Lyxose -, D-Fucose -, D-Arabitol -, L-Arabitol -, K2-Cetogluconate -, K5-Cetogluconate -.
Из спиртов усваивает: Dulcitol, D-Mannitol, D-Sorbitol,
Из спиртов не усваивает: Glycerol (48 ч), Inositol, Erythritol, Xylitol, D-Arabitol, L-Arabitol.
Расщепляет: K- глюконат.
He расщепляет: K 2-кетоглюконат, K 5- кетоглюконат, гликоген
Не усваивает цитрат, целлюлозу, этанол, бутанол.
Створаживают молоко через 12-14 часов.
Исследуемый штамм фенотипически апатогенный, т.е. не обладает гемолитической, протеолитической, летициназной, гиалуронидазной, антилизоцимной, ДНК-ной и РНК-ной активностью.
Антагонистическая активность.
Исследование антагонистической активности проводили методом, описанным в (Блинкова Л.П. Получение томицида нового бактерийного препарата и изучение его биологической активности. Автореф. дис. д-ра биол. наук. М., - 1986. - С. 25) на тест-штаммах Staphylococcus aureus АТСС 25923, Candida albicans АТСС 885-653, Pseudomonas aeruginosa ATCC 27853, Shigella sonnei I фазы 941, Bacillus subtillis 534, Escherichia coli 25922. Salmonellla typhimurium ГКПМ 5715. Учет результатов проводили через 24-48 часов инкубирования при 37°C в термостате по величине зоны отсутствия роста тест-культуры. Степень антагонизма определяли по следующим критериям: 10 мм и менее - низкая, 10-20 мм - средняя, 21 мм и более - высокая.
Показано, что исследуемый штамм подавляет рост патогенных и условно-патогенных микроорганизмов: S.aureus, B.subtilis, E.coli, Sh.sonnei I фазы, P.aeruginosa, Salmonella typhimurium, и средней степени дрожжевых грибов C.albicans (табл. 1).
Отношение к антибактериальным препаратам
Отношение штамма Lactobacillus rhamnosus к антимикробным препаратам (качественнно) изучали в соответствие с методиками, рекомендованными научно-исследовательским центром фармакотерапии (НИЦФ) www. nicf.spb. ru
Исследования показали, что заявляемый штамм обладает чувствительностью к бензилпенициллину, ампициллину, гентамицину, стрептомицину, эритромициу, тетрациклину, доксициклину, рифампицину, левомицетину, фурадонину, меропенему, линезолиду, левофлоксацину, устойчивостью к ванкомицину, ципрофлоксацину (табл. 2).
Культура Lactobacillus rhamnosus длительно хранится в криопробирках на триптиказо-соевом бульоне (ТСБ) (TSB: Difco Laboratories, Detroit, Mich.) с 15% глицерина в морозильной камере при температуре -80°C 5 лет или -20°C до 3-6 месяцев, а также в лиофилизированном виде более 10 лет.
Изобретение иллюстрируется следующими примерами.
Пример 1. Культивирование штамма Lactobacillus rhamnosus лабораторных условиях.
Штамм Lactobacillus rhamnosus выращивают в колбах на жидкой питательной среде MRS бульон (Difco™ Lactobacilli MRS Broth) при температуре 36±1°C в течение 24-48 часов в аэробных условиях. Объем питательной среды 500 мл. Посев петлей одной изолированной колонии. Через 24 и 48 часов наблюдается рост в виде помутнения бульона и выпадения бело-серого осадка на дне. Для определения количества жизнеспособных лактобацилл проводят раститровку выращенных бактерий на изотоническом растворе хлорида натрия с шагом 10 и последующим высевом из разных разведений по 0,3 мл на плотную среду MRS или лактоагар. Через 24 часа культивирования при 36±1°C в аэробных условиях проводят подсчет колоний и рассчитывают количество жизнеспособных микроорганизмов - колониеобразующих единиц (КОЕ) в 1 мл жидкой питательной среды (MRS бульоне). В результате определения установлено, что через 24 часа культивирования количество выросших лактобацилл составило 4⋅108-1,7⋅109 КОЕ/мл. Через 48 культивирования - 1,3-2⋅109 КОЕ/мл.
Пример 2. Исследование свойств штамма Lactobacillus rhamnosus . Кислотообразующая способность.
Активность кислотообразования определяют титрометрическим методом (Лянная A.M., Гончарова Г.И., Высоцкий В.В. Морфология бифидобактерий в светооптическом и электронно-микроскопическом уровне и их биологические свойства // Микробиология. - 1979. №6. - С. 54 - 58). Измерения проводят в течение 72 часов, используя питательные среды без глюкозы и с добавлением глюкозы и отбирая образцы культуральной жидкости каждые 24 часа. Результат выражают в градусах Тернера (Т° - величина, выражающая количество 0,1 Н щелочи, пошедшей на титрование 100 мл исследуемого образца).
Полученные результаты (табл. 3) показывают, что в течение первых суток культивирования без глюкозы кислотность составила 32°Т. В последующем она постепенно увеличивается (ко 2 суткам - 38°Т и к 3-м - 50°Т). После добавлении в среду глюкозы к концу первых суток наблюдалось закисление среды до 44°Т, к концу 2-х суток кислотность повысилась до 52°Т, к 3-м - 78°Т.
Способность к адгезии.
Степень адгезии микроорганизмов определяют, пользуясь средним показателем адгезии (СПА) по методу Брилис В.И. (Брилис В.И., Брилене Т.А., Ленцнер Х.П. и др Методика изучения адгезивного процесса // Лаб. дело. - 1986. - №4. - С. 210-212) на эритроцитах человека О (I) группы Rh+.
Исследования показывают, что степень адгезии штамма Lactobacillus rhamnosus составляет 5,52±2,14, что является высоким показателем.
Способность к аутоагрегации.
Аутоагрегация лактобацилл определяют методом A. Andreu et al. (Andreu A., Stapleton, A., Fennell, C., Hillier, S., and Stamm, E. Hemagglutination, adherence and surface properties of vaginal Lactobacillus species. J. Infect. Dis. - 1995 - 171: 1237-1243). Аутоагрегация оценивают как способность формировать скопления (агрегаты) в течение 2 минут. Исследования показывают, что штамм Lactobacillus rhamnosus имеет высокий показатель аутоаггрегации.
Способность к поверхностной гидрофобности.
Поверхностную гидрофобность лактобацилл изучают по тесту солевой агрегации (ТСА) (Andreu A., Stapleton, A., Fennell, С., Hillier, S., and Stamm, Е. Hemagglutination, adherence and surface properties of vaginal Lactobacillus species. J. Infect. Dis. - 1995. - 171: 1237-1243). Исследования показывают, что штамм Lactobacillus rhamnosus обладает высокой поверхностной гидрофобностью (ТСА<0,9 моль/л).
Способность к коагрегации.
Способность лактобацилл к коаггрегации определяют методом G. Reid et al. (Reid G., Mac Groarty, J., Chow, A., Bruce, A., Eisen, A., and Costerton, W. Coaggregation of urogenital bacteria in vitro and in vivo. Curr. Microbiol. 1990, 20: 47-52). В качестве тестовых культур для данной методики используют следующие патогенные и условно-патогенные штаммы Staphylococcus aureus 209, Candida albicans 531, Pseudomonas aeruginosa ATCC 9027, Escherichia coli ATCC 25922; Salmonella typhimurium 11, Shigella flexneri 26, Bacillus subtilis 534. Тест на коагрегацию считается положительным, если исследуемая культура образовывает агрегаты с другим видом микроорганизмов. Исследования показывают, что штамм Lactobacillus rhamnosus коагрегирует с Bacillus subtilis и Pseudomonas aeruginosa.
Чувствительность к соляной кислоте и желчи.
Чувствительность штамма к соляной кислоте и желчи, которая во многом определяет его способность к персистентции в ЖКТ, определяют по изменению оптической плотности (ОП) суточной бульонной культуры, в зависимости от концентрации соляной кислоты или желчи (Casey PG, Casey GD, Gardiner GE et al. (2004) Isolation and characterization of anti-Salmonella lactic acid bacteria from the porcine gastrointestinal tract. Lett Appl Microbiol 39: 431-438). Измерения проводят на спектрофотометре КФК-3 при длине волны 590 мкм или 600 мкм, соответственно. В качестве контроля используют чистую суточную бульонную культуру.
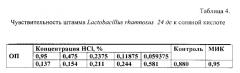
Результаты показывают, что минимальная ингибирующая концентрация (МИК) соляной кислоты составляет 0,95% (табл. 4), а желчь в концентрациях 20% ингибирует размножение и рост бульонной культуры штамма Lactobacillus rhamnosus (табл. 5).
Определение газовых сигнальных молекул.
Анализ газовых сигнальных молекул проводится методом газовой хроматографии с применением газового хроматографа Кристаллюкс 400М, оснащенного детектором по теплопроводности и пламенно-ионизационным детектором, подключенными последовательно, что обеспечивает одновременный анализ горючих и негорючих компонентов. Разделение газовой смеси проводится на трехметровой колонке, заполненной полимером MN270, фракции 100-125 мкм. Анализ проводится в режиме программирования температуры в течение 25 минут: 40°C (4 минуты) - 12°C (до 250°C) - 250°C (3 минуты). В качестве эталона для калибровочных кривых использовались чистые газы. Объем пробы 1 мл все концентрации пересчитывались с текущих условий анализа на стандартные условия. Было выявлено, что L. rhamnosus 24 дст выделяет CH4, CO2, C2H6, и CO, продукция пропана не определялось (табл. 6).
Продукция аммиака определялась по фотометрическому методу с использованием реактива Несслера по ГОСТ 33045-2014. Количественный химический анализ вод. Методика измерений массовой концентрации катионов аммония, калия, натрия, лития, магния, стронция, бария и кальция в пробах питьевых, природных (в том числе минеральных) и сточных вод методом капиллярного электрофореза с использованием системы капиллярного электрофореза «Капель». ПНД Ф 14.1:2:4.167-2000. Москва 2000 г. Измерения проводили на базе центра гигиены и эпидемиологии Тверской области на аппарате КАПЕЛЬ 105. При расчете результатов учитывали концентрацию аммония в контрольном стерильном бульоне МРС. Разница в бульоне с лакто-бациллами и без них представлена в таблице (табл. 7).
Результаты показывают, что Lactobacillus rhamnosus выделяет аммиак, а при повторном измерении его количество снижалось.
Заявленное решение иллюстрируется следующими чертежами.
Фиг. 1 Чувствительность штамма Lactobacillus rhamnosus к соляной кислоте.
Таким образом, заявляемый штамм L. rhamnosus ВКПМ В-12598 отличается высокой антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам: S.aureus АТСС 25923, B.subtilis 534, E.coli АТСС 25922, Sh.sonnei I фазы 941, P.aeruginosa ATCC 27853, Salmonella typhimurium ГКПМ 5715 и дрожжевых грибов С.albicans АТСС 885-653. Кислотопродукция, выраженная в градусах Тернера колеблется от 32 до 50°Т в среде без глюкозы и от 44 до 78°Т при добавлении глюкозы в питательную среду. L. rhamnosus обладает чувствительностью к бензилпенициллину, ампициллину, гентамицину, стрептомицину, тетрациклину, ципрофлоксацину, рифампицину, левомицетину, фурадонину, меропенему, линезолиду, промежуточной чувствительностью к эритромициу, устойчивостью к ванкомицину, доксициклину, левофлоксацину. Исследуемый штамм фенотипически апатогенный, т.е. не обладает гемолитической, протеолитической, летициназной, гиалуронидазной, антилизоцимной, ДНК-ной и РНК-ной активностью. Lactobacillus rhamnosus обладает высокими показателями адгезии 5,52±2,14 и поверхностной гидрофобности (ТСА<0,9 моль/л), высокими показателями аутоаггрегации. Коаггрегирует с Bacillus subtilis и Pseudomonas aeruginosa. Минимальная ингибирующая концентрация соляной кислоты для Lactobacillus rhamnosus составляет 0,95%. Желчь только в концентрациях 20% ингибирует размножение и рост бульонной культуры штамма Lactobacillus rhamnosus . Выявлена продукция газовых сигнальных молекул: аммиака, метана, этана, угарного и углекислого газа.
Штамм высокотехнологичен, на искусственных питательных средах быстро накапливает биомассу с высокой концентрацией лактобактерий.
Все это позволяет предложить штамм Lactobacillus rhamnosus ВКПМ В-12596 для использования в производстве пробиотических бактерийных препаратов, биологически активных добавок к пище, кисломолочных ферментированных и неферментированных пищевых продуктов, заквасок, обеспечивающих пробиотический эффект и нормализацию микробиоценозов организма человека, в т.ч. желудочно-кишечного и мочеполового трактов, кожных и слизистых покровов.
Штамм бактерий Lactobacillus rhamnosus ВКПМ В-12596, обладающий широким спектром антагонистической активности по отношению к патогенным и условно-патогенным микроорганизмам.