Новые модуляторы и способы их применения
Иллюстрации
Показать всеИзобретение относится к области биохимии. Заявлено антитело, специфически связывающееся с PTK7 (протеинтирозинкиназа 7) человека, а также конъюгат указанного антитела с цитотоксическим агентом. Также предложены нуклеиновые кислоты, кодирующие указанное антитело, и включающие их экспрессионные векторы и клетки-хозяева. Кроме того, предложены способы применения указанного антитела, в том числе в составе конъюгата, для диагностики и лечения рака у субъекта. Изобретение обеспечивает эффективное нацеливание на опухолевые стволовые клетки, что может быть использовано для лечения пациентов, страдающих от широкого спектра злокачественных образований. 16 н. и 36 з.п. ф-лы, 42 ил., 5 табл., 16 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА ЗАЯВКИ
В данной заявке заявлен приоритет предварительной заявки США 61/444614, поданной 18 февраля 2011 года и заявки PCT под номером PCT/US 2011/050451, поданной 2 сентября 2011 года, каждая из которых включена в данную заявку посредством ссылки во всей полноте.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был представлен в ASCII формате посредством EFS-Web и включен в данное описание посредством ссылки во всей полноте. Указанная копия ASCII, созданная 26 января, 2012, называется 112304PCT.txt и имеет размер 163049 байт.
Область изобретения
Данная заявка в целом относится к новым композициям и способам их применения в предупреждении, лечении или облегчении гиперпролиферативных расстройств и любого их распространения, повторного проявления, рецидива или метастазов. В широком аспекте настоящее изобретение относится к применению модуляторов протеинтирозинкиназы 7 (PTK7), включая анти-PTK7 антитела и слитые конструкции, для лечения или профилактики опухолевых заболеваний. В особенно предпочтительных воплощениях настоящего изобретения предложено применение таких модуляторов PTK7 для иммунотерапевтического лечения злокачественных образований, включающего снижение частоты появления опухоль-инициирующих клеток.
Предшествующий уровень техники
Дифференцировка стволовых клеток и клеток-предшественников, а также клеточная пролиферация являются нормальными непрерывными процессами, которые действуют совместно для поддержания роста тканей во время органогенеза, а также замены клеток и восстановления большинства тканей в течение жизни всех живых организмов. Решения о дифференцировке и пролиферации часто контролируется многочисленными факторами и сигналами, которые уравновешены так, чтобы поддерживать решения относительно судьбы клеток и архитектуры тканей. Нормальная архитектура ткани в основном сохраняется клетками в ответ на сигналы микроокружения, которые регулируют деление клеток и созревание тканей. Соответственно, клеточная пролиферация и дифференцировка обычно происходит только по мере необходимости для замены поврежденных или умирающих клеток или для роста. К сожалению, нарушение клеточной пролиферации и/или дифференцировки может быть результатом множества факторов, в том числе, например, недостатка или избытка различных химических агентов, участвующих в передаче сигналов, наличия измененного микроокружения, генетических мутаций или любой их комбинации. Нарушение или какое-либо расстройство нормальной клеточной пролиферации и/или дифференцировки может привести к различным заболеваниям или расстройствам, в том числе к гиперпролиферативным расстройствам, таким как рак.
Обычные методы лечения рака включают химиотерапию, лучевую терапию, хирургию, иммунотерапию (например, модификаторы биологического ответа, вакцины или терапевтические средства направленного действия) или их комбинации. К сожалению, слишком многие виды рака не отвечают или минимально отвечают на такие традиционные методы лечения, предоставляя пациентам небольшой выбор. Например, у ряда больных в случае некоторых видов рака обнаруживаются генные мутации, которые делают их нечувствительными, несмотря на общую эффективность выбранной терапии. Кроме того, в зависимости от типа рака, некоторые доступные виды лечения, такие как хирургия, не могут являться реальной альтернативой. Ограничения, присущие существующим терапевтическим средствам, представляющим стандарт лечения, особенно очевидны при попытке лечить пациентов, прошедших предыдущее лечение и имеющих после этого рецидивы. В таких случаях безрезультатные схемы лечения и результирующее ухудшение состояния пациента может содействовать трудноизлечимым опухолям, которые часто проявляются, как относительно агрессивное заболевание, которое в конечном счете оказывается неизлечимым. Несмотря на большие успехи в диагностике и лечении рака на протяжении многих лет, уровень общей выживаемости для многих солидных опухолей остается в значительной степени неизменным из-за неспособности существующих методов лечения предотвратить рецидив, повторное проявление опухоли и метастазы. Таким образом, остается проблема разработки более целенаправленной и эффективной терапии.
Одно из перспективных направлений исследований включает использование терапевтических средств направленного действия для преследования онкогенных "затравочных" клеток, которые, по-видимому, лежат в основе многих видов рака. Исходя из этого, в настоящее время известно, что большинство твердых тканей содержит популяции взрослых, расположенных в тканях, стволовых клеток, образующих дифференцированные клеточные типы, которые составляют большую часть этой ткани. Опухоли, образующиеся в этих тканях, также состоят из гетерогенных популяций клеток, которые также возникают из стволовых клеток, но заметно отличаются по своей общей пролиферации и организации. Хотя все чаще признается, что большинство опухолевых клеток имеют ограниченную способность к пролиферации, меньшая часть популяции раковых клеток (общеизвестная как раковые стволовые клетки или CSC) обладает исключительной способностью активно самообновляться, тем самым наделяя опухоль присущей ей способностью к возобновлению. Более конкретно, гипотеза раковых стволовых клеток предполагает, что существует отдельная подгруппа клеток (то есть CSC) в каждой опухоли (приблизительно 0,1-10%), которая способна неограниченно самообновляться и образовывать опухолевые клетки с постепенным ограничением их репликативной способности в результате дифференцировки в клетки-предшественники опухоли и затем в окончательно дифференцированные опухолевые клетки.
В последние годы становится все более очевидным, что эти CSC (также известные как клетки, поддерживающие опухоль, или TPC) могут быть более резистентными к традиционным химиотерапевтическим агентам или облучению и, таким образом, сохраняться после стандартного клинического лечения, чтобы позже поддерживать рост трудноизлечимых опухолей, вторичных опухолей и содействовать образованию метастазов. В этом отношении раковые стволовые клетки вовлечены в стимулирование миграционного и инвазивного потенциала различных неоплазий. Кроме того, растущие доказательства свидетельствуют о том, что пути, регулирующие органогенез и/или самообновление расположенных в нормальных тканях стволовых клеток, разрегулированы или изменены в CSC, что приводит к непрерывному увеличению количества самообновляющихся раковых клеток и к образованию опухоли. См. в целом AI-Hajj et al., 2004, PMID: 15378087; и Dalerba et al., 2007, PMID: 17548814; каждый из которых включен в настоящее описание во всей полноте посредством ссылки. Таким образом, эффективность традиционных, а также более современных методов лечения посредством направленной доставки, по-видимому, ограничена существованием и/или появлением резистентных раковых клеток, которые способны поддерживать рак, даже вопреки этим разнообразным методам лечения. Huff et al., European Journal of Cancer 42: 1293-1297 (2006) и Zhou et al., Nature Reviews Drug Discovery 8: 806-823 (2009), каждый из которых включен в настоящее описание во всей полноте посредством ссылки. Такие наблюдения подтверждены устойчивой неспособностью традиционных циторедуктивных агентов существенно увеличивать выживаемость пациентов, страдающих от солидных опухолей, а также развитием более тонкого понимания того, как опухоли растут, рецидивируют и метастазируют. Соответственно, в современных стратегиях лечения опухолевых заболеваний признается важность ликвидации, уменьшения, подавления или стимуляции дифференцировки клеток, поддерживающих опухоль, с тем чтобы уменьшить возможность повторного проявления опухоли, метастазов или рецидивов у пациента.
Усилия по разработке таких стратегий включают последние работы с использованием нетрадиционных ксенотрансплантатных (NTX) моделей, в которых образцы первичных человеческих солидных опухолей имплантировали и пассировали исключительно мышам с ослабленным иммунитетом. Такие способы подтверждают существование субпопуляции клеток с уникальной способностью образовывать гетерогенные опухоли и поддерживать их рост в течение неопределенного времени при многих видах раковых заболеваний. Как ранее предполагалось, работа на NTX-моделях подтверждает, что идентифицированные CSC-субпопуляции опухолевых клеток являются более резистентными к циторедуктивным схемам лечения, таким как химиотерапия и лучевая терапия, что может объяснить несоответствие между показателями клинического ответа и общей выживаемостью. Кроме того, применение NTX-моделей в исследовании CSC вызвало фундаментальное изменение в разработке лекарственных средств и в доклинической оценке кандидатов в лекарственные средства, которое может привести к CSC-нацеленной терапии, оказывающей существенное воздействие на повторное проявление опухоли и метастазирование, тем самым повышая выживаемость пациентов. Несмотря на прогресс, главными проблемами являются имеющиеся технические трудности, связанные с обработкой первичной и/или ксенотрансплантатной опухолевой ткани, наряду с отсутствием экспериментальных оснований для характеристики отличительных особенностей CSC и способности к дифференцировке. Таким образом, по-прежнему сохраняется существенная потребность в селективном нацеливании на раковые стволовые клетки и разработке диагностических, профилактических или терапевтических соединений и методов, которые можно использовать в лечении, предупреждении и/или контролировании гиперпролиферативных расстройств.
Краткое изложение сущности изобретения
Эти и другие цели предусмотрены настоящим изобретением, которое в широком смысле относится к способам, соединениям, композициям и изделиям, которые можно использовать в лечении PTK7-ассоциированных расстройств (например, гиперпролиферативных расстройств или опухолевых заболеваний). В связи с этим в настоящем изобретении предлагаются новые модуляторы протеинтирозинкиназы (PTK7), которые эффективно нацеливаются на опухолевые или раковые стволовые клетки и могут быть использованы для лечения пациентов, страдающих от широкого спектра злокачественных образований. Как будет обсуждаться более подробно ниже, в настоящее время имеется семь известных изоформ PTK7 и раскрытые модуляторы предпочтительно содержат один или более из них или ассоциированы с одним или более из них. Кроме того, в некоторых воплощения раскрытые модуляторы PTK7 могут содержать любое соединение, которое распознает, конкурирует, является агонистом, является антагонистом, взаимодействует, связывается или соединяется с полипептидом PTK7 или его геном (или их фрагментом) и модулирует, регулирует, изменяет, меняет или модифицирует воздействие белка PTK7 на один или более физиологических путей. Таким образом, в широком смысле настоящее изобретение относится к выделенным модуляторам PTK7 и их применению. В предпочтительных воплощениях изобретение более конкретно относится к выделенным модуляторам PTK7, содержащим антитела (то есть антитела, которые иммунологически предпочтительно связываются, реагируют или ассоциируют по меньшей мере с одной изоформой PTK7). Кроме того, как подробно рассмотрено ниже, такие модуляторы могут быть использованы для получения фармацевтических композиций, полезных для профилактики, диагностики или лечения пролиферативных расстройств.
В отдельных воплощениях изобретения модуляторы PTK7 могут содержать полипептид PTK7 или его фрагмент либо в выделенной форме, либо слитым, либо соединенным с другими группировками (например, Fc-PTK7, PEG-PTK7 или PTK7, соединенный с группировкой, обеспечивающей направленную доставку). В других выбранных воплощениях модуляторы PTK7 могут содержать антагонисты PTK7, которые в контексте настоящей заявки, означают любую конструкцию или соединение, которое распознает, конкурирует, взаимодействует, связывается или соединяется с PTK7 и нейтрализует, устраняет, уменьшает, сенсибилизирует, перепрограммирует, ингибирует или контролирует рост опухолевых клеток, в том числе опухоль-инициирующих клеток. В предпочтительных воплощениях модуляторы PTK7 по настоящему изобретению содержат анти-PTK7 антитела, или их фрагменты, или их производные, которые, как было неожиданно обнаружено, останавливают, нейтрализуют, снижают, уменьшают, истощают, сдерживают, ослабляют, перепрограммируют, устраняют или иным способом ингибируют способность опухоль-инициирующих клеток размножаться, сохраняться, распространяться, пролиферировать или другим способом содействовать выживанию, повторному проявлению, регенерации и/или метастазированию опухолевых клеток. В особенно предпочтительных воплощениях антитела или иммунореактивные фрагменты могут быть соединены или конъюгированы с одним или более противораковыми агентами (например, с цитотоксическим агентом).
В отдельных воплощениях совместимые модуляторы PTK7 могут содержать антитело, имеющее вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи включает аминокислотную последовательность, имеющую по меньшей мере 60%-ную идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58 и SEQ ID NO: 60 и, где указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60%-ную идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59 и SEQ ID NO: 61.
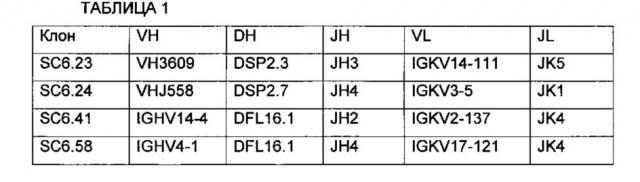
Безусловно, с учетом настоящего описания специалисты в данной области могут легко идентифицировать CDR, связанные с каждой их вышеупомянутых вариабельных областей тяжелой и легкой цепи и использовать эти CDR для конструирования или изготовления химерных, гуманизированных или CDR-привитых антител без излишнего экспериментирования. Таким образом, в отдельных воплощениях настоящее изобретение относится к анти-PTK7 антителам, содержащим один или более CDR из последовательности вариабельной области, представленной на Фиг. 6А или Фиг. 6Б. В предпочтительных воплощениях такие антитела включают моноклональные антитела, а в более предпочтительных воплощениях включают химерные, CDR-привитые или гуманизированные антитела. Как описано более подробно ниже, другие воплощения включают антитела, конъюгированные или связанные с одним или более цитотоксическими агентами.
Соответственно, в других воплощениях настоящее изобретение включает гуманизированный модулятор PTK7, выбранный из группы, состоящей из hSC6.23, hSC6.24, hSC6.41 и hSC6.58. Другие воплощения относятся к модулятору PTK7, содержащему гуманизированное антитело, где указанное гуманизированное антитело включает вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи включает аминокислотную последовательность, имеющую по меньшей мере 60%-ную идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66 и SEQ ID NO: 68 и, где указанная вариабельная область тяжелой цепи включает аминокислотную последовательность, имеющую по меньшей мере 60%-ную идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67 и SEQ ID NO: 69.
Как было указано ранее, один аспект настоящего изобретения включает неожиданные ассоциации PTK7 полипептидов с раковыми стволовыми клетками. Таким образом, в некоторых других воплощениях изобретение относится к модулятору PTK7, который снижает частоту появления опухоль-инициирующих клеток при введении субъекту. Предпочтительно уменьшение частоты появления определяют, используя анализ методом серийных разведений in vitro или in vivo. В особенно предпочтительных воплощениях такой анализ может быть выполнен с использованием анализа методом серийных разведений in vivo, включающего трансплантацию живых опухолевых клеток человека мышам с ослабленным иммунитетом. Альтернативно, анализ методом серийных разведений может быть выполнен с использованием анализа методом серийных разведений in vitro, включающего посев живых опухолевых клеток человека in vitro методом серийных разведений в условиях, поддерживающих образование колоний. В любом случае анализ, вычисление или количественное определение снижения частоты появления предпочтительно включает использование статистических параметров распределения Пуассона для обеспечения точного подсчета. Следует иметь в виду, что, хотя такие количественные методы являются предпочтительными, другие, менее трудоемкие методы, такие как проточная цитометрия или иммуногистохимия, также могут быть использованы для получения нужных значений и, соответственно, явным образом рассматриваются как входящие в объем настоящего изобретения. В таких случаях снижение частоты появления можно определить, используя проточный цитометрический анализ или иммуногистохимическое обнаружение поверхностных маркеров опухолевых клеток, которыми, как известно, богаты опухоль-инициирующие клетки.
Таким образом, в другом предпочтительном воплощении настоящее изобретение включает способ лечения PTK7-ассоциированного расстройства, включающий введение терапевтически эффективного количества модулятора PTK7 нуждающемуся в этом субъекту, в результате чего снижается частота появления опухоль-инициирующих клеток. Предпочтительно PTK7-ассоциированное расстройство включает опухолевое расстройство. И опять снижение частоты появления опухоль-инициирующих клеток предпочтительно определяют, используя анализ методом серийных разведений in vitro или in vivo.
В связи с этим следует иметь в виду, что настоящее изобретение основано, по меньшей мере частично, на обнаружении того, что PTK7-иммуногены ассоциированы с клетками, поддерживающими опухоль, (то есть раковыми стволовыми клетками), которые вовлечены в этиологию различных неоплазий. Более конкретно, в настоящей заявке неожиданно продемонстрировано, что введение различных типичных модуляторов PTK7 может опосредовать, снижать, истощать, ингибировать или ликвидировать онкогенную передачу сигналов опухоль-инициирующими клетками (то есть снижать частоту появления опухоль-инициирующих клеток). Эта уменьшенная, либо посредством истощения, нейтрализации, уменьшения, удаления, перепрограммирования или подавления опухоль-инициирующих клеток, либо посредством изменения морфологии опухолевых клеток (например, индуцированной дифференцировки, разрушения ниши), передача сигнала в свою очередь обеспечивает возможность более эффективного лечения PTK7-ассоциированных расстройств посредством ингибирования онкогенеза, поддержания опухоли, увеличения объема и/или метастазирования и ее повторного появления.
Помимо вышеупомянутых ассоциаций с раковыми стволовыми клетками, есть свидетельства, что изоформы PTK7 могут быть вовлечены в ангиогенез, миграцию эндотелиальных клеток и развитие определенные сигнальные каскады развития, которые связаны с онкогенезом (то есть Wnt-пути передачи сигнала). Вмешательство в такие клеточные взаимодействия с использованием новых модуляторов PTK7, описанных здесь, может, таким образом, облегчить или лечить расстройство посредством более чем одного механизма (то есть уменьшения опухоль-инициирующих клеток и нарушения пути передачи онкогенного сигнала) с обеспечением аддитивного или синергичного эффектов. Также в других предпочтительных воплощениях можно использовать клеточную интернализацию PTK7 клеточной поверхности для доставки модулятор-опосредованного противоракового агента. В связи с этим, следует понимать, что настоящее изобретение не ограничено каким-либо конкретным механизмом действия, а охватывает широкое использование раскрытых модуляторов для лечения PTK7-ассоциированных расстройств (в том числе различных неоплазий).
В других аспектах настоящего изобретения используется способность раскрытых модуляторов потенциально разрушать пути онкогенного выживания с одновременным подавлением опухоль-инициирующих клеток. Такие мультиактивные модуляторы PTK7 (например, антагонисты PTK7) могут оказаться особенно эффективными при использовании в комбинации со стандартными противораковыми агентами или циторедуктивными агентами. Соответственно, предпочтительные воплощения настоящего изобретения включают использование раскрытых модуляторов в качестве антиметастатических агентов для поддерживающей терапии после первоначального лечения. Кроме того, два или более антагонистов PTK7 (например, антитела, которые специфически связываются с двумя отдельными эпитопами на PTK7) можно использовать в комбинации в соответствии с идеями настоящего изобретения. Кроме того, как обсуждается более подробно ниже, модуляторы PTK7 по настоящему изобретению по настоящему изобретению можно использовать в конъюгированном или неконъюгированном состоянии и возможно в качестве сенсибилизирующего агента в комбинации с различными химическими или биологическими противораковыми агентами.
Соответственно, другое предпочтительное воплощение настоящего изобретения включает способ сенсибилизации опухоли субъекта к лечению противораковым агентом, включающий стадию введения модулятора PTK7 указанному субъекту. Другие воплощения включают способ уменьшения метастазирования после лечения, включающий введение модулятора PTK7 нуждающемуся в этом субъекту. В особенно предпочтительном аспекте изобретения модулятор PTK7 конкретно приводит к снижению частоты появления опухоль-инициирующих клеток, определенной с использованием in vitro или in vivo анализа методом серийных разведений
В более общем случае предпочтительные воплощения изобретения включают способ лечения PTK7-ассоциированного расстройства у нуждающегося в этом субъекта, включающий стадию введения модулятора PTK7 этому субъекту. В особенно предпочтительных воплощениях модулятор PTK7 соединен (например, конъюгирован) с противораковым агентом. В других воплощениях модулятор PTK7 интернализуется после соединения или связывания с PTK7 на или около поверхности клетки. Кроме того, полезные аспекты настоящего изобретения, включающие любое нарушение путей передачи сигнала и сопутствующие преимущества, могут быть достигнуты независимо от того, демонстрирует опухолевая ткань субъекта повышенный уровень PTK7 или уменьшенные или сниженные уровни PTK7 по сравнению с нормальной прилегающей тканью.
В еще одном аспекте настоящее изобретение включает способ лечения субъекта, страдающего от опухолевого заболевания, включающий стадию введения терапевтически эффективного количества по меньшей мере одного интернализованного модулятора PTK7. Предпочтительные воплощения включают введение интернализованных антительных модуляторов, где, в других выбранных воплощениях, интернализованные антительные модуляторы конъюгированы или соединены с цитотоксическим агентом.
Другие воплощения относятся к способу лечения субъекта, страдающего от PTK7-ассоциированного расстройства, включающему стадию введения терапевтически эффективного количества по меньшей мере одного истощающего модулятора PTK7.
В другом воплощении в настоящем изобретении предлагаются способы поддерживающей терапии, в которых раскрытые эффекторы или модуляторы вводят в течение некоторого периода времени после начальной процедуры (например, химиотерапии, лучевой терапии или хирургического вмешательства), предназначенной для удаления по меньшей мере части опухолевой массы. Такие схемы лечения могут быть введены на протяжении недель, месяцев и даже лет, где модуляторы PTK7 могут действовать профилактически с целью ингибирования метастазирования и/или повторного появления опухоли. В других воплощениях раскрытые модуляторы можно вводить в соответствии с известными циторедуктивными схемами для предупреждения или замедления метастазирования, поддержания опухоли или ее повторного появления.
Кроме того, следует понимать, что модуляторы PTK7 по настоящему изобретению могут быть изготовлены или выбраны так, чтобы взаимодействовать с одной изоформой PTK7 или с несколькими выбранными изоформами (то есть полученными как варианты сплайсинга) белка или, напротив, могут содержать пан-модулятор PTK7, который взаимодействует или связывается с некоторыми или всеми изоформами PTK7 (в настоящее время идентифицировано пять изоформ). Более конкретно, как описано здесь, предпочтительные модуляторы, такие как антитела, могут быть получены и выбраны так, чтобы они взаимодействовали с доменами, представленными единичными вариантами сплайсинга (например, при конкретных соединениях экзонов) или с Ig-доменами, которые сохраняются у многих или у всех изоформ PTK7. Очень важно для настоящего изобретения, что определенные изоформы могут предпочтительно экспрессироваться на TIC и, следовательно, могут служить терапевтическими мишенями для обеспечения селективного снижения частоты появления онкогенных клеток и/или истощения популяций раковых стволовых клеток.
Соответственно, в выбранном воплощении изобретение включает пан-модулятор PTK7. В других отдельных воплощениях изобретение включает модулятор PTK7, который иммуноспецифически соединяется с одним или более вариантами сплайсинга или изоформами. Предпочтительно, варианты сплайсинга могут быть выбраны из группы, состоящей из изоформы a, изоформы b, изоформы с и изоформы d. В других воплощениях настоящее изобретение относится к способу лечения субъекта, нуждающегося в этом, включающему введение терапевтически эффективного количества пан-модулятора PTK7. Другие воплощения относятся к способу лечения субъекта, нуждающегося в этом, включающему введение терапевтически эффективного количества модулятора PTK7, который иммуноспецифически соединяется с одной или более изоформами.
Очевидно, что, помимо терапевтических применений, описанных выше, модуляторы по настоящему изобретению можно использовать для диагностики PTK7-ассоциированных расстройств и, в частности, гиперпролиферативных расстройств. В некоторых воплощениях модулятор можно вводить субъекту и определять или контролировать in vivo. Специалистам в данной области техники понятно, что такие модуляторы могут быть мечеными или соединенными с маркерами или репортерными группами, как описано ниже, и могут быть обнаружены с использованием любого из нескольких стандартных методов (например, MRI (визуализация методом ядерного магнитного резонанса), CAT (компьютерная томография) сканирование, PET (позитронно-эмиссионная томография) сканирование и т.д.).
В других случаях модуляторы можно использовать в диагностических установках in vitro с использованием принятых в данной области операций. Таким образом, предпочтительное воплощение включает способ диагностики гиперпролиферативного расстройства у субъекта, нуждающегося в этом, включающий стадии:
а. получение образца ткани из указанного субъекта;
б. приведение образца ткани в контакт по меньшей мере с одним модулятором PTK7; и
в. обнаружение или количественное определение модулятора PTK7, соединенного с образцом.
Такие способы могут быть легко поняты с учетом настоящей заявки и могут быть легко осуществлены с использованием общедоступной промышленной технологии, такой как автоматические планшет-ридеры, специально предназначенные репортерные системы и т.д. В выбранных воплощениях модулятор PTK7 соединен с клетками, поддерживающими опухоль, присутствующими в образце. В других предпочтительных воплощениях стадия обнаружения и количественного определения включает снижение частоты появления опухоль-инициирующих клеток и их обнаружение. Кроме того, анализ методом серийных разведений может быть проведен, как упоминалось выше, и предпочтительно с использованием статистических параметров распределения Пуассона для обеспечения точного подсчета снижения частоты появления.
Аналогично, в настоящем изобретении также предложены наборы, которые полезны в диагностике и контроле PTK7-ассоциированных расстройств, таких как рак. С этой целью в настоящем изобретении предпочтительно предложено изделие, полезное для диагностики или лечения PTK7-ассоциированных расстройств, содержащее контейнер, содержащий модулятор PTK7 и инструкции по применению указанного модулятора PTK7 для лечения или диагностики PTK7-ассоциированного расстройства.
В других предпочтительных воплощениях изобретения также используются свойства раскрытых модуляторов как инструмента, полезного для идентификации, выделения, разделения или обогащения популяций или субпопуляций опухоль-инициирующих клеток посредством таких методов, как проточный цитометрический анализ, сортировка флуоресцентно-активированных клеток (FACS) или лазерное отделение.
Таким образом, другое предпочтительное воплощение настоящего изобретения направлено на способ идентификации, выделения, разделения или обогащения популяции опухоль-инициирующих клеток, включающий стадию приведения указанных опухоль-инициирующих клеток в контакт с модулятором PTK7.
Вышеизложенное представляет собой краткое изложение сущности изобретения и, таким образом, содержит, по необходимости, упрощения, обобщения и опускания деталей; следовательно, специалистам в данной области техники будет понятно, что краткое изложение является лишь иллюстративным и не предназначено являться каким-либо ограничением. Другие аспекты, характеристики и преимущества способов, композиций и/или устройств и/или других объектов, описанных здесь, станут очевидными из изложенного здесь руководства. Краткое изложение представлено для того, чтобы изложить в упрощенной форме ряд концепций, которые дополнительно описаны ниже в Подробном описании изобретения. Это краткое изложение не предназначено для определения ключевых или существенных признаков заявленного изобретения и не предназначено для использования в качества помощи для определении объема заявленного изобретения
Краткое описание графических материалов
На Фиг. 1А-В показаны, соответственно, последовательность нуклеиновой кислоты, кодирующая человеческий PTK7 (SEQ ID NO: 1), аминокислотная последовательность типичного варианта PTK7 человека (SEQ ID NO: 2), а на Фиг. 1В показаны выровненные и снабженные условными обозначениями последовательности четырех типичных изоформ PTK7 (SEQ ID NO: 3-6), где подчеркнутый участок на Фиг. 1А представляет собой открытую рамку считывания PTK7-1 открытая рамка считывания, подчеркнутый участок на Фиг. 1Б указывает внеклеточный домен PTK7, как определено здесь, а на Фиг. 1В показано белковое выравнивание четырех известных типичных изоформ белка PTK7 человека, как описано в базе данных генов NCBI (Национальный центр биотехнологической информации США) (учетные номера белков: изоформа a=NP_002812, изоформа b=NP_690619; изоформа c=NP_690620; изоформа d=NP_690621), где на Фиг. 1 В также раскрыты пептидные мотивы "GxGxFGxV," "HRDLxxxN" и "SDVWSxG" как SEQ ID NO: 11-13 соответственно.
На Фиг. 2 показаны графики, представляющие уровни экспрессии генов PTK7 у необработанных (-) и у обработанных иринотеканом (+) мышей при измерении с использованием секвенирования всей последовательности транскриптома популяций, значительно обогащенных клетками-предшественниками опухоли (TProg), и клетками, поддерживающими опухоль (TPC), и неонкогенными клетками (NTG), полученными из подгруппы всех образцов колоректальной опухоли.
На Фиг. 3 представлен график, показывающий относительные уровни генной экспрессии человеческого PTK7 в популяциях, значительно обогащенных клетками-предшественниками опухоли (TProg), и клетками, поддерживающими опухоль (TPC), полученных из мышей, несущих одну из четырех разных нетрадиционных ксенотрансплантатных (NTX) клеточных линий колоректальной опухоли или опухоли поджелудочной железы, и нормализированных относительно популяций, обогащенных неонкогенными клетками (NTG), при измерении с использованием количественной ОТ-ПЦР (полимеразная цепная реакция с обратной транскрипцией).
На Фиг. 4А и 4Б представлены графики, показывающие относительные уровни экспрессии гена человеческого PTK7 при измерении с использованием ОТ-ПЦР во всех образцах колоректальной опухоли от пациентов с I-IV стадией болезни, нормализованных относительно средней экспрессии в нормальной ткани толстой и прямой кишки (Фиг. 4А) или относительно нормальной соседней ткани (Фиг. 4Б).
На Фиг. 5А и 5Б показаны относительные и абсолютные уровни экспрессии генов, соответственно, человеческих генов PTK7 при измерении с помощью ОТ-ПЦР в целых образцах опухоли (серые точки) или сопоставимой NAT (нормальной соседней ткани; белые точки) из пациентов с одним из восемнадцати разных типов солидных опухолей.
На Фиг. 6А и 6Б представлены в табличном виде близлежащие аминокислотные последовательности вариабельных областей тяжелой и легкой цепей ряда мышиных и гуманизированных типичных модуляторов PTK7, выделенных, клонированных и разработанных, как описано в Примерах в данном описании.
На Фиг. 7А-7Д в графической и табличной форме представлены физико-химические характеристики типичных модуляторов PTK7, где на Фиг. 7А показаны характеристики связывания некоторых модуляторов с мышиным и человеческим PTK7, На Фиг. 7Б показаны данные по аффинности, биннингу и перекрестной реакционной способности для выбранных модуляторов, на Фиг. 7В и 7Г показаны сравнительные характеристики связывания выбранного мышиного модулятора и его гуманизированного аналога, а на Фиг. 7Д представлены аффинности связывания выбранных модуляторов с человеческим PTK7 и его мышиным ортологом.
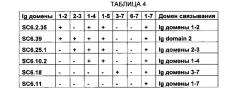
На Фиг. 8А-8Ж показаны различные конструкции PTK7 в соответствии с настоящим изобретением, где на Фиг. 8А-8Е показаны аминокислотные последовательности шести вариантов модулятора PTK7 в форме конструкций Ig-PTK7-ECD, где варьируется участок внеклеточного домена каждой конструкции, а на Фиг. 8Ж схематически изображены семь Ig-доменов внеклеточной области PTK7 вместе с выявленными посредством ELISA участками связывания нескольких модуляторов PTK7, как указано с помощью скобок.
На Фиг. 9А-9Д показаны уровни белка PTK7 в разных лизатах опухоли и в NTX-образцах, где на Фиг. 9А-9Г показаны уровни в лизатах разных опухолей и на разных стадиях заболевания по сравнению с контролями нормальной соседней ткани и на Фиг. 9Д представлены гистограммы, иллюстрирующие окрашивание человеческих нетрадиционных ксенотрансплантатов выбранными модуляторами, где контрольное окрашивание (серый) сравнивали с окрашиванием неопухолевых (пунктирная линия) и предполагаемых раковых стволовых клеточных популяций (непрерывная линия).
На Фиг. 10А-10Д графически показана способность выбранного модулятора по настоящему изобретению интернализоваться при связывании с PTK7 на клеточной поверхности, где на Фиг. 10В показан сдвиг флуоресценции, связанный с типичным модулятором (то есть SC6.10.2, называемым H10 на Фиг. 10В), на Фиг. 10А и 10Б представлены контроли, а на Фиг. 10Г показано, что типичные модуляторы из супернатантов гибридомы могут быть подвергнуты скринингу в отношении интернализации по сравнении с очищенными контролями (SC6.2.35, SC6.10.2 и SC6.25.1, называемыми H2.35, H10.2 и H25.1 соответственно) и на Фиг. 10Д продемонстрирована степень интернализации различных модуляторов (каждая точка на графике представляет отдельный модулятор), где пунктирная линия указывает пороговое значения для фона и число молекул PTK7, которые интернализируются клеткой в ответ на событие связывания, откладывают по оси y.
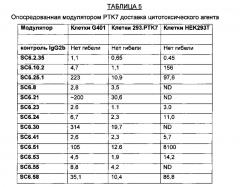
На Фиг. 11А-11Г графически показана способность раскрытых модуляторов иммуноспецифически опосредовать доставку цитотоксических агентов и содействовать клеточной гибели, где на Фиг. 11А представлено применение трех типичных модуляторов (SC6.2.35, SC6.10.2 и SC6.25.3, называемых Н2.35, Н10.2 и Н25.3, соответственно) в качестве группировок, обеспечивающих напра