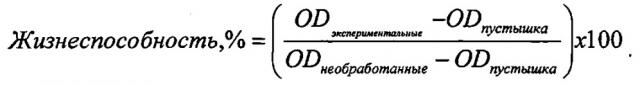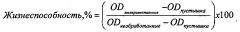Новые связывающие молекулы с противоопухолевой активностью
Иллюстрации
Показать всеНастоящая группа изобретений относится к биотехнологии и медицине. Предложены связывающая молекула, специфически связывающаяся с двумя различными эпитопами на HER2, и способ ее получения, а также кодирующая ее молекула нуклеиновой кислоты, экспрессирующий вектор, включающий эту молекулу нуклеиновой кислоты, клетка-хозяин для экспрессии связывающей молекулы, трансформированная экспрессирующим вектором, и фармацевтическая композиция для лечения рака, включающая связывающую молекулу, или молекулу нуклеиновой кислоты ее кодирующую, или экспрессирующий вектор. Предложенная связывающая молекула включает первый полипептид, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO:1, и второй полипептид, являющийся антителом, с тяжелой и легкой цепями, содержащими аминокислотные последовательности, по меньшей мере на 95% идентичные SEQ ID NO:154 и SEQ ID NO:155 соответственно. Связывающая молекула эффективно подавляет рост опухолевых клеток и показывает высокую антипрофилиративную активность. Предложенная группа изобретений может быть использована в медицине в противоопухолевой терапии. 6 н. и 11 з.п. ф-лы, 13 ил., 1 табл., 14 пр.
Реферат
Настоящее изобретение относится к связывающей молекуле, которая специфически связывается с двумя различными эпитопами антигена, экспрессированного на опухолевых клетках, при этом связывающая молекула включает (а) первый связывающий (поли)пептид, который специфически связывается с первым эпитопом указанного антигена, экспрессированного на опухолевых клетках, при этом указанный первый связывающий (поли)пептид представляет собой полипептид, образованный из Fyn SH3; и (b) второй связывающий (поли)пептид, который специфически связывается со вторым эпитопом указанного антигена, экспрессированного на опухолевых клетках. Настоящее изобретение также относится к молекуле нуклеиновой кислоты, кодирующей связывающую молекулу по изобретению, вектору, включающему указанную молекулу нуклеиновой кислоты, а также клетке-хозяину или хозяину, не являющемуся человеком, трансформированному указанным вектором. Изобретение также относится к способу получения связывающей молекулы по изобретению, а также к фармацевтической и диагностической композиции. Кроме того, настоящее изобретение также относится к связывающей молекуле, молекуле нуклеиновой кислоты, вектору или клетке-хозяину по изобретению для применения при лечении опухолей.
В данном описании цитируется ряд документов, в том числе, заявки на патент и руководства изготовителей. Указанные документы, хотя и не рассматриваются как относящиеся к патентоспособности данного изобретения, включены в данное описание в качестве ссылок. Конкретнее, все цитированные документы включены в качестве ссылок в такой же степени, как если бы каждый отдельный документ специфически и отдельно включался в качестве ссылки.
Связывающие реагенты, происходящие не от иммуноглобулинов (все вместе называемые «каркасами»; см., например, Skerra (2000), J. Mol. Recognit, 13, 167-187), предполагаются для применения в качестве диагностических и терапевтических средств. Свыше 50 различных белковых каркасов предложено за последние 10-15 лет, причем наиболее продвинутыми подходами в этой области (как суммировано в работе Gebauer and Skerra (2009), Curr. Opinion in Chemical Biology, 13: 245-255) являются аффитела (на основе Z-домена стафилококкового белка А), домены типа Kunitz, аднектины (на основе 10-го домена фибронектина человека), антикалины (образованные из липокалинов), DARPins (образованные из белков анкиринового повтора), авимеры (основанные на полимеризованном LDLR-A) и финомеры, которые образованы от человеческого домена Fyn SH3.
Вообще, домен SH3 присутствует в самых разных белках, участвующих в клеточной передаче сигналов (Musacchio et al. (1994), Prog. Biophys. Mol. Biol., 61, 283-297). Такие домены не занимают фиксированное положение в белках и могут быть экспрессированы и очищены независимо. В настоящее время известно более 1000 появлений домена, в том числе, примерно 300 доменов SH3 человека (Musacchio (2003), Advances in Protein Chemistry, 61, 211-268). Хотя существует большое разнообразие последовательностей доменов SH3, их всех объединяет консервативная складка: компактный бета-бочонок, образованный двумя антипараллельными бета-листами (Musacchio (2003), Advances in Protein Chemistry, 61, 211-268). Типично домены SH3 связываются с богатыми пролином пептидами, содержащими связывающий лейтмотив РХХР (Ren et al. (1993), Science, 259, 1157-1161), но также описаны примеры необычных сайтов связывания SH3 (Karkkainen et al. (2006), EMBO Rep., 7, 186-191). Большинство доменов SH3, секвенированных до сих пор, имеют общую длину приблизительно в 60-65 аминокислот, но некоторые из них могут, в отличие, иметь 85 аминокислот из-за вставок в петли, соединяющие основные консервативные элементы вторичной структуры (Коуата et al. (1993), Cell 72(6), 945-952). Выравнивание различных доменов SH3 выявляет консервативные аминокислотные остатки, ответственные за правильное формирование структуры, а также за узнавание канонического богатого пролином мотива (Larson et al. (2000), Protein Science, 9, 2170-2180).
Лечение опухолей обычными химиотерапевтическими средствами опирается на ожидание того, что лекарственные средства будут преимущественно убивать быстро делящиеся опухолевые клетки, а не здоровые клетки. Однако отсутствие селективности в отношении опухолевых клеток ведет к токсичности для здоровых тканей с увеличенными скоростями пролиферации, таких как костный мозг, желудочно-кишечный тракт и волосяные фолликулы. Химиотерапевтические средства показывают плохое накопление в массе опухоли вследствие плохой перфузии крови, неравномерной сосудистой сети и высокого интерстициального давления в окружающей среде опухоли (Bosslet et al. (1998), Cancer Res., 58: 1195-1201). Более того, белки с множественной лекарственной устойчивостью могут снижать усвоение лекарственного средства (Ramachandran et al. (1999), Mol. Diagn., 4: 81-94). Как следствие, разработка терапевтических средств, нацеленных преимущественно на опухолевые клетки, представляет собой основное средоточие современных противораковых исследований. В таком контексте направленная доставка терапевтических средств в место нахождения опухоли путем связывания с опухольассоциированными антигенами является развивающейся областью в современных противораковых исследованиях, которая сулит концентрацию биоактивных молекул в неопластических повреждениях, сберегая в то же время здоровые ткани (Pfaffen et al. (2010), Exp. Cell Res., 316(5), 836-847). Например, при раке молочной железы и яичников наблюдается положительная регуляция белка HER2, что коррелирует с неблагоприятным прогнозом (Slamon et al. (1987), Science, 235: 177-182; Slamon et al. (1989), Science, 244: 707-712). При ряде других типов опухолей, включая карциномы мочевого пузыря, слюнных желез, эндометрия, поджелудочной железы, щитовидной железы, почек, легких, верхнего отдела желудочно-кишечного тракта и толстой кишки, также наблюдают сверхэкспрессию HER2 (часто, но не постоянно, из-за амплификации гена) (Scholl et al. (2001), Ann. Oncol., 12 Suppl. 1: S81-87; Ross J.S. (2011), Biomark Med., 3: 307-318; Fukushige et al. (1986), Mol. Cell Biol., 3: 955-958; Cohen et al. (1989), Oncogene, 1: 81-88; Weiner et al. (1990), Cancer Res., 50: 421-425; Park et al. (1989), Cancer Res., 23: 6605-6609; Zhau et al. (1990), Mol. Carcinog., 5: 254-257; Aasland et al. (1988), Br. J. Cancer, 4: 358-363; Seliger et al. (2000), Int. J. Cancer, 87(3): 349-359). Кроме того, обнаружено, что HER2 сверхэкспрессируется при раке предстательной железы, хотя на меньших уровнях по сравнению с тканями молочной железы (Minner et al. (2010), Clin. Cancer Res., 16(5): 1553-1560).
Ранее описаны некоторые HER2-связываюшие белки, такие как аффитела и DARPins (Wikman et al. (2004), Protein Eng. Des. Sel., 17(5): 455-462; Zahnd et al. (2007), 369(4): 1015-1028). Кроме того, Hudziak с сотр. описывают создание панели мышиных анти-HER2 антител (включающей антитела 4D5 и 2С4), которые охарактеризованы с использованием клеточной опухолевой линии рака молочной железы человека (Hudziak et al. (1989), Mol. Cell Biol., 9(3): 1165-1172; см. также патент США №5677171). Определялась относительная клеточная пролиферация клеток после воздействия антител. Авторы показывают, что антитела 4D5 ингибируют клеточную пролиферацию наиболее эффективно. Рекомбинантная гуманизированная версия мышиных анти-HER2 антител 4D5 (huMAb4D5-8, трастузумаб, герцептин, см. также патент США №5821337) одобрена Управлением по пищевым продуктам и лекарственным средствам США в 1998 для лечения HER2-положительного метастазирующего рака молочной железы (МВС) в комбинации с химиотерапией. В настоящее время трастузумаб рекомендуется как первоочередное лечение для пациентов с метастазирующими HER2-положительными опухолями или как единственное средство (ограниченная группа пациентов) или в комбинации с эндокринной терапией или химиотерапией, а также во вспомогательном фоне (Awada et al. (2012), Cancer Treat. Rev., 106(1): 6-13). Однако во время лечения трастузумабом часто встречается первичная (присущая) или вторичная (приобретенная во время лечения) устойчивость (Tsang et al. (2012), Br. J. Cancer, 106: 6-13). Например, наблюдали, что степень первичной устойчивости к единственному средству трастузумабу в случае сверхэкспрессирующего HER2 метастазирующего рака молочной железы составляет 66-89%. Кроме того, у большинства пациентов, у которых достигалась начальная реакция на схемы лечения на основе трастузумаба, устойчивость развивается в пределах 1 года (Nahta et al. (2006), Nat. Clin. Pract. Oncol., 3(5): 269-280). В литературе описано несколько стратегий для преодоления устойчивости к лечению трастузумабом (см. обзоры Tsang et al. (2012), Br. J. Cancer, 106: 6-13; Awada et al. (2012), Cancer Treat. Rev., 106(1): 6-13).
Одно привлекательное направление для преодоления устойчивости представляет собой использование комбинаций HER2-связывающих средств. В таком контексте несколько групп показывают, что комбинация двух анти-HER2 антител подавляет рост клеточных опухолевых линий человека in vitro и/или in vivo лучше, чем лечение только одним антителом (Yamashita-Kashima et al. (2011), Clin. Cancer Res., 17(15): 5060-5070; Scheuer et al. (2009), Cancer Res., 69(24): 9330-9336; Lee-Hoeflich et al. (2008), Cancer Res., 68(14): 5878-5887; Kasprzyk et al. (1992), Cancer Res., 52: 2771-2776; Ben-Kasus et al. (2009), Proc. Natl. Acad. Sci. USA, 106(9): 3294-3299). Примечательно, что повышенную эффективность наблюдают при предклинических исследованиях, когда трастузумаб объединяют с пертузумабом (пертузумаб представляет собой гуманизированную форму мышиного антитела 2С4, описанную Hudziak et al. (Hudziak et al. (1989), Mol. Cell Biol., 9(3): 1165-1172; патент США №5677171); Adams C.W. et al. (2006), Cancer Immunol. Immunother., 55: 717-727; WO 2001/00245)), и клинические испытания фазы 2 показывают, что совместное введение трастузумаба и пертузумаба вызывает противоопухолевые реакции у пациентов, которые имели предварительно установленное развитие заболевания, пока получали терапию на основе трастузумаба (Baselga et al. (2010), J. Clin. Oncol., 28: 1138-1144). Пертузумаб связывается с доменом II внеклеточной части HER2, в то время как трастузумаб связывается с сайтом в домене IV HER2, который является ближайшим к мембране. Показано, что пертузумаб из-за его специфичности связывания предотвращает образование активных гетеродимеров HER2 с другими рецепторами HER (такими как HER1, HER3 и HER4) (Agus et al. (2002), Cancer Cell, 2: 127-137; Fendly et al. (1990), Cancer Res., 50(5): 1550-1558).
Недавно в клиническом исследовании фазе III показано, что комбинация пертузумаб плюс трастузумаб плюс доцетаксел по сравнению с плацебо плюс трастузумаб плюс доцетаксел существенно пролонгирует выживание без развития, когда используется как первоочередное лечение для пациентов с HER2-положительным метастазирующим раком молочной железы (Baselga et al. (2012), N. Engl. J. Med., 366(2): 109-119). Однако среднее независимо оцененное выживание без развития пролонгируется только на 6,1 месяцев (из 12,4 месяцев в контрольной группе до 18,5 месяцев в группе пертузумаба). Кроме того, комбинация двух или большего числа биологических соединений делает необходимой дозировку двух молекул, что обычно делает регулирование и клинические процедуры более трудными. Кроме того, различия в фармакокинетике и концентрации в тканях могут снизить эффективность двух антител.
На основании улучшенной терапевтической эффективности комбинаций антител, имеющих целью различные эпитопы на HER2 или EGFR (HER1) (Perera et al. (2005), Clin. Cancer Res., 11: 6390-6399), были предприняты усилия для конструирования полиспецифических белков, имеющих целью EGFR и HER2, которые связываются с различными эпитопами или EGFR (WO 2011/020033) или HER2 (устная презентация Woisetschlager М., Bispeciflc Antibody Summit 2011, September 27, 2011, Boston, USA; слайды №№5 и 15).
В WO 2011/020033 EGFR-связьшаюшие белки на основе домена фибронектина выделили и слили с С- или N-концом или тяжелой и/или легкой цепи моноклонального анти-EGFR антитела 225 (также известного как цетуксимаб (эрбитукс®)). Показано, что EGFR-связывающие домены фибронектина узнают эпитопы иные, чем антитело 225. Обнаружено, что некоторые из полученных гибридов фибронектин-антитело индуцируют образование кластеров EGFR, и отрицательная регуляция более эффективна, чем самого антитела 225.
В презентации Woisetschlager М. (устная презентация Woisetschlager М., Bispecific Antibody Summit 2011, September 27, 2011, Boston, USA; слайды №№5 и 15) описывается биспецифическое антитело на основе трастузумаба, имеющее целью HER2, трастузумаб-HER2-1, связывающееся с двумя различными эпитопами на HER2. Однако усиленной активности биспецифического антитела на основе трастузумаба по сравнению с немодифицированным трастузумабом не наблюдают.
Таким образом, несмотря на тот факт, что много усилий вложено в улучшение противопухолевых терапий, все еще требуется идентификация новых терапевтических соединений для улучшенного лечения рака, которые преодолевают вышеописанные недостатки.
К такой потребности обращены положения воплощений, охарактеризованные в формуле изобретения.
Соответственно, настоящее изобретение относится к связывающей молекуле, которая специфически связывается с двумя различными эпитопами антигена, экспрессированного на опухолевых клетках, при этом связывающая молекула включает (а) первый связывающий (поли)пептид, который специфически связывается с первым эпитопом указанного антигена, экспрессированного на опухолевых клетках, при этом указанный первый связывающий (поли)пептид представляет собой полипептид, образованный из Fyn SH3; и (b) второй связывающий (поли)пептид, который специфически связывается со вторым эпитопом указанного антигена, экспрессированного на опухолевых клетках.
Термин «связывающая молекула, которая специфически связывается с двумя различными эпитопами на антигене» относится к связывающей молекуле с двумя специфичностями связывания для одного антигена, экспрессированного на опухолевых клетках. Иными словами, связывающая молекула по настоящему изобретению способна специфически связываться с двумя различными сайтами связывания (т.е., эпитопами) в указанном одном антигене. Более того, биспецифическая связывающая молекула по настоящему изобретению способна связываться с указанными двумя различными эпитопами в одно и то же время.
Согласно настоящему изобретению считается, что молекула связывается специфически (что также в данном случае называется «взаимодействует специфически»), когда соответствующая молекула, по существу, не реагирует перекрестно с эпитопом подобной структуры. Перекрестную реактивность панели молекул при исследовании можно проверить, например, путем оценки связывания указанной панели молекул в обычных условиях с эпитопом, представляющим интерес, а также с рядом более или менее (структурно и/или функционально) близких родственных эпитопов. Только те молекулы, которые связываются с эпитопом, представляющим интерес, в его релевантном контексте (например, специфический мотив в структуре белка), но по существу не связываются с каким-либо другим эпитопом, считаются специфическими для эпитопа, представляющего интерес.Соответствующие способы описаны, например, в Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988; или в Harlow and Lane, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1999). Термин «молекула, которая по существу не реагирует перекрестно с эпитопом подобной структуры», используемый в данном описании, относится к молекуле, которая связывается с антигеном-мишенью с аффиностью, по меньшей мере, в 5 раз большей, чем с эпитопом подобной структуры, предпочтительнее, с аффиностью, по меньшей мере, в 10 раз большей, такой как, например, в 50 раз более высокая аффинность, предпочтительнее, с аффиностью, по меньшей мере, в 100 раз большей, такой как, например, в 500 раз более высокая аффинность. Даже предпочтительнее, она связывается с антигеном-мишенью с аффиностью, по меньшей мере, в 1000 раз большей, чем с эпитопом подобной структуры, такой как, например, по меньшей мере, в 10000 раз более высокая аффинность, и наиболее предпочтительно, по меньшей мере, в 100000 раз более высокая аффинность
Термин «антиген, эксперссированный на опухолевых клетках» относится к антигену, который или не экспрессируется на неопухолевых клетках, или экспрессируется на опухолевых клетках в большем количестве, чем на неопухолевых клетках. Предпочтительно антиген экспрессируется на опухолевых клетках в количестве, по меньшей мере, в два раза большем, чем на неопухолевых клетках, предпочтительнее, по меньшей мере, в пять раз большем количестве, таком как, например, по меньшей мере, в 10 раз большее количество, даже предпочтительнее, по меньшей мере, в 100 раз большее количество, такое как, например, по меньшей мере, в 1000 раз большее количество, и наиболее предпочтительно, по меньшей мере, в 10000 раз большее количество. Подходящие антигены-мишени включают любой такой антиген, который экспрессируется более интенсивно на опухолевых клетках, предпочтительно, антиген является одним из антигенов, определенных в данном описании ниже.
Термин «(поли)пептид», используемый в связи с настоящим изобретением, описывает линейные молекулярные цепи аминокислот, включая одноцепочечные белки или их фрагменты. Термин относится к группе молекул, которые включают группу пептидов, состоящую из аминокислот числом до 30, а также группу полипептидов (также называемых в данном описании белками), состоящих из более чем 30 аминокислот.
Кроме того, настоящим изобретением также охватываются пептидомиметики такого (поли)пептида, при этом аминокислотная(ые) и/или (поли)пептидная(ые) связь(и) заменена(ы) функциональными аналогами. Такие функциональные аналоги включают все известные аминокислоты иные, чем аминокислоты, кодируемые геном 20, такие как селеноцистеин. Термин «(поли)пептид» также относится к природным модифицированным (поли)пептидам, где модификация осуществлена, например, путем гликозилирования, ацетилирования, фосфорилирования, и подобные модификации, которые хорошо известны в технике.
Согласно настоящему изобретению, связывающая молекулы включает два связывающих (поли)пептида, определенных в (а) и (b).
Первый связывающий (поли)пептид специфически связывается с первым эпитопом на указанном антигене, экспрессированном на опухолевых клетках, и представляет собой полипептид, образованный из Fyn SH3. Следует иметь в виду, что в связывающей молекуле по изобретению могут присутствовать одна или несколько копий указанного первого связывающего (поли)пептида, например, две, три или четыре копии первого связывающего (поли)пептида.
Эпитоп может представлять собой конформационный или линейный эпитоп.В полипептидных антигенах конформационный (или прерывистый) эпитоп характеризуется присутствием двух или больше дискретных аминокислотных остатков, которые разделены в первичной последовательности, но располагаются близко друг к другу на поверхности молекулы, когда полипептид складывается в нативную трехмерную структуру, составляющую эпитоп (Sela (1969), Science, 166, 1365; и Laver (1990), Cell, 61, 553-6). Два или больше дискретных аминокислотных остатков, вносящих вклад в эпитоп, присутствуют в отдельных участках или даже в одной или нескольких (поли)пептидных цепях антигена. Напротив, линейный или непрерывный эпитоп состоит из двух или больше дискретных аминокислотных остатков, которые располагаются вблизи друг друга в одном линейном сегменте (поли)пептидной цепи.
Термин «полипептид, образованный из Fyn SH3», в данном случае используемый взаимозаменяемо с термином «финомер», относится к связывающему (поли)пептиду, образованному не от иммуноглобулина (например, так называемому каркасу, как описано выше), образованному из домена Fyn SH3 человека. Образованные из Fyn SH3 полипептиды хорошо известны в технике и описаны, например, в Grabulovski et al. (2007), JBC, 282, p. 3196-3204, или в WO 2008/022759, Bertschinger et al. (2007), Protein Eng. Des. Sel., 20(2): 57-68, Gebauer and Skerra (2009), Curr. Opinion in Chemical Biology, 13: 245-255).
Домен SH3 киназы Fyn (Fyn SH3) включает 63 остатка, а именно, аминокислоты 83-145 последовательности, описанной в Semba et al. (1986) (Proc. NatI. Acad. Sci. USA, 83(15): 5459-63), и Kawakami et al. (1986) (Mol. Cell Biol., 6(12): 4195-201), с последовательностью показанной в SEQ ID NO: 164. Fyn представляет собой член Src семейства тирозинкиназ в 59 кД. В результате альтернативного сплайсинга белок Fyn существует в двух различных изоформах, отличающихся их киназными доменами: одна форма обнаружена в тимоцитах, спленоцитах и некоторых гематолифоидных клеточных линиях, в то время как вторая форма накапливается в основном в головном мозгу (Cooke and Perlmutter (1989), New Biol. 1(1): 66-74). Биологические функции Fyn, которая является внутриклеточным белком, разнообразны и включают передачу сигнала через Т-клеточный рецептор, регуляцию функции головного мозга, а также передачу сигнала, опосредуемую слипанием (Resh (1998), Int. J. Biochem. Cell Biol., 30(11): 1159-62). Как и другие домены SH3, Fyn SH3 состоит из двух антипараллелльных β-листов и содержит две эластичные петли (петли RT-Src и n-Src) для того, чтобы взаимодействовать с другими белками. Последовательности двух эластичных петель (называемых RT-Src- и n-Src-петлями) подчеркнуты соответственно один и два раза. Аминокислотная последовательность Fyn SH3 полностью консервативна у человека, мыши, крысы и обезьяны (гиббона).
Как показано в технике (WO 2008/022759; Grabulovski et al. (2007), JBC, 282, p. 3196-3204), домен Fyn SH3 является особенно привлекательным каркасом для получения связывающих белков, т.н., финомеров. Это разумно, поскольку финомеры (i) могут быть экспрессированы в бактериях в растворимой форме в больших количествах, (ii) не образуют агрегатов при хранении в растворе, (iii) являются весьма устойчивыми (Тпл 70,5°С), (iv) не имеют цистеиновых остатков и (v) первоначально происходят от человека, отличаясь полностью консервативной аминокислотной последовательностью от мыши до человека, причем за счет этого снижаются нежелательные иммуногенные реакции.
В технике описано получение производных Fyn SH3 полипептида, подходящих для определенного антигена-мишени. Например, можно создать бибилиотеку различных Fyn SH3, в которых изменена последовательность, показанная выше в SEQ ID NO: 164. Предпочтительно изменение осуществляют (i) в последовательности, представляющей RT-петлю, или, необязательно, в позиции в пределах двух аминокислот, граничащих с указанной последовательностью (т.е., последовательностью DYEARTEDDL, показанной выше в SEQ ID NO: 164), или (ii) Scr-петле или, необязательно, в позиции в пределах двух аминокислот, граничащих с указанной последовательностью (т.е., последовательностью LNSSEG, показанной выше в SEQ ID NO: 164), или (iii) в обеих последовательностях одновременно. Предпочтительно изменение представляет собой замену, делецию или присоединение, описанные в технике (см., например, WO 2008/022759; Grabulovski et al. (2007), JBC, 282, p. 3196-3204). Средства и способы изменения аминокислотной последовательности хорошо известны в технике и описаны в технике, например, в Grabulovski et al. (2007), JBC, 282, p. 3196-3204. Затем такую библиотеку Fyn SH3 можно клонировать в фагмидный вектор, такой как, например, pHEN1 (Hoogenboom et al. "Multi-subunit proteins on the surface of filamentous phage: methodologies for displaying antibody (Fab) heavy and light chains", Nucleic Acids Res., 19(15): 4133-7, 1991), и затем библиотеку презентируют на фагах (фаговый дисплей) и подвергают пэннингу, предпочтительно, повторяющимся циклам пэннинга, например, по меньшей мере, двум, предпочтительнее, по меньшей мере, трем циклам пэннинга против соответствующего антигена. Затем можно выполнить скрининг на связывание (поли)пептидов установленными методами, такими как, например, моноклональный фаговый ELISA. Затем можно использовать секвенирование идентифицированных таким образом клонов для обнаружения обогащенных последовательностей. Идентифицированный таким образом связывающий (поли)пептид затем можно подвергнуть дополнительным стадиям созревания, например, путем генерации дополнительных библиотек на основе изменений идентифицированных последовательностей и повторенных стадий фагового дисплея и пэннинга. Наконец, можно проанализировать перекрестную реактивность и иммуногенность полученного образованного из Fyn SH3 полипептида, и можно выбрать образованный из Fyn SH3 полипептид, специфический для антигена-мишени.
Такие способы скринига фагового дисплея и оптимизации связывающих (поли)пептидов вообще известны в технике.
Второй связывающий (поли)пептид, определенный в (b), специфически связывается со вторым эпитопом указанного антигена, экспрессированного на опухолевых клетках. Соответственно, и как описано в данном описании выше, это означает, что тот же антиген связывается таким вторым связывающим (поли)пептидом, однако связывается другой эпитоп на указанном антигене. Термин «другой» эпитоп относится к эпитопу, который не перекрывается эпитопом, с которым специфически связывается первый связывающий (поли)пептид. Соответственно связывание одного связывающего (поли)пептида согласно изобретению не блокирует связывание второго связывающего (поли)пептида, причем таким образом создается возможность одновременного связывания обоих связывающих (поли)пептидов. Второй связывающий (поли)пептид может представлять собой любой (поли)пептид, способный специфически связываться с эпитопом-мишенью, такой как, например, антитело или любой из описанных выше связывающих реагентов неиммуноглобулинового происхождения или каркасы, предпочтительно, каркас, выбранный из группы, состоящей из аффител (на основе Z-домена стафилококкового белка А), доменов типа Kunitz, аднектинов (на основе 10-го домена фибронектина человека), антикалинов (образованных из липокалинов), DARPins (образованных из белков анкиринового повтора), авимеров (образованные из полимерного LDLR-A). Все такие каркасы хорошо известны в технике и описаны в ссылках, цитированных в данном описании выше.
Связывающие (поли)пептиды, заключенные в связывающей молекуле по изобретению, могут образовывать одну полипептидную цепь или могут присутствовать в связывающей молекуле по изобретению в виде нескольких полипептидных цепей, которые могут ковалентно или нековалентно связываться друг с другом. Когда связывающие (поли)пептиды образуют одну полипептидную цепь, они могут располагаться в любом порядке в пределах каждой молекулы, например, (а)-(b) или (b)-(а). Предпочтительнее связывающие (поли)пептиды (а) и (b) располагаются в изложенном порядке, например, в порядке (а)-(b) в направлении от N-конца к С-концу. Когда связывающие (поли)пептиды не образуют одну полипептидную цепь, они еще могут образовывать линейную цепь, в которой они связываются друг с другом. В таком случае они также могут располагаться в любом порядке в указанной линейной цепи, таком как, например, (а)-(b) или (b)-(а). Предпочтительнее связывающие (поли)пептиды (а) и (b) располагаются в изложенном порядке, например, в порядке (а)-(b). Связывающие (поли)пептиды могут располагаться к каждому другому в порядке голова-к-хвосту, т.е., один связывающий (поли)пептид (ковалентно или нековалентно) связывается своим N-концом с С-концом другого связывающего (поли)пептида, или может располагаться в порядке голова-к-голове или хвост-к-хвосту, т.е., один связывающий (поли)пептид связывается (ковалентно или нековалентно) своим N-концом с N-концом другого связывающего (поли)пептида, или своим С-концом с С-концом другого связывающего (поли)пептида. Следует иметь в виду, что связывающие (поли)пептиды также могут образовывать нелинейную компановку. Также следует иметь в виду, что существует требование ко всем связывающим молекулам, описанным в данном описании, что связывающая активность двух связывающих (поли)пептидов с их соответствующими эпитопами сохраняется или, по существу, сохраняется, как определено в данном описании ниже, после образования связывающих молекул, т.е., ковалентной или нековалентной ассоциации двух связывающих(поли)пептидов. Когда связывающая молекула образуется из нескольких (поли)пептидных цепей, предпочтительно, когда такие цепи ковалентно связываются друг с другом.
Связывающую молекулу по изобретению можно получить любым из способов получения (поли)пептидов, известных в технике. Например, как подробнее описано в данном описании ниже, одна или несколько молекул нуклеиновой кислоты, кодирующих связывающую молекулу по настоящему изобретению, могут быть экспрессированы в подходящем хозяине, и затем полученную таким образом связывающую молекулу можно выделить. Альтернативным способом получения связывающей молекулы по изобретению является трансляция мРНК in vitro. Подходящие бесклеточные экспрессирующие системы для применения согласно настоящему изобретению включают лизат кроличьих ретикулоцитов, экстракт зерна пшеницы, микросомные мембраны поджелудочной железы собаки, экстракт S30 Е. coli и спаренные системы транскрипция/трасляция, такие как TNT-система (Promega). Такие системы создают возможность эксперссии рекомбинантных (поли)пептидов после добавления клонирующих векторов, фрагментов ДНК или последовательностей РНК, содержащих кодирующие участки и соответствующие промоторные элементы.
Кроме получения рекомбинанта, связывающую молекулу по изобретению можно получить синтетически, например, прямым пептидным синтезом с использованием твердофазных методов (сравни Stewart et al. (1969), Solid Phase Peptide Synthesis; Freeman Co, San Francisco; Merrifield, J. Am. Chem. Soc, 85 (1963), 2149-2154). Синтез синтетических белков можно выполнить с использованием ручных методов или автоматически. Автоматизированный синтез можно осуществить, например, с использованием пептидного синтезатора Applied Biosystems 431A (Perkin Elmer, Foster City CA) согласно инструкциям, предоставленным изготовителем. Различные фрагменты можно химически синтезировать по отдельности и объединить с использованием химических способов получения полноразмерных молекул. Как указано выше, можно использовать химический синтез, такой как твердофазная процедура, описанная в Houghton, Proc. Natl. Acad. Sci. USA (82), (1985), 5131-5135. Кроме того, связывающую молекулу по изобретению можно получить полусинтетически, например, путем комбинирования получения рекомбинантным и синтетическим методом.
Согласно настоящему изобретению, неожиданно обнаружилось, что связывающая молекула, включающая полипептид, образованный из Fyn SH3, и второй связывающий (поли)пептид со специфичностью связывания с тем же антигеном, но другим эпитопом указанного антигена, показывает в результате щревосходную антипролиферативную активность в отношении опухолевых клеток. Такая активность выше, чем активность моноспецифического полипептида, образованного из Fyn SH3 (в двухвалентном формате как гибрид Fc), или одного второго связывающего (поли)пептида, и самое неожиданное, также значительно выше, чем антипролиферативное действие обоих соединений, взятых в комбинации. Соответственно, получение связывающей молекулы по настоящему изобретению приводит к улучшенному действию по сравнению с двумя отдельными связывающими (поли)пептидами.
Соответственно, настоящее изобретение относится к связывающей молекуле, при этом связывание указанной связывающей молекулы с опухолевыми клетками, экспрессирующими соответствующий антиген-мишень на своей поверхности, приводит к улучшенному ингибированию опухолевой активности, которое выше, чем ингибирование опухолевой активности, полученное путем комбинированного связывания двух моноспецифических связывающих белков, при этом первый моноспецифический связывающий белок включает или состоит из полипептида, образованного из Fyn SH3 (а), и второй моноспецифический связывающий белок включает или состоит из связывающего (поли)пептида (b). Предпочтительно улучшенное ингибирование опухолевой активности является синергическим, т.е., больше, чем аддитивный эффект по сравнению с ингибированием опухолевой активности, полученным путем комбинированного связывания двух моноспецифических связывающих белков.
В предпочтительном воплощении связывающей молекулы по изобретению антиген, экспрессированный на опухолевых клетках, выбирают из группы, состоящей из HER2, других членов семейства EGFR, включая HER1, HER3 и HER4, других семейств тирозинкиназных рецепторов, включая ALK, AXL, DDR, ЕРН, FGFR, ЕРН, FGFR, INSR, MET, MUSK, PDGFR, РТК7, RET, ROR, ROS, RYK, TIE, TRK, VEGFR, семейства AATYK, EpCAM, CD20, CD33, CD52 и CD30.
HER2 определяется согласно области техники, к которой относится данное изобретение, и относится к рецептору типа 2 эпидермального фактора роста человека (также называемому HER2/neu или ErbB-2, см. выше), рецептору в 185 кД, впервые описанному в 1984 (Schlechter et al. (1984), Nature, 312: 513-516). Человеческий HER2 (SEQ ID NO: 171) представлен ссылкой NCBI NP_004439 (дата публикации 26 февр. 2012) и описан в технике, например, в Robinson et al. (2000), Oncogene, 19: 5548-5557, а также в ссылках, цитированных в данном описании выше. Другие мишени семейств тирозинкиназных рецепторов (EGFR, ALK, AXL, DDR, ЕРН, FGFR, ЕРН, FGFR, INSR, MET, MUSK, PDGFR, PTK7, RET, ROR, ROS, RYK, TIE, TRK, VEGFR, AATYK) хорошо известны в технике и описаны, в том числе, в ссылках в Robinson et al. (2000), Oncogene, 19: 5548-5557.
EpCAM определяется согласно области техники, к которой относится данное изобретение, и относится к фактору адгезии эпителиальных клеток, который представляет собой панэпителиальный дифференцировочньш антиген, который экспрессируется почти на всех карциномах. Человеческий ЕрСАМ представлен UniProtKB/Swiss-Prot, инвентарный номер Р16422.2 (дата публикации 22 февр. 2012) и описан в технике, например, в Strnad et al. (1989), Cancer Res., 49(2): 314-317.
CD20 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену В-лимфоцитов CD20. Человеческий CD20 представлен ссылочной последовательностью NCBI NP_690605.1 (дата публикации 8 янв. 2012) и описан в технике, например, в Dawidowicz et al. (2011), Clin. Exp. Rheumatol., 29(5): 839-842.
CD33 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену CD33. Человеческий CD33 представлен ссылочной последовательностью NCBI NP_001763.3 (дата публикации 18 дек. 2011) и описан в технике, например, в Raponi et al. (2011), Leuk. Lymphoma, 52(6): 1098-1107.
CD52 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену CD52 (антиген САМРАТН-1). Человеческий CD52 представлен GenBank, инвентарный номер ЕАХ07822.1 (дата публикации 4 февр. 2010) и описан в технике, например, в Venter et al. (2001), Science, 291(5507): 1304-1351.
CD30 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену CD30. Человеческий CD30 представлен GenBank, инвентарный номер ААА51947.1 (дата публикации 1 ноя. 1994) и описан в технике, например, в Durkop, Н et al. (1992), Cell, 68(3): 421-427.
В предпочтительном воплощении биспецифической связывающей молекулы по изобретению антигеном является HER2.
В другом предпочтительном воплощении биспецифической связывающей молекулы по изобретению второй связывающий (поли)пептид представляет собой антитело.
Антитело может представлять собой моноклональное или поликлональное антитело любого класса антител. Термин «антитело» также включает фрагменты антитела или его производные, которые еще сохраняют специфичность связывания полноразмерного или немодифицированного антитела. Антитело по изобретению также включает такие воплощения, как синтетические, химерные, одноцепочечные и гуманизированные антитела.
Термин «фрагмент антитела» относится к фрагментам, таким как (i) Fab-фрагмент, (ii) F(ab')2-фрагмент, (iii) Fd-фрагмент (состоящий из доменов VHC и CH1), (iv) Fv-фрагмент и (v) изолированный участок, определяющий комплементарность (CDR), имеющий достаточный каркас для специфического связывания, например, антигенсвязывющую часть вариабельного участка. Термин «производное антитела» в контексте изобретения определяет химически модифицированные антитела и фрагменты антител. Определение включает svFv-фрагменты, одно доменные антитела и т.д.. Соответственно, производные антител обычно представляют собой (поли)пептиды, образованные из молекул антител, и/или (поли)пептиды, которые модифицированы химическими/биохимическими методами или методами молекулярной биологии. Минимальным требованием для специфического взаимодействия фрагмента антитела со специфическим эпитопом является присутствие одного или нескольких CDR из вариабельной тяжелой цепи (VH) и/или вариабельной легкой цепи (VL) исходного антитела в контексте, который допускает подбор фрагмента и эпитопа. Такой контекст может быть обеспечен использованием подходящего каркаса антитела. Как известно в технике, термин «каркас» применительно к антителу или фрагменту антитела определяет аминокислотную последовательность, которая функционирует как спейсер между CDR, а также наращивает их N-концы и С-концы и обеспечивает структуру, которая допускает образование CDR антигенсвязывающего сайта. Модификация каркаса или последовательностей CDR, например, для улучшения аффинности связывания, методами молекулярной биологии может включать модификацию (поли)пептидов с использованием обычных методов, известных в технике, например, с использованием аминокислотной(ых) делеции(й), вставки(вставок), замены(замен), добавления(й), и/или рекомбинации(й) и/или другой(их) модификации(й) (например, посттрансляционных и химических модификаций, таких как гликозилирование или фосфорилирование), известных в технике, одних или в комбинации. Способы введения таких модификаций в последовательность ДНК, лежащую в основе аминокислотной последовательности цепи иммуноглобулина, хорошо известны специалистам в данной области техники, см., например, Sa