Способ диагностики наличия мутации l576p гена c-kit в тканях меланомы
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и медицины и предназначено для диагностики наличия мутации L576P гена c-KIT в тканях меланомы. Оценку наличия мутации проводят по соотношениям значений пороговых циклов Ct в трех реакциях ПЦР в реальном времени с аллель-специфичными праймерами. По результатам трех дублей реакции рассчитывают долю мутантной ДНК в образце. Изобретение обеспечивает оптимизацию аллель-специфичной ПЦР в реальном времени для диагностики мутации рецептора тирозинкиназы c-KIT L576P в тканях меланомы. 6 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к молекулярной биологии и медицине, в частности к дерматологии, молекулярной онкологии, и может применяться для диагностики мутации гена KIT, приводящей к замене лейцина на пролин в положении 576 в белке c-KIT (далее - мутации L576 гена c-KIT), в лабораторных центрах.
Меланома, как и любое другое злокачественное новообразование, характеризуется индивидуальным генетическим профилем у каждого пациента. По этой причине для успешного лечения меланомы очень важно не только своевременное ее выявление, но и оценка всех особенностей конкретного заболевания, позволяющих выбрать адекватную терапию для данного пациента. На этом основывается принцип персонифицированной медицины, получающий сегодня все большую поддержку со стороны врачей-онкологов.
Среди параметров оценки индивидуальных особенностей меланомы важна диагностика возможного наличия ряда генетических мутаций в опухолевых клетках. Присутствие этих мутаций обусловливает выбор того или иного препарата для лечения меланомы.
Одной из диагностически важных мутаций является миссенс-мутация, приводящая к замене лейцина на пролин в положении 576 (L576P) в полипептидной цепочке белка-рецептора тирозинкиназы c-KIT - мутация L576P гена c-KIT. Данная мутация располагается в 11 экзоне гена KIT и встречается главным образом в акральной меланоме (4,4-8%), меланоме слизистых (5,3-7%) и участках кожи, подвергаемых длительному ультрафиолетовому облучению (5,5%) [Beadling С., Jacobson-Dunlop F.S. Hodi С. Le et al. KIT gene mutations and copy number in melanoma subtypes // Clin. Cancer Res. - 2008. - Vol. 14, №21. - 6821-6828; Curtin J.A., Busam K., Pinkel D., Bastian B.C. Somatic activation of KIT in distinct subtypes of melanoma // J. Clin. Oncol. - 2006. - Vol. 24, №26. - P. 4340-4346; Torres-Cabala C.A., Wang W.L., Trent J., Yang D., Chen S., Galbincea J., Kim K.B., Woodman S., Davies M., Plaza J.A., Nash J.W., Prieto V.G., Lazar A.J., Ivan D. Correlation between KIT expression and KIT mutation in melanoma: a study of 173 cases with emphasis on the acral-lentiginous/mucosal type // Mod. Pathol. - 2009. - Vol. 22, №11. - p. 1446-1456].
На сегодняшний день показано, что наличие данной мутации приводит к непрерывной активации рецептора тирозинкиназы KIT, не требующей лиганда SCF, что проявляется в ускоренном росте и избегании апоптоза меланоцитов на начальных стадиях меланомы (в первичной меланоме) [Smalley K.S.M., Sondak V.K. and Weber J.S. C-KIT signaling as the driving oncogenic event in sub-groups of melanomas // Histol Hepathol. - 2009. - Vol. 24. - P. 643-650]. При этом повышается чувствительность опухоли к терапии препаратами - ингибиторами тирозинкиназы дазатиниб, иматиниб, нилотиниб [Antonescu C.R., Busam K.J., Francone T.D., Wong G.C. et al. L576P KIT mutation in anal melanomas correlates with KIT protein expression and sensitive to specific kinase inhibition // Int. J. Cancer. - 2007. - Vol. 121. - P. 257-264]. Соответственно, для пациентов с данным видом мутации шансы на ремиссию значительно возрастают.
Таким образом, выявление мутации L576P в гене c-KIT в клинических лабораториях является важным и актуальным при лечении пациентов с меланомой.
На сегодняшний день одним из распространенных способов выявления мутаций на участках ДНК является секвенирование по Сэнгеру [Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors // Proc. Natl. Acad. Sci. U.S.A. - 1977. - Vol. 74, №12. - P. 5463-5467]. Данный способ предполагает постановку полимеразной реакции в четырех пробирках в присутствии терминирующих дидезоксинуклеотидтрифосфатов (ddNTPs: ddATP, ddTTP, ddCTP, ddGTP - по одному виду в каждой смеси), которые при встраивании в цепь приводят к ее обрыву. В результате в каждой смеси образуются фрагменты ДНК различной длины, заканчивающиеся на одинаковые нуклеотиды. Разделение молекул в смеси посредством гель-электрофореза позволяет выявить длины фрагментов, а при сопоставлении длин в четырех смесях выстраивают последовательность нуклеотидов в исходной молекуле ДНК. Данный способ может быть успешно применен для выявления нескольких мутаций на участке ДНК, но для детекции единственной мутации может оказаться нерентабельным, поскольку требует высокой квалификации персонала, достаточно высоких трудозатрат, связанных как с проведением исследования, так и с анализом данных, приобретения дорогостоящего оборудования и реактивов.
Другим нередко используемым способом детекции однонуклеотидных замен в ДНК считается анализ кривых плавления высокого разрешения (HRM analysis - high resolution melting analysis) [US 2008/0003603 Al, 03.01.2008]. В его основе лежит способность двухцепочечных молекул нуклеиновых кислот медленно «расплавляться» с образованием одноцепочечных при постепенном повышении температуры. При этом скорость расплавления зависит от нуклеотидного состава молекулы. Таким образом, молекулы, содержащие и не содержащие мутацию, будут иметь отличающиеся профили плавления [Montgomery J., Wittwer С.Т., Palais R., Zhou L. Simultaneous mutation scanning and genotyping by high-resolution DNA melting analysis // Nature Protocols. - 2007. - Vol. 2, №1. - P. 59-66]. Данный способ подходит для выявления однонуклеотидных замен, однако требует специальных надстроек или функций оборудования, что делает его проведение менее доступным.
Наиболее близким к предлагаемому является способ генотипирования однонуклеотидных полиморфизмов, основанный на полимеразной цепной реакции в реальном времени (патент US 007018816, 28.03.2006). Авторами предложено проведение полимеразной цепной реакции, при которой разделение между диким типом и мутантным аллелем осуществляют при помощи специфичных праймеров, содержащих сознательно введенный некомплементарный нуклеотид на 3'-конце. При этом некомплементарность мишеневого нуклеотида праймеру в совокупности с заведомо имеющимся непарным основанием значительно снижает эффективность протекания реакции вплоть до полного ее отсутствия. Для детекции продуктов реакции в описанном способе предлагают использовать флуоресцентные красители, метод кривых плавления или гель-электрофорез. Однако в способе не учтено, что метод аллель-специфичной полимеразной цепной реакции (ПЦР) далеко не всегда может быть применим для тканей, фиксированных формалином и заключенных в парафиновые блоки - FFPE (formalin fixed paraffin embaged). Причиной этому является тот факт, что при фиксации ткани формалином нуклеиновые кислоты в клетках частично повреждаются, искажая результат ПЦР, например приводя к снижению эффективности реакции, не связанной с мутацией. Таким образом, результаты аллель-специфичной ПЦР могут быть искажены и с трудом интерпретированы. Кроме того, при работе с тканями злокачественных новообразований возникает проблема гетерогенности, когда часть клеток содержит мутацию, тогда как другая часть обладает диким вариантом полиморфизма. Это также может приводить к возникновению сомнительных результатов.
Задача заявляемого способа - оптимизация аллель-специфичной полимеразной цепной реакции в реальном времени для диагностики мутации L576 гена c-KIT в FFPE-тканях меланомы для дальнейшего подбора индивидуального лечения.
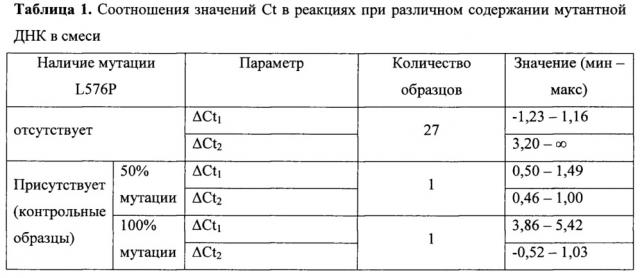
Поставленную задачу решают за счет того, что оценку наличия мутации проводят по соотношениям значений пороговых циклов Ct в трех реакциях, смеси для постановки трех реакций готовят в отдельных пробирках и добавляют праймеры и зонды в следующих сочетаниях: первая смесь - ASF1, ASR, ASP; вторая смесь - ASF2, ASR, ASP; третья смесь - QF, ASR, ASP, где ASF1 (последовательность ) - прямой праймер первого комплекта; ASF2 - прямой праймер второго комплекта; QF - прямой праймер третьего комплекта; ASR - обратный праймер; ASP - зонд; по результатам трех дублей реакции рассчитывают среднее значение CtQF, CtASF1, CtASF2, где CtQF, - значение пороговых циклов Ct в реакции QF, CtASF1 - значение пороговых циклов Ct в реакции ASF1, CtASF2 - значение пороговых циклов Ct в реакции ASF2; при (CtASF1-CtQF)≤1,16 и (CtASF2-CtQF)≥3,2 доля мутантной ДНК в образце приближена к 0, при (CtASF1-CtQF)≈(CtASF2-CtQF) доля мутантной ДНК составляет 50%, при (CtASF1-CtQF)≥3,2, a (CtASF2-CtQF)≤1,16 доля мутантной ДНК приближена к 100%.
Предлагаемый способ осуществляют следующим образом.
Биоптат меланомы, фиксированный формалином и заключенный в парафин, подвергают макродиссекции с целью удаления окружающих здоровых тканей. Далее проводят депарафинизацию ткани ксилолом и этанолом по стандартной методике. Преимущественное наличие опухолевых клеток в образце проверяют с помощью изготовления среза, окрашенного гематоксилином и эозином, с последующей оценкой с помощью световой микроскопии. При помощи микротома из диссектированного участка залитой в парафин ткани получают серию срезов. Далее проводят депарафинизацию ткани ксилолом и этанолом по стандартной методике.
Выделение ДНК осуществляют при помощи имеющегося набора для выделения ДНК, например «ДНК-Сорб В» (AmpliSens, ФГУН ЦНИИЭ Ростпотребнадзора, Россия) по прилагаемому протоколу. Для проведения анализа необходимо получить не менее 25 мкл очищенной ДНК в концентрации не менее 3 нг/мкл.
Часть очищенной ДНК (6 мкл) используют для постановки предварительной реакции ПЦР в реальном времени, содержащей особый комплект праймеров и зонда, в котором прямой праймер комплементарен тому же участку ДНК, что и аллель-специфичные праймеры, но не затрагивает мишеневую мутацию. Последовательность нуклеотидов праймеров:
Прямой праймер (QF):
Обратный праймер (ASR):
Флуоресцентный зонд (ASP):
Для постановки реакции используют реакционную смесь, содержащую Tris-HCl (рН 8,8), KCl, Tween 20, MgCl2 в концентрации 5,5 мМ, дезоксинуклеозидтрифосфаты, глицерол, Taq-полимеразу (использована SynTaq-полимераза (Синтол, Россия). Концентрация каждого праймера и зонда 350 нМ. Реакцию ПЦР в реальном времени осуществляют на приборе StepOne™ (Applied Biosystems, Сингапур). Условия реакции: предварительная денатурация 95°C - 5 минут; 40 циклов реакции в режиме 95°C - 15 сек, 55°C - 1 мин (детекция флуоресценции). По окончании реакции анализируют графики уровня флуоресцентного сигнала в пробах, выстраиваемые прибором. Устанавливают пороговый уровень флуоресценции, выше которого сигнал считается положительным. Номер цикла, в котором график интенсивности флуоресценции для данной пробы пересек пороговый уровень и стал положительным, называют пороговым циклом - Ct. Оценивают значения Ct для каждого образца. Если значение Ct не превышает 35 цикл, очищенную ДНК образца считают подходящей для дальнейшего анализа. Это позволяет оценить эффективность протекания реакции ПЦР в реальном времени для каждой пробы, отсутствие препятствий для амплификации в виде низкой концентрации ДНК, дополнительных мутаций или разрывов ДНК на исследуемом участке гена.
Если образец подходит для анализа мутации, осуществляют постановку аллель-специфичной ПЦР с тремя комплектами праймеров.
Первый прямой аллель-специфичный праймер, обозначенный ASF1, комплементарен дикому варианту гена, c-KIT не содержащему мутацию L576P, за исключением 3'-концевого нуклеотида:
ASF1:
где жирным шрифтом с подчеркиванием отмечен исследуемый нуклеотид, в данном случае, неизмененный мутацией тимин.
Второй аллель-специфичный праймер, обозначенный ASF2, комплементарен варианту гена c-KIT, содержащему мутацию L576P:
ASF2:
где жирным шрифтом с подчеркиванием отмечен исследуемый нуклеотид, в данном случае, измененный мутацией цитозин.
Третью реакцию осуществляют с праймером QF (последовательность представлена выше).
Обратный праймер ASR и флуоресцентный зонд ASP при этом остаются одинаковыми для всех трех реакций.
Таким образом, для постановки трех реакций ПЦР в реальном времени готовят в отдельных пробирках смеси со следующими сочетаниями праймеров и зонда:
первая смесь - ASF1, ASR, ASP; вторая смесь - ASF2, ASR, ASP; третья смесь - QF, ASR, ASP. Другие компоненты смесей - Tris-HCl (рН 8,8), KCl, Tween 20, MgCl2 в концентрации 5,5 мМ, дезоксинуклеозидтрифосфаты, глицерол, Taq-полимераза (использована SynTaq-полимераза (Синтол, Россия).
Температурный режим реакции: 95°C - 5 минут; 10 циклов чередования 95°C - 15 сек и 55°C - 1 мин, затем 40 циклов чередования 95°C - 15 сек и 55°C - 1 мин (детекция).
По окончании реакции производят расчеты разности значений пороговых циклов Ct (ΔCt) в следующих реакциях:
ΔCt1=(CtASFl-CtQF),
ΔCt2=(CtASF2-CtQF),
где CtASF1 - значение порогового цикла Ct в реакции с праймером ASF1, CtASF2 - значение порогового цикла Ct в реакции с праймером ASF2, CtQF - значение порогового цикла Ct в контрольной реакции с праймером QF.
Был проведен анализ 27 образцов меланомы, заключенных в парафиновые блоки, а также осуществлены реакции с искусственно синтезированными фрагментами ДНК 11 экзона гена KIT, содержащими и не содержащими исследуемую мутацию. В таблице 1 представлены результаты расчетов ΔCt1 и ΔCt2 для исследованных образцов.
Из таблицы 1 видно, что при отсутствии мутации в тканях значения их Ct почти совпадают, ограничиваясь только разницей в один искусственно неспаренный нуклеотид ΔCt1≤1,16. Это означает, что реакция с праймером ASF1 протекает в среднем с той же эффективностью, что и в контрольной реакции: Эффективность реакции с праймером ASF2 при этом заметно снижена: ΔCt2≥3,2.
При наличии мутации в 50% клеток ткани эффективность амплификации в реакции с праймером ASF2 повышается: ΔCt2≈ΔCt1.
При наличии 100% мутации, согласно теоретическим расчетам, должна отмечаться картина обратная варианту с отсутствием мутации: ΔCt1≥3,2, ΔCt2≤1,16, и в исследованном контрольном образце полученные данные попадают в указанные диапазоны.
Предлагаемый способ позволяет осуществлять детекцию мутации L576P гена c-KIT в ткани меланомы, фиксированной формалином и заключенной в парафиновый блок, в течение одного рабочего дня.
Пример 1
Образец опухолевой ткани пациента с диагнозом акрально-лентигинозная меланома с локализацией на кисти руки. Данный тип меланомы относится к типу меланом, способных содержать мутацию L576P гена c-KIT.
На рисунке 1А изображены графики изменения уровня флуоресценции в пробах при постановке реакций предлагаемым способом.
По результатам анализа значения пороговых циклов составили: CtQF=22,6 (черные графики флуоресценции), CtASF1=23,3 (темно-серые графики флуоресценции), CtASF2>40 (светло-серые графики флуоресценции).
ΔCt1=(23,3-22,6)=0,7<1,16
ΔCt2>3,2
Согласно предложенному способу в данном образце доля мутантной ДНК близка к 0%.
Полученные данные подтверждены секвенированием (Рисунок 1Б).
Таким образом, данному пациенту рекомендуется дальнейшее молекулярно-генетическое исследование.
Пример 2.
Образец меланомы, полученный от пациента с диагнозом поверхностно-распространяющаяся меланома. Графики изменения флуоресцентного сигнала в реакциях ПЦР в реальном времени представлены на рисунке 2А. В данном случае CtQF=22,8 (графики черного цвета), QASF1=22,9 (графики темно-серого цвета), CtASF2=26,1 (графики светло-серого цвета).
ΔCt1=(22,9-22,8)=0,1<1,16
ΔCt2=(26,1-22,8)=3,3>3,2
Согласно предложенному способу в данном образце доля мутантной ДНК близка к 0%. Результат подтвержден секвенированием (рисунок 2Б).
Данному пациенту рекомендуется дальнейшее молекулярно-генетическое исследование.
Пример 3.
Искусственно синтезированный образец ДНК, содержащий фрагмент 11 экзона гена KIT с мишеневым нуклеотидом. В приготовленной смеси 50% ДНК образца содержало мутацию L576P, тогда как другие 50% не содержали мутацию. При проведении реакции ПЦР в реальном времени по предложенному способу были получены графики роста уровня флуоресценции, представленные на рисунке 3. По результатам трех дублей реакции среднее значение CtQF составило 20,5, CtASF1=21,4, CtASF2=21,2.
ΔCt1=(21,4-20,5)=0,9
ΔCt2=(21,2-20,5)=0,7
Данному пациенту рекомендовано лечение препаратами-ингибиторами тирозинкиназ.
Пример 4.
Искусственно синтезированный образец ДНК 11 экзона гена KIT, содержащий мутацию L576P. При проведении реакции предложенным способом были получены графики изменения уровня флуоресценции, представленные на рисунке 4.
По результатам трех дублей реакции среднее значение CtQF составило 20,4, CtASF1=25,1, CtASF2=20,7
ΔCt1=(25,1-20,4)=4,7
ΔCt2=(20,7-20,4)=0,3
Данному пациенту рекомендовано лечение препаратами-ингибиторами тирозинкиназ.
Таким образом, результаты предложенного способа могут быть интерпретированы даже при наличии гетерогенности ткани по мутации L576P гена c-KIT или в случае гетерозиготной мутации.
Способ диагностики наличия мутации L576P гена c-KIT в тканях меланомы, включающий проведение полимеразной цепной реакции в реальном времени с аллель-специфичными праймерами, отличающийся тем, что оценку наличия мутации проводят по соотношениям значений пороговых циклов Ct в трех реакциях, смеси для постановки трех реакций готовят в отдельных пробирках и добавляют праймеры и зонды в следующих сочетаниях: первая смесь - ASF1, ASR, ASP; вторая смесь - ASF2, ASR, ASP; третья смесь - QF, ASR, ASP, где ASF1 (последовательность 5'-TTATGTTTACATAGACCCAACACAACTTT-3') - прямой праймер первого комплекта; ASF2 (5'-TTATGTTTACATAGACCCAACACAACCTT-3') - прямой праймер второго комплекта; QF (5'-CAATTATGTTTACATAGACCCAACACAAC-3') - прямой праймер третьего комплекта; ASR (5'-GAACAAAACAAAGGAAGCCACTG-3') - обратный праймер; ASP (5'-FAM-CCAGAAACAGGCTGAGTTTTGGTCAGT-BHQ1-3') - зонд; по результатам трех дублей реакции рассчитывают среднее значение CtQF, CtASF1, CtASF2, где CtQF - значение пороговых циклов Ct в реакции QF, CtASF1 - значение пороговых циклов Ct в реакции ASF1, CtASF2 - значение пороговых циклов Ct в реакции ASF2; при (CtASF1-CtQF)≤1,16 и (CtASF2-CtQF)≥3,2 доля мутантной ДНК в образце приближена к 0, при (CtASF1-CtQF)≈(CtASF2-CtQF) доля мутантной ДНК составляет 50%, при (CtASF1-CtQF)≥3,2, a (CtASF2-CtQF)≤1,16 доля мутантной ДНК приближена к 100%.