Способ моделирования подострого токсического поражения печени формалином
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для моделирования подострого токсического поражения печени формалином. Используют формалин (CH2O), который вводят крысам-самцам перорально, ежедневно, из расчета 0,1 мл на 100 г массы животного, в течение 14 дней. На 14 день животных декапитируют с последующим проведением лабораторных тестов и с исследованием печени. Получена модель подострого поражения, вызванная пероральным введением формалина (CH2O), выражающаяся в усилении дегенеративных процессов в печени, развивающейся креатининемии, повышении уровня трансаминаз, развитии холестаза и гистологически подтверждающаяся в выраженных дегенеративных повреждениях практически всех участков печени. Способ позволяет получить модель подострого поражения печени для использования в эксперименте. 2 табл.
Реферат
Изобретение относится к медицине, а именно к экспериментальной биологии, токсикологии, и может быть использовано для изучения формирования и прогрессирования изменений в печени, возникающих под действием токсико-химического повреждающего фактора.
Одно из ведущих мест профессиональной патологии у работников предприятий с особо вредными и опасными условиями труда занимают токсические поражения печени. Используемые на производствах гепатотропные вещества, например формалин, всасываются и депонируются в печени, подвергаясь метилированию, аминированию, карбоксилированию, окислению с участием ферментов гепатобилиарной системы [Т.Б. Попова, П.Н. Любченко, 1996; Л.Б. Лазебник, Э.Я. Селезнева, 2004]. При этом яды и продукты их дезинтоксикации оказывают неблагоприятное влияние на пигменто-, белково-, углеводообразующую и ферментативную функции печени, что сопровождается определенными гистоморфологическими сдвигами, проявляющиеся в воспалительной реакцией - токсическим поражением печени.
Использование формальдегида в производстве смол в качестве бактерицидного и бальзамического средства, фунгицида - в качестве промежуточных продуктов при производстве химических веществ и как компонента конечного использования потребительских товаров придает этому веществу определенное токсикологическое значение при экспериментальном моделировании токсических поражений печени.
Известны следующие способы моделирования токсического поражения печени в эксперименте: ежедневное использование вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением, с одновременным пероральным введением формалина (СН2О), крысам-самцам, через день, из расчета 0,2 мл на 100 г массы животного, в течение 21 дня, с последующим проведением лабораторных тестов и исследования печени (Козлова В.В, Котова М.Е., Репс В.Ф. Способ моделирования токсического гепатита формалином и этиловым спиртом в эксперименте. Изобретение, патент №2564758 от 09.10.2015 г.); подкожное введение крысам 50% масляного раствора четыреххлористого углерода (Литвинова, Е.С. Фармакологическая коррекция нарушений иммунного гомеостаза при сочетанном воздействии гепатотропных агентов и постоянного магнитного поля: автореферат дис. канд. мед. наук: 14.00.25. / Литвинова Елена Сергеевна. - Курск, 2005. - С. 22)
К недостаткам данных способов можно отнести введение четыреххлористого углерода в растворителе, подкожно, хотя большинство профессиональных заболеваний формируется при поступлении токсических веществ ингаляторно и per os, использование для моделирования токсичного соединения, а также сочетанное применение двух токсикантов, несколько усложняющее процесс моделирования.
Наиболее близким по технической сущности к предлагаемому изобретению является способ инициации токсического поражения печени путем перорального введения крысам-самцам четыреххлористого углерода (CCl4) марки ХЧ через день, из расчета 0,1 мл на 100 г массы животного, в течение 21 дня, с последующим проведением лабораторных тестов и с исследованием печени (Козлова В.В, Репс В.Ф., Котова М.Е. Способ моделирования токсического поражения четыреххлористым углеродом в токсикологическом эксперименте. Изобретение, патент №2487421 от 10.07. 2013 г.).
Недостатком данного способа является относительная длительность создания экспериментальной патологической модели подострого поражения (21 день), а также использование четыреххлористого углерода марки ХЧ, представляющего опасность для здоровья экспериментаторов и оказывающего побочные эффекты на нервную, дыхательную и мочеполовую системы экспериментальных животных, снижая процент выживаемости. При этом следует отметить, что временной показатель для создания экспериментальных моделей подострого токсического гепатита формалином при нашем варианте моделирования составляет 14 дней и при ежедневном введении токсиканта позволяет за более короткие сроки достигнуть желаемого результата.
Техническим результатом предлагаемого способа является решение задачи, заключающейся в создании модели подострого токсического поражения печени формалином в более короткие сроки, ежедневным пероральным введением, с соответствующей картиной поражения, физиологичным способом, с высокой воспроизводимостью и меньшей токсичностью для экспериментатора.
Преимущества предлагаемой модели в том, что она легко воспроизводима, является менее токсичной для экспериментатора и результат достигается за более короткий промежуток времени по сравнению с прототипом. Повышение воспроизводимости формирования подострого патологического процесса в печени достигается за счет ежедневного перорального введения формалина экспериментальным животным и сокращения сроков опыта до 14 дней.
Указанный технический результат достигается тем, что ежедневно перорально крысам-самцам вводили формалин (CH2O) из расчета 0,1 мл на 100 г массы животного, в течение 14 дней, с последующим проведением лабораторных тестов.
Для достижения адекватности предлагаемой модели изучено 50 крыс-самцов линии Вистар массой тела 200-215 г, разделенных на группы. Первую группу составляли 10 интактных животных. 20 крысам, представляющим вторую группу, ежедневно перорально вводили формалин (CH2O) из расчета 0,1 мл на 100 г массы животного, в течение 14 дней. 20 крысам третьей группы инициировалось токсическое поражение путем перорального введения крысам-самцам четыреххлористого углерода (CCl4) марки ХЧ через день, из расчета 0,1 мл на 100 г массы животного, в течение 21 дня, по способу прототипа.
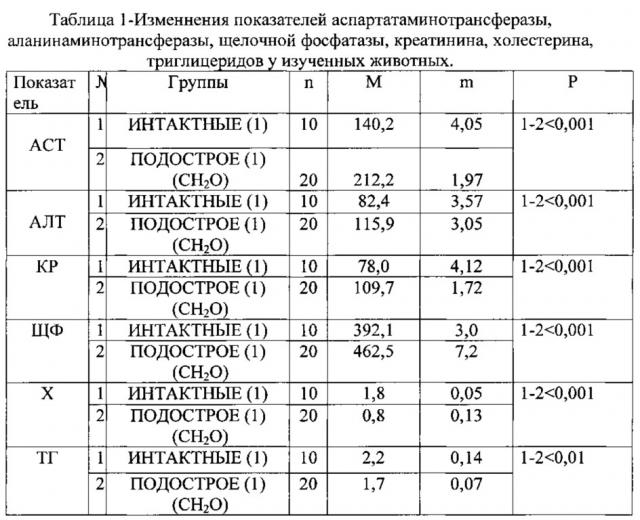
На 14 и 21 день животных декапитировали с последующим проведением лабораторных тестов и патоморфологических и гистологических исследований печени. Изучали содержание в сыворотке крови аспартатаминотрансферазы (ACT) и аланинаминотрансферазы (АЛТ) в Ед/л, креатинина (КР) в мкмоль/л, щелочной фосфатазы (ЩФ) в МЕ/л, холестерина (X) в ммоль/л, триглицеридов (ТГ) в ммоль/л.
Способ осуществлялся следующим образом. Группе животных в течение 14 дней ежедневно перорально вводили формалин (CH2O) из расчета 0,1 мл раствора на 100 г массы животного. Воспроизведение модели констатировали по изменению биохимических показателей, таких как содержание в сыворотке крови аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), креатинина (КР), щелочной фосфатазы (ЩФ), холестерина (X), триглицеридов (ТГ).
Приготовление формалина (CH2O) производили путем растворения формальдегида в воде до концентрации 40%.
Способ апробирован в условиях отдела изучения механизмов действия физических факторов (ОИМДФФ) ФГБУ ПГНИИК ФМБА России.
Объектом исследований послужили 50 крыс-самцов линии Вистар, разделенные на 3 группы - интактные, с моделью подострой интоксикации формалином и с моделью прототипа. По истечении срока эксперимента сравнивали полученную картину патогенетических реакций в системах, контролирующих метаболические реакции.
Способ может быть проиллюстрирован следующими примерами.
Интактная крыса-самец линии Вистар №3, масса тела 200 г. Дополнительных воздействий не получала. Исследование животного осуществлено одновременно с животными опытной группы. Содержание в крови КР - 78,5 мкмоль/л, ЩФ - 392,9 МЕ/л, ACT - 137,1 Ед/л, АЛТ - 80,0 Ед/л, X - 1,8 ммоль/л, ТГ - 2,1 ммоль/л.
Крыса-самец линии Вистар №11, масса тела - 205 г. Животному осуществлялось ежедневное пероральное введение формалина (CH2O) из расчета 0,1 мл на 100 г массы животного, в течение 14 дней. КР - 110,8 мкмоль/л, ЩФ - 454,2 МЕ/л, ACT - 202,0 Ед/л, АЛТ - 110,0 Ед/л, X - 0,8 ммоль/л, ТГ - 1,7 ммоль/л. Результат расценен как подострое отравление.
Крыса-самец №47 линии Вистар, масса тела 210 г. Через день, 1 раз в сутки, в течение 21 дня, перорально шприцем вводили 0,1 мл четыреххлористого углерода марки ХЧ (CCl4) на 100 г массы животного. Содержание в крови КР - 96,7 мкмоль/л, ЩФ - 500,2 МЕ/л, ACT - 299,5 Ед/л, АЛТ - 138,4 Ед/л X - 1,7 ммоль/л, ТГ - 1,9 ммоль/л. Результат расценен как подострое отравление.
Из представленной таблицы следует, что увеличение содержания ACT; АЛТ (Р<0,001), а также повышение КР (Р<0,001) в сыворотке крови указывают на усиление степени поражения печени и свидетельствуют о повреждении гепатоцитов, значительное снижение показателей X и ТГ (Р<0,001, Р<0,01) указывает на снижение синтетической функции печени, а повышение уровня ЩФ (Р<0,001) - на развитие холестаза.
Для подтверждения достоверности изменения полученных биохимических показателей дополнительно проведены патоморфологические и гистологические исследования, для чего изучены макро- и микропрепараты.
Макропрепараты
Группа 1. При патоморфологическом исследовании печень крыс нормальных размеров 2,5±0,5 см на 2,42±0,3 см, средняя масса 6,65±0,3 г. Капсула печени плотная, гладкая, блестящая; консистенция плотная. У всех крыс печень при разрезе красно-коричневого цвета, без патологических очагов.
Группа 2. При патоморфологическом исследовании печень некоторых крыс имела охряно-красный цвет, светло-коричневая с множественными кровоизлияниями. Орган гипертрофирован, в большинстве случаев рыхлый, в отдельных местах с уплотненными участками; размеры 4,3±0,4 см на 6,6±0,5 см; средняя масса 10,23±0,7 г. У большинства крыс печень на разрезе сухая, кровь не выступает, в ряде случаев кровь на разрезе выступает умеренно.
Подострое поражение подтверждается и увеличением в размере печени на 3,58 г или на 53,83%. Гепатотоксическое действие формалина на фоне приема 10% этилового спирта на печень крыс подтвердилось с достоверной вероятностью (Р<0,001).
Группа 1. Микроскопическая картина печени интактных животных без патологии. Балочное строение печени не нарушено. Гапатоциты содержат овальные ядра с хорошо просматриваемыми ядрышками. В единичных гепатоцитах выявлено наличие жировой дистрофии.
Группа 2. При гистологическом исследовании печени 20 отравленных крыс определяется дистрофия гепатоцитов в виде набухания, цитоплазма их мутная, границы клеток нечеткие, ядра также набухшие. Отдельные клетки очень крупные и представляют собой сплошную вакуоль. Основная локализация измененных гепатоцитов преимущественно в перипортальной зоне, тут же формируется дискомплексация печеночных балок, пролиферация соединительной ткани в портальных трактах с утолщением фиброзных тяжей. В описанных участках - лимфоплазмоцитарная инфильтрация с примесью единичных сегментоядерных лейкоцитов. В 30% случаев обнаружены мелкие очаги некрозов разных размеров, в которых структурные элементы клеток не визуализируются, а ткань печени представляет собой гомогенную бесструктурную массу. Среди клеток большое количество лейкоцитов, макрофагов. В целом, у подавляющего большинства крыс отмечена картина токсического гепатита с достаточно высокой интенсивностью повреждения тканей. Обнаруженные изменения свидетельствуют о развитии у животных типичной токсической дистрофии печени.
Таким образом, получена модель подострой интоксикации, вызванной формалином, выражающаяся в усилении дегенеративных процессов в печени, развивающейся креатининемии, развитии холестаза и гистологически подтверждающаяся в выраженных дегенеративных повреждениях практически всех участков печени, т.е. предлагаемый способ моделирования является достаточно информативным и показывает эффективность его использования в эксперименте.
Способ моделирования подострого токсического поражения печени, отличающийся тем, что используют формалин (СН2O), который вводят крысам-самцам перорально, ежедневно, из расчета 0,1 мл на 100 г массы животного, в течение 14 дней, с последующим проведением лабораторных тестов.