Новые вакцинные композиции, содержащие иммуностимулирующие олигонуклеотиды
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к ветеринарии и иммунологии, и может быть использовано для получения вакцинной композиции. Вакцинная композиция содержит антигенный компонент и адъювантный компонент, где антигенный компонент содержит антиген EHV (вирус герпеса лошадей) и адъювантный компонент содержит иммуностимулирующий олигонуклеотид Р-класса и масло SP. При этом масло SP содержит полиоксиэтилен-полиоксипропиленовый блоксополимер, сквалан и полиоксиэтиленсорбитана моноолеат, полученные в фармацевтически приемлемом разбавителе из одного из следующих: буфер, вода, обычный физиологический раствор или ростовые среды для культуры клеток, где указанное масло SP составляет 2-20% об./об. вакцинной композиции. Использование в заявленной вакцине в качестве адъюванта комбинации олигонуклеотида Р-класса и масла SP обеспечивает их синергитический эффект для усиления иммунного ответа на вакцину против вируса герпеса лошадей. 9 з.п. ф-лы, 8 табл., 2 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым адъювантам для усиления иммунного ответа на вакцины против лейшмании и вируса герпеса лошадей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Вирус герпеса лошадей представляет собой важный патоген лошадей, ответственный за индуцированные вирусом выкидыши, неврологическое заболевание, такое как парез, инфекции верхних дыхательных путей и заболевание новорожденных жеребят (NFD). NFD возникает из-за близкой ко времени родов трансплацентарной инфекции плодов, которые рождаются слабыми, с тяжелым респираторным заболеванием, и некоторые с желтухой из-за инфекции печени EHV-1 (вирус герпеса лошадей-1). Такие животные обычно умирают в течение нескольких суток после рождения. Вирус ринопневмонии лошадей (EHV-4) является главной причиной острого заболевания дыхательных путей («ринопневмонии») и инфицирует большинство лошадей в течение первых двух лет их жизни. Ринопневмония характеризуется лихорадкой, анорексией и обильными водянистыми выделениями из носа, которые позднее становятся слизисто-гнойными. В редких случаях инфекция EHV4 вызывает выкидыш у беременных кобыл. Кроме того, EHV1 и EHV4 формируют стойкие, продолжающиеся всю жизнь латентные инфекции. При повторной активации данные вирусы вызывают повторное заболевание, сопровождающееся выделением вируса и передачей к другим животным.
Контроль за инфекцией вирусом герпеса лошадей и вызванными им заболеваниями остается неадекватным, в частности, против выкидышей, опосредованных EHV1, пареза и заболевания новорожденных жеребят, возникающего из-за близкой ко времени родов трансплацентарной инфекции плода. Хотя доступны инактивированные, а также модифицированные живые вакцины, ни одна вакцина, по-видимому, не блокирует инфекцию в достаточной степени и не предупреждает формирования латентности, опосредованной вирусом дикого типа. Следовательно, имеется огромная потребность в безопасных вакцинах с улучшенной защитой против полевых инфекций данными вирусами, особенно против инфекций, вызванных EHV1.
Лейшманиоз является главным и тяжелым паразитарным заболеванием человека, псовых (собаки, волки, лисы, койоты, шакалы) и кошачьих (львы, тигры, домашние кошки, дикие кошки, другие крупные кошки и другие кошачьи, включая гепарда и рысь). Агентом, вызывающим лейшманиоз, является простейший паразит, и он принадлежит к комплексу Leishmania donovani. Этот паразит широко распространен в странах с сезонным и субтропическим климатом Южной Европы, Африки, Азии, Южной Америки и Центральной Америки (Desjeux P., Trans. R. Soc. Trop. Med. Hyg., 2001, 95: 239-43). Leishmania donovani infantum (L. infantum) вызывает заболевание кошачьих и псовых в Южной Европе, Африке и Азии. В Южной Америке и Центральной Америке болезнетворным агентом является Leishmania donovani chagasi (L. chagasi), которая является близкородственной с L. infantum. У человека болезнетворным агентом является Leishmania donovani donovani (L. donovani), которая является близкородственной с L. infantum и L. chagasi.
Данные паразиты вызывают висцеральный лейшманиоз и/или кожный лейшманиоз. Висцеральный лейшманиоз приводит к клиническим симптомам, таким как лихорадка, кахексия, гепатоспленомегалия (увеличение печени и селезенки) и цитопения крови. Кожный лейшманиоз встречается в разных проявлениях: от самоограничивающихся и даже самостоятельно проходящих кожных форм до смертельного системного заболевания. Поражения кожного лейшманиоза могут встречаться в любом месте на теле, но самыми обычными местами являются те места, которые подвергаются воздействию окружающей среды и, следовательно, являются более подверженными укусам москитов. Исходная папула быстро приводит к язве. Системный лейшманиоз является редким, но неизменно смертельным, если его не лечат незамедлительно. Системный лейшманиоз поражает внутренние органы организма, в частности, селезенку и печень.
У псовых данное заболевание ассоциировано с кожными симптомами или с висцеральными симптомами, или как с кожными, так и с висцеральными симптомами, и является смертельным в отсутствие терапии.
Было описано множество способов лечения, но ни один из них не является полностью удовлетворительным из-за токсичности самого лечения или тенденции животного к рецидиву.
Соответственно, требуются новые вакцинные композиции для защиты домашних животных против инфекций EHV и лейшманией.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении решаются недостатки предшествующего уровня техники путем предложения, в одном аспекте, вакцинной композиции, содержащей антигенный компонент, выбранный из группы, состоящей из антигена EHV или антигена лейшмании, и адъювантный компонент, где адъювантный компонент содержит иммуностимулирующий олигонуклеотид Р-класса и комбинацию сапонина и стерина; или масляную фазу, содержащую масло и возможно один или более чем один эмульгатор, причем указанная масляная фаза составляет 2-20% об./об. вакцинной композиции.
В одной совокупности воплощений иммуностимулирующий олигонуклеотид Р-класса, который может быть модифицирован и/или стабилизирован, присутствует в количестве 20-500 мкг на дозу, например, 100-250 мкг на дозу.
В одной совокупности воплощений адъювантный компонент содержит сапонин, такой как Quit А или его очищенную фракцию, и стерин, такой как холестерин, каждый в количестве примерно 5-100 мкг/мл. В конкретном воплощении каждый из Quil А и холестерина присутствует в количестве 50 мкг/мл.
В другом воплощении присутствуют масло и возможно по меньшей мере один эмульгатор (например, два эмульгатора), и масляная фаза содержит 2-20% об./об. (например, от примерно 5% до примерно 10%) вакцинной композиции. В конкретном воплощении масло представляет собой масло SP.
В некоторых воплощениях изобретения вакцинная композиция не является липосомной.
ПОДРОБНОЕ ОПИСАНИЕ ИЗБРАННЫХ ВОПЛОЩЕНИЙ
Следующие неограничивающие определения приведены для лучшего понимания изобретения.
Термин «примерно» или «приблизительно», при использовании в связи с измеримой числовой переменной, относится к указанному значению переменной и ко всем значениям переменной, которые находятся в пределах экспериментальной ошибки указанного значения (например, в пределах 95%-ного доверительного интервала среднего) или в пределах 10 процентов от указанного значения, независимо от того, какое из них является большим, если «примерно» не используется в связи с интервалами времени в неделях, где «примерно 3 недели» составляет от 17 до 25 суток, и от примерно 2 до примерно 4 недель составляет от 10 до 40 суток.
Термин «адъювант» означает любое вещество, которое увеличивает гуморальный или клеточный иммунный ответ на антиген. Адъюванты обычно используются для осуществления двух целей: медленного высвобождения антигенов из места инъекции и стимуляции иммунной системы.
Термин «антитело» относится к молекуле иммуноглобулина, которая может связываться со специфическим антигеном в результате иммунного ответа на данный антиген. Иммуноглобулины представляют собой сывороточные белки, состоящие из «легкой» и «тяжелой» полипептидных цепей, имеющих «константные» и «вариабельные» области, и подразделяемые на классы (например, IgA, IgD, IgE, IgG и IgM) на основе состава константных областей.
Термин «антиген» или «иммуноген» относится к любому веществу, которое стимулирует иммунный ответ. Данный термин включает умерщвленных, инактивированных, ослабленных или модифицированных живых бактерий, вирусов или паразитов. Термин «антиген» также включает полинуклеотиды, полипептиды, рекомбинантные белки, синтетические пептиды, белковый экстракт, клетки (включая опухолевые клетки), ткани, полисахариды или липиды, или их фрагменты, индивидуально или в любой их комбинации. Термин антиген также включает антитела, такие как антиидиотипические антитела или их фрагменты, и мимотопы синтетических пептидов, которые могут имитировать антиген или антигенную детерминанту (эпитоп).
Термин «бактерии» означает суспензию одной или более чем одной умерщвленной бактерии, которую можно использовать в качестве компонента вакцины или иммуногенной композиции.
Термин «буфер» означает химическую систему, которая предотвращает изменение концентрации другого химического вещества, например, системы донора и акцептора протонов служат в качестве буферов, предотвращающих заметные изменения концентрации иона водорода (pH). Дополнительным примером буфера является раствор, содержащий смесь слабой кислоты и ее соли (сопряженное основание) или слабого основания и его соли (сопряженная кислота).
«Клеточный иммунный ответ» или «клеточно-опосредованный иммунный ответ» представляет собой иммунный ответ, опосредованный Т-лимфоцитами или другими лейкоцитами, или и теми, и другими, и включает продукцию цитокинов, хемокинов и аналогичных молекул, продуцируемых активированными Т-клетками, лейкоцитами или и теми, и другими.
Термин «по существу состоящий» в том виде, в котором он применяется к адъювантным композициям, относится к композиции, которая не содержит неперечисленные дополнительные адъювантные или иммуномодулирующие агенты в количествах, в которых указанный агент оказывает измеримые адъювантные или иммуномодулирующие эффекты.
Термин «доза» относится к вакцине или иммуногенной композиции, которую дают субъекту. Термин «первая доза» или «примирующая вакцина» относится к дозе такой композиции, которую дают в сутки 0. Термин «вторая доза» или «третья доза», или «ежегодная доза» относится к количеству такой композиции, которое дают после первой дозы, которая может или может не представлять собой такую же вакцину или иммуногенную композицию, что и первая доза.
«Гуморальный иммунный ответ» относится к иммунному ответу, который опосредован антителами.
«Иммунный ответ» у субъекта относится к развитию гуморального иммунного ответа, клеточного иммунного ответа или гуморального и клеточного иммунного ответа на антиген. Иммунные ответы обычно можно определять с использованием стандартных иммуноанализов и анализов нейтрализации, которые известны в данной области.
«Иммунологически защитным количеством» или «иммунологически эффективным количеством» или «эффективным количеством для получения иммунного ответа» антигена является эффективное количество для индукции иммуногенного ответа у реципиента. Иммуногенный ответ может быть достаточным для диагностических целей или другого тестирования, или может быть адекватным для предупреждения признаков или симптомов заболевания, включая вредные эффекты на здоровье или их осложнения, вызванные инфекцией агентом, вызывающим заболевание. Могут индуцироваться либо гуморальный иммунитет, либо клеточно-опосредованный иммунитет, либо и тот, и другой. Иммуногенный ответ животного на иммуногенную композицию может оцениваться, например, опосредованно через измерение титров антитела, анализы пролиферации лимфоцитов, либо непосредственно через отслеживание признаков и симптомов после заражения штаммом дикого типа, тогда как защитный иммунитет, который дает вакцина, может оцениваться измерением, например, уменьшения клинических признаков, таких как смертность, заболеваемость, значение температуры, общее физическое состояние и общее состояние здоровья и активности субъекта. Иммунный ответ может включать, без ограничения, индукцию клеточного и/или гуморального иммунитета.
Термин «иммуногенный» означает вызывающий иммунный или антигенный ответ. Таким образом, иммуногенная композиция представляла бы собой любую композицию, которая индуцирует иммунный ответ.
Термин «иммуностимулирующая молекула» относится к молекуле, которая генерирует иммунный ответ.
Термин «липиды» относится к любой группе органических соединений, включающей жиры, масла, воски, стерины и триглицериды, которые являются нерастворимыми в воде, но растворимыми в неполярных органических растворителях, являются маслянистыми на ощупь, и вместе с углеводами и белками составляют основной структурный материал живых клеток.
Термин «фармацевтически приемлемый» относится к веществам, которые в пределах объема обоснованного медицинского заключения подходят для применения в контакте с тканями субъектов без чрезмерной токсичности, раздражения, аллергического ответа и тому подобного, соразмерно с приемлемым отношением пользы к риску, и являются эффективными для их намеченного применения.
Термин «реактогенность» относится к побочным эффектам, вызванным у субъекта в ответ на введение адъюванта, иммуногенной композиции или вакцинной композиции. Она может иметь место в месте введения и обычно оценивается в показателях развития числа симптомов. Данные симптомы могут включать воспаление, покраснение и абсцесс. Она также оценивается в показателях проявления, продолжительности и тяжести. «Слабая» реакция, например, включает припухлость, которая выявляется только пальпацией и не видна, или имеет короткую продолжительность. Более тяжелой реакцией, например, будет реакция, которая видна глазу или имеет большую продолжительность.
Термин «комнатная температура» означает температуру от 18 до 25°C.
Термин «сапонин» относится к группе поверхностно-активных гликозидов растительного происхождения, состоящих из гидрофильной области (обычно несколько цепей сахаров) в ассоциации с гидрофобной областью либо стероидной, либо тритерпеноидной структуры.
Термин «стероиды» относится к любой группе органических соединений, принадлежащих к биохимическому классу липидов, которые легко растворяются в органических растворителях и слегка растворимы в воде. Стероиды содержат систему четырех конденсированных колец из трех конденсированных циклогексановых (шестиуглеродных) колец плюс четвертого циклопентанового (пятиуглеродного) кольца.
Термин «стерины» относится к соединениям у животных, которые продуцируются биологически из терпеноидных предшественников. Они содержат структуру колец стероидов, имеющую гидроксильную группу (ОН), обычно присоединенную к углероду-3. Углеводородная цепь заместителя в виде жирной кислоты варьирует в длину, обычно от 16 до 20 атомов углерода, и может быть насыщенной или ненасыщенной. Стеролы обычно содержат одну или более чем одну двойную связь в структуре кольца и также целый ряд заместителей, присоединенных к кольцам. Стеролы и их сложные эфиры с жирными кислотами являются по существу нерастворимыми в воде.
Термин «субъект» относится к любому животному, для которого желательным является введение адъювантной композиции. Он включает млекопитающих и отличных от млекопитающих животных, включая приматов, домашний скот, животных-спутников, лабораторных опытных животных, диких животных, содержащихся в неволе, пернатых (в том числе in ovo), рептилий и рыб. Таким образом, данный термин включает обезьян, людей, свиней; крупный рогатый скот, овец, коз, лошадей, мышей, крыс, морских свинок, хомяков, кроликов, кошачьих, псовых, куриц, индеек, уток, другую домашнюю птицу, лягушек и ящериц.
Термин «терапевтически эффективное количество» относится к количеству антигена или вакцины, которое будет индуцировать иммунный ответ у субъекта, получающего антиген или вакцину, которое является адекватным для предупреждения или уменьшения признаков или симптомов заболевания, включая вредные эффекты на здоровье или их осложнения, вызванные инфекцией патогеном, таким как вирус или бактерия. Может индуцироваться гуморальный иммунитет или клеточно-опосредованный иммунитет, или и гуморальный, и клеточно-опосредованный иммунитет. Иммуногенный ответ животного на вакцину может оцениваться, например, опосредованно через измерение титров антител, анализы пролиферации лимфоцитов, или непосредственно через отслеживание признаков и симптомов после заражения штаммом дикого типа. Защитный иммунитет, который дает вакцина, может быть оценен путем измерения, например, уменьшения клинических признаков, таких как смертность, заболеваемость, значение температуры, общее физическое состояние и общее состояние здоровья и активности субъекта. Количество вакцины, которое является терапевтически эффективным, может варьировать, в зависимости от конкретного использованного адъюванта, конкретного использованного антигена или состояния субъекта, и может быть определено специалистом в данной области.
Термин «проведение лечения» относится к предупреждению расстройства, состояния или заболевания, по отношению к которому применяется такой термин, или к предупреждению или уменьшению одного или более чем одного симптома такого расстройства, состояния или заболевания.
«Лечение» относится к акту «проведения лечения», как определено выше.
Термин «тритерпеноиды» относится к большому и разнообразному классу встречающихся в природе органических молекул, образующихся из шести пятиуглеродных изопреновых (2-метил-1,3-бутадиен) звеньев, которые могут быть собраны и модифицированы тысячами способов. Большинство из них являются мультициклическими структурами, которые отличаются друг от друга функциональными группами и их основными углеродными скелетами. Данные молекулы можно обнаружить у всех классов живых существ.
Термин «вакцина» относится к композиции, которая включает антиген, как здесь определено. Введение вакцины субъекту приводит к иммунному ответу, обычно против одного или более чем одного конкретного заболевания. Количество вакцины, которое является терапевтически эффективным, может варьировать, в зависимости от конкретного используемого антигена или состояния субъекта, и может быть определено специалистом в данной области.
Как отмечено выше, согласно настоящему изобретению предложена вакцинная композиция, содержащая антигенный компонент, выбранный из группы, состоящей из антигена EHV или антигена лейшмании, и адъювантный компонент, где адъювантный компонент содержит (или, в разных совокупностях воплощений, по существу состоит, или, в еще одной другой совокупности воплощений, состоит) из иммуностимулирующего олигонуклеотида Р-класса и комбинации сапонина и стерина; или масла, причем указанное масло составляет 2-20% об./об. вакцинной композиции.
В одной совокупности воплощений вакцинные композиции по настоящему изобретению являются нелипосомными. В воплощениях, когда присутствует масло, антиген обычно будет диспергирован или растворен в водной фазе и не заключен в оболочку липосомами или аналогичными структурами. В воплощениях, когда присутствуют сапонин и стерин, указанные сапонины и указанные стерины будут образовывать спиральные мицеллы, и антиген будет находиться в смеси с указанными спиральными мицеллами, но не будет интегрирован в них.
Антигены
Для настоящего изобретения подходят разные антигены, происходящие из лейшмании или EHV. Данные антигены могут включать, без ограничения, целые организмы (инактивированные, ослабленные или живые модифицированные), нуклеотиды, полинуклеотиды, пептиды, полипептиды, рекомбинантные белки, синтетические пептиды, белковый экстракт, полисахариды, углеводы, жирные кислоты, тейхоевую кислоту, пептидогликаны, липиды или гликолипиды, индивидуально или в любой их комбинации.
Живые, живые модифицированные и ослабленные вирусные штаммы, которые не вызывают заболевания у субъекта, были выделены в невирулентной форме или были ослаблены с использованием способов, хорошо известных в данной области, включающих серийный пассаж в подходящей линии клеток или воздействие ультрафиолетового света или химического мутагена. Инактивированными или умерщвленными вирусными штаммами являются штаммы, которые были инактивированы способами, известными специалистам в данной области, включающими обработку формалином, бетапроприолактоном (BPL), бинарным этиленимином (BEI), стерилизующую радиацию, нагревание или другие такие способы.
Количество антигена, используемого для индукции иммунного ответа, будет значительно варьировать, в зависимости от используемого антигена, субъекта и уровня желательного ответа, и может быть определено специалистом в данной области. Для вакцин, содержащих живой модифицированный или ослабленный EHV, терапевтически эффективное количество антигена обычно варьирует от примерно 102 дозы заражения 50% культуры ткани (TCID50) до примерно 1010 TCID50 включительно. Для многих таких вирусов терапевтически эффективная доза обычно находится в интервале от примерно 102 TCID50 до примерно 108 TCID50 включительно. В некоторых воплощениях интервалы терапевтически эффективных доз составляют от примерно 103 TCID50 до примерно 106 TCID50 включительно. В некоторых других воплощениях интервалы терапевтически эффективных доз составляют от примерно 104 TCID50 до примерно 105 TCID50 включительно.
Для вакцин, содержащих инактивированный EHV, терапевтически эффективное количество антигена обычно составляет по меньшей мере примерно 100 относительных единиц на дозу и часто находится в интервале от примерно 1000 до примерно 4500 относительных единиц на дозу включительно. В других воплощениях терапевтически эффективное количество антигена находится в интервале от примерно 250 до примерно 4000 относительных единиц на дозу включительно, от примерно 500 до примерно 3000 относительных единиц на дозу включительно, от примерно 750 до примерно 2000 относительных единиц на дозу включительно, или от примерно 1000 до примерно 1500 относительных единиц на дозу включительно.
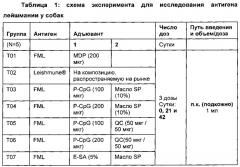
Число клеток для антигена лейшмании, введенных в вакцину, варьирует от примерно 1×102 до примерно 1×1010 на дозу включительно. В других воплощениях число клеток варьирует от примерно 1×103 до примерно 1×109 на дозу включительно или от примерно 1×104 до примерно 1×108 на дозу включительно, или от примерно 1×105 до примерно 1×107 на дозу включительно, или от примерно 1×106 до примерно 1×108 на дозу включительно.
Терапевтически эффективное количество антигена в вакцинах, содержащих инактивированные вирусы, также можно измерять в показателях относительной эффективности (RP) на мл. Терапевтически эффективное количество часто находится в интервале от примерно 0,1 до примерно 50 RP на мл включительно. В других воплощениях терапевтически эффективное количество антигена находится в интервале от примерно 0,5 до примерно 30 RP на мл включительно, от примерно 1 до примерно 25 RP на мл включительно, от примерно 2 до примерно 20 RP на мл включительно, от примерно 3 до примерно 15 RP на мл включительно или от примерно 5 до примерно 10 RP на мл включительно.
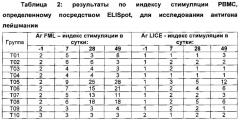
Подходящие неограничивающие примеры антигенов лейшмании включают целые организмы, белковые экстракты, гликопротеины, белки и экстракты наружного капсида и последовательности нуклеиновой кислоты, которые кодируют указанные белки наружного капсида. Конкретные антигены могут включать Gp63, PSA-2 и фукозно-маннозный лиганд. В другой сововкупности воплощений можно использовать экскреторно-секреторные антигены (ESA) лейшмании. Были идентифицированы ESA для по меньшей мере семнадцати ESA с относительными молекулярными массами 11, 13, 16, 18, 21, 23, 26, 33, 35, 42, 51, 54, 58, 64, 70 и 80 кДа. Обнаружили, что две фракции - F1 (11, 13 и 16 кДа) и F3 (26, 29 и 33 кДа) являются сильно иммуногенными, так как они значительно индуцировали активности NADPH оксидазы и SOD (супероксиддисмутаза), а также продукцию NOx, TNF-α (фактор некроза опухоли-альфа), IFN-γ (интерферон-гамма) и IL-12 (интерлейкин-12) в стимулированных макрофагах RAW 264.7. Кроме того, данные антигены также индуцировали значительную пролиферацию человеческих одноядерных клеток периферической крови с повышенной продукцией IFN-γ и IL-12. См. Gour et al., Experimental Parasitology, 2012; 132(3), 355-361.
Самыми обычными разновидностями EHV являются EHV-1 и EHV-4. EHV состоит из икосаэдрического нуклеокапсида, содержащего вирусный геном, окруженного аморфной оболочкой, которая содержит одиннадцать гликопротеинов (gB, gC, gD, gE, gG, gH, gI, gK, gL, gM и gN). См. Paillot et al., Open Vet Sc J, 2008; 2: 68-91.
Подходящие неограничивающие примеры антигенов EHV включают цельные вирусы (инактивированные, ослабленные и живые модифицированные), белковые экстракты, белки оболочки и последовательности нуклеиновых кислот, которые кодируют указанные белки, а также рекомбинантные антигены субъединиц или векторные антигены.
Сапонины и CpG
Тритерпеноидные сапонины, подходящие для применения в адъювантных композициях, можно получать из многих источников, они могут либо происходить из растений, либо являться синтетическими эквивалентами, включая экстракты Quillaja saponaria, томатина, жень-шеня, грибы, и гликозиды алкалоидов, аналогичные по структуре стероидным сапонинам. Таким образом, подходящие для применения в адъювантных композициях тритерпеноиды включают сапонины, сквален и ланостерол. Количество подходящих для применения в адъювантных композициях тритерпеноидов зависит от природы используемого тритерпеноида. Однако они обычно используются в количестве от примерно 1 мкг до примерно 5000 мкг на дозу. Они также используются в количестве от примерно 1 мкг до примерно 4000 мкг на дозу, от примерно 1 мкг до примерно 3000 мкг на дозу, от примерно 1 мкг до примерно 2000 мкг на дозу и от примерно 1 мкг до примерно 1000 мкг на дозу. Они также используются в количестве от примерно 5 мкг до примерно 750 мкг на дозу, от примерно 5 мкг до примерно 500 мкг на дозу, от примерно 5 мкг до примерно 200 мкг на дозу, от примерно 5 мкг до примерно 100 мкг на дозу, от примерно 15 мкг до примерно 100 мкг на дозу и в количестве от примерно 30 мкг до примерно 75 мкг на дозу.
При использовании сапонина адъювантные композиции обычно содержат фракцию иммунологически активного сапонина из коры Quillaja saponaria. Сапонин может представлять собой, например, Quil А или другой препарат очищенного или частично очищенного сапонина, который можно приобрести коммерчески. Например, Quil А в США продает компания Е.М. Sergeant. QS-7, QS-17, QS-18 и QS-21 можно приобрести у компании Antigenics, Массачусетс, США. Таким образом, экстракты сапонина можно использовать в виде смесей или очищенных индивидуальных компонентов, таких как QS-7, QS-17, QS-18 и QS-21. В одном воплощении Quil А является по меньшей мере на 85% чистым. В других воплощениях Quil А является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% чистым.
Олигонуклеотиды CpG представляют собой недавно описанный класс фармакотерапевтических агентов, которые характеризуются присутствием неметилированного динуклеотида CG в контекстах специфической последовательности оснований (мотив CpG). (Hansel ТТ, Barnes PJ (eds): New Drugs for Asthma, Allergy and COPD. Prog Respir Res. Basel, Karger, 2001, vol 31, pp 229-232, которая включена сюда посредством ссылки). Такие мотивы CpG не наблюдаются в эукариотической ДНК, в которой динуклеотиды CG супрессированы, и, если присутствуют, обычно являются метилированными, но присутствуют в бактериальной ДНК, которой они придают иммуностимулирующие свойства.
В адъювантах по настоящему изобретению используется так называемый иммуностимулирующий олигонуклеотид Р-класса, более предпочтительно, модифицированные иммуностимулирующие олигонуклеотиды Р-класса. Иммуностимулирующие олигонуклеотиды Р-класса представляют собой олигонуклеотиды CpG, характеризующиеся присутствием палиндромов, обычно имеющих длину 6-20 нуклеотидов. Олигонуклеотиды Р-класса имеют способность к спонтанной самосборке в конкатемеры in vitro и/или in vivo. Данные олигонуклеотиды, в строгом смысле, являются одноцепочечными, но присутствие палиндромов обеспечивает образование конкатемеров или возможно структур типа «стебель-петля». Общая длина иммуностимулирующих олигонуклеотидов Р-класса составляет от 19 до 100 нуклеотидов, например, 19-30 нуклеотидов, 30-40 нуклеотидов, 40-50 нуклеотидов, 50-60 нуклеотидов, 60-70 нуклеотидов, 70-80 нуклеотидов, 80-90 нуклеотидов, 90-100 нуклеотидов.
В одном аспекте изобретения иммуностимулирующий олигонуклеотид содержит 5' активирующий домен TLR (Toll-подобный рецептор) и по меньшей мере две палиндромные области, причем одна палиндромная область представляет собой 5' палиндромную область из по меньшей мере 6 нуклеотидов в длину, соединенную с 3' палиндромной областью из по меньшей мере 8 нуклеотидов в длину либо непосредственно, либо через спейсер.
Иммуностимулирующие олигонуклеотиды Р-класса могут быть модифицированы согласно методикам, известным в данной области. Например, J-модификация относится к нуклеотидам, модифицированным йодом. Е-модификация относится к нуклеотиду(ам), модифицированному(ым) этилом. Таким образом, Е-модифицированные иммуностимулирующие олигонуклеотиды Р-класса представляют собой иммуностимулирующие олигонуклеотиды Р-класса, в которых по меньшей мере один нуклеотид (предпочтительно 5' нуклеотид) является этилированным. Дополнительные модификации включают присоединение 6-нитро-бензимидазола, О-метилирование, модификацию проинил-dU, модификацию инозином, присоединение 2-бромвинила (предпочтительно к уридину).
Иммуностимулирующие олигонуклеотиды Р-класса также могут содержать модифицированную межнуклеотидную связь, включающую, без ограничений, фосфодиэфирные связи и фосфоротиоатные связи. Олигонуклеотиды по настоящему изобретению могут быть синтезированы или получены из коммерческих источников.
Олигонуклеотиды Р-класса и модифицированные олигонуклеотиды Р-класса дополнительно раскрыты в опубликованной заявке РСТ № WO 2008/068638, опубликованной 12 июня 2008 года. Подходящие неограничивающие примеры модифицированных иммуностимулирующих олигонуклеотидов Р-класса приведены ниже ("*" относится к фосфоротиоатной связи, и «_» относится к фосфодиэфирной связи).
Количество иммуностимулирующего олигонуклеотида Р-класса для применения в адъювантных композициях зависит от природы используемого иммуностимулирующего олигонуклеотида Р-класса и намеченного вида. Однако они обычно используются в количестве от примерно 20 мкг до примерно 500 мкг на мл. Они также используются в количестве от примерно 25 мкг до примерно 400 мг на мл, от примерно 40 мкг до примерно 250 мкг на мл, от примерно 50 мкг до примерно 200 мкг на мл, от примерно 100 мкг на мл до примерно 200 мкг на мл.
Стерины
Стерины, подходящие для применения в адъювантных композициях, включают β-ситостерин, стигмастерин, эргостерин, эргокальциферол и холестерин. Данные стерины хорошо известны в данной области и могут быть приобретены коммерчески. Например, холестерин раскрыт в Merck Index, 12th Ed., p. 369. Количество стеринов, подходящих для применения в адъювантных композициях, зависит от природы используемого стерина. Однако они обычно используются в количестве от примерно 1 мкг до примерно 5000 мкг на мл. Они также используются в количестве от примерно 1 мкг до примерно 4000 мкг на мл, от примерно 1 мкг до примерно 3000 мкг на мл, от примерно 1 мкг до примерно 2000 мкг на мл и от примерно 1 мкг до примерно 1000 мкг на мл. Они также используются в количестве от примерно 5 мкг до примерно 750 мкг на мл, от примерно 5 мкг до примерно 500 мкг на мл, от примерно 5 мкг до примерно 200 мкг на мл, от примерно 5 мкг до примерно 100 мкг на мл, от примерно 15 мкг до примерно 100 мкг на мл и от примерно 30 мкг до примерно 75 мкг на мл.
Получение композиций, содержащих сапонин и стерин, согласно настоящему изобретению находится в пределах обычной квалификации в данной области. Вкратце, получают водную смесь, причем указанная смесь содержит антиген, иммуностимулирующий олигонуклеотид Р-класса и сапонин. Стерин затем постепенно (или по каплям) добавляют в данную смесь.
Масляная фаза
В дополнительных воплощениях адъювантный компонент содержит масляную фазу в количестве от примерно 2 до примерно 20% об./об. вакцинной композиции, например, от примерно 3 до примерно 15%, от примерно 5 до примерно 15%, от примерно 10 до примерно 15%, от примерно 10 до примерно 20% и т.д. Масляная фаза обычно содержит масло и возможно один или более чем один эмульгатор. В одном воплощении масляная фаза содержит два эмульгатора, один из которых является липидорастворимым, а другой является водорастворимым.
Для применения по настоящему изобретению подходят многочисленные масла и их комбинации. Данные масла включают, без ограничения, животные масла, растительные масла, а также неметаболизируемые масла.
Неограничивающими примерами растительных масел, подходящих для целей настоящего изобретения, являются кукурузное масло, арахисовое масло, соевое масло, кокосовое масло и оливковое масло. Неограничивающим примером животных масел является сквалан. Подходящие неограничивающие примеры неметаболизируемых масел включают легкое минеральное масло, насыщенные масла с прямой или разветвленной цепью, сквалан и тому подобное.
В одной совокупности воплощений, масло, используемое в адъювантных композициях по настоящему изобретению, представляет собой легкое минеральное масло. Термин «минеральное масло» в том виде, как он здесь используется, относится к смеси жидких углеводородов, полученных из петролатума посредством методики перегонки. Данный термин синонимичен «ожиженному парафину», «жидкому петролатуму» и «белому минеральному маслу». Подразумевается, что данный термин также включает «легкое минеральное масло», т.е. масло, которое аналогичным образом получают перегонкой петролатума, но которое имеет немного меньшую удельную плотность, чем белое минеральное масло. См., например, Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pa.: Mack Publishing Company, 1990, на страницах 788 и 1323). Минеральное масло можно получать из разных коммерческих источников, например, J. Т. Baker (Phillipsburg, Pa.), USB Corporation (Кливленд, Огайо). Предпочтительным минеральным маслом является легкое минеральное масло, имеющееся в продаже под названием DRAKEOL®.
В другой совокупности воплощений масло представляет собой масло SP, которое содержит полиоксиэтилен-полиоксипропиленовый блоксополимер (доступный от BASF, Mt. Olive, NJ), сквалан (доступный от Kodak, Rochester, NY), и полиоксиэтиленсорбитана моноолеат (TWEEN®80, доступный от Sigma Chemical, St. Louis, МО). Сквалан используется в количестве приблизительно 5% (масс/об.), полиоксиэтилен-полиоксипропиленовый блоксополимер используется в количестве приблизительно 2,5% (масс/об.), полиоксиэтиленсорбитана моноолеат (TWEEN®-80) используется в количестве приблизительно 0,2% (масс/об.), полученные в фармацевтически приемлемом разбавителе из одного из следующих: буфер, вода, обычный физиологический раствор или ростовые среды для культуры клеток.
Масляная фаза включает масло и растворимые в масле эмульгаторы (например, SPAN 80), при наличии любых таких эмульгаторов. Объем масляной фазы рассчитывается как сумма объемов масла и растворимого в масле эмульгатора. Таким образом, например, если объем масла составляет 10%, и объем растворимого в масле эмульгатора составляет 2% от композиции, тогда масляная фаза присутствовала бы в количестве 12% об./об. композиции. Аналогичным образом, если масло присутствует в количестве примерно 5%, и липидорастворимый эмульгатор присутствует в количестве примерно 6% композиции, тогда масляная фаза присутствует в количестве примерно 11% об./об. композиции.
Подходящие для применения в настоящем изобретении эмульгаторы включают природные биологически совместимые эмульгаторы и неприродные синтетические поверхностно-активные вещества. Биологически совместимые эмульгаторы включают фосфолипидные соединения или смесь фосфолипидов. Предпочтительными фосфолипидами являются фосфатидилхолины (лецитин), такие как соевый или яичный лецитин. Лецитин может быть получен в виде смеси фосфатидов и триглицеридов посредством промывки водой неочищенных растительных масел и разделения и сушки образующихся гидратированных камедей. Очищенный продукт может быть получен фракционированием смеси в отношении нерастворимых в ацетоне фосфолипидов и гликолипидов, остающихся после удаления триглицеридов и растительных масел посредством промывки ацетоном. В качестве альтернативы, лецитин может быть получен из разных коммерческих источников. Другие подходящие фосфолипиды включают фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, фосфатидную кислоту, кардиолипин и фосфатидилэтаноламин. Фосфолипиды могут быть выделены из природных источников или синтезированы традиционными способами.
В дополнительных воплощениях используемые здесь эмульгаторы не включают лецитин, или лецитин используется в количестве, которое не является имм