Фармацевтический ниосомальный гель на основе вещества n-гидрокси-2-(2-(нафтален-2-ил)-1h-индол-3-ил)-2-фенилацетамид с противоопухолевой активностью к глиобластоме
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к композиции для лечения злокачественной опухоли мозга - глиобластомы. Композиция представляет собой ниосомальный гель, содержащий инкапсулированное в ниосомы синтезированное вещество N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид. Осуществление изобретения позволяет повысить эффективность транспорта противоопухолевого вещества в клетки мишени, что позволяет повысить терапевтическое действие ниосомального геля для лечения глиобластомы. 1 табл., 2 ил.
Реферат
Ограничением для терапевтического использования противоопухолевых веществ является их токсичность по отношению к здоровым тканям. Эффективным способом ее снижения считается использование противоопухолевых веществ не в свободной форме, а в составе лекарственных композиций с переносчиком (транспортная система), влияющих на биораспределение лекарства в организме.
Широкое применение на сегодняшнее время находят такие формы противоопухолевых веществ, которые обеспечивают сохранение или увеличение терапевтического противоопухолевого действия при снижении побочных эффектов. Наиболее распространенные системы доставки - липосомальные формы, основанные на фосфолипидах. Преимущества липосомальной формы в настоящее время связаны в первую очередь с улучшенной фармакокинетикой и снижением побочных эффектов. Известен липосомальный препарат доксорубицина, основанный на включении доксорубицина в состав фосфолипидных наночастиц (НФ-доксорубицин), что снижает процент лекарства, связанного с форменными элементами крови (Патент РФ №2411935).
Наиболее близким к заявляемому изобретению является лечение глиобластомы при использовании липидных наноконтейнеров для доставки противоопухолевых веществ. Израильские ученые сообщили об эксперименте по лечению глиобластомы у лабораторных мышей с помощью наночастиц, доставляющих к опухоли малые интерферирующие РНК. Такие молекулы способны блокировать производство белков злокачественными клетками (Zvi R. Cohen, Srinivas Ramishetti, Naama Peshes-Yaloz, Meir Goldsmith, Anton Wohl, Zion Zibly, Dan Peer. Localized RNAi therapeutics of chemoresistant grade IV glioma using hyaluronan-grafted lipid-based Nanoparticles / Jornal ACS Nano, 2015, 9 (2), pp 1581-1591). Однако использование нанопереносчиков, основанных на гиалуроновой кислоте и липидах, имеет свои недостатки, они быстро разрушаются, так как они являются субстратом для перикисного окисления липидов (ПОЛ). В результате чего образуются высокореактивные альдегидные продукты ПОЛ, что приводит к нарушению метаболизма клетки. Кроме того, крупные липидные частицы взаимодействуют с макрофагами организма, что ускоряет развитие лекарственной устойчивости.
Таким образом, каждая из имеющихся на рынке липосомальных форм противоопухолевых препаратов обладает определенными недостатками: низкая стабильность, высокая себестоимость, быстрое выведение липосом из крови, которое связано с поглощением их ретикуло-эндотелиальной системой (РЭС) печени и селезенки, чему способствует их относительно большой размер - выше 150 нм, в сочетании с незащищенной поверхностью.
Целью предлагаемого изобретения является создание такой формы, которая увеличивала бы время ее циркуляции в кровяном русле в несколько раз. С учетом того, что в зоне пораженной опухолью ткани кожи имеют быть место ишемические процессы, особенно необходима трансдермальная пролонгированная доставка лекарственного препарата. Эта задача решается за счет инкапсулирования синтезированного вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид в кремнийорганические нановезикулы - ниосомы, имеющие размер до 100 нанометров. По отношению к прототипу заявляемое изобретение отличает то, что в отличие от липосом ниосомы обладают рядом преимуществ. В частности, ниосомы кремнийорганической природы, являясь неионогенным поверхностно-активным веществом, обладают большей проникающей способностью, чем липосомы. Они структурно сходны с липосомами в наличии бислоя, однако кремнийорганические компоненты, используемые для приготовления ниосом сделали их более стабильными. Молекулы ниосом, как правило, ориентируются таким образом, что гидрофильные концы неионогенного поверхностно-активного вещества направлены наружу, а гидрофобные концы обращены друг к другу, чтобы сформировать бислой. Ниосомы являются осмотически активными, их химическая стабильность обусловила более длительный срок хранения по сравнению с липосомами. Они могут повысить терапевтическую эффективность молекул лекарственного вещества, защищая препарат от клеток ретикуло-эндотелиальной системы, так как их размер менее 100 нанометров делает их невидимыми для этих клеток. Это улучшает доступность ниосом к клеткам-мишеням и возможность контролируемой доставки лекарственных средств. Таким образом, их главное достоинство, как целевых носителей, заключается в длительной циркуляции в кровотоке и, как следствие, пролонгированной доставке в ниосомах противоопухолевого синтезированного вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид.
Сущность изобретения
Конструирование предлагаемого лекарственного геля заключается в иммобилизации синтезированного противоопухолевого вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид в кремнийорганические везикулы - ниосомы, обладающие высокой трансдермальной проникающей способностью. Данная рецептура позволяет плавно наращивать терапевтическую дозу и повысить эффективность препарата за счет депонирования препарата. Встраивание синтезированного противоопухолевого вещества в кремнийорганические наноструктуры - ниосомы, обладающие значительной липофильностью, позволяет ему не попадать в здоровые ткани, проникая лишь через дефектные капилляры глиобластомы. Трансдермальный путь введения позволяет снизить токсический эффект препарата.
Предлагаемое противоопухолевое средство представляет собой стабильный, однородный гель для наружного применения.
Осуществление изобретения
В качестве поверхностно активного соединения для формирования ниосом использовали ПЭГ-12 диметикон. Предварительно взвешивали 40 мг кристаллообразного вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид и растворяли в 1 мл этилового спирта. Затем готовили молярные концентрации компонентов противопухолевого препарата. Первоначально добавляли 1,2-пропиленгликоль и готовили раствор вещества в концентрации 1 мМ (миллимоль/литр пропиленгликоля). Для иммобилизации в ниосомы противоопухолевого вещества использовали ультразвук. Дисперсию ниосом и противопухолевое вещество N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид в 1,2-пропиленгликоле помещали в сосуд для ультразвуковой обработки. Режим озвучивания: частота - 20 кГц, мощность - 200 Вт, экспозиция - 10 минут. При этом образовывались монола-меллярные ниосомы с включенным иммобилизируемым противоопухолевым средством размером менее 100 Нм. Инкапсулировали противоопухолевое вещество в ниосомы и получали опытные образцы препарата с концентрацией в 1, 5 и 10 мкМ (микромоль/литр ниосом).
Затем эмульсию ниосом эмульгировали с очищенной водой до 1000 мл, содержащей 50 мл гелеобразователя. В заключительной стадии для формирования «пространственной сетки» полимера добавляли 20 мл триэтаноламина.
Количественный состав противопухолевого ниосомального геля:
| N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид | 4 мг |
| ПЭГ-12 диметикон (ниосомы) | 100 мл |
| Гелеобразователь | 50 мл |
| Триэтаноламин | 20 мл |
| Вода очищенная | до 1000,0 мл |
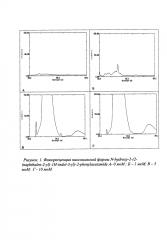
Установлена способность проотивоопухолевого вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид к флуоресценции при длине волн возбуждения и эмиссии, которые составили Еех=322 нм и Ееm=422 нм. Исследовали несколько опытных образцов препарата с содержанием в ниосомах количества противоопухолевого вещества, равного 1, 5 и 10 мкМ (микромоль).
При повышении концентрации этого вещества в ниосомах наблюдалось увеличение интенсивности флуоресценции (рис. 1). На основании полученных результатов построили калибровочную кривую для изучения степени включения противоопухолевого вещества в ниосомы. Эффективность включения вещества в ниосомы определяли по формуле:
ЭВ=С ниос/С общ×100,
где ЭВ - эффективность включения, С ниос - концентрация препарата в ниосомах, С общ - общая концентрация препарата в растворе, мкМ.
В результате установлено, что эффективность включения противоопухолевого вещества в ниосомы составляла более 80% и зависит от концентрации вносимого вещества (табл. 1).
Изучение механизмов проникновения противоопухолевого вещества в живые клетки, т.е. взаимодействие этих соединений с клеточными мембранами, является очень важным при исследовании эффективности биологического действия in vivo. С целью сравнительного изучения механизмов повышения эффективности переноса противоопухолевого вещества в ниосомальной и липосомальной формах проводили измерение микровязкости мембран. Для этого использовали метод латеральной диффузии гидрофобного флуоресцентного зонда пирена. Определение микровязкости было основано на образовании эксимеров (активных димеров) пирена в липидном окружении. Флуоресценцию пирена измеряли спектрофлуорометрически на спектрофлуориметре RF-5301PC (Шимадзу, Япония) при длине волны возбуждения 334 нм, длина волны мономеров - 395 нм, длина волны эксимеров - 470 нм.
Взаимодействие ниосомальной формы противоопухолевого вещества изменяло структурное состояние мембран (увеличением текучести липидного компонента в целом и в особенности в области белок-липидных контактов; возрастанием полярности окружения молекул пирена). Так, реакция образования эксимера пирена лимитируется скоростью диффузии в области жирнокислотных цепей липидов, что позволяет исследовать текучесть мембран по отношению 1 эк/1 м, которое зависит от гидрофобного объема, доступного для пирена, а также от подвижности углеводородных цепей липидов. В нашем случае увеличение флуоресценции эксимерной формы свидетельствует, что ниосомы обладают более низкой микровязкостью по сравнению с липосомами, образованными фосфолипидами. Наличие кремний органических полимеров в составе ниосом делает их более стабильными и осмотически активными по сравнению с липосомами (рис. 2).
При увеличении текучести мембрана становится более проницаемой для воды и других малых гидрофильных молекул, растет скорость латеральной диффузии интегральных белков. Если активный центр интегрального белка, осуществляющий некую функцию, располагается исключительно в гидрофильной его части, то изменение текучести липидов, вероятно, не скажется слишком сильно на активности белка. Но если белок выполняет транспортную функцию и транспортный компонент пересекает мембрану, то изменения свойств липидной фазы могут привести к значительному изменению скорости транспорта веществ через мембраны. В нашем случае показанные выше фенотипические особенности воздействия на раковые клетки 2-арил-2-(3-индолил) ацетогидроксамовых кислот могут быть связаны с такими не апоптотическими типами гибели клеток, как некроз, аутофагия, параптоз, метуозис. Это необходимо учитывать в качестве альтернативной стратегии борьбы с опухолями, резистентными к апоптозу.
Эксперимент показал, что инкапсулирование противоопухолевого вещества в ниосомы составило не менее 80%. Встраивание ниосом в клеточные мембраны повышает эффективность транспорта противоопухолевого вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид в клетки мишени, что позволит повысить терапевтическое действие ниосомального геля для лечения глиобластомы.
Фармацевтический ниосомальный гель на основе вещества N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид с противоопухолевой активностью к глиобластоме, содержащий:
| N-гидрокси-2-(2-(нафтален-2-ил)-1H-индол-3-ил)-2-фенилацетамид | 4 мг |
| ПЭГ-12 диметикон - ниосомы | 100 мл |
| Гелеобразователь | 50 мл |
| Триэтаноламин | 20 мл |
| Вода очищенная | до 1000,0 мл |