Способ коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиологии, и может быть использовано для коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда. Для этого пациентам за 30 минут до реканализации вводят внутривенно капельно в течение 30 минут 20 мл раствора Цитофлавин, разведенного в 250 мл 5% раствора глюкозы. Изобретение обеспечивает стабилизирующее влияние на процессы пероксидации, повышает активность антиоксидантной системы, обеспечивая предупреждение реперфузионного повреждения и улучшение функционального состояния ишемизированного миокарда. 2 табл., 2 пр.
Реферат
Изобретение относится к медицине, в частности к кардиологии и клинической фармакологии, может быть использовано для коррекции процессов перекисного окисления липидов биомембран с целью профилактики реперфузионных осложнений и найти применение в клинической практике в комплексном лечении больных острым инфарктом миокарда.
Восстановление кровотока в окклюзированной коронарной артерии является решающим фактором в улучшении прогноза при остром инфаркте миокарда, однако повышается вероятность возникновения реперфузионных аритмий (РА), в основе развития которых лежит совокупность взаимодополняющих друг друга и взаимосвязанных кислородного и кальциевого парадоксов: с одной стороны, неблагоприятные эффекты реоксигенации ишемизированной ткани с образованием свободных радикалов кислорода; с другой, избыточное поступление ионов кальция из экстрацеллюлярного пространства внутрь кардиомиоцита с последующим нарушением функции митохондрий, снижением продукции аденозинтрифосфата (АТФ), образованием контрактуры кардиомиоцита и, в последующем, их гибелью [1, Бобров В.А. и соавт., Терапевтический архив, 1993].
Положительное влияние кислорода на функциональное состояние сердца в раннем периоде инфаркта миокарда во многом обусловлено уменьшением размеров зоны ишемии и сохранением большего количества кардиомиоцитов, способных к эффективному сокращению, однако реоксигенация является важным фактором, способствующим повышению интенсивности процессов перекисного окисления липидов (ПОЛ) на фоне снижения активности антиоксидантной системы (АОС), что является патогенетической основой формирования окислительного стресса, базируемого на накоплении продуктов радикального характера и липидных перекисей. Увеличение концентрации продуктов пероксидации над стационарным уровнем рассматривается как универсальный механизм повреждения клетки при различных патологических состояниях, в том числе и при остром инфаркте миокарда [2, Патент РФ №2178704]. Известно, что продукты ПОЛ (перекиси) крайне аритмогенны [3, Михин В.П., Архив внутренней медицины, 2014]. В связи с этим использование антиоксидантных препаратов, снижающих интенсивность процессов ПОЛ и содержание продуктов пероксидации, позволит осуществлять профилактику и лечение реперфузионных аритмий, связанных с активацией перекисных процессов в зоне реперфузии.
Известны способы повышения антиоксидантного статуса теплокровного организма в условиях воздействия прооксидантных факторов введением синтетических препаратов антиоксидантного действия - дибунола, токоферола ацетата и др. [4, Машковский М.Д., Лекарственные средства, 2010; 5, Доровских В.А., Антиоксиданты в профилактике и коррекции холодового стресса, 2000; 6, Степанова М.С., автореф. дис. канд. биол. наук, 2009]. Недостатками этих способов являются необходимость применения фармакологических препаратов синтетического происхождения, имеющих ряд побочных и токсических эффектов и относительно высокую себестоимость.
Известны способ коррекции процессов перекисного окисления липидов биомембран в условиях ультрафиолетового облучения [7, Патент РФ №2550016]; способ коррекции процессов липопероксидации в эксперименте [8, Патент РФ №2393891]; способ предотвращения нарастания интенсивности ПОЛ у животных с инфарктом миокарда введением сукцината и солей янтарной кислоты [9, Маркиянова С.С. и соавт., Пермский медицинский журнал, 2008]; способ коррекции метаболических сдвигов в ишемизированном миокарде у животных внутривенным введением цитофлавина [10, Бизенкова М.Н. и соавт., Современные проблемы науки и образования, 2005]. При этом известно, что дозировка биологически активного соединения в эксперименте на крысах и других лабораторных животных не является эквивалентной [11, Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Приложение 1 / Под общей редакцией члена-корреспондента РАМН, профессора Р.У. Хабриева, Москва, 2000] и «Оценка фармакологической активности потенциального лекарственного средства для лечения того или иного заболевания проводится на моделях заболеваний/синдромов лабораторных животных и является основой для разработки показаний к применению и дизайна дальнейших клинических исследований» [12, Фармацевтическая разработка: концепция и практические рекомендации. Научно-практическое руководство для фармацевтической отрасли / Под ред. Быковского С.Н. и др. - М.: Изд-во Перо, 2015. - 472 с. - С. 315]. Помимо этого, в отличие от экспериментальных исследований, традиционное применение антиоксидантов при реканализации не позволяет полностью избежать реперфузионного поражения миокарда [13, Патент РФ №2226097].
Известен способ антиоксидантной терапии больных инфарктом миокарда [14, Зарубина Е.Г., автореф. дис. д-ра мед. наук, 2003]. Недостатком способа является значительная продолжительность курса фармакокоррекции и многокомпонентность антиоксидантной терапии, влияющая, соответственно, на экономическую эффективность лечения.
Известен способ коррекции перекисного окисления липидов у больных ишемической болезнью сердца [2, Патент РФ №2178704]. Недостатком способа являются определенные сложности в получении и хранении фетальной ткани печени, легких, сердца и плаценты человека.
Известен способ применения препарата пробукол в комплексной терапии больных с ишемией миокарда [15, Голиков А.П. и соавт., Лечащий врач, 2009]. Недостатками данного способа являются отсутствие инъекционной формы, наличие осложнений (удлинение интервала QT).
Известны способ коррекции реперфузионного повреждения миокарда у больных острым инфарктом миокарда с зубцом Q путем приема карведилола в течение 3-6 месяцев [16, Мамонова Т.Ю., автореф. дис. канд. мед. наук, Томск, 2009]; способ комплексного лечения острого инфаркта миокарда с целью профилактики «синдрома реперфузии» введением эмоксипина в течение 25-40 дней [4, Машковский М.Д., Лекарственные средства, 2010]. Недостатком способов является значительная продолжительность курса фармакокоррекции.
Известны способы нормализации концентрации продуктов перекисного окисления липидов в крови больных с острым инфарктом миокарда введением триметазидина [15, Голиков А.П. и соавт., Лечащий врач, 2009], мексидола (мексикора) [17, Патент РФ №2168993; 18, Николенко Т.А. и соавт., Фундаментальные исследования, 2004; 19, Голиков А.П. и соавт., Кардиология, 2005]; мельдония (милдроната) на санаторном этапе реабилитации после перенесенного инфаркта миокарда [20, Туев А.В. и соавт., Пермский медицинский журнал, 2006] на фоне традиционной терапии. Недостатками способов является однонаправленность механизма действия препаратов в сторону оптимизации клеточного энергетического обмена на фоне уменьшения потребности ишемизированной ткани в кислороде без существенного влияния на интенсивность свободнорадикальных процессов в ишемизированных тканях.
Известны способ лечения острого инфаркта миокарда, заключающийся в интракоронарном введении аденозина в инфаркт-ответственную артерию при проведении коронарной ангиопластики [21, Claeys M.J. et al., Cardiol., 2004]; способ лечения острого инфаркта миокарда, включающий интракоронарное введение в инфаркт-ответственную артерию при проведении коронарной ангиопластики кардиопротективного вещества [22, Иоселиани Д.Г., Патент РФ №2299730). Недостатком способов является отсутствие возможности коррекции метаболических изменений в кардиомиоцитах у пациентов острым инфарктом миокарда без проведения коронарной ангиопластики.
Известен способ снижения перекисного окисления липидов в остром и подостром периоде инфаркта миокарда введением инъекционной формы «Реамберин 1,5% для инфузий» [23, Норина Т.И., Пермский медицинский журнал, 2007]. Недостатком данного способа является позднее развитие антиоксидантного эффекта.
Известно использование цитофлавина у пациентов с острым инфарктом миокарда в качестве цитопротектора при совместном применении с перфтораном [24, Ливанов Г.А. и соавт., Профилактическая и клиническая медицина, 2010]. Поскольку в данном способе осуществляется введение комбинации из двух препаратов, возникают определенные сложности в интерпретации полученных данных: положительная динамика интенсивной терапии связана, в большей степени, с использованием перфторана или ее можно отнести в пользу доказательной базы цитофлавина, что теоретически требует проведения дополнительных исследований.
Известны результаты клинико-экспериментального исследования эффективности цитофлавина, свидетельствующие о нецелесообразности применения цитофлавина при стабильной стенокардии напряжения [25, Ромащенко О.В. и соавт., Вестник проблем биологии и медицины, 2013]. Однако в диапазон данного исследования не входило изучение влияния цитофлавина на содержание продуктов перекисного окисления липидов биомембран, являющихся ключевым звеном в формировании реперфузионных осложнений у больных острым инфарктом миокарда, что не раскрывает перспектив доказательной базы антиоксидантной активности сукцинатсодержащего препарата и ставит под сомнение ранее опубликованные факты: «При внутривенном введении препарата Цитофлавин активизируется аэробный метаболизм клеток, повышается устойчивость мембран клеток к воздействию ишемии, улучшается коронарный и мозговой кровоток…» [26, Агафьина А.С., Сборник статей по применению препарата Цитофлавин, Санкт-Петербург, 2006].
Известен способ реперфузионной терапии больных острым инфарктом миокарда путем реканализации коронарной артерии и введения препарата Гистохром внутривенно болюсом по 100 мг за 10 минут перед реканализацией и через 1 ч, далее ежедневно в течение 10 суток после реканализации [13, Патент РФ №2226097]. Гистохром - водорастворимый препарат эхинохрома - пигмента морских беспозвоночных (что не исключает возможности развития побочных эффектов, в частности аллергических реакций). Производитель: Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук (ТИБОХ ДВО РАН), Россия, 690022, г. Владивосток, пр-т 100-летия Владивостока, 159. В настоящий момент купить препарат не представляется возможным: Гистохром в аптеках Москвы, Санкт-Петербурга, Воронежа, Тулы и других городов отсутствует. Кроме этого, стоимость препарата Гистохром в два раза превышает стоимость препарата, заявленного в нашем изобретении. Данное техническое решение взято нами за прототип.
Задачей настоящего изобретения явилось расширение арсенала средств, позволяющих осуществлять коррекцию процессов перекисного окисления липидов у больных острым инфарктом миокарда, на основе доступной отечественной фармацевтической продукции и повышения стойкого фармакологического эффекта в условиях сокращения длительности курса коррекции.
Поставленная задача решена путем разработки нового способа коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда, протекающего в условиях окислительного стресса, введением препарата Цитофлавин производства НТФФ «Полисан» г. Санкт-Петербург (Регистрационный номер: Р-003135/01 от 21.11.2008 г.). Препарат Цитофлавин представляет собой раствор для парентерального введения (фармакотерапевтическая группа: метаболическое средство), в состав которого входят следующие активные компоненты (на 1 л раствора): янтарная кислота - 100 г; никотинамид - 10 г; рибоксин (инозин) - 20 г; рибофлавина мононуклеотид - 2 г. При внутривенном введении препарата Цитофлавин активизируется аэробный метаболизм клеток, повышается устойчивость мембран нервных и глиальных клеток к воздействию ишемии, улучшается коронарный и мозговой кровоток, активируются метаболические процессы в ЦНС [26].
Сущность изобретения заключается в том, что в способе коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда, включающем введение лекарственного средства до реканализации коронарной артерии, пациентам вводят внутривенно капельно в течение 30 минут за 30 минут до реканализации 20 мл раствора Цитофлавин, разведенного в 250 мл 5% раствора глюкозы.
Осуществление способа. Больным острым инфарктом миокарда за 30 минут до реканализации коронарной артерии внутривенно капельно вводят 20 мл раствора Цитофлавин, разведенного в 250 мл 5% раствора глюкозы.
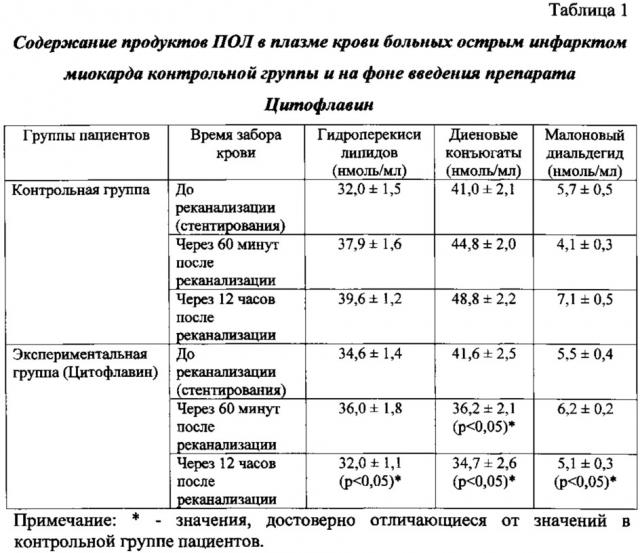
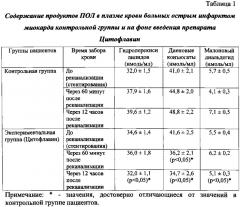
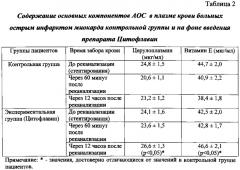
Забор венозной крови осуществлялся перед реканализацией (коронароангиографией и стентированием), через 60 минут и 12 часов после реканализации.
Результаты учитывались по соотношению содержания продуктов ПОЛ (гидроперекисей липидов, диеновых конъюгатов, малонового диальдегида) и основных компонентов АОС (церулоплазмина, витамина Е) в плазме крови до реканализации, через 60 минут и 12 часов после стентирования в сравнении с пациентами контрольной группы, обработаны стандартными параметрическими методами с использованием t-критерия Стьюдента. Результаты считали достоверными при p<0,05.
Способ позволил обеспечить коррекцию процессов перекисного окисления липидов у больных острым инфарктом миокарда, базируемую на увеличении антиоксидантной активности и снижении степени накопления продуктов радикального характера и липидных перекисей в плазме крови пациентов, в условиях сокращения длительности курса коррекции и повышения стойкого фармакологического эффекта на основе доступной отечественной фармацевтической продукции в сравнении с прототипом.
Исследовано содержание продуктов перекисного окисления липидов (гидроперекисей липидов, диеновых конъюгатов, малонового диальдегида) и основных компонентов АОС (церулоплазмина, витамина Е) в плазме крови пациентов контрольной и экспериментальной групп до реканализации, через 60 минут и 12 часов после стентирования.
В результате проведенных исследований содержание диеновых конъюгатов в крови больных с острым инфарктом миокарда, получавших перед реканализацией коронарной артерии Цитофлавин, достоверно ниже уже через 60 минут после стентирования на 20% по сравнению с пациентами контрольной группы (p<0,05). Через 12 часов после реканализации содержание всех исследуемых продуктов пероксидации в плазме крови пациентов, получавших Цитофлавин, достоверно ниже аналогичных показателей в контроле: уровень гидроперекисей липидов - на 20% (p<0,05), диеновых конъюгатов - на 29% (p<0,05), малонового диальдегида - на 28% (p<0,05) (таблица 1).
В плазме крови пациентов экспериментальной группы (цитофлавин) через 12 часов после реканализации содержание церулоплазмина достоверно выше относительно аналогичного показателя в контроле на 25% (p<0,05), уровень витамина E - на 21% (p<0,05) (таблица 2).
Таким образом, установлена возможность коррекции процессов перекисного окисления липидов у больных с острым инфарктом миокарда введением Цитофлавина, основанная на снижении содержания первичных и вторичных продуктов пероксидации и увеличении активности основных компонентов антиоксидантной системы в плазме крови пациентов, что указывает на антиоксидантную активность комбинированного препарата, взаимодополняющее действие компонентов которого (янтарная кислота, рибоксин, рибофлавин и никотинамид) обеспечивает комплексное решение проблемы мембранопротекции. Янтарная кислота, выполняя каталитическую функцию по отношению к циклу Кребса, снижает концентрацию лактата, пирувата и цитрата, накапливающихся в условиях ишемии. Активация сукцинатдегидрогеназного окисления, восстановление активности ключевого фермента дыхательной цепи - цитохромоксидазы позволяет обеспечить энергокоррекцию, активизировать защитные механизмы, повышающие резистентность к окислительному стрессу за счет активации собственных антиоксидантных систем. Кроме того, при гипоксии, развивающейся на фоне окклюзии коронарной артерии, для восстановления дыхательной цепи митохондрий необходима активация никотинамидадениндинуклеотид-зависимых ферментов. Введение никотинамида активирует зависимые ферменты клеток, в том числе антиоксидантные системы убихиноновых оксидоредуктаз, защищающие мембраны клеток от разрушения активными радикалами. Свойством усиления синтеза макроэргических молекул обладает активный компонент цитофлавина - рибоксин, антиоксидантное действие которого реализуется за счет активации синтеза никотинамидадениндинуклеотида в митохондриях из никотинамида, где рибоксин выступает в качестве донора рибозы, стимуляции анаэробного гликолиза с образованием лактата и никотинамидадениндинуклеотида, ингибирования фермента ксантиноксидазы и подавления радикальных процессов. Введение в состав цитофлавина рибофлавина обеспечивает активацию сукцинатдегидрогеназы, участвующей в реакции превращения янтарной кислоты. Таким образом, активные компоненты цитофлавина обладают взаимопотенциирующими эффектами, являются индукторами основных метаболических путей в клетках, активаторами энергообразующих процессов, способствующих утилизации свободного кислорода, что, в конечном итоге, способствует снижению интенсивности перекисных процессов. Учитывая, что продукты ПОЛ (перекиси) крайне аритмогенны, снижение степени их накопления в условиях введения Цитофлавина позволяет осуществлять профилактику реперфузионных осложнений, в частности аритмий, связанных с активацией перекисных процессов в зоне реперфузии, на фоне реканализации у больных острым инфарктом миокарда.
Клинический пример №1 (контроль; история болезни №1831).
Больная С., 63 года, поступила в отделение неотложной кардиологии РСЦ 11.01.2015 г. в 1115 с типичной клинической картиной острого инфаркта миокарда. Манифестация клинической симптоматики 11.01.15 г. в 800. На ЭКГ при поступлении имелись признаки повреждения миокарда (подъем сегмента ST в отведениях II, III и aVF с реципрокной депрессией сегмента ST в противоположных отведениях) в области нижней стенки левого желудочка. Болевой синдром не купировался наркотическими анальгетиками и нитратами.
Учитывая наличие признаков инфаркта миокарда давностью до 12 часов, принято решение о проведении полипроекционной коронароангиографии, по результатам которой была выявлена окклюзия проксимального сегмента правой коронарной артерии при правом типе кровоснабжения миокарда. Выполнена реканализация пораженного сегмента артерии с последующей баллонной ангиопластикой. В зону остаточного стеноза установлен кобальт-хромовый стент. Кровоток по целевому сосуду TIMI 3.
На этапе баллонной ангиопластики инфаркт-зависимой артерии развились явления реперфузионного синдрома в виде пароксизма суправентрикулярной тахикардии с ЧСС до 160-180 ударов в минуту. Начата антиаритмическая терапия (болюсное введение кордарона в дозе 300 мг с последующей инфузией 450 мг), на фоне проведения которой произошло восстановление синусового ритма с ЧСС 60-70 ударов в минуту.
Таким образом, восстановление кровотока в миокарде было достигнуто в течение 4-х часов от начала заболевания, и сопровождалась реперфузионными нарушениями, потребовавшими проведения антиаритмической терапии.
В послеоперационном периоде проводилась профилактика ретромбоза коронарной артерии согласно принятым рекомендациям комитета экспертов. Больной получал также традиционную (общепринятую) терапию инфаркта миокарда.
Активность процессов перекисного окисления липидов после реперфузии оценивали по содержанию в плазме крови первичных продуктов пероксидации (гидроперекисей липидов, диеновых конъюгатов) и вторичного продукта ПОЛ (малонового диальдегида) на фоне определения активности основных компонентов АОС (церулоплазмина, витамина Е). Повышенное содержание гидроперекисей липидов, диеновых конъюгатов, малонового диальдегида определялось через 60 минут после проведения коронароангиографии и стентирования, имея тенденцию к нарастанию через 12 часов после реканализации коронарной артерии.
Наличие у больной нижнего инфаркта миокарда было подтверждено типичными изменениями в динамике ЭКГ и гиперферментемией. Клиническое течение инфаркта протекало без осложнений. Эпизодов постинфарктной стенокардии, клинических проявлений сердечной недостаточности не зафиксировано.
Больная была выписана на амбулаторное лечение в удовлетворительном состоянии.
Клинический пример №2 (цитофлавин; история болезни №21929).
Больная П., 60 лет, поступила в отделение неотложной кардиологии РСЦ 8.11.15 г. в 1230 с типичной клинической картиной острого инфаркта миокарда и ЭКГ признаками поражения миокарда в области нижней стенки левого желудочка (подъем сегмента ST в отведениях II, III и aVF с реципрокной депрессией сегмента ST в отведениях I, AVL, V2-V6). Манифестация клинических признаков с 1030 8.11.15 г.
Учитывая наличие признаков инфаркта миокарда давностью до 12 часов, принято решение о проведении полипроекционной коронароангиографии, по результатам которой была выявлена окклюзия проксимального сегмента правой коронарной артерии и стеноз ПМЖВ до 80% при правом типе кровоснабжения миокарда. Выполнена реканализация пораженного сегмента артерии с последующей баллонной ангиопластикой. В зону остаточного стеноза установлен стент. Кровоток по целевому сосуду TIMI 3.
С целью профилактики реперфузионного синдрома за 30 минут до начала интервенционного вмешательства внутривенно капельно ввели 20 мл раствора цитофлавина, разведенного в 250 мл 5% раствора глюкозы.
Восстановление кровотока в миокарде было достигнуто в течение 3,5-х часов от начала заболевания, не сопровождалось сопутствующим реперфузионным нарушением ритма сердца, состояние пациентки оставалось стабильным.
Активность процессов перекисного окисления липидов после реперфузии оценивали по содержанию в плазме крови первичных и вторичного продуктов пероксидации на фоне определения активности основных компонентов АОС (церулоплазмина, витамина Е). Повышенное содержание гидроперекисей липидов, диеновых конъюгатов, малонового диальдегида определялось перед и через 60 минут после проведения коронароангиографии и стентирования, имея тенденцию к снижению через 12 часов после реканализации коронарной артерии на фоне повышения концентрации церулоплазмина и витамина Е.
Наличие у больной крупноочагового нижнего инфаркта миокарда было подтверждено типичными изменениями в динамике на ЭКГ и гиперферментемией.
Клиническое течение инфаркта миокарда у больной протекало без осложнений. Не было эпизодов постинфарктной стенокардии, развития клинических проявлений сердечной недостаточности.
Больная была выписана на амбулаторное лечение в удовлетворительном состоянии.
Предлагаемый способ коррекции процессов перекисного окисления липидов применен у 36 пациентов с острым инфарктом миокарда. В контрольной группе, включающей 26 пациентов, открытие коронарной артерии во всех случаях сопровождалось появлением реперфузионного синдрома (реперфузионные нарушения ритма), требующего проведения антиаритмической терапии. Применение цитофлавина ни в одном из выполненных вмешательств не сопровождалось сопутствующим реперфузионным нарушением ритма сердца, не было эпизодов постинфарктной стенокардии, развития клинических проявлений сердечной недостаточности, что подчеркивает целесообразность включения цитофлавина в комплексную терапию больных с острым инфарктом миокарда с целью профилактики ранних реперфузионных нарушений электрической стабильности и сократимости миокарда.
Таким образом, заявленный способ коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда обеспечивает предупреждение реперфузионного повреждения и улучшение функционального состояния ишемизированного миокарда. Из приведенных примеров видно, что после применения раствора цитофлавина улучшаются параметры антиоксидантной защиты на фоне снижения содержания продуктов липопероксидации, свидетельствующие о сохранении структурно-функциональной целостности кардиомиоцитов после восстановления антеградного кровотока в инфаркт-ответственной артерии в первые часы развития острого инфаркта миокарда, отражая достоверно более благоприятную динамику без развития реперфузионных осложнений. Осуществление заявленного способа способствует улучшению клеточного энергообмена за счет активирования энергосинтезирующих функций митохондрий на фоне снижения интенсивности процессов перекисного окисления липидов и восстановления функциональной активность клеток с сохранением структурно-функциональной целостности биомембран, что обеспечивает комплексное воздействие лекарственного средства на энергетику и клеточный метаболизм и дает основание рекомендовать Цитофлавин к применению у больных с острым инфарктом миокарда для профилактики реперфузионных осложнений, расширяя диапазон показаний к назначению данного лекарственного средства.
Технический результат использования изобретения заключается в расширении диапазона возможных показаний к назначению препарата Цитофлавин и сокращении длительности курса коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда на основе применения доступной отечественной фармацевтической продукции и повышения стойкого фармакологического эффекта в сравнении с прототипом в условиях внутривенного капельного введения Цитофлавина, обладающего антиоксидантной активностью.
ИНФОРМАЦИОННЫЕ ИСТОЧНИКИ
1. Бобров В.А., Симорот В.Н. Реперфузионные аритмии: механизмы развития, пути коррекции // Терапевтический архив. - 1993. - Т. 65, №9. - С. 56-62.
2. Колесникова Л.И., Рунович А.А., Курильская Т.Е., Никифоров С.Б., Голдобина А.В. Способ коррекции перекисного окисления липидов у больных ишемической болезнью сердца. - Патент РФ на изобретение №2178704. - Опубликовано: 27.01.2002.
3. Михин В.П. Цитопротекция в кардиологии: достигнутые успехи и перспективы // Архив внутренней медицины. - 2014. - №2(16). - С. 33-40.
4. Машковский М.Д. Лекарственные средства: пособие для врачей. - М.: Медицина, 2010. - 685 с.
5. Доровских В.А., Бородин Е.А., Целуйко С.С Антиоксиданты в профилактике и коррекции холодового стресса. - Благовещенск, 2000. - 183 с.
6. Степанова М.С. Коррекция окислительного стресса мозга с помощью природных и синтетических антиоксидантов: автореф. дис. канд. биол. наук. - Москва, 2009. - 24 с.
7. Симонова Н.В., Доровских В.А., Ли О.Н., Анохина Р.А., Доровских В.Ю. Способ коррекции процессов перекисного окисления липидов биомембран в условиях ультрафиолетового облучения. - Патент РФ на изобретение №2550016. Опубликовано: 10.05.2015.
8. Киричук В.Ф., Цымбал А.А., Креницкий А.П., Майбородин А.В. Способ коррекции процессов липопероксидации в эксперименте. - Патент РФ на изобретение №2393891. - Опубликовано: 10.07.2010.
9. Маркиянова С.С., Котляров А.А., Плешаков М.Г., Ванькова Л.В. Эффекты солей янтарной кислоты при острой сердечно-сосудистой патологии в эксперименте // Пермский медицинский журнал. - 2008. - Т. XXV, №4. - С. 78-85.
10. Бизенкова М.Н., Чеснокова Н.П., Романцов М.Г. Патогенетическое обоснование целесообразности использования цитофлавина при ишемическом повреждении миокарда // Современные проблемы науки и образования. - 2005. - №1. - С. 20-21.
11. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Приложение 1 / Под общей редакцией члена-корреспондента РАМН, профессора Р.У. Хабриева. - Москва, 2000. - С. 98.
12. Фармацевтическая разработка: концепция и практические рекомендации. Научно-практическое руководство для фармацевтической отрасли / Под ред. Быковского С.Н. и др. - М.: Изд-во Перо, 2015. - 472 с. - С. 315.
13. Марков В.А., Афанасьев С.А., Максимов И.В., Буймов Г.А. Способ реперфузионной терапии больных острым инфарктом миокарда. - Патент РФ на изобретение №2226097.
14. Зарубина Е.Г. Структурно-функциональные эритроцитарные нарушения у больных инфарктом миокарда и их коррекция: автореф. дис. д-ра мед. наук. - Москва, 2003. - 46 с.
15. Голиков А.П., Бойцов С.А., Михин В.П., Полумисков В.Ю. Свободно-радикальное окисление и сердечно-сосудистая патология: коррекция антиоксидантами // Лечащий врач. - Опубликовано: 24.08.2009.
16. Мамонова Т.Ю. Плейотропные эффекты карведилола в профилактике реперфузионных осложнений при остром инфаркте миокарда: автореф. дис. канд. мед. наук. - Томск, 2009.
17. Михин В.П., Смирнов Л.Д., Сернов Л.Н. Средство для лечения нестабильной стенокардии и острого инфаркта миокарда. - Патент РФ на изобретение №2168993. - Опубликовано: 20.06.2001.
18. Николенко Т.А., Савельева В.В. Влияние мексикора на аритмическую активность миокарда и параметры перекисного окисления липидов у больных ИБС // Фундаментальные исследования. - 2004. - №4. - С. 78-79.
19. Голиков А.П., Давыдов Б.В., Руднев Д.В., Клычникова Е.В., Быкова Н.С., Рябинин В.А., Полумисков В.Ю., Николаева Н.Ю., Голиков П.П. Влияние мексикора на окислительный стресс при остром инфаркте миокарда // Кардиология. - 2005. - №45(7). - С. 21-26.
20. Туев А.В., Рямзина И.Н., Хабаров А.В., Гришина Л.В. О применении милдроната в санаторной реабилитации больных, перенесших инфаркт миокарда // Пермский медицинский журнал. - 2006. - Т. XXIII, №6. - С. 20-27.
21. Claeys M.J. et al. Effect of introcoronary adenosine infusion during coronary intervention on myocardial reperfusion injury in patients with acute myocardial infarction // Cardiol. - 2004. - №94(1). - P. 9-13.
22. Иоселиани Д.Г., Колединский А.Г. Способ лечения острого инфаркта миокарда. - Патент РФ на изобретение №2299730.
23. Норина Т.И. Динамика показателей свободнорадикального окисления липидов при лечении инфаркта миокарда с зубцом Q с использованием препаратов янтарной кислоты // Пермский медицинский журнал. - 2007. - Т. XXIV, №3. - С. 76-80.
24. Ливанов Г.А., Амагыров В.П., Батоцыренов Б.В., Лодягин А.Н., Батоцыренова Х.В. Коррекция метаболических расстройств при осложненных формах инфаркта миокарда // Профилактическая и клиническая медицина. - 2010. - №2(35).
25. Ромащенко О.В., Горбач Т.В., Румбешт В.В. Клинико-экспериментальное исследование эффективности цитофлавина при ишемии миокарда // Вестник проблем биологии и медицины. - 2013. - Вып. 2. (100). - С. 196-200.
26. Агафьина А.С. Сборник статей по применению препарата Цитофлавин. - Санкт-Петербург, 2006. - 104 с.
Способ коррекции процессов перекисного окисления липидов у больных острым инфарктом миокарда, включающий введение лекарственного средства до реканализации коронарной артерии, отличающийся тем, что пациентам за 30 минут до реканализации вводят внутривенно капельно в течение 30 минут 20 мл раствора Цитофлавин, разведенного в 250 мл 5% раствора глюкозы.