Способы лечения рака с применением ингибитора аутофагии на основе тиоксантона
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения рака. Для этого применяют ингибитор аутофагии на основе тиоксантона для изготовления лекарственного средства для лечения рака в комбинации с вызывающим аутофагию соединением. Также предложены фармацевтическая композиция и фармацевтический набор для лечения рака, содержащие ингибитор аутофагии на основе тиоксантона и вызывающее аутофагию соединение. Группа изобретений обеспечивает усиление противораковой активности терапии за счет уменьшения жизнеспособности клеток и увеличения апоптоза. 3 н. и 5 з.п. ф-лы, 26 ил., 7 пр.
Реферат
ИСПРАШИВАЕМЫЙ ПРИОРИТЕТ
[01] Настоящая заявка на патент испрашивает приоритет согласно § 119 (е) Раздела 35 Свода законов США на основании предварительной заявки на патент США №61/131736, поданной 8 марта 2010 года, которая, тем самым, включена в настоящую заявку посредством ссылки в полном объеме.
ВВЕДЕНИЕ
[02] Рак является второй основной причиной смерти людей в США; по оценкам, в 1998 году было зафиксировано 1228600 новых случаев этого заболевания и 564800 смертей от рака. На протяжении последних 50 лет уровень смертности от рака неуклонно повышался за счет, главным образом, высокого роста уровня смертности от рака легких, вызванного курением. Рак встречается у людей всех возрастов, но его распространенность сильно возрастает среди людей в возрасте старше 45 лет. Однако в США рак является основной причиной смерти людей в возрасте от 35 до 65 лет, а также основной причиной не связанных с несчастным случаем смертей в США среди детей в возрасте до 15 лет. У мужчин коэффициент смертности от рака выше, чем у женщин, при этом темнокожее население имеет наибольший коэффициент смертности от рака среди основных расовых групп. В США риск развития рака в течение жизни для мужчин составляет примерно 1 к 2, а для женщин - примерно 1 к 3. С учетом ожидаемого непрерывного снижения количества смертей от заболеваний сердца и инсультов, к 2010 году раковые заболевания станут общей основной причиной смерти для всего американского населения.
[03] Диагностика рака обычно требует гистологического исследования специалистом образца биопсии ткани, хотя начальный признак злокачественности может представлять собой симптомы или отклонения от нормы на рентгеновских снимках. После постановки диагноза рак в большинстве случаев лечат путем хирургического вмешательства, химиотерапии, радиационной терапии или направленной терапии, такой как иммунотерапия, гормональная терапия или терапия с применением ингибитора ангиогенеза. Выбор терапии зависит от локализации и степени злокачественности опухоли и стадии заболевания, а также общего состояния пациента (функционального статуса). Более того, в зависимости от типа и стадии рака, можно комбинировать вместе два или более из указанных способов лечения рака или применять их один за другим. Хотя целью лечения является полное удаление рака без нанесения вреда остальному организму, современные подходы к лечению раковых заболеваний имеют ограниченный успех. Что касается хирургического вмешательства, проблемы частично обусловлены склонностью отдельных раковых клеток или небольшого количества раковых клеток поражать соседнюю ткань или метастазировать в отдаленные участки, ограничивая тем самым эффективность местных хирургических способов лечения. Эффективность химиотерапии и радиационной терапии часто ограничена токсичностью в отношении нормальных тканей тела или их повреждением. Поэтому очень востребованны соединения, композиции и способы, которые могут обеспечить более эффективное лечение рака. Кроме того, также были бы желательны соединения, композиции и способы, позволяющие лечить конкретный вид рака, для которого не существует современных способов лечения.
[04] Аутофагия (макроаутофагия или аутофагоцитоз), представляет собой катаболический процесс, при котором клетки разрушают поврежденные, избыточные или ненужные в других отношениях цитоплазматические компоненты, в том числе белки и органеллы, используя лизосомальный механизм. Будучи жестко контролируемым процессом, такой путь распада индуцируется недостаточностью питательных веществ, метаболическим стрессом или состоянием микросреды и обеспечивает энергетический баланс, клиренс поврежденных белков и адаптацию к стрессу. Аутофагия играет важную роль при нормальном клеточном росте и развитии, помогая сохранить баланс между синтезом и разрушением компонентов клетки. Кроме того, в результате этого процесса образуются продукты распада, которые могут служить в качестве альтернативного источника энергии при метаболическом стрессе для поддержания гомеостаза и жизнеспособности. По существу, аутофагия играет цитопротекторную роль в случаях недостатка питательных веществ.
[05] Процесс саморазрушения включает инкапсуляцию части цитоплазмы клеток в везикуле, ограниченной двойной мембраной, называемой аутофагосомой или аутофагической вакуолью и секвестирующей компоненты, в том числе белки и органеллы, из остатка цитоплазмы. Аутофагосомы образуются в результате элонгации малых мембранных структур, известных как предшественники аутофагосомы. Такого рода синтез инициируется фосфоинозитид-3-киназой класса III и геном, связанным с аутофагией (Atg) 6 (также известным как Beclin-1). Рост указанных предшественников аутофагосомы требует участия 2 убиквитино-подобных систем конъюгации, которые продуцируют модифицированные комплексы регуляторов аутофагии. Этот процесс включает конъюгацию комплекса ATG12-ATG5-ATG16 и комплекса фосфатидилэтаноламина (РЕ) с LC3/ATG8 и комплексом ATG4 протеазы. Далее, при завершении процесса образования аутофагосомы происходят нуклеация, расширение и сбрасывание оболочки. Затем наружная мембрана аутофагосомы сливается в цитоплазме с лизосомой с образованием аутолизосомы или аутофаголизосомы, где их содержимое разрушается под действием лизосомальных кислых гидролаз. Конечный результат активации аутофагии сильно зависит от клеточного окружения и силы и продолжительности сигнала, индуцирующего стресс.
[06] Продукты распада цитоплазмы и органелл, в том числе аминокислоты, липиды, нуклеиновые кислоты и сахара, с помощью пермеаз удаляются из лизосом и поступают в цитоплазму. Клетки используют указанные продукты клеточного распада в качестве строительных блоков для макромолекулярного синтеза или поддержания энергетического гомеостаза. По существу, аутофагия является основным механизмом, с помощью которого клетка рециркулирует и перераспределяет питательные вещества, обеспечивая ими более существенные клеточные процессы. Аутофагия также участвует в контроле качества белка и органелл путем разрушения поврежденных или старых компонентов клетки, таких как деполяризованные митохондрии и неструктурированные белки. Обновление белков и органелл за счет аутофагии имеет решающее значение для поддержания гомеостаза, так как позволяет предотвратить токсичное накопление старых и поврежденных компонентов клеток.
[07] Было обнаружено, что аутофагия представляет собой ранее неизвестный цитопротекторный механизм, который увеличивает выживаемость опухолевых клеток в условиях метаболического стресса и гипоксии, а также позволяет избежать некроза клеток, вызванного химиотерапией, радиационной терапией или направленной терапии. Например, в случае агрессивных видов рака аутофагия позволяет сохранить метаболизм, необходимый для поддержания выживаемости опухолевых клеток, в частности, в условиях гипоксии и недостатка питательных веществ. Кроме того, аутофагия продуцирует небольшое количество покоящихся опухолевых клеток, способных возобновить клеточную пролиферацию после устранения стресса. Тем самым аутофагия позволяет раковым клеткам за счет пластичности выдержать стресс, даже стресс, вызванный терапией, и возобновить рост при более благоприятных условиях. Такой процесс выживаемости при стрессе, покоя и регенерации, обеспечиваемый аутофагией, может быть главным препятствием для проведения успешного лечения ракового заболевания. Кроме того, основной аспект лечения рака, такой как, например, химиотерапия, направленная терапия и радиационная терапия, состоит в нанесении опухолевым клеткам повреждения, достаточного для их уничтожения посредством апоптоза, некроза или чередующихся форм гибели клеток. В дополнение к собственному метаболическому стрессу, имеющему место в микроокружении опухоли, указанные способы лечения усиливают клеточный стресс и инициируют аутофагию. По существу, аутофагия позволяет продлить выживаемость опухолевых клеток за счет обеспечения защитной функции, которая ограничивает некроз опухоли и воспаление и уменьшает повреждение генома в опухолевых клетках, в ответ на метаболический стресс и апоптоз, вызванный терапией.
[08] Поскольку аутофагия представляет собой путь выживания, используемый опухолевыми клетками для выдерживания метаболического стресса, ингибиторы аутофагии, как ожидают, могут подходить для лечения рака. Ингибиторы аутофагии являются особенно привлекательными, поскольку они могут нацеленно воздействовать на те опухолевые клетки на гипоксических участках опухоли, которые устойчивы к действию терапии, в частности, излучению. Кроме того, опухолевые клетки в процессе метастазирования могут, в частности, зависеть от аутофагии, что подтверждает правильность способов лечения, направленных на прекращение аутофагии в начале развития болезни и применение адъювантной терапии. В частности, подходящей противораковой терапией было бы применение агентов, ингибирующих аутофагический распад, с целью усиления эффективности традиционной химиотерапии, которая, как правило, активирует путь аутофагии. Можно было бы ожидать, что добавление ингибиторов аутофагии усилит цитотоксичность указанных агентов. Например, лечение с применением ингибитора аутофагии позволяет увеличить эффективность апоптоз-индуцирующей химиотерапии у пациентов-людей, болеющих раком. Таким образом, терапия рака, направленная на блокирование опосредованной аутофагией выживаемости клеток с помощью ингибиторов аутофагии, может иметь чрезвычайную ценность.
[09] Хотя идентификация ключевых ингибиторов аутофагии является крайне желательной, агенты, которые специфично и нацеленно воздействуют на путь аутофагии, в настоящее время отсутствуют. В настоящем описании предложены ингибиторы аутофагии, которые в комбинации с химиотерапевтическим соединением или излучением, вызывающем аутофагию, обеспечивают синергический положительный эффект при лечении широкого спектра раковых заболеваний.
КРАТКОЕ ОПИСАНИЕ
[010] Таким образом, аспекты настоящего описания изобретения включают ингибитор аутофагии на основе тиоксантона. Применяемые ингибиторы аутофагии на основе тиоксантона включают, без ограничения, 1-((2-(диэтиламино)этил)амино)-4-метилтиоксантен-9-он, 1-(2-диэтиламиноэтиламино)-4-(гидроксиметил)-9-тиоксантенон, Т-[[1-[[2-(диэтиламино)этил]амино]-9-оксо-9Н-тиаксантен-4-ил]метил]метансульфонамид, их индазольные аналоги или их соли.
[011] Другие аспекты настоящего описания изобретения включают вызывающее аутофагию соединение для лечения рака. Неограничивающие примеры таких соединений включают триоксид мышьяка, этопозид, рапамицин, ингибиторы гистондеацетилазы, ингибиторы тирозинкиназы, тамоксифен, темозоломид, иматиниб, бортезомиб ингибитор гистондеацетилазы. Подходящие ингибиторы гистондеацетилазы включают, без ограничения, ингибитор гистондеацетилазы гидроксаматного типа или ингибитор гистондеацетилазы бензамидного типа. Неограничивающие примеры таких ингибиторов включают (2Е,4Е,6R)-7-(4-диметиламинофенил)-N-гидрокси-4,6-диметил-7-оксогепта-2,4-диенамид,
N-гидрокси-N’-фенилоктандиамид, 4-диметиламино-N-(6-гидроксикарбамоилгексил)-бензамид, N-гидрокси-3-[(Е)-3-(гидроксиамино)-3-оксопроп-1-енил]бензамид, (2Е)-3-[3-(анилиносульфонил)фенил]-N-гидроксиакриламид, ((E)-N-гидрокси-3-[4-[[2-гидроксиэтил-[2-(1Н-индол-3-ил)этил]амино]метил] фенил]проп-2-енамид, (Е)-N-гидрокси-3-[4-[[2-(2-метил-1Н-индол-3-ил) этиламино]метил] фенил]проп-2-енамид, N-(2-аминофенил)-N’-фенилоктандиамид, 4-(2-аминофенилкарбамоил)бензилкарбамат, 4-ацетамидо-N-(2-аминофенил)бензамид, N-(2-аминофенил)-4-[[(4-пиридин-3-илпиримидин-2-ил)амино]метил]бензамид, 3-(диметиламинометил)-N-[2-[4-(гидроксикарбамоил)фенокси]этил]-1-бензофуран-2-карбоксамид или {6-[(диэтиламино) метил]-2-нафтил}метил {4-[(гидроксиамино)карбонил]фенил}карбамат или их соли.
[012] Другие аспекты настоящего описания изобретения включают фармацевтическую композицию, содержащую соединение или соединения, предложенные в настоящем изобретении. В одном из аспектов, фармацевтическая композиция содержит терапевтически эффективное количество ингибитора аутофагии на основе тиоксантона. В другом аспекте, фармацевтическая композиция содержит терапевтически эффективное количество вызывающего аутофагию соединения для лечения рака. В еще одном аспекте, фармацевтическая композиция содержит терапевтически эффективное количество ингибитора аутофагии на основе тиоксантона; и терапевтически эффективное количество вызывающего аутофагию соединения для лечения рака. Фармацевтическая композиция, описанная в настоящей заявке, может дополнительно содержать фармацевтически приемлемый носитель.
[013] Другие аспекты настоящего описания изобретения включают применение соединения или соединений, предложенных в настоящем изобретении, или композиции, предложенной в настоящем изобретении, для получения лекарственного средства для лечения рака.
[014] Другие аспекты настоящего описания включают способ лечения рака, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества ингибитора аутофагии на основе тиоксантона, предложенного в настоящем изобретении; и введение млекопитающему, нуждающемуся в этом, эффективного количества вызывающего аутофагию соединения для лечения рака, предложенного в настоящем изобретении; при этом введение как ингибитора аутофагии на основе тиоксантона, так и вызывающего аутофагию соединения для лечения рака, уменьшает симптом, связанный с раком, с обеспечением тем самым лечения рака. Ингибитор аутофагии на основе тиоксантона и вызывающее аутофагию соединение для лечения рака, можно ввести одновременно или последовательно. Последовательное введение ингибитора аутофагии на основе тиоксантона и вызывающего аутофагию соединения для лечения рака, можно осуществить в пределах примерно трех часов относительно друг друга, в пределах примерно двух часов относительно друг друга или в пределах примерно одного часа относительно друг друга. Неограничивающий пример ракового заболевания, которое можно лечить с применением соединений, композиций и способов, предложенных в настоящем изобретении, включает рак легких, рак мозга, рак центральной нервной системы, рак молочной железы, рак толстой кишки, лейкемию, миелому, рак простаты или яичника. В дополнительных аспектах, способ также включает применение радиационной терапии.
[015] Дополнительные аспекты настоящего описания изобретения включают применение ингибитора аутофагии на основе тиоксантона и вызывающего аутофагию соединения для лечения рака, предложенного в настоящем изобретении, или композиции, содержащей указанные соединения, предложенные в настоящем изобретении, для лечения рака, при этом введение как ингибитора аутофагии на основе тиоксантона, так и вызывающего аутофагию соединения для лечения рака, уменьшает симптом, связанный с раком, с обеспечением тем самым лечения рака. Неограничивающий пример ракового заболевания, которое можно лечить с применением соединений, композиций и способов, описанных в настоящем документе, включают рак легких, рак мозга, рак центральной нервной системы, рак молочной железы, рак толстой кишки, лейкемию, миелому, рак простаты или яичника. В еще других аспектах, способ дополнительно включает применение радиационной терапии.
[016] Дополнительные аспекты настоящего описания включают фармацевтический набор, содержащий фармацевтическую композицию, содержащую терапевтически эффективное количество ингибитора аутофагии на основе тиоксантона и фармацевтически приемлемый носитель, и фармацевтическую композицию, содержащую терапевтически эффективное количество вызывающего аутофагию соединения для лечения рака, и фармацевтически приемлемый носитель.
[017] Другие аспекты настоящего описания включают способ лечения рака, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества ингибитора аутофагии на основе тиоксантона, предложенного в настоящем изобретении; и воздействие на млекопитающее, нуждающееся в этом, эффективной дозы радиационной терапии, предложенной в настоящем изобретении; при этом как введение ингибитора аутофагии на основе тиоксантона, так и применение радиационной терапии уменьшает симптом, связанный с раком, с обеспечением тем самым лечения рака. Ингибитор аутофагии на основе тиоксантона и радиационную терапию можно использовать одновременно или последовательно. Последовательное применением ингибитора аутофагии на основе тиоксантона и радиационной терапии можно осуществить в пределах примерно трех часов относительно друг друга, в пределах примерно двух часов относительно друг друга или в пределах примерно одного часа относительно друг друга. Неограничивающий пример ракового заболевания, которое можно лечить с применением соединений, композиций и способов, описанных в настоящем документе, включает рак легких, рак мозга, рак центральной нервной системы, рак молочной железы, рак толстой кишки, лейкемию, миелому, рак простаты или яичника.
[018] Дополнительные аспекты настоящего описания изобретения включают применение ингибитора аутофагии на основе тиоксантона или композиции, содержащей такое соединение, и радиационной терапии, описанной в настоящем изобретении, для лечения рака, при этом как введение ингибитора аутофагии на основе тиоксантона, так и применение радиационной терапии уменьшает симптом, связанный с раком, с обеспечением тем самым лечения рака. Неограничивающий пример ракового заболевания, которое можно лечить с применением соединений, композиций и способов, предложенных в настоящем изобретении, включает рак легких, рак мозга, рак центральной нервной системы, рак молочной железы, рак толстой кишки, лейкемию, миелому, рак простаты или яичника.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
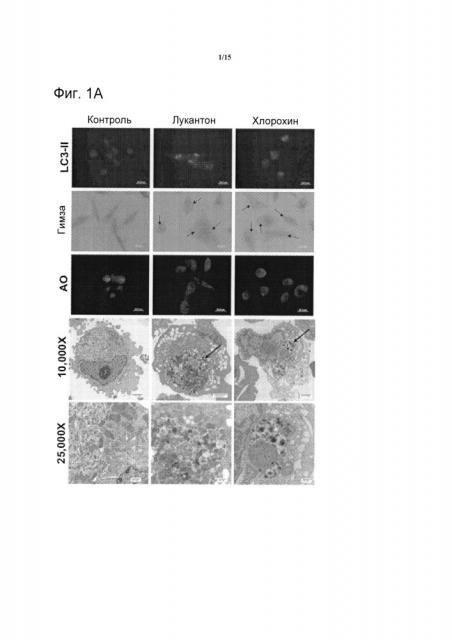
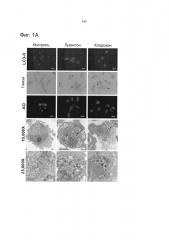
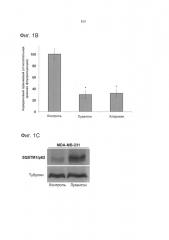
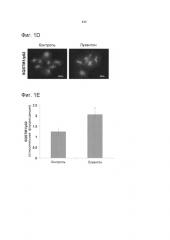
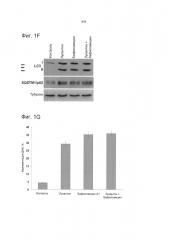
[019] Фиг.1. Лукантон ингибирует аутофагию. Фиг.1А. Индукция лукантоном образования LC3-II, вакуолизации и пермеабилизации лизосомальных мембран (LMP). Присутствие LC3-II обнаруживали при помощи иммуноцитохимии, вакуолизацию (стрелки) - с помощью окрашивания с применением Giemsa и пермеабилизацию лизосомальных мембран - по потере интенсивности флуоресценции акридинового оранжевого. Электронная микроскопия демонстрирует вакуолизацию и аккумуляцию электроноплотных частиц (стрелки), что предполагает аккумуляцию недеградированного белка. Фиг.1В. Количественное определение пермеабилизации лизосомальных мембран. Среднее значение ± стандартное отклонение, n=5. Указывает на значительное отличие от контрольных экспериментов. P<0,05. Фиг.1С. Лукантон стимулирует аккумуляцию SQSTM1/p62. Фиг.1D. Лукантон стимулирует агрегацию SQSTM1/p62, как наглядно показано с помощью флуоресцентной микроскопии (Фиг.1D) и путем количественного определения относительной флуоресценции (Фиг.1Е). Фиг.1F. Лукантон, бафиломицин А1 и их комбинация индуцируют образование LC3-II и аккумуляцию SQSTM1/p62. Фиг.1G. Лукантон, бафиломицин А1 и их комбинация индуцируют апоптоз в клеточных линиях рака молочной железы.
[020] Фиг.2. Обработка с применением лукантона и хлорохина уменьшает жизнеспособность клеток. Фиг.2А. Кривая зависимости ответа от дозы лукантона для семи клеточных линий рака молочной железы. Фиг.2В. Кривая зависимости ответа от дозы хлорохина для семи клеточных линий рака молочной железы.
[021] Фиг.3. Экспрессия катепсина D резко повышается после обработки лукантоном. Фиг.3А. Экспрессионные биочипы Affymetrix идентифицируют катепсин D (CTSD) в клетках рака молочной железы как сильно активированный ген. Фиг.3В. Количественный анализ экспрессии катепсина D в клетках рака молочной железы в реальном масштабе времени на основе полимеразной цепной реакции (PCR). Среднее значение ± стандартное отклонение, n=4. Указывает на значительное отличие от контрольных экспериментов. P<0,05. Фиг.3С. Лукантон увеличивает уровни катепсин D и стимулирует его агрегацию.
[022] Фиг.4. Индукция катепсина D способствует апоптозу, опосредованному лукантоном. Фиг.4А. Лукантон индуцирует экспрессию катепсина D и образование LC3-II. Фиг.4 В. Лукантон индуцирует апоптоз в четырех различных клеточных линиях рака молочной железы. Среднее значение ± стандартное отклонение, n=3. Указывает на значительное отличие от контрольных экспериментов. P<0,05. Фиг.4С. Нокдаун катепсина D уменьшает апоптоз, индуцированный лукантоном, как показано с помощью иммуноблоттинга. Фиг.D. Количественное определение уменьшения апоптоза, индуцированного лукантоном, при нокдауне катепсина D. Среднее значение ± СО, n=3. Указывает на значительное отличие от нецелевых трансфицированных siRNA клеток, обработанных лукантоном. P<0,05.
[023] Фиг.5. Лукантон индуцирует экспрессию катепсина D и уменьшает жизнеспособность клеток независимо от р53. Фиг.5А. Клетки НСТ116 р53+/+ и р53-/- применяли для оценки, является ли необходимым белок р53 для апоптоза, опосредованного лукантоном. Фиг.5В. Лукантон увеличивает уровни катепсина D в клетках НСТ116, независимо от состояния р53. Фиг.5С. Клетки НСТ1 16 р53+/+ и р53-/- в равной степени чувствительны к лукантону. Среднее значение ± стандартное отклонение, n=3.
[024] Фиг.6. Лукантон усиливает противораковую активность вориностата. Фиг.6А. Комбинация лукантона и вориностата увеличивает уровни катепсина D. Фиг.6В. Количественное определение воздействия лукантона и вориностата на жизнеспособность клеток рака молочной железы. Среднее значение ± стандартное отклонение, n=3. Указывает на значительное отличие по сравнению с контрольными пробами. * Указывает на значительное отличие по сравнению с группами, включающими один агент. P<0,05. Фиг.6С. Лукантон усиливает апоптоз, опосредованный вориностатом. Среднее значение ± стандартное отклонение, n=3. Указывает на значительное отличие по сравнению с контрольными пробами. ** Указывает на значительное отличие по сравнению с группами, включающими один агент. P<0,05.
[025] Фиг.7. Лукантон усиливает противораковую активность белиностата. Фиг.7А. Количественное определение воздействия лукантона и белиностата на жизнеспособность клеток рака молочной железы. Среднее значение ± стандартное отклонение, n=3. Указывает на значительное отличие по сравнению с контрольными пробами. ** Указывает на значительное отличие по сравнению с группами, включающими один агент. P<0,05. Фиг.7В. Лукантон усиливает апоптоз, опосредованный белиностатом. Среднее значение ± стандартное отклонение, n=3. Указывает на значительное отличие по сравнению с контрольными пробами. ** Указывает на значительное отличие по сравнению с группами, включающими один агент. P<0,05. Фиг.7С. Кривая зависимости от дозы белиностата в клетках из клеточных линий рака молочной железы MDA-MB-231. Фиг.7D. Кривая зависимости от дозы белиностата в клетках из клеточных линий ВТ-20 рака молочной железы.
ОПИСАНИЕ
[026] Поскольку неконтролируемый клеточный рост является первопричиной всех раковых заболеваний, соединения, композиции и способы, которые позволяют уменьшить или предотвратить такой неконтролируемый рост клеток, будут эффективными при лечении рака. В настоящем описании изобретения предложены соединения, композиции и способы, позволяющие уменьшить или предотвратить неконтролируемый клеточный рост, проявляемый раковыми клетками. Соединения содержат, частично, ингибитор аутофагии на основе тиоксантона (TAPI) и вызывающее аутофагию соединение для лечения рака (CTAPIC). TAPI ингибируют опосредованную аутофагией выживаемость опухолевых клеток, делая их более чувствительными к метаболическому стрессу, гипоксии и лечению рака, такому как, например, химиотерапия, радиационная терапия или направленные терапии, такие как иммунотерапия, гормональная терапия или терапия с применением ингибитора ангиогенеза. CTAPIC являются общепринятыми химиотерапевтическими или целенаправленными терапевтическими агентами, которые вызывают аутофагию как последствие механизма их действия. Неожиданным образом, хотя TAPI и CTAPIC оказывают противоположное воздействие на опухолевые клетки, было обнаружено, что комбинация соединений TAPI и HDACI (ингибитор гистондеацетилазы) обеспечивает синергический эффект, который значительно улучшает терапевтический лечебный результат и обеспечивает более эффективное лечение ракового заболевания. В качестве вывода из этого обнаруженного факта, комбинированное лечение с применением TAPI и радиационной терапии за счет синергического эффекта будет также способствовать благоприятному лечению рака, поскольку радиационная терапия также индуцирует аутофагию.
[027] Аспекты настоящего описания изобретения включают, частично, ингибитор аутофагии на основе тиоксантона (TAPI). Как показано в разделе Примеры, TAPI ингибирует аутофагию, разрушает лизосомную функцию, индуцирует экспрессию катепсина D, является цитотоксичным для раковых клеток, обладает противораковой активностью, которая не зависит от состояния р53, и усиливает противораковую активность CTAPIC. TAPI, подходящий для применения в способах, предложенных в настоящем изобретении, включает любое соединение на основе тиоксантона, содержащее присоединенные короткие цепи, напоминающие кольцо дезоксирибозного сахара без присоединенного основания и фосфодиэфирной связи. Неограничивающие примеры TAPI включают лукантон (мирацил D), 1-((2-(диэтиламино)этил)амино)-4-метилтиоксантен-9-он, гикантон 1-(2-диэтиламиноэтиламино)-4-(гидроксиметил)-9-тиоксантенон, индазольные аналоги лукантона и гикантона, (WIN33377) N-[[1-[[2-(диэтиламино)этил]амино]-9-оксо-9Н-тиаксантен-4-ил]метил]метансульфонамид, наряду с их физиологически допустимыми производными, аналогами и солями. Другие тиоксантоновые ингибиторы апуриновой/апиримидиновой эндонуклеазы описаны, например, в публикациях Thomas Corbett с соавторами, Antitumor Activity of N-[[1-[[2-(diethylamino)ethyl]amino]-9-oxo-9H-thiaxanthen-4-yl]methyl] meth anesulfonamide (WIN33377) и Analogues, Exp. Opin. Invest. Drugs 3:1281-1292 (1994), и Mark P. Wentland с соавторами, Anti-solid Tumor Efficacy and Preparation of N-[[1-[[2-(diethylamino)ethyl]amino]-9-oxo-9H-thiaxanthen-4-yl]methyl]meth anesulfonamide (WIN33377) и Related Derivatives, Bioorg. Med. Chem. Lett. 4:609-614 (1994), каждая из которых в полном объеме включена в настоящую заявку посредством ссылки.
[028] В аспектах данного варианта реализации изобретения, TAPI представляет собой 1-((2-(диэтиламино)этил)амино)-4-метилтиоксантен-9-он, 1 -(2-диэтиламиноэтиламино)-4-(гидроксиметил)-9-тиоксантенон или N-[[1-[[2-(диэтиламино)этил]амино]-9-оксо-9Н-тиаксантен-4-ил]метил]метансульфонамид. Химическая структура указанных соединений показана ниже.
Тиоксатенон
Лукантон (Мирацил D)
1-((2-(диэтиламино)этил)амино)-4-метилтиоксантен-9-он
Гикантон
1-(2-диэтиламиноэтиламино)-4-(гидроксиметил)-9 тиоксантенон
WIN-33377 (SR-233377)
N-[[1-[[2-(диэтиламино)этил]амино]-9-оксо-9Н-тиаксантен-4-ил]метил]метансульфонамид
[029] Аспекты настоящего описания изобретения включают, частично, вызывающее аутофагию соединение для лечения рака. Вызывающее аутофагию соединение для лечения рака (CTAPIC), относится к классу противораковых соединений, применимых при лечении широкого ряда раковых заболеваний, которые, тем не менее, вызывают аутофагию и, тем самым, ингибируют апоптоз. Многие противораковые терапевтические средства индуцируют аутофагию, поскольку они вызывают повреждение (цитотоксичная химиотерапия), метаболический стресс (ингибиторы ангиогенеза, 2-дезоксиглюкоза) или блокируют развитие сигнальных путей (целенаправленные нецитотоксические препараты, ингибиторы киназы) за счет имитирования депривации факторов или голодания. По существу, CTAPIC включает химиотерапевтические и целенаправленные терапевтические соединения, такие как иммунотерапевтические соединения, гормональные терапевтические соединения или соединения ингибиторы ангиогенезы. Неограничивающие примеры таких соединений включают противо-ангиогенезесные соединения, ингибиторы тирозинкиназы, ингибиторы фактора роста эндотелия сосудов (VEGFR), ингибиторы гистондеацетилазы, ингибиторы фарнезилтрансферазы, ингибиторы mTOR, ингибиторы гликолиза и аналоги витамина D и ретиноиды. Другие CTAPIC включают, без ограничения, мышьяковистый ангидрид, бевацизумаб карбоплатин 1/11, бортезомиб, дезоксиглюкозу, доцетаксел, эндостатин, этопозид, эверолимус, гефинитиб, иматиниб, иксабепилон, лонафарниб, рапамицин, яблочнокислый сунитиниб, тамоксифен, темозоломид и темсиролимус.
[030] Аспекты настоящего описания изобретения включают, частично, ингибитор гистондеацетилазы. Ингибиторы гистондеацетилазы (ингибиторы гистондеацетилазы (HDAC, HDACI), или ингибиторы гистондеацтилаз (HDI)) представляют собой класс соединений, которые препятствуют функционированию HDAC и могут привести к гиперацетилированию гистонов, воздействуя, тем самым, на экспрессию генов. Ингибиторы HDAC классифицируют согласно их химическим структурам, при этом они обладают различной специфичностью и сродством в отношении HDAC класса 1, 2 и 4. Среди ингибиторов HDAC, наиболее сильнодействующими являются гидроксаматного типа ингибиторы HDAC (типа гидроксамовой кислоты), которые проявляют дозозависимую противоопухолевую активность в отношении рака молочной железы и были недавно одобрены в качестве терапевтического средства для лечения лимфом кожных Т-клеток. Неограничивающие примеры гидроксаматного типа ингибиторов HDAC включают трихостатин А, вориностат, М-344, СВНА, белиностат, дациностат и панобиностат. Другим важным классом клинически эффективных ингибиторов HDAC являются бензамидного тира ингибиторы HDAC, которые демонстрировали низкую токсичность и активность в твердых и гематологических неоплазмах. Неограничивающие примеры бензамидного типа ингибиторов HDAC включают энтиностат, тацединалин и моцетиностат. Другие классы ингибиторов HDAC представляют собой короткоцепочечные жирные кислоты (SCFA), такие как, например, фенилбутират, вальпроевая кислота и подобные соединения алифатических кислот; циклические тетрапептиды, содержащие эпоксикетон и не содержащие эпоксикетон, такие как, например, трапоксин B и депсипептиды; электрофильные кетоны и гибридные молекулы. SCFA, хотя и широко применяемые (в частности, вальпроевая кислота) и клинически эффективные, имеют низкие константы ингибирования HDAC. Сиртуиновые HDAC класса III зависят от NAD+ и, следовательно, ингибируются никотинамидом, а также производными NAD, дигидрокумарином, нафтопираноном и 2-гидроксинафальдегидами. Ингибиторы HDAC также являются сильнодействующими радиосенсибилизаторами.
[031] Эпигенетические модификации представляют собой обратимые перегруппировки хроматина, которые в нормальных клетках модулируют транскрипционную экспрессию генов, не изменяя последовательность ДНК. Транскрипция является одной из стадий, участвующих в продуцировании белков из ДНК. Для протекания транскрипции транскрипционные факторы должны связываться со специфическими участками связывания в ДНК. Когда ДНК находится в своей конденсированной форме, транскрипционным факторам физически трудно получить доступ к их акцессорным участкам связывания, с конечным результатом, который нечасто имеет место.
[032] Гистоны представляют собой белки, которые играют основную роль в транскрипционной регуляции генов. Такие глобулярные белки имеют гибкие N-концы, обычно положительно заряженные благодаря аминовым группам, присутствующим в лизиновых и аргининовых остатках. Такие положительные заряды помогают N-концевой части гистонов взаимодействовать с отрицательно заряженными фосфатными группами на основной цепи ДНК и связывать их. Именно такое взаимодействие гистон-ДНК помогает конденсировать ДНК в ее компактную хроматиновую форму в виде хромосом. Таким образом, при обеспечении упаковки ДНК в ее конденсированную форму гистоны играют основную роль в ограничении связывания транскрипционных факторов с ДНК.
[033] Связывание гистонов с ДНК регулируется различными ферментами, присутствующими в клетке. В условиях, при которых имеется поддержка транскрипции определенного гена, ферменты, известные как гистон-ацетилтрансферазы (HATs) или лизин-деацетилазы (KDAC), добавляют ацетиловые группы к ε-N-ацетиллизиновым остаткам в гистонах. Ацетилирование нейтрализует положительные заряды на N-концевом участке гистонов, в результате чего ацетилированные гистоны больше не способны взаимодействовать с основной цепью ДНК. Такое уменьшение связывания приводит к увеличению количества хроматина (или деконденсации хроматина), что обеспечивает протекание транскрипции гена, поскольку транскрипционные факторы могут теперь получить доступ к их ДНК-участкам связывания и активировать транскрипцию гена. В условиях, при которых отсутствует поддержка транскрипции гена, ферменты, известные как гистондеацетилазы (HDAC), удаляют добавленные ацетиловые группы с помощью HAT. Деацетилирование увеличивает положительный заряд N-концевых групп гистонов, стимулируя, тем самым, высокоаффинное связывание гистонов и основной цепи ДНК. Возникающая конденсация хроматина предотвращает транскрипцию гена, поскольку транскрипционные факторы физически заблокированы от взаимодействия с их ДНК-участками связывания. Таким образом, HAT облегчают деконденсацию хроматина и по существу способствуют транскрипции гена, тогда как HDAC облегчают конденсацию хроматина и по существу подавляют транскрипцию генов.
[034] Существует 18 известных человеческих HDAC, сгруппированных в четыре класса на основе сходства функций и последовательностей ДНК их вспомогательных доменов. Первые два класса считаются «классическими» HDAC, активность которых ингибирует трихостатин (TSA), тогда как третья группа представляет собой семейство NAD+-зависимых белков, на которые не воздействует TSA. Четвертый класс рассматривается как атипичная категория, основанная исключительно на отличии их последовательности ДНК от других. Класс I включает HDAC1, HDAC2, HDAC3 и HDAC8 и имеет гомологию подобную дрожжевому белку 3 (RPD3) с пониженной калиевой зависимостью. HDAC4, HDAC5, HDAC7 и HDAC9 принадлежат к классу II и имеют гомологию подобную дрожжевой гистондеацетилазе 1 (HDA1). HDAC6 и HDAC 10 содержат два каталитических участка и относятся к классу На. Класс III, также известный как сиртуины, связан с SIR2 и включает SIRT1-7, тогда как HDAC11 относят к классу IV, поскольку он сохранил в своем каталитическом центре остатки, которые являются общими как для класса I, так и класса II HDAC.
[035] Известны несколько противоопухолевых соединений, которые действуют как ингибиторы HDAC. По существу, полагают, что ингибирование конденсации хроматина сможет обеспечить терапевтически целебный эффект при лечении рака, поскольку такое ремоделирование хроматина приводит к 1) транскрипционной супрессии регуляторных генов ключевого апоптоза и клеточного цикла, что, тем самым, стимулирует остановку клеточного цикла и апоптоз; 2) повышенной гетерозиготности опухолевого супрессора, и/или 3) ингибированию ангиогенеза. Таким образом, эпигенетическая регуляция транскрипции генов за счет конденсации хроматина становится важным механизмом, приводящим к образованию опухолей.
[036] В аспектах такого варианта реализации изобретения ингибитор гистондеацетилазы представляет собой гистондеацетилазу гидроксаматного типа или гистондеацетилазу бензамидного типа. В других аспектах таких вариантов реализации изобретения, ингибитор гистондеацетилазы представляет собой (2E,4E,6R)-7-(4-диметиламинофенил)-N-гидрокси-4,6-диметил-7-оксогепта-2,4-диенамид, N-гидрокси-N’-фенилоктандиамид, 4-диметиламино-N-(6-гидроксикарбамоилгексил)-бензамид, N-гидрокси-3-[(Е)-3-(гидроксиамино)-3-оксопроп-1-енил] бензамид, (2Е)-3-[3-(анилиносульфонил)фенил]-N-гидроксиакриламид, ((Е)-N-гидрокси-3-[4-[[2-гидроксиэтил-[2-(1Н-индол-3-ил)этил]амино]метил]фенил]проп-2-енамид, (E)-N-гидрокси-3-[4-[[2-(2-метил-1Н-индол-3-ил)этиламино]метил]фенил]проп-2-енамид, N-(2-аминофенил)-N’-фенил-октандиамид, 4-(2-аминофенилкарбамоил)бензилкарбамат, 4-ацетамидо-N-(2-аминофенил) бензамид, N-(2-аминофенил)-4-[[(4-пиридин-3-илпиримидин-2-ил)амино]метил] бензамид, 3-(диметиламинометил)-N-[2-[4-(гидроксикарбамоил)фенокси]этил]-1-бензофуран-2-карбоксамид или {6-[(диэтиламино)метил] -2-нафтил} метил {4-[(гидроксиамино)карбонил] фенил} карбамат. Химическая структура таких ингибиторов показана ниже.
Трихостатин А