Короткие антимикробные липопептиды
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа лечения микробной инфекции кожи или слизистой ткани у млекопитающего, включающего введение в инфицированную область указанного млекопитающего терапевтически эффективного количества композиции, содержащей по меньшей мере один пептид формулы Pal-липид-лизин-пролин-NH2 или Pal-липид-лизин-d-пролин-NH2, и фармацевтически приемлемый носитель в течение эффективного количества времени. Изобретение обеспечивает лечение микробной инфекции кожи или слизистой ткани у млекопитающего. 5 з.п. ф-лы, 1 пр., 4 табл.
Реферат
[0001] По данной заявке испрашивается приоритет в соответствии с предварительной заявкой США 61/613212, поданной 20 марта 2012 года, которая включена в настоящий документ в качестве ссылки в своем полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Изобретение относится к пептидам, обладающим биологической и терапевтической активностью. В частности, настоящее изобретение относится к модифицированным липидами ди- или трипептидным аналогам KPV или KdPT, которые обладают противомикробной активностью. В частности, пептиды, соответствующие данному изобретению, обеспечивают повышенную противомикробную активность по сравнению с основными трипептидами, лизин-пролин-валином и лизин-d-пролин-тирозином. Кроме того, изобретение относится к способам применения этих пептидов для лечения различных поражений, воспалений или бактериальных инфекций, негативно воздействующих на кожу и другие связанные поверхности тела, такие как ротовая полость.
ПРЕДПОСЫЛКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0003] Исследователями на протяжении десятилетий разрабатывались противомикробные средства и методы лечения. В последнее время наблюдается потребность в новых противомикробных средствах для лечения все большего количества лекарственно-резистентных бактериальных, вирусных и грибковых инфекций.
[0004] О различных биоактивных пептидах сообщалось как в научной литературе, так и в выданных патентах. Пептиды исторически были выделены из природных источников, а в последнее время были предметом исследований взаимосвязи структура-действие. Кроме того, природные пептиды служили отправными точками для проектирования синтетических пептидных аналогов.
[0005] Имеются различные патенты, описывающие косметические композиции, содержащие короткие пептиды. Например, в патенте США № 6492326 предложено получение и применение композиций для ухода за кожей, содержащих пентапептиды и активные ингредиенты для ухода за кожей.
[0006] В своей работе Strom et al. 2003 (Journal of Medicinal Chemistry 46: 1567-1570) описывают короткие противобактериальные пептиды, сосредотачиваясь в основном на очень коротких пептидах (димеры и тримеры), имеющих химические модификации. Также были описаны некоторые гексапептиды. Однако исследование или обсуждение противомикробной активности указанных гексапептидов в этих документах отсутствует.
[0007] Альфа-меланоцитстимулирующий гормон (α-MSH) представляет собой 13-аминокислотный нейропептид с сильной противовоспалительной активностью. Он образуется путем посттрансляционной модификации большей молекулы предшественника проопиомеланокортина. Было показано, что карбоксиконцевой трипептид α-MSH, состоящий из остатков от 11 до 13, KPV, оказывает противовоспалительное действие in vivo и in vitro (Brzoska, T., Luger, T.A. et al., α-melanocyte-stimulating hormone and related tripeptides: biochemistry, anti-inflammatory and protective effects in vitro and in vivo, and future perspectives for the treatment of immune-mediated inflammatory diseases. Endocrine Reviews 2009. 29 (5): 581-602). Было описано близкое по структуре производное KdPT (KPT), коллинеарное по остаткам 193-195 IL-1β и, по-видимому, способное взаимодействовать с рецептором IL-1 типа I (Luger T.A., and Brzoska T. α-MSH related peptides: a new class of anti-inflammatory and immunomodulating drugs. Ann Rheum Dis 2007; 66 (suppl III): iii52-iii55). Имелось одно сообщение о том, что KPV обладает противомикробным действием в отношении S. стафилококка (S. aureus) и C. альбиканс (C. albicans), однако МИК не определялась (Cutuli M et al., 2000, antimicrobial effects of α-MSH peptides, J. Leukocyte Biology, 67:233-239). В отличие от KPV, никогда не сообщалось о том, что трипептид KdPT обладает противомикробным действием.
[0008] Таким образом, существует потребность в разработке пептидов, обладающих широким спектром мощной противомикробной активности в отношении ряда микроорганизмов, в том числе грамотрицательных и грамположительных бактерий. Затраты на получение противомикробных пептидов также являются важным фактором для фармацевтического и косметического использования. В данном изобретении предложены экономически эффективные короткие противомикробные пептиды, которые могут быть использованы в фармацевтических или косметических композициях для местного лечения или сдерживания развития кожных заболеваний, связанных с бактериальными и грибковыми инфекциями.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение относится к модифицированным липидами ди- или трипептидным аналогам KPV или KdPT, которые проявляют противомикробную активность. В частности, пептиды по настоящему изобретению обеспечивают повышенную противомикробную активность по сравнению с основными трипептидами, лизин-пролин-валином и лизин-d-пролин-тирозином. Противобактериальная активность, являющаяся задачей выделенных пептидов, направлена против таких бактерий, которые негативно воздействуют на кожу и связанные поверхности слизистых оболочек. Не предполагая ограничиваться каким-либо конкретным механизмом действия, возможно, пептиды по настоящему изобретению способны стимулировать здоровое состояние кожи, ингибируя бактериальный рост и ингибируя связанное с этим воспаление, вызванное бактериальной инфекцией.
[0010] Один вариант осуществления настоящего изобретения касается модифицированных липидами ди- или трипептидов общей формулы:
C12-18 липид-KXZ-NH2,
где K представляет собой лизин; X представляет собой пролин, D-пролин (D-изомер пролина), гистидин или аргинин; Z является необязательным и, если присутствует, Z представляет собой валин, треонин, аланин или лейцин; и концевая COOH амидирована NH2. Пептид модифицирован C12-18 липидом и, предпочтительно, липидным фрагментом лауриновой кислоты (C12), миристиновой кислоты (C14), пентадекановой кислоты (C15), пальмитиновой кислоты (C16) или стеариновой кислоты (C18). Пентадеканоил и пальмитоил являются наиболее предпочтительными липидными группами.
[0011] Предпочтительные модифицированные липиды ди- и три-аминокислот включают
C12-18 липид-лизин-пролин-валин-NH2;
C12-18 липид-лизин-d-пролин-треонин-NH2;
C12-18 липид-лизин-пролин-аланин-NH2;
C12-18 липид-лизин-пролин-лейцин-NH2;
C12-18 липид-лизин-пролин-NH2;
C12-18 липид-лизин-d-пролин-NH2;
C12-18 липид-лизин-гистидин-NH2 и
C12-18 липид-лизин-аргинин-NH2.
[0012] Другой вариант осуществления настоящего изобретения относится к композициям, которые содержат фармацевтически или косметически приемлемый носитель и один или несколько из вышеупомянутых пептидов. Пептид в таких композициях, предпочтительно, находится в диапазоне концентраций от примерно 0,1 мкг/мл до примерно 20 мкг/мл, или от примерно 0,1 мкг/мл до примерно 10% (масс./об.). Предпочтительными формами композиции являются аэрозоли, эмульсии, жидкости, водные растворы, лосьоны, кремы, пасты, мази, порошки и пены, подходящие для местного применения.
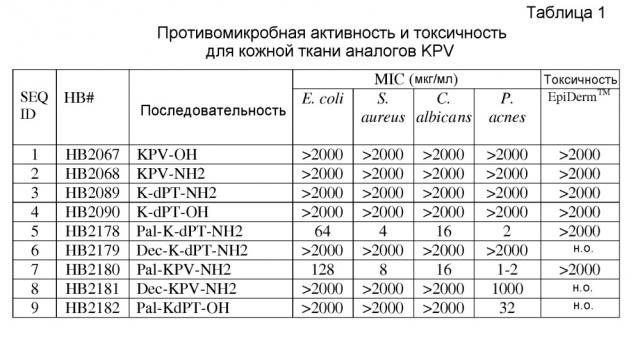
[0013] Настоящее изобретение касается также способов применения указанных выше композиций для лечения или профилактики микробных инфекций кожи млекопитающих. Как правило, способ лечения влечет за собой введение эффективного количества содержащих пептид композиций на пораженные участки кожи (эпидермис) и связанных тканей слизистой оболочки в течение эффективного количества времени. Способы также могут быть использованы, когда бактериальная инфекция вызвана бактерией, выбранной из P. acnes, S. aureus, E. coli и C. albicans.
[0014] Кроме того, пептиды по настоящему изобретению и композиции, содержащие их, могут обеспечить полезные характеристики для включения их в общеизвестные средства по уходу за кожей и в косметические препараты, такие как различная косметика для кожи, кремы для кожи, лосьоны, солнцезащитные кремы и терапевтические лосьоны или кремы, такие как противоугревые препараты.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0015] Для того чтобы описанное в данном документе настоящее изобретение было более понятным, далее дано его подробное описание. Настоящее изобретение в целом относится к композиции и способам, включающим противомикробные модифицированные липидами ди- или трипептидные аналоги KPV или KdPT общей формулы:
C12-18 липид-KXZ-NH2,
где K представляет собой лизин; X представляет собой пролин, d-пролин, гистидин или аргинин; Z является необязательным и, если присутствует, Z представляет собой валин, треонин, аланин или лейцин; и концевая COOH амидирована NH2.
Примеры насыщенных или ненасыщенных жирных кислот, которые могут быть использованы для обеспечения C12-18 липид-компонента соединений по настоящему изобретению включают:
| Системное название | Общее название | Сокращенное обозначение |
| додекановая кислота | лауриновая кислота | 12:0 |
| тетрадекановая кислота | миристиновая кислота | 14:0 |
| гексадекановая кислота | пальмитиновая кислота | 16:0 |
| гептадекановая кислота | маргариновая (датуровая) кислота | 17:0 |
| октадекановая кислота | стеариновая кислота | 18:0 |
| 9-цис-тетрадеценовая кислота | миристинолеиновая кислота | 14:1 (n-5) |
| 9-цис-гексадеценовая кислота | пальмитолеиновая кислота | 16:1 (n-7) |
| 6-цис-гексадеценовая кислота | сапиеновая кислота | 16:1 (n-10) |
| все-цис-7,10,13-гексадекатриеновая кислота | 16:3 (n-3) | |
| 9-цис-октадеценовая кислота | олеиновая кислота | 18:1 (n-9) |
| все-цис-9,12-октадекадиеновая кислота | линолевая кислота | 18:2 (n-6) |
[0016] Альфа-меланоцитстимулирующий гормон (α-MSH) представляет собой 13-аминокислотный нейропептид с сильной противовоспалительной активностью. Он образуется путем посттрансляционной модификации большей молекулы предшественника проопиомеланокортина. Как было показано, карбоксиконцевой трипептид α-MSH, состоящий из остатков от 11 до 13, KPV, оказывает противовоспалительное действие in vivo и in vitro (Brzoska, T., Luger, T.A. et al., α-melanocyte-stimulating hormone and related tripeptides: biochemistry, anti-inflammatory and protective effects in vitro and in vivo, and future perspectives for the treatment of immune-mediated inflammatory diseases. Endocrine Reviews 2009. 29 (5): 581-602). Было описано, что близкое по структуре производное KdPT (KPT) является коллинеарным по остаткам 193-195 IL-1β и, по-видимому, способно взаимодействовать с рецептором IL-1 типа I (Luger T.A., and Brzoska T. α-MSH related peptides: a new class of anti-inflammatory and immunomodulating drugs. Ann Rheum Dis 2007; 66 (suppl III): iii52-iii55). Имелось одно сообщение о том, что KPV обладает противомикробным действием в отношении S. aureus и C. albicans, однако МИК не была определена (Cutuli M et al., 2000, antimicrobial effects of α-MSH peptides, J. Leukocyte Biology, 67:233-239). В отличие от KPV, никогда не сообщалось о том, что трипептид KdPT обладает противомикробным действием.
[0017] Авторы настоящего изобретения осуществили определение минимальной ингибирующей концентрации (МИК) в соответствии с рекомендациями CLSI (Институт клинических лабораторных стандартов) с помощью стандартного подхода по выбору противомикробных средств (Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Ninth Edition). К удивлению авторов настоящего изобретения, ни KPV, ни KdPT не показали определяемые МИК при концентрациях вплоть до 2000 мкг/мл в отношении E. coli, S. aureus или дрожжей. Такой плохой противомикробный профиль делает оба трипептида гораздо менее желательным для терапевтического или косметического использования, когда требуется проявление противомикробной активности.
[0018] Авторы настоящего изобретения модифицировали оба пептида посредством N-концевого ацилирования липидами различной длины по альфа-аминогруппе KPV и KdPT. Такая модификация генерирует молекулы с новой превосходной и неожиданной противомикробной активностью в отношении широкого спектра микроорганизмов. Полученные липотрипептиды показали неожиданную противомикробную активность, превосходящую активность исходных пептидов в отношении грамотрицательных и грамположительных бактерий и дрожжей. Длина липида также влияет на такую активность, и авторы настоящего изобретения обнаружили, что липиды с числом атомов углерода в диапазоне от 12 до 18 были наиболее эффективными. После такой липидной модификации МИК была значительно улучшена в бульоне Мюллера-Хинтона в интервале от 1 до 64 мкг/мл в отношении P. acnes, S. aureus, E. coli и C. albicans. Замена третьего остатка в Pal-KPV-NH2 на A или L сохраняла противомикробную активность, и обнаружение этого факта помогло авторам настоящего изобретения удалить третий аминокислотный остаток у KPV или KdPT. Полученные липопептиды, Pal-KP-NH2, Pal-K-dP-NH2, все продемонстрировали новую противомикробную активность. Кроме того, оба, и KP-NH2, и KdP-NH2, продемонстрировали умеренную противовоспалительную активность в отношении индуцированной гистамином экспрессии IL-6 в кератиноцитах кожи человека (данные не представлены). Авторы настоящего изобретения затем заменили второй остаток P или dP на V, A, F, G, S, H, K, I, L, D, R, S, W или Y. Эта работа обеспечила группе липодипептидов новую противомикробную активность, о чем никогда не сообщалось ранее. Противомикробная активность может быть транслирована на терапевтическое применение в фармацевтическом или косметическом препарате.
[0019] Таким образом, настоящее изобретение основано на разработке конкретных липодипептидов и липотрипептидов, полученных из KPV, состоящих из липида-KXZ, где липид может быть желательно выбран из группы пальмитоил-, лаурил-, миристил-, пентадеканоил- и стеарил-; и х может быть выбран из P, G, I, H и R, в L- или D-энантиомерной форме, Z является необязательным и, если присутствует, Z представляет V, T, А или L, амидированных по карбокси-концу. Такие короткие липопептиды являются новыми противомикробными средствами в отношении грамположительных и грамотрицательных бактерий, включая Escherichia coli (E. coli), Staphylococcus aureus (S. aureus), Propionibacterium acnes (P. acnes), дерматофитов, таких как Trichophyton spp., и дрожжей Candida spp., включая C. albicans, C. glabrata и C. Tropicalis.
[0020] Ключ к аббревиатурам: Липиды, перечисленные выше, которые присоединены посредством амидной связи к ди- или трипептиду, используя стандартные способы синтеза химии пептидов: myr = миристиновая кислота, pen = пентадекановая кислота, pal = пальмитиновая кислота, ste = стеариновая кислота, lau = лауриновая кислота. Декстроформа аминокислоты обозначена сокращенно "d", например, декстроформа пролина обозначена d-пролин. Кроме того, аббревиатуры аминокислот соответствуют общепринятым:
| Аланин | Ala | A |
| Аргинин | Arg | R |
| Аспарагины | ASN | N |
| Аспарагиновая кислота | Asp | D |
| Цистеин | Cys | C |
| Глутаминовая кислота | Glu | E |
| Глутамин | Gln | Q |
| Глицин | Gly | G |
| Гистидин | His | H |
| Изолейцин | Ile | I |
| Лейцин | Leu | L |
| Лизин | Lys | K |
| Метионин | Met | M |
| Фенилаланин | Phe | F |
| Пролин | Pro | P |
| Серин | Ser | S |
| Треонин | Thr | T |
| Триптофан | Trp | W |
| Тирозин | Tyr | Y |
| Валин | Val | V |
[0021] Подробную информацию о способах разработки и введения фармацевтических препаратов можно найти в последнем издании Remington's Pharmaceutical Sciences (Mack Publishing Co, Easton Pa.). Хотя желательна местная наружная доставка, есть и другие средства доставки, например: пероральное, парентеральное, с помощью аэрозоля, внутримышечное, подкожное, чрескожное, интрамедуллярное, интратекальное, внутрижелудочковое, внутривенное, внутрибрюшинное или интраназальное средство. Препараты по настоящему изобретению могут быть в составе с рядом доставляющих носителей, например, в составе спрея; аэрозоля; эмульсии типа вода-масло; эмульсии типа масло-вода; крема для лица или крема для тела; лосьона для загара или лосьона после загара; или с другими доставляющими носителями для местного введения. Кроме того, пептиды по настоящему изобретению и композиции, содержащие их, могут обеспечивать полезные характеристики для включения в общеизвестные средства по уходу за кожей и косметические препараты, такие как различная косметика для кожи, кремы для кожи, лосьоны, солнцезащитные кремы и терапевтические лосьоны или кремы, такие противоугревые препараты.
[0022] Как используется в настоящем документе, термин "терапевтический" обозначает агент, используемый для лечения, подавления, облегчения, предотвращения или улучшения нежелательного состояния или заболевания пациента. Состояние, которое лечат, в настоящем изобретении включает различные бактериальные инфекции, которые обычно действуют на кожу или слизистые участки млекопитающих, таких как люди. Способы могут быть также использованы при бактериальной инфекции, вызванной бактерией или грибком, выбранными из P. acnes, S. aureus, E. coli и C. albicans.
[0023] В зависимости от предусмотренного конкретного применения фармацевтическая композиция в соответствии с объектом изобретения может быть изготовлена в виде раствора, суспензии, препарата для парентерального введения, мази, крема, лосьона, спрея, порошка, таблеток или капсул. Препараты для парентерального введения могут включать наполнитель для лекарственной формы, такой как специально дистиллированная апирогенная вода, фосфатный буфер или физиологический раствор. Мази, кремы, лосьоны и спреи могут включают носитель, такой как растительное или минеральное масло, белый вазелин или высокомолекулярный спирт, т.е. больше, чем C12. Таблетки или капсулы могут включать разбавители (например, лактозу), связующие вещества, смазывающие вещества (например, стеариновую кислоту) и разрыхлитель (например, кукурузный крахмал).
[0024] Спрей для рта, содержащий эффективное количество активного агента, может быть также приготовлен с одним или несколькими модифицированными липидами пептидами по настоящему изобретению. Этот материал может быть распылен в качестве противомикробного агента аликвотами от 0,25 до 0,5 мл на поверхности зубов и десен в каждом квадранте от 1 до 3 раз в день. В случае зубных протезов спрей может быть использован непосредственно на поверхности зубного протеза перед ежедневным надеванием протеза. При желании может быть предусмотрен препарат для полоскания рта, содержащий эффективное количество противомикробного агента.
[0025] Композиции по настоящему изобретению также могут включать фармацевтически или дерматологически приемлемый носитель. Примеры носителей включают эмульсии и гели. Эмульсии часто являются смесью масляной фазы и водной фазы. Композиции могут также содержать отшелушивающие абразивные материалы. Композиции могут также содержать стабилизатор. Композиции могут также включать соединение, подавляющее пену.
[0026] Композиции также могут включать один или несколько дополнительных активных компонентов по уходу за кожей. Примеры активных компонентов по уходу за кожей включают десквамативные активные вещества, противоугревые активные вещества, соединения витамина B3, ретиноиды (включая ретинол, ретиналь, эфиры ретинола, ретинилпропионат, ретиноевую кислоту и ретинилпальмитат), гидроксильные кислоты, поглотители свободных радикалов, хелаторы, противовоспалительные агенты, местные анестетики, дубильные активные вещества, осветляющие кожу средства, антицеллюлитные средства, флавоноиды, противомикробные активные вещества, оздоровляющие кожу агенты, противогрибковые активные вещества, фарнезол, фитантриол, аллантоин, салициловую кислоту, ниацинамид, декспантенол, токоферол ацетат и глюкозамин.
[0027] Композиции также могут включать солнцезащитные соединения. Примеры солнцезащитных соединений включают неорганические солнцезащитные соединения и органические солнцезащитные соединения. Неорганические солнцезащитные вещества могут включать оксиды металлов, такие как оксид цинка, оксид титана и оксид железа. Органические солнцезащитные соединения могут включать октилметоксициннамат, октилсалицилат, терефталиден-дикамфор-сульфоновую кислоту, авобензон и октокрилен.
Материалы и способы
[0028] 1. Пептидный синтез. Все описанные пептиды были синтезированы с использованием стандартного Fmoc (9-флуоренилметоксикарбонил) твердофазного химического синтеза. Пептиды были получены в виде амидированных или свободнокислотных последовательностей с использованием стандартных аминокислот.
[0029] 2. Бактериальные штаммы и условия культивирования. Штаммы бактерий, включенные в это исследование, приведены в таблице 1. E. coli UB1005, S. aureus SAP0017 (MRSA) и C. albicans 105 выращивали на пластинах с агаром Мюллера-Хинтона (MH) (Difco, BD Biosciences, MD) и в бульоне (2 г мясного экстракта, 17,5 г кислотного гидролиза казеина и 1,5 г крахмала на литр) при 37°C, если не указано иное. Перед исследованием чувствительности к антимикробным препаратам бактерии из замороженного бульона пересевали на плашки со свежеприготовленным агаром MH. Для P. acnes бактерии выращивали в бульоне BBLTM Brain-Heart Infusion (Becton, Dickinson & Company, Sparks MD) или на агаровых пластинах при температуре 37°С в анаэробных условиях, генерируемых с использованием анаэростата и AnaeroGenTM (Oxoid, Basingstoke, Hampshire, England).
[0030] 3. Определение противомикробной активности. Минимальную ингибирующую концентрацию (МИК) каждого пептида определяли с использованием модифицированного анализа CLSI микротитрованием разведений бульона (Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Ninth Edition). Был использован инокулят 105-106 колониеобразующих единиц (КОЕ)/мл или 104 КОЕ/мл для дрожжей. Значение МИК было принято в качестве наименьшей концентрации пептида, при которой подавлялось более 90% роста микроорганизмов после 15-20 часов инкубирования при температуре 37°С. Для P. acnes инкубирование в анаэробных условиях при температуре 37°С продолжали в течение 2 недель, после чего определяли МИК. Определение кинетики гибели проводили с использованием заданной концентрации (около 2-5-кратной МИК) пептида, смешанного с индикаторным микроорганизмом. После соответствующего разведения клетки высевали на чашки с агаром через определенные промежутки времени и инкубировали при температуре 37°С в течение ночи. В случае P. acnes требовался длительный период инкубации. Подсчитывали КОЕ и наносили на график зависимости выживания бактерий после обработки пептидом от времени, который показывает эффективность пептида в уничтожении микроорганизма.
[0031] 4. Определение токсичности в отношении кожной ткани. Совместимость и токсичность по отношению к коже определяли с помощью кожной ткани EpiDerm (EPI-200) и набора MTT Kit (MTT-100) (MatTek, Ashland, MA) в соответствии с инструкцией завода-изготовителя. В качестве положительного (токсичного) и отрицательного (нетоксичного) контроля были использованы 1% Triton X-100 и PBS, соответственно.
[0032] 5. Анализ профилирования генов. Были проанализированы 84 гена, кодирующие молекулы адгезии к внеклеточному матриксу в фибробластах кожи человека, используя массивы PCR (PCR arrays), производимых Sunny Biodiscovery, Inc (Santa Paula, CA). Фибробласты кожи человека были получены от фирмы Zen-Bio, Research Triangle Park, NC (cat.# DF-F, lot# DFMF112410). Клетки (низкий перенос) выращивали в среде DMEM/10% FCS w/o фенолового красного, пока они не достигали конфлюэнтной стадии, после чего их инкубировали дважды с исследуемыми веществами при концентрации 3, 5 или 10 мкг/мл, или с водой в течение 24 часов. В конце инкубирования клетки наблюдали под инвертированным микроскопом Nikon TS. Ни в одном из экспериментальных условий не было выявлено цитотоксичности. Качественная оценка показала больше клеток, подвергающихся митозу под действием исследуемых веществ при 5 мкг/мл, чем при 10 мкг/мл, и поэтому условие 5 мкг/мл было выбрано для экстракции РНК.
[0033] В конце инкубационного периода клетки хранили в растворе RNAlater (Ambion, Austin, TX) в течение 6 час. РНК экстрагировали и очищали с помощью набора NucleoSpin RNA II от фирмы Machery-Nagel, Bethleem, PA). Общую очищенную РНК оценивали при 230 нм, 260 нм и 280 нм с помощью спектрофотометра Agilent HP-8452A с диодной матрицей. Концентрацию РНК усредняли по образцам, и экспрессию генов, представляющих интерес, измеряли с помощью системы BioRad iCycler iQ Detection System с проведением PCR в режиме реального времени, используя массивы PCR PAHS-013A (www.sabiosciences.com/rt_pcr_product/HTML/PAHS-013A.html), с набором синтеза 1-й нити, SYBR Green master mix и условий проведения PCR от фирмы Qiagen (ранее SA Biosciences). После нормализации экспрессии генов до 5 генов «домашнего хозяйства», проведенной с помощью коммерческого набора RT2 Profiler PCR Array для анализа, программное обеспечение версии 3.5, для количественного определения результатов был использован эффективный метод ΔΔCt.
Результаты и обсуждение
[0034] Противовоспалительная активность in vitro и in vivo как KPV, так и KdPT трипептидов была известна. Сообщалось также, что трипептид KPV проявлял противомикробную активность в фосфатном буфере в отношении S. aureus и C. albicans (Cutulis M. et al., Antimicrobial effects of α-MSH peptides. J. Leukocyte Bio. 2000 67:233-239). Однако значение МИК для KPV никогда не было определено или об этом не сообщали. Неизвестно также было, обладает ли KdPT противомикробным действием или нет.
[0035] Авторы настоящего изобретения исследовали антимикробную активность KPV и K-dPT в культуральной среде с использованием рекомендованного CLSI анализа серийного разведения в бульоне, стандартного анализа по определению МИК in vitro на противомикробную и противогрибковую активность (Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Ninth Edition). К удивлению авторов, ни KPV (HB2067, HB2068), ни KdPT (HB2089, HB2090) с С-концевым амидированием или без него не показали определяемые МИК при концентрациях вплоть до 2000 мкг/мл в бульоне MH (таблица 1). Это согласовывалось с выводами, описанными Rauch и сотрудниками, о том, что KPV не подавляет рост дрожжей вплоть до 100 мкМ в анализе роста в отношении C. albicans штамма SC5314, стандартного лабораторного штамма в экспериментах по противогрибковой чувствительности (Rauch I., Holzmeister S., and Kofler B. Anti-Candida activity of alpha-melanocyte-stimulating hormone (alpha-MSK) peptides. J. Leukoc. Biol. 2009. 85 (3):371-372).
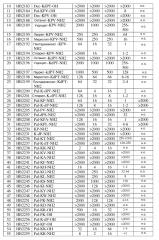
[0036] Авторы настоящего изобретения модифицировали KPV и KdPT липидами различной длины с целью поиска аналогов с лучшим или улучшенным противомикробным профилем, чем исходные трипептиды. Ацетилирование трипептидного ядра показало удивительные результаты. Длина липида, по-видимому, является важной, и в таблице 2 показаны результаты с использованием KPV в качестве примера.
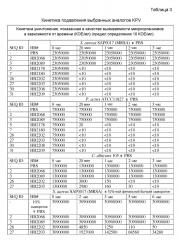
[0037] Липид с количеством атомов углерода от 11 до 18, по-видимому, проявляет положительное влияние на противомикробную активность обоих, и KPV, и KdPT (таблица 1, 2). Оптимальная длина липида была установлена равной 15 и 16 для KPV и KdPT (таблица 1, 2). Такие липиды значительно повышают противомикробную активность обоих пептидов к широкому спектру микроорганизмов, включая грамположительные, грамотрицательные бактерии и дрожжи, как видно по SEQ ID NO 5 (HB2178), 7 или 24 (HB2180 или HB2200), 17 (HB2192), 23 (HB2199) (таблица 1, 2). Действительно, липопептиды показали почти 2000-кратное улучшение в МПК, начиная от 1-64 мкг/мл в отношении P. acnes, S. aureus, E. coli и C. albicans, по сравнению с исходным трипептидом KPV-NH2 или KdPT-NH2 самим по себе, который был неактивным вплоть до 2000 мкг/мл (таблица 1). Увеличение длины липида до 18-углеродов отменяет грамотрицательную селективную активность, но сохраняет как грамположительную, так и дрожжевую селективную активность (таблица 1, 2). Авторы настоящего изобретения далее провели замещение третьей аминокислоты в Pal-KPV-NH2 с участием либо A, либо L и получением ID NO 30 (HB2208) и 31 (HB2209). Интересно, что обе SEQ ID NO 30 и 31 сохраняли достаточно широкий спектр противомикробной активности, что предполагало, что третий остаток V в Pal-KPV-NH2 либо может, либо не может потребоваться для наблюдаемой новой противомикробной активности. В дополнение к широкому спектру активности, как показывает МИК, аналоги, включая SEQ ID NO 5 (HB2178), 7 (2180), 30 (HB2208) и 31 (HB2209) были все фунгицидными и уничтожали 5-6 log S. Aureus в течение 20 минут в анализе по подавлению микроорганизмов (таблица 3). Резюмируя, можно сказать, что присоединение липидов к KPV-NH2 или KdPT-NH2 с числом атомов углерода от 12 до 18 позволяет генерировать липотрипептиды с новым широким спектром противомикробной активности, о чем никогда не сообщалось ранее. Третий остаток в Pal-KPV-NH2 или Pal-KdPT-NH2 может быть или может не быть определяющим для наблюдаемой новой противомикробной активности. Амидирование по C-концу является весьма важным для описанной противомикробной активности, так как неамидированные дубликаты, такие как HB2184 и HB2182, были менее активны или неактивны.
[0038] То, что замещение третьего остатка Pal-KPV-NH2 с участием A и L не отменяло активность, побудило авторов настоящего изобретения к дальнейшим модификациям. Так, авторы настоящего изобретения удалили третий аминокислотный остаток у обоих, Pal-KPV-NH2 и Pal-KdPT-NH2, с получением липодипептидов SEQ ID NO 26 (HB2202) и SEQ ID NO 27 (HB2203). Оба производные показали новую противомикробную активность, подобную исходным липотрипептидам Pal-KPV-NH2 и Pal-KdPT-NH2 (таблица 1). Такая активность была неожиданной и никогда не была описана. Кинетика подавления предполагает, что оба липодипептидных производных были одинаково фунгицидными и уничтожали 5-6 log микроорганизмов, включая P. acnes, S. aureus, E. coli и дрожжи C. albicans в течение 20 минут при прямом контакте в PBS (таблица 3). Противомикробная активность липодипептидов, описанных в настоящем изобретении, была также очевидной, как и сохраняемая значительная подавляющая активность в отношении S. aureus в присутствии 10%-ной фетальной бычьей сыворотки (таблица 3). Это имеет особую важность. Пептидные антибиотики часто являются проблемой из-за взаимодействия и связывания с белками хозяина, что приводит к снижению противомикробной активности. Учитывая, что порезы или повреждения кожи, включая акне, часто сопровождаются инфильтрацией серозной жидкости в область поражения, противомикробная активность в сыворотке является очень важной для возможных терапевтических средств.
[0039] Чтобы убедиться в том, что Pal-KP-NH2 имеет конструкцию для проявления оптимальной активности, авторы настоящего изобретения поменяли положение для P и K с образованием HB2251 (Pal-PK-NH2) и HB2255 (Pal-PK-OH). По сравнению с Pal-KP-NH2, Pal-PK-NH2 показал более чем 8-кратное снижение активности. Неамидированные производные Pal-PK-OH и Pal-KP-OH были неактивны, снова позволяя предполагать, что С-концевое амидирование является определяющим для противомикробной активности.
[0040] Возможность лечения кожного раздражения липодипептидами была протестирована с помощью модели EpiDermTM Skin Model (MatTek, Ashland, MA) в сочетании с модифицированным анализом МТТ. Модель EpiDermTM Skin Model демонстрирует in vivo-подобные морфологические и ростовые характеристики, которые являются однородными и легко воспроизводимым. EpiDermTM состоит из органических базальных, остистых, гранулированных и ороговевших слоев, аналогичных тем, которые имеются in vivo. Ткани обрабатывали каждым соединением при желаемой концентрации в течение 20 часов. Как видно из таблицы 1, ни один из выбранных липопептидов, представленных HB2202, HB2203, HB2180 HB2208 и HB2209, не проявлял негативного действия на жизнеспособность тканей вплоть до 2000 мкг/мл.
[0041] Воодушевленные новыми липодипептидами HB2202 и HB2203, авторы настоящего изобретения продолжили модификации путем замещения второго остатка Pal-KP-NH2 и Pal-K-dP-NH2 с участием V, A, F, G, L, S, H, K, I, S, R, T, Y или W. Как показано в таблице 1, такая модификация приводит к открытию обширной группы новых липодипептидов, которые оказывают либо широкий спектр противомикробной активности (Pal-KH-NH2, Pal-KR-NH2, Pal-KR-OH), либо большую грамположительную селективную активность (Pal-KG-NH2, Pal-KL-NH2 и Pal-KI-NH2) (таблица 1).
[0042] Три показательных соединения, SEQ ID NO 26 (HB2202), SEQ ID NO 41 (HB2242) и SEQ ID NO 55 (HB2259), были выбраны для изучения генной пролиферации на дермальных фибропластах человека. Как показано в таблице 4, три соединения показали одинаковый характер тренда с точки зрения влияния на фибробласты кожи человека. Генами, которые подвергались воздействию, являлись те, которые участвуют в заживления ран и противофиброзных каскадах. Три соединения влияют на интегрины, как показывает то, что HB2202 и HB2242 активируют экспрессию ITGA2 (интегрин альфа 2), тогда как HB2259 индуцирует ITGA6 (интегрин альфа 6) (таблица 4). Интегрины присоединяются к коллагенам и играют важную роль в клетке при матричных взаимодействиях. Эти белки обильно экспрессируются базальными кератиноцитами в неповрежденной коже и являются необходимыми для реэпителизации кожных ран человека. Соединения также модулируют экспрессию ADAMTS (адам металлопептидаза с тромбоспондином типа 1) и THBS3 (тромбоспондин) (таблица 4), оба из которых участвуют в заживлении ран. В исследованиях на животных моделях даун-регуляции тромбоспондина было показано, что THBS-нулевые мыши имеют улучшенные артериогенез, ангиогенез и восстановление кровотока после ишемии по сравнению с контрольными мышами (Kyriakides TR and MacLauchlan S. The role of thrombospondins in wound healing, ischemia, and the foreign body reaction. J Cell Commun Signal 2009. 3:215-225). Кроме того, в таблице 4 показано, что все три соединения значительно снижают экспрессию CTGF (фактор роста соединительной ткани), а также CTNND1 (катенин). Оба, и CTGF, и CTNND1, связаны с фибропролиферативной активностью, и повышенные уровни экспрессии были обнаружены при таких заболеваниях, как келоиды и гипертрофированные рубцы (HTS) (Poon R et al., Catenin driven neoplastic and reactive fibroproliferative disorders. PLoS One. 2012; 7:e37940). HTS представляет собой отклонения от нормы фундаментальных процессов заживления ран, вызывая чрезмерное производство коллагена фибробластами. Ожоги, травматические повреждения и хирургические процедуры часто продуцируют HTS. Раневые инфекции также оставляют кожу с HTS после удаления инфекционных агентов, таких как бактерии и грибки, с помощью противомикробных агентов. Липодипептиды также влияют на KAL1 (таблица 4). Это особенно интересно, поскольку было обнаружено, что белок, кодируемый геном KAL1, участвует в модулировании плотности эпидермального нерва при атопическом дерматите. Сверхэкспрессия KAL1 подавляет рост аксонов, возможно ингибируя гипериннервацию и аномальное восприятие зуда при атопическом дерматите (Tengara S et al., Keratinocyte-derived anosmin-1, an extracellular glycoprotein encoded by the X-linked Kallmann syndrome gene, is involved in modulation of epidermal nerve density in atopic dermatitis. J Dermatol Sci 2010. 58:64-71). В заключение, помимо обсуждаемого широкого спектра противомикробной активности, короткие липопептиды могут активировать кожные клетки человека, что способствует заживлению ран и антифиброзной активности. Таким образом, липопептиды являются полезными для восстановления раны после противомикробной терапии.