Дикатионные ионные жидкости с полисилоксановым фрагментом в составе катиона в качестве теплоносителей
Иллюстрации
Показать всеИзобретение относится к области жидких теплоносителей. Предложены дикатионные ионные жидкости с полисилоксановым фрагментом в составе катиона общей формулы (I), где R1 и R2 - метил или фенил, R3 - CH2 или (СН2)3, n=3-8, в качестве теплоносителей. Технический результат – предложенные новые дикатионные ионные жидкости (ИЖ) с полисилоксановым фрагментом в составе катиона общей формулы (I) являются жидкими при нормальных условиях и имеют более низкое давление насыщенных паров (ниже 10-6 мм рт.ст.) в области высоких температур (>200°С) по сравнению с прототипом и с другими известными теплоносителями (включая изученные к настоящему времени ИЖ), что обеспечивает их взрывобезопасность и значительно меньшую испаряемость в условиях динамического вакуума <1 мг⋅час-1⋅см-2 (200°С). Эти свойства полученных ИЖ позволяют использовать их в открытом космическом пространстве в качестве теплоносителей. Они также имеют физико-химические и теплофизические характеристики (вязкость, плотность, летучесть, теплоемкость и теплопроводность), необходимые для использования их в качестве теплоносителей. 1 табл., 6 пр.
Реферат
Изобретение относится к области жидких теплоносителей, в частности, к новым, неописанным в литературе дикатионным ионным жидкостям с полисилоксановым фрагментом в составе катиона. Предлагаемые ионные жидкости могут найти применение в качестве теплоносителей, предназначенных для переноса тепловой энергии в различных устройствах и промышленных процессах в широком интервале температур и давлений, в том числе и в условиях динамического вакуума в открытом космосе.
Разработка новых теплоносителей, предназначенных для использования в качестве рабочего тела в промышленности, на транспорте и в других, более узкоспециализированных областях, например, в космических аппаратах, представляет собой чрезвычайно актуальную задачу. Наиболее широкое применение нашли теплоносители среднего рабочего диапазона температур (до 200°С), сочетающие высокую теплоемкость и низкую вязкость. Существует ряд областей науки и техники, предъявляющих особые требования к свойствам теплоносителя: высокая термостойкость (цветная и черная металлургия), термическая и радиационная стойкость (ядерная энергетика), широкий рабочий интервал температур, низкие плотность и летучесть (ракетно-космическая отрасль). Одним из приоритетных направлений современной теплотехники является поиск соединений или создание композиционных жидкостей, обладающих необходимой набором физико-химических характеристик. Особый интерес вызывают теплоносители, имеющие приемлемые теплофизические параметры и отличающиеся низким давлением насыщенных паров при высоких температурах (>200°С).
В настоящее время в промышленных теплообменных аппаратах широко используются высоко- и среднетемпературные теплоносители на основе алифатических (Shell Thermia, BP Transcal, Mobiltherm, Addinol) и ароматических (Marlotherm (SH, LH, N), Dowtherm (A, G, Q, T), Therminol (VP-1, 59, 66, 72)) углеводородов, многоатомных спиртов (Ucon HTF 500, DOWCAL 200), полидиалкил- и полиалкиларилсилоксанов (ПМС, ПЭС, ПФМС различных марок и фирм).
Практически все используемые в настоящее время органические теплоносители получены на основе низкомолекулярных соединений и являются малополярными и, следовательно, слабо ассоциированными средами. Поэтому при высоких рабочих температурах давление их насыщенных паров достигает довольно высоких значений (например, для Dowtherm А при 405°С оно составляет ~11 атм), что требует применения замкнутой аппаратуры и повышенных мер пожаробезопасности.
Термостойкие кремнийорганические жидкости обладают уникальным сочетанием свойств и широко используются в качестве теплоносителей и высокотемпературных смазок. Практически все они химически и коррозионно инертны, взрывобезопасны и мало токсичны. Однако силоксаны, имеющие низкую вязкость, при температурах 200-350°С также имеют довольно высокое давление насыщенных паров - более 1 мм рт.ст.
Жидкости от ПМС-5 до ПМС-1000 представляет собой узкие фракции полидиметилсилоксана (ПДМС), числовое значение в наименовании которых соответствует их кинематической вязкости. ПДМС-жидкости в чистом виде могут быть использованы при температурах от -60°С до 200°С (ГОСТ 13032-77, 1979). Высокотемпературные ПДМС теплоносители Пента-410, Софэксил ТСЖ-В и Syltherm 800 являются аналогами, отличающимися лишь разновидностью или количеством веденных низкомолекулярных стабилизирующих модификаторов. В соответствии с рекомендациями фирмы-производителя жидкость Пента-410 может быть использована при температурах до 400°С в замкнутом контуре и до 250°С - в открытом контуре (теплоноситель Пента-410. Пента Силикон, Москва, 2006), а рабочие температуры Софэксил ТСЖ-В находятся в интервале от -50°С до 400°С (Софэксил ТСЖ-В. Рекомендации по применению. Софэкс Силикон, Москва, С. 12, 2014).
Кремнийорганическая жидкость ПФМС-2/5 является низкокипящей фракцией полиметилфенилсилоксана с вязкостью 15-19 сСт и давлением насыщенных паров 4⋅10-6 мм рт.ст. при 20°С. Жидкость ПФМС-4 представляет собой фракцию полисилоксана с 8-10 метилфенильными звеньями в цепи, кипящую выше 360°С при остаточном давлении не более 2⋅10-1 мм рт.ст. и имеющую вязкость 600-1000 сСт при комнатной температуре. ПФМС-4 используется в качестве теплоносителя при температурах до 300°С длительное время и до 350°С кратковременно (ГОСТ 15866-70, 1971).
Высокотемпературный теплоноситель Dow Corning 705 является 1,3,5-триметил-1,1,3,5,5-пентафенилтрисилоксаном (ПФТМТС) высокой степени чистоты, а его российский аналог ФМ-1 является узкой ректификационной фракцией метилфенилсилоксанов с весовым содержанием ПФТМТС не ниже 70%. Оба теплоносителя имеют эксплуатационные температуры от 10 до 350°С.
Ионные жидкости (ИЖ) - это низкотемпературные расплавы органических солей, как правило, образованных органическими катионами и неорганическими анионами. Важнейшим специфическим свойством ионных жидкостей является очень низкое давление насыщенных паров в широком интервале температур.
Известны смеси полиолов (в частости, пропан-1,3-диола) с некоторыми ионными жидкостями, которые предлагаются к использованию в качестве теплоносителей (WO 2008124087 А1)). Однако эти системы из-за наличия в составе спиртовой компоненты характеризуется довольно высоким давлением паров даже при средних температурах эксплуатации (<200°С).
Описаны фосфониевые ионные жидкости и их возможное применение в качестве теплоносителей (US 8586798 В2), поскольку некоторые образцы показали достаточно высокую термостойкость (до 375°С) по данным ТГА. Других теплофизических характеристик публикация не содержит.
Получены термостойкие ионные жидкости на основе катионов диалкилимидазолия и алкилпирролидиния с анионами PF6-, BF4-, CF3SO3- и (CF3SO2)2N- (C. Maton, N. De Vos, С.V. Stevens. Ionic liquid thermal stabilities: decomposition mechanisms and analysis tools. Chem. Soc. Rev. 2013, 42, 5963), которые обладают приемлемыми теплофизическими свойствами. Однако, жидкости, содержащие анионы PF6- и BF4- при температурах выше 50°С подвергаются гидролизу с выделением HF, что приводит к сокращению сроков службы оборудования вследствие коррозии. (J. Jacquemin, P. Husson, А.А.Н. Padua, V. Majer. Density and viscosity of several pure and water-saturated ionic liquids. Green Chem., 2006, 8, 172).
Давление паров изученных диалкилимидазолиевых ИЖ с анионом (CF3SO2)2N- при температуре 200°С находится в интервале 10-3-10-4 мм рт.ст (М.A.A. Rocha, С.F.R.А.С. Lima, L.R. Gomes, В. , J.А.P. Coutinho, I.M. Marrucho, J.M.S.S. , L.P.N. Rebelo, K. Shimizu, J.N. Canongia Lopes, L.M.N.B.F. Santos. High-Accuracy Vapor Pressure Data of the Extended [CnC1im][Ntf2] Ionic Liquid Series: Trend Changes and Structural Shifts. J. Phys. Chem. B, 2011, 115, 10919).
Работ, посвященных синтезу силоксансодержащих ионных жидкостей (солей, имеющих Тпл.<100°С) очень мало (US Pat. 8027148; US Pat. 20120082903; H. Niedermeyer, M.A. Ab Rani, P.D. Lickiss, J.P. Hallett, T. Welton, A.J.P. White, P.A. Hunt. Understanding siloxane functionalised ionic liquids. Phys. Chem. Chem. Phys., 2010, 12, 2018; S. Bulut, M.A. Ab Rani, T. Welton, P.D. Lickiss, I. Krossing. Preparation of [Al(hfip)4]--Based Ionic Liquids with Siloxane-Functionalized Cations and Their Physical Properties in Comparison with Their [Tf2N]- Analogue. ChemPhysChem, 2012, 13, 1802). Описаны бис(трифторметилсульфонил)имиды и бис(оксалато)бораты тетраалкиламмониевых катионов, содержащих пентаметилдисилоксановый фрагмент (US Pat. 8027148). Полученные соли имеют низкие температуры стеклования (-30 - -60°С), и авторы рассматривают возможность их применения в качестве электролитов. Описан также синтез имидазолиевых и пирролидиниевых ИЖ с пентаметилдисилоксановым и разветвленным гептаметилтрисилоксановым фрагментами в составе катионов и с Tf2N- и Al[OCH(CF3)2]4- в качестве противоионов (Н. Niedermeyer, М.A. Ab Rani, P.D. Lickiss, J.P. Hallett, T. Welton, A.J.P. White, P.A. Hunt, Phys. Understanding siloxane functionalised ionic liquids. Chem. Chem. Phys., 2010, 12, 2018; S. Bulut, M.A. Ab Rani, T. Welton, P.D. Lickiss, I. Krossing. Preparation of [Al(hfip)4]--Based Ionic Liquids with Siloxane-Functionalized Cations and Their Physical Properties in Comparison with Their [Tf2N]- Analogue. ChemPhysChem, 2012, 13, 1802). Использование жидкостей как теплоносителей не рассматривается, и свойства применительно к этому не приведены.
В литературе есть публикации по синтезу и применению дикатионных имидазолиевых, пиридиниевых и пирролидиниевых ионных жидкостей с полиметиленовой и полиэтиленоксидными развязками различной длины (С2-С9). Как правило, это кристаллические или высоковязкие жидкости, характеризующиеся температурой деструкции в интервале температур 200-250°С (Jui-Cheng Chang, Wen-Yueh Но, I-Wen Sun, Yung-Liang Tung, Meng-Chin Tsui, Tzi-Yi Wu, Shih-Shin Liang. Synthesis and characterization of dicationic ionic liquids that contain both hydrophilic and hydrophobic anions. Tetrahedron, 2010, 66, 6150). Такие ИЖ предлагают использовать в качестве сильнополярных растворителей в синтезах (Xinxin Han and Daniel W. Armstrong. Using Geminal Dicationic Ionic Liquids as Solvents for High-Temperature Organic Reactions. Organic Letters, 2005, 7, 4205), в микроэлектронике по причине их высокой магнитной восприимчивости (с анионом Cl3FeOFeCl3-2, Jui-Cheng Chang, Wen-Yueh Ho, I-Wen Sun, Yu-Kai Chou, Hsin-Hsiu Hsieh, Tzi-Yi Wu, Shih-Shin Liang. Synthesis and properties of new (μ-oxo)bis[trichloroferrate(III)] dianion salts incorporated with dicationic moiety. Polyhedron, 2010, 29, 2976) и в качестве смазок для уменьшения трения (М. Mahrova, F. Pagano, V. Pejakovic, A. Valea, М. Kalin, A Igartua, Е. Tojo Pyridinium based dicationic ionic liquids as base lubricants or lubricant additives. Tribology International, 2015, 82, 245).
Дикатионных ионных жидкостей с силоксановым фрагментом структуры синтезировано мало. Как правило, это твердые при комнатной температуре соли, образованные двухзарядными имидазолиевыми катионами с галогенид-анионами (Br- или I-). Авторы предлагают использовать их в качестве ПАВ, антивспенивателей, смазозочных материалов, аппретов для стекловолокна (GB Pat. 1006729) или в качестве добавок в электролиты в солнечных батареях (Soonho Lee, Youngtae Jeon, Youngdon Lim, Younggil Cho, Sangyoung Lee, and Whangi Kim. Bull. Korean Chem. Soc. 2013, 34, 2583).
В литературе также известны дикатионные ионные жидкости с дисилоксановым фрагментом в составе катиона и с бис(трифторметил-сульфонил)имид-анионом в качестве противоиона (Л.М. Глухов, В.Г. Красовский, Е.А. Черникова, Г.И. Капустин, Л.М. Кустов, А.А. Коротеев. Синтез и свойства дикатионных ионных жидкостей с силоксановым структурным фрагментом. Журн. физической химии, 2015, 89, 1858). Из-за низкой летучести (~0.1 мг⋅час-1⋅см-2 при 200°С) и высокой термостойкости (~400°С) авторы предлагают использовать эти ИЖ в качестве теплоносителей, но применение в условиях динамического вакуума при низких температурах (открытый космос) ограничено высокой температурой плавления (35-69°С), т.е. ИЖ при нормальных условиях твердые.
Известны ИЖ с кремнийорганическим фрагментом в составе катиона в качестве теплоносителя (Патент РФ №2566755), принятый за прототип. Описанные в патенте монокатионные ИЖ характеризуются высокой термостойкостью (~400°С), низкой температурой стеклования (~-60°С) и низкой вязкостью (~120-150 сСт при 25°С), что дает возможность использовать их в качестве теплоносителей в условиях динамического вакуума даже при очень низких температурах. Они имеют низкую по сравнению с традиционными органическими ионными жидкостями летучесть (~3 мг⋅час-1⋅см-2), но на порядок уступает летучести описанных выше дикатионных дисилоксановых жидкостей. Создание новых термостойких ионных жидкостей с низкой летучестью, пригодных к использованию в качестве теплоносителей в условиях динамического вакуума не только при высоких, но и при низких температурах, является в настоящее время актуальной задачей, в частности, в ракетно-космической отрасли.
Технической задачей настоящего изобретения является создание новых теплоносителей на основе ионных жидкостей с возможностью применения их в условиях динамического вакуума в диапазоне рабочих температур от 0°С до 400°С, имеющих при этом более низкую летучесть и высокую термостойкость при сохранении высоких значений теплофизических характеристик.
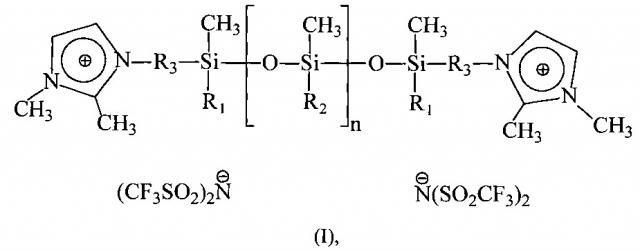
Поставленная задача достигается за счет использования новых дикатионных ионных жидкостей с полисилоксановым фрагментом в составе катиона общей формулы:
где R1 и R2 = метил или фенил, R3=CH2 или (СН2)3, n=~3-8,
в качестве теплоносителей.
Новые ионные жидкости согласно настоящему изобретению содержат полисилоксановую цепь с диметилсилокси- или метилфенилсилокси-звеньями и имидазолий бис(трифторметилсульфонил)имидными группировками, удаленными на одно или три метиленовых звена от атома кремния, на концах полимерной цепи, и могут найти применения в качестве теплоносителей, так как обладают всеми необходимыми характеристиками для использования их в условиях динамического вакуума в диапазоне рабочих температур от 0°С до 400°С и имеющих при этом низкую летучесть <1 мг⋅час-1⋅см-2 (200°С) и высокую термостойкость ~400°С при сохранении высоких значений теплофизических характеристик.
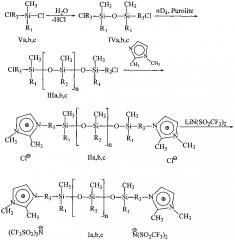
Способ получения предложенных в качестве теплоносителей ионных жидкостей формулы I заключается в том, что раствор α,ω-ди(хлоралкил)полидиметилсилоксана, синтезированного полимеризацией октаметилциклотетрасилоксана в присутствии 1.3-ди(хлоралкил)дисилоксана, и 1,2-диметилимидазола в смеси тетрагидрофурана и ацетонитрила, выдерживают 72 часов при температуре 80°С. К образовавшиеся соответствующим хлоридам (II) добавляется расчетное количество бис(трифторметилсульфонил)имида лития, и суспензия перемешивается в течение 10 часов. Далее органические растворители отгоняются, образовавшийся хлорид лития отмывается водой. Водный слой удаляется, и получается соединение I.
Процесс протекает по следующей схеме:
Введение в структуру ионной жидкости двух катионов имидазола способствует существенному снижению летучести (давления насыщенных паров) ИЖ при высоких температурах (220-230°С), а присутствие полисилоксановой цепи превращает дикатионную ИЖ в жидкость при комнатной температуре. Так, например, сравнение испаряемости α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан бис(трифторметилсульфонил)имида (Ia) и ионную жидкость Ia из патента РФ №2566755 - 1,2-диметил-3-(1',1',3',3'-тетраметил-3'-фенилдисилоксанил)метилимидазолий бис(трифторметилсульфонил)имид - с единицы площади при высоких температурах показывает, что летучесть первого в 30 раз ниже (см. таблицу).
Таблица – Физические характеристики теплоносителей на основе ионных жидкостей.
| №п/п | Теплоноситель | Вязкость, V, сСт (°С) | Тстекл,°С | Тдестр,°С | Испаряемость, мг/чассм2 (°С) в вакууме 10-4мм рт.ст. |
| 1 | Ia R1=CH3, R2=CH3,R3=CH2,n=8 | 493 (25)273 (40)190 (50) | -68 | 417 | 0.038 (150)0.074 (190)0.310 (220) |
| 2 | Ib R1=CH3, R2=CH3,R3=CH2,n=4 | 354 (25)188 (40)131 (50) | -65 | 420 | 0.059 (150)0.286 (190)1.262 (220) |
| 3 | Ic R1=CH3, R2=CH3,R3=CH2,n=3 | 341 (25)178 (40)122 (50) | -57 | 432 | 0.102 (150)0.249 (190)0.480 (220) |
| 4 | Id R1=CH3, R2=C6H5,R3=CH2,n=4 | 1443 (25)670 (40)355 (50) | -39 | 398 | 0.836 (150)1.964 (190)0.962 (220) |
| 5 | Ie R1=CH3, R2=CH3,R3=(CH2)3,n=4 | 606 (25)273 (40)169 (50) | -64 | 407 | 0.127 (150)0.109 (190)0.468 (220) |
| 6 | If R1=C6H5, R2=CH3,R3=(CH2)3,n=4 | 1912 (25)929 940)480 (50) | -37 | 405 | 0.040 (150)0.073 (190)0.231 (220) |
| 7 | Прототип (Ia изпатента РФ№2566755) | 120 (25) | -60 | 397 | 0.794 (190)2.551 (230) |
Однако введение двух пар ионов в структуру ИЖ приводит к значительному снижению не только ее летучести, но и подвижности. Дикатионные имидазолиевые дисилоксановые ионные жидкости ИЖ-1, ИЖ-2 и ИЖ-3 с бис(трифторметилсульфонил.)имид-анионом, обладающие сравнимой летучестью при высоких температурах, при комнатной температуре являются кристаллами (Л.М. Глухов, В.Г. Красовский, Е.А. Черникова, Г.И. Капустин, Л.М. Кустов, А.А. Коротеев. Синтез и свойства дикатионных ионных жидкостей с силоксановым структурным фрагментом. Журн. физической химии, 2015, 89, 1858).
Удлинение силоксановой цепи позволяет получить ИЖ с температурой плавления значительно ниже 0°С. Ионные жидкости с полисилоксановой развязкой представляют собой жидкости с довольно высокой вязкостью (См. таблицу). Однако, как и для всех силоксанов, с повышением температуры их вязкость быстро уменьшается, и уже при 40°С она достигает значений ~200 сСт.
Одной из наиболее важных особенностей дикатионных ИЖ, обусловленных ионным характером жидкого состояния, является практически полное отсутствие давления насыщенных паров при нормальных условиях (~10-11 мм рт.ст. при 25°С и очень низкое значение (~10-6 мм рт.ст.) при температурах ~200°С. Именно это качество обеспечивает их нелетучесть и взрывобезопасность, а также делает особенно привлекательными в качестве теплоносителей для работы в условиях динамического вакуума и открытого космического пространства. Введение полисилоксанового фрагмента в состав дикатионной ИЖ позволяет получать некристаллические вещества, имеющие, при одинаковой молекулярной массе, более низкую вязкость, чем ИЖ с углеводородными заместителями длиной С6-С10. Также можно ожидать снижения коррозионного воздействия кремнийорганической ИЖ на металлы и конструкционные сплавы.
Техническим результатом предлагаемого изобретения являются новые дикатионные ИЖ с полисилоксановым фрагментом в составе катиона общей формулы I, являющиеся жидкими при нормальных условиях и имеющие более низкое давление насыщенных паров (ниже 10-6 мм рт.ст.) в области высоких температур (>200°С) по сравнению с прототипом и с другими известными теплоносителями (включая изученные к настоящему времени ИЖ), что обеспечивает их взрывобезопасность и значительно меньшую испаряемость в условиях динамического вакуума <1 мг⋅час-1⋅см-2 (200°С). Эти свойства полученных ИЖ позволяют использовать их в открытом космическом пространстве в качестве теплоносителей. Они также имеют физико-химические и теплофизические характеристики (вязкость, плотность, летучесть, теплоемкость и теплопроводность), необходимые для использования их в качестве теплоносителей.
Примеры использования моно- и дикатионных ионных жидкостей с кремнийорганическим фрагментом в составе катиона в качестве теплоносителей в зарубежной литературе и зарубежных патентах отсутствуют.
Изобретение иллюстрируется примерами и таблицей.
Пример 1.
A. Получение 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана (IVa).
В трехгорлую колбу с обратным холодильником, капельной воронкой и термометром было загружено 100 мл воды и при перемешивании медленно прикапан 50 мл (54.3 г, 0.38 моля) хлорметилдиметилхлорсилана (Va). Реакционная масса перемешивалась в течение часа при комнатной температуре, затем для лучшего разделения смеси был прилит серный эфир. Реакционная смесь была перенесена в делительную воронку, органический слой отделен от кислого водного слоя, промыт водой до pH=7 по универсальной индикаторной бумаге. Далее раствор целевого продукта в серном эфире был высушен над безводным сульфатом натрия и выделен перегонкой в вакууме. Выход составил 39.05 г (89%).
B. Получение α,ω-ди(хлорметил)полидиметилсилоксана (IIIa)
В колбу с магнитной мешалкой было загружено 1.6 г (0.007 моля) 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана, 4.1 г (0.014 моля) окта-метилтетрациклосилоксана и 0.17 г (3% от реакционной смеси) катализатора - катионита Purolite СТ 175/2429. Реакционноя смесь интенсивно перемешивалась при 60°С в течение 6 часов и затем фильтрацией был отделен от катионита. Выход 5.43 г (97%).
C. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан дихлорида (IIa)
В стеклянную ампулу было загружено и запаяно 4.70 г α,ω-ди(хлорметил)-полидиметилсилоксана, 1.5 г (0.016 моля, 10% избыток) 1, 3-диметилимидазола (расчет проводился на 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксан, используемый на предыдущей стадии), 4 мл тетрагидрофурана и 1 мл ацетонитрила. Смесь грелась в термошкафе при 80°С в течение 72 часов. Затем реакционная смесь была перенесена в круглодонную колбу для использования на следующей стадии.
D. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан бис(трифторметилсульфонил)имида (Ia)
К раствору α,ω-ди((1,3-диметилимидазолий)метил)полидиметилсилоксан дихлорида (с предыдущей стадии синтеза) было присыпано 4.37 г. (0.015 моля, 10%-ный избыток бис(трифторметилсульфонил)имида лития (расчет проводился на 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксан, используемый на второй стадии). Далее смесь перемешивалась при комнатной температуре в течение 1 часа, удалялся в вакууме тетрагидрофуран и ацетонитрил, было добавлено 50 мл метиленхлорида и суспензия перенесена в делительную воронку. В делительной воронке органический слой был отмыт водой от солей до отсутствия изменений в промывочной воде при добавлении нитрата серебра. Далее органический слой был перенесен в колбу и высушен азеотропной отгонкой абсолютированного метиленхлорида (500 мл). После осушки следы метиленхлорида были удалены в вакууме. Выход 7.96 г (85%). 1Н ЯМР-спектр (300,13 МГц, ДМСО-d6): 0.03-0.19 м.д. (60Н, м, CH3-Si), 2.54 м.д. (6Н, с, ССН3), 3.76 м.д. (6Н, с, NCH3), 3.83 м.д. (4Н, с, NCH2Si), 7.43 м.д. (2Н, д, СН), 7.62 м.д. (2Н, д, СН); 13С ЯМР-спектр (75.47 МГц, ДМСО-d6): 0.49-1.33 м.д. (с, CH3-Si), 9.69 м.д. (с, ССН3), 35.23 м.д. (с, NCH3), 40.35 м.д. (с, NCH2Si), 113.45-м.д.-117.80 м.д.-122.07 м.д.-126.34 м.д. (кв., SCF3), 121.80 м.д. (с, СН), 122.83 м.д. (с, СН), 143,94 м.д. (с, NCN).
Пример 2.
A. Получение 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана (IVb).
Синтез 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана описан в примере 1 (IVa).
B. Получение α,ω-ди(хлорметил)полидиметилсилоксана (IIIb).
Синтез α,ω-ди(хлорметил)полидиметилсилоксана описан в примере 1 (IIIa). Единственное отличие - мольное соотношение 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксан : D4 = 1:1.
C. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан дихлорида (IIb).
Синтез α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан дихлорида описан в примере 1 (IIa).
D. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан бис(трифторметилсульфонил)имида (Ib).
Синтез α,ω-ди((1,3-(диметил)имидазолий)метил)полидиметилсилоксан бис(трифторметилсульфонил)имида описан в примере 1 (IIa). Выход целевого продукта 87%. 1Н ЯМР-спектр (300,13 МГц, ДМСО-d6): 0.03-0.19 м.д. (36Н, м, CH3-Si), 2.54 м.д. (6Н, с, ССН3), 3.76 м.д. (6Н, с, NCH3), 3.83 м.д. (4Н, с, NCH2Si), 7.43 м.д. (2Н, д, СН), 7.62 м.д. (2Н, д, СН); 13С ЯМР-спектр (75.47 МГц, ДМСО-d6): 0.49-1.33 м.д. (с, CH3-Si), 9.69 м.д. (с, ССН3), 35.23 м.д. (с, NCH3), 40.35 м.д. (с, NCH2Si), 113.45-м.д.-117.80 м.д.-122.07 м.д.-126.34 м.д. (кв., SCF3), 121.80 м.д. (с, СН), 122.83 м.д. (с, СН), 143,94 м.д. (с, NCN).
Пример 3.
A. Получение 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана (IVc).
Синтез 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана описан в примере 1 (IVa).
B. Получение α,ω-ди(хлорметил)полидиметилсилоксана (IIIc).
Синтез α,ω-ди(хлорметил)полидиметилсилоксана описан в примере 1 (IIIa). Единственное отличие - мольное соотношение 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксан : D4 = 2:1.
C. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан дихлорида (IIc).
Синтез α,ω-ди((1,3-(диметил)имидазолий)метил)полидиметилсилоксан дихлорида описан в примере 1 (IIa).
D. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)полидиметилсилоксан бис(трифторметилсульфонил)имида (Ic).
Синтез α,ω-ди(3(1,2-(диметил)имидазолий)метил)полидиметилсилоксан бис(трифторметилсульфонил)имида описан в примере 1 (IIa). Выход целевого продукта 89%. 1Н ЯМР-спектр (300,13 МГц, ДМСО-d6): 0.03-0.19 м.д. (30Н, м, СН3-Si), 2.54 м.д. (6Н, с, ССН3), 3.76 м.д. (6Н, с, NCH3), 3.83 м.д. (4Н, с, NCH2Si), 7.43 м.д. (2Н, д, СН), 7.62 м.д. (2Н, д, СН); 13С ЯМР-спектр (75.47 МГц, ДМСО-d6): 0.49-1.33 м.д. (с, CH3-Si), 9.69 м.д. (с, ССН3), 35.23 м.д. (с, NCH3), 40.35 м.д. (с, NCH2Si), 113.45-м.д.-117.80 м.д.-122.07 м.д.-126.34 м.д. (кв., SCF3), 121.80 м.д. (с, СН), 122.83 м.д. (с, СН), 143,94 м.д. (с, NCN).
Пример 4.
A. Получение 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана (IVd).
Синтез 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана описан в примере 1 (IVa).
B. Получение α,ω-ди(хлорметилдиметилсилокси)полиметилфенилсилоксана (IIId).
В колбу с магнитной мешалкой было загружено 1.05 г (0.0045 моля) 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксана, 2.45 г (0.006 моля) тетраметил-тетрафенилтетрациклосилоксана и 0.11 г (3% от реакционной смеси) катализатора - катионита Purolite СТ 175/2429. Реакционноя смесь интенсивно перемешивалась при 60°С в течение 6 часов и затем фильтрацией был отделен от катионита. Выход 3.39 г (97%).
C. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метилдиметилсилокси)полиметилфенилсилоксан дихлорида (IId)
В стеклянную ампулу было загружено и запаяно 3.5 г α,ω-ди(хлорметилдиметилсилокси)полиметилфенилсилоксана, 0.96 г (0.01 моля, 10% избыток) 1,3-диметилимидазола (расчет проводился на 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксан, используемый на предыдущей стадии), 4 мл тетрагидрофурана и 1 мл ацетонитрила. Смесь грелась в термошкафе при 80°С в течение 72 часов. Затем реакционная смесь была перенесена в круглодонную колбу для использования на следующей стадии.
D. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метилдиметилсилокси)полиметилфенилсилоксан бис(трифторметилсульфонил)имида (Id)
К раствору α,ω-ди(3(1,2-(диметил)имидазолий)метилдиметилсилокси)-полиметилфенилсилоксан дихлорида (с предыдущей стадии синтеза) было присыпано 2.87 г. (0.01 моля, 10%-ный избыток бис(трифторметилсульфонил)имида лития (расчет проводился на 1,1,3,3-тетраметил-1,3-(дихлорметил)дисилоксан, используемый на второй стадии). Далее смесь перемешивалась при комнатной температуре в течение 1 часа, удалялся в вакууме тетрагидрофуран и ацетонитрил, было добавлено 50 мл метиленхлорида и суспензия перенесена в делительную воронку. В делительной воронке органический слой был отмыт водой от солей до отсутствия изменений в промывочной воде при добавлении нитрата серебра. Далее органический слой был перенесен в колбу и высушен азеотропной отгонкой абсолютированного метиленхлорида (500 мл). После осушки следы метиленхлорида были удалены в вакууме. Выход 2.51 г (48%). 1Н ЯМР-спектр (300,13 МГц, ДМСО-d6): 0.03-0.17 м.д. (87Н, м, CH3-Si), 2.54 м.д. (6Н, с, ССН3), 3.73 м.д. (6Н, с, NCH3), 3.75 м.д. (4Н, с, NCH2Si), 7.2-7.7 м.д. (4Н, СН+125Н, м, С6Н5).
Пример 5.
А. Получение диметил(3-хлорпропил)хлорсилана (Ve).
В трехгорлую колбу с обратным холодильником, термометром и вводом аргона было загружено 17.04 г (20 мл, 0.18 моля) диметилхлорсилана, 18.78 г (20 мл, 0.24 моля) аллилхлорида, 10 мл толуола и 50 мкм катализатора Карстедта (РС072). Реакционная смесь при перемешивании на магнитной мешалке была медленно нагрета до температуры 60°С в течение 3 часов. Далее ректификационной разгонкой было выделено 28.35 г диметил(3-хлорпропил)хлорсилана. Выход от теории 92%.
B. Получение 1,1,3,3-тетраметил-1,3-ди(3-хлорпропил)дисилоксана (IVe).
Синтез 1,1,3,3-тетраметил-1,3-ди(3-хлорпропил)дисилоксана проведен аналогично методике, описанной в примере 1 для IVa из 50 мл (0.17 моля) диметил(3-хлорпропил)хлорсилана. Целевой продукт выделен перегонкой в вакууме в количестве 35.64 г. Выход составил 87%.
С. Получение α,ω-(3-хлорпропил)полидиметилсилоксана (IIIe).
Синтез α,ω-(3-хлорпропил)полидиметилсилоксана проведен по методике, описанной в примере 1 для IIIa, из 4.98 г (5 мл, 0.017 моля) 1,1,3,3-тетраметил-1,3-ди(3-хлорпропил)дисилоксана, 5.14 г (0.017 моля) октаметилтетрациклосилоксана и 0.30 г (3% от реакционной смеси) катализатора - катионита Purolite СТ 175/2429. Выход 9.92 г (98%).
D. Получение α,ω-(3-(1,2-диметилимидазолий)пропил)полидиметилсилоксан дихлорида (IIe).
Синтез α,ω-(3-(1,2-диметилимидазолий)пропил)полидиметилсилоксан дихлорида проведен по методике, описанной в примере 1 для IIa, из 9.92 г α,ω-ди(3-хлорпропил)полидиметилсилоксана и 3.28 г (0.034 моля, 10% избыток) 1,3-диметилимидазола (расчет проводился на дисилоксан, используемый стадии IIIe).
E. Получение α,ω-(3-(1,2-диметилимидазолий)пропил)полидиметилсилоксан бис(трифторметилсульфонил)имида (Ie).
Синтез α,ω-(3-(1,2-диметилимидазолий)пропил)полидиметилсилоксан бис(трифторметилсульфонил)имида проведен по методике, описанной в примере 1 для Ia, из раствора α,ω-ди(3-(1,3-диметилимидазолий)пропил)-полидиметилсилоксан дихлорида (с предыдущей стадии синтеза), к которому было присыпано 10.80 г. (0.038 моля, 10%-ный избыток, расчет проводился на дисилоксан, используемый на стадии IIIe) бис(трифторметилсульфонил)имида лития. Далее смесь перемешивалась при комнатной температуре в течение 1 часа, удалялся в вакууме тетрагидрофуран и ацетонитрил, было добавлено 80 мл метиленхлорида, и суспензия была перенесена в делительную воронку. В делительной воронке органический слой был отмыт водой от солей до отсутствия изменений в промывочной воде при добавлении нитрата серебра. Далее органический слой был перенесен в колбу и высушен азеотропной отгонкой абсолютированного метиленхлорида (500 мл). После осушки следы метиленхлорида были удалены в вакууме. Выход 19.36 г (88%). 1Н ЯМР-спектр (300.13 МГц, ДМСО-d6): 0.03-0.19 м.д. (36Н, м, СН3-Si), 0.50 м.д. (4Н, т, CH2Si), 1.70 м.д. (4Н, квнт, СН2СН2СН2), 2.57 м.д. (6Н, с, ССН3), 3.75 м.д. (6Н, с, NCH3), 4.08 м.д. (4Н, т, NCH2, 7.62 м.д. (2Н, д, СН), 7.63 м.д. (2Н, д, СН); 13С ЯМР-спектр (75.47 МГц, ДМСО-d6): 0.29-1.43 м.д. (м, CH3-Si), 9.51 м.д. (с, CH2CH2Si). 14.43 м.д. (с, СН2СН2СН2), 23.90 м.д. (с, ССН3), 35.04 м.д. (с, NCH3), 50,48 м.д. (с, NCH2CH2), 113.45-м.д.-117.80 м.д.-122.07 м.д.-126.34 м.д. (кв., SCF3), 121.22 м.д. (с, СН), 122.75 м.д. (с, СН), 144,58 м.д. (с, NCN).
Пример 6.
A. Получение метилфенил(3-хлорпропил)хлорсилана (Vf)
Синтез метилфенил(3-хлорпропил)хлорсилана проведен аналогично методике, описанной в примере 2 для Ve, из 20.86 г (20 мл, 0.13 моля) метилфенилхлорсилана. Целевой продукт выделен перегонкой в вакууме в количестве 19.25 г. Выход от теории 62%.
B. Получение 1,3-диметил-1,3-дифенил-1,3-(дихлорпропил)дисилоксана (IVf)
Синтез 1,3-диметил-1,3-дифенил-1,3-(дихлорпропил)дисилоксана проведен аналогично методике, описанной в примере 1 для IVa, из 10 г (0.043 моля) метилфенил(хлорпропил)хлорсилана. После сушки над сульфатом натрия эфирный раствор декантировали, эфир удалили отгонкой. Целевой продукт вакуумировали для удаления следов растворителя в течение 5 часов при температуре 50°С.
C. Получение α,ω-ди((хлорпропил)метилфенилсилокси)полидиметилсилоксана (IIIf)
Синтез α,ω-ди((хлорпропил)метилфенилсилокси)полидиметилсилоксана проведен по методике, описанной в примере 1 для IIIa, из 4.1 г (0.01 моля) 1,3-диметил-1,3-дифенил-1,3-(дихлорпропил)дисилоксана, 2.97 г (0.01 моля) октаметилтетрациклосилоксана и 0.21 г (3% от реакционной смеси) катализатора - катионита Purolite СТ 175/2429. Выход 6.93 г (98%).
D. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)метилфенилсилокси)полидиметилсилоксан дихлорида (IIf)
Синтез α,ω-ди(3-(1,2-(диметил)имидазолий)метил)метилфенилсилокси)-полидиметилсилоксан дихлорида проведен по методике, описанной в примере 1 для IIa, из 6.93 г α,ω-ди((хлорпропил)метилфенилсилокси)полидиметилсилоксана и 2.11 г (0.022 моля, 10% избыток) 1,3-диметилимидазола (расчет проводился на дисилоксан, используемый на стадии IIIf).
E. Получение α,ω-ди(3-(1,2-(диметил)имидазолий)метил)метилфенилсилокси)полидиметилсилоксан бис(трифторметилсульфонил)имида (If)
Синтез α,ω-ди(3-(1,2-(диметил)имидазолий)метил)метилфенилсилокси)-полидиметилсилоксан бис(трифторметилсульфонил)имида проведен по методике, описанной в примере 1 для Ia, из раствора α,ω-ди(3-(1,2-(диметил)имидазолий)метил)метилфенилсилокси)полидиметилсилоксан дихлорида (со стадии синтеза IIf), к которому было присыпано 6.31 г. (0.022 моля, 10%-ный избыток, расчет проводился на дисилоксан, используемый на стадии IIIf). Выход 8.05 г (91%). 1Н ЯМР-спектр (300.13 МГц, ДМСО-d6): 0.05 м.д. (24Н, м, CH3-Si-CH3), 0.34 м.д. (6Н, м, CH3-Si-C6H5), 0.74 м.д. (4Н, т, CH2Si), 1.68 м.д. (4Н, квнт, СН2СН2СН2), 2.51 м.д. (8Н, с, ССН3), 3.73 м.д. (6Н, с, NCH3), 4.06 м.д. (4Н, т, NCH2), 7.37-7.59 м.д. (4Н, д, СН+10Н, м, С6Н5); 13С ЯМР-спектр (75.47 МГц, ДМСО-d6): -1.09- -0.96 м.д. (м, CH3-Si-С6Н5), 1.29-1.63 м.д. (м, CH3-Si-CH3), 9.47 м.д. (с, CH2CH2CH2Si). 13.49 м.д. (с, СН2СН2СН2), 23.92 м.д. (с, ССН3), 35.04 м.д. (с, NCH3), 50,33 м.д. (с, NCH2CH2), 113.45 м.д.-117.80 м.д.-122.07 м.д.-126.37 м.д. (кв., SCF3), 121.16 м.д. (с, СН), 122.76 м.д. (с, СН), 128.32 м.д.-130.06 м.д.-133.42 м.д.-137.86 м.д (С6Н5), 144,53 м.д. (c, NCN).
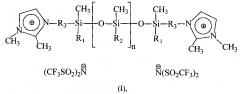
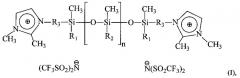
Дикатионные ионные жидкости с полисилоксановым фрагментом в составе катиона общей формулы:
где R1 и R2 - метил или фенил, R3 - CH2 или (СН2)3, n=3-8, в качестве теплоносителей.