Кристаллические формы 1-(3-трет-бутил-1-п-толил-1н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1н-индазол-5-илокси)бензил) мочевины гидрохлорида
Иллюстрации
Показать всеНастоящее изобретение относится к кристаллической полиморфной Форме В гидрохлоридной соли 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, которая характеризуется наличием пиков РПД дифракции (градусы 2θ при ± 0,3) при около 12,3, 13,0, 15,9, 16,9 и 17,6, и к фармацевтической композиции для лечения пролиферативных расстройств, содержащей указанную полиморфную Форму В. Изобретение также относится к способу лечения пролиферативных заболеваний с помощью заявленной фармацевтической композиции, к применению фармацевтической композиции и способу получения указанной полиморфной Формы В. 5 н. и 84 з.п. ф-лы, 7 ил., 23 табл., 10 пр.
Реферат
Область техники
В настоящем документе представлена хлороводородная соль 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины, кристаллические формы 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины гидрохлорида, способы получения указанных кристаллических форм, фармацевтические композиции, содержащие кристаллические формы 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В, способы получения указанных композиций, фармацевтические композиции, полученные по указанным способам, и применение указанных композиций при лечении различных заболеваний и расстройств.
Уровень техники
Миелодиспластические синдромы (МДС, ранее известные как предлейкоз) представляют собой разнообразную группу гематологических (связанных с кровью) медицинских состояний, которые включают неэффективную выработку (или дисплазию) миелоидного класса кровяных клеток. У пациентов с МДС зачастую развивается тяжелая анемия, и они нуждаются в частых переливаниях крови. В большинстве случаев заболевание ухудшается, и у пациента развивается цитопения (низкое количество кровяных телец) из-за прогрессирующей недостаточности костного мозга. Примерно у одной трети пациентов с МДС это заболевание трансформируется в острый миелогенный лейкоз (ОМЛ), обычно в течение от нескольких месяцев до нескольких лет. Миелодиспластические синдромы включают все расстройства стволовых клеток в костном мозге. При МДС гематопоэз (выработка крови) происходит беспорядочной и неэффективно. Количество и качество кроветворных клеток необратимо уменьшается, дополнительно ухудшая выработку крови
Цели терапии для пациентов с МДС заключаются в контролировании симптомов, улучшении качества жизни, улучшении общей выживаемости и в снижении прогрессирования ОМЛ. Возможности лечения для пациентов с миелодиспластическими синдромами варьируются от поддерживающей терапии, которая помогает облегчить симптомы, до интенсивной терапии, которая может замедлять или предотвращать прогрессирование заболевания. Болезни, обусловленные низким количеством кровяных клеток, такие как усталость и инфекции, можно лечить переливанием кровяных продуктов или использованием факторов роста. Для отсрочки прогрессирования заболевания может быть использована химиотерапия. Для уменьшения потребности в переливаниях может быть использована другая лекарственная терапия. Некоторые пациенты могут иметь преимущество от интенсивного лечения с помощью химиотерапии, с последующей трансплантацией стволовых клеток с использованием стволовых клеток от донора. Для пациентов с анимией, зависящей от переливания, из-за низкой или промежуточной-1 групп риска, связанных с делецией 5q цитогенетических аномалий, одобренным лекарственным средством в Соединенных Штатах является леналидомид (Revlimid®). Другие возможности лечения включают иммуноподавляющие агенты, химиотерапия низкой/промежуточной интенсивности (например, азацитидин, децитабин, цитарабин) и, наконец, антилейкозная химиотерапия высокой интенсивности и трансплантация гематопоэтических клеток. Соответственно, сохраняется необходимость в новых фармацевтических композициях и способах лечения МДС.
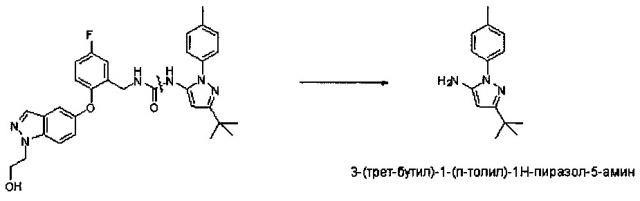
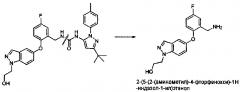
1-(3-Трет-бутил-1-n-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевина (известная также как «ARRY-614») показана на примере в публикации WO 2007/089646, и она имеет следующую структурную формулу:
Было показано, что 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевина обладает мощной ингибирующей активностью против р38 MAPK и Tie2 протеинкиназ и, следовательно, может быть пригодна при лечении опосредованных киназами состояний, включая пролиферативные расстройства (такие как миелодиспластические синдромы), воспалительные заболевания, аутоиммунные заболевания, деструктивные нарушения костей, инфекционные заболевания, вирусные заболевания, фибротические заболевания и нейродегенеративные заболевания.
1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевина была испытана в клинических испытаниях на людях 1 Фазы для лечения миелодиспластических синдромов (МДС) (см. R. Komrokji, et al., «Phase 1 Dose-Escalation/Expansion Study of the p38/Tie2 Inhibitor ARRY-614 in Patients with IPSS Low/Int-1 Risk Myelodysplastic Syndromes», 2011 Annual Meeting of the American Society of Hematology, 11 декабря, 2011; которое можно найти также по адресу: http://www.arraybiopharma.com/_documents/Publication). В этом исследовании была приготовлена композиция аморфного ARRY-614 в форме порошка в капсуле («ПВК») и введена пациентам с миелодиспластическим синдромом, и показатели вариабельности у разных пациентов в профилях воздействия (профили концентрации/времени) и ФК параметров воздействия (AUC и Cмакс) были высокими. Кроме того, по протоколу клинического исследования было необходимо вводить 12×100 мг капсул на дозу (то есть введение один раз в сутки 12×100 мг капсул), из-за невозможности достичь более высокого содержания лекарства на одну капсулу для аморфной формы соединения. Это обусловило нежелательно большое количество пилюль, которые необходимо было принять пациентам. Из-за ограничений содержания лекарственного средства на одну капсулу, была достигнута лишь максимально вводимая доза, но не реальная максимально переносимая доза. Новый препарат может обеспечивать более высокую возможность дозирования, при необходимости.
Для составления композиции фармацевтически активного соединения, такого как 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевина, в подходящую приемлемую лекарственную форму, желательно, чтобы активное соединение обладало приемлемой стабильностью и свойствами пригодности к переработке, помимо того, что оно должно обладать приемлемыми биофармацевтическими свойствами, такими как растворимость и растворение. 1-(3-Трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевина существует в аморфной форме. Она представляет собой молекулу II класса биофармацевтической системы классификации (BCS) с низкой растворимостью в воде (<10 мкг/мл) при стандартных физиологических pH в диапазоне 2-8, с ClogP 6,8 и расчетным pKа менее 3.
Биодоступность представляет собой один из ключевых параметров для многих терапевтических показаний и может зависеть от формы вещества, используемого в фармацевтической композиции. Потенциальные фармацевтические твердые формы активных лекарств включают кристаллические твердые формы и аморфные твердые формы. Известно, что аморфные формы многих фармацевтических веществ демонстрируют другие характеристики растворения и профили биодоступности, по сравнению с кристаллическими формами (Konno Т., Chem. Pharm. Bull., 1990, 38: 2003-2007). Зачастую происходит снижение растворимости в 12-1600 раз при переходе из аморфной формы в кристаллическую форму (В.С. Hancock and M. Parks, Pharmaceutical Research, 2000, 17(4) 397-404). Идентификация и выбор твердой формы фармацевтического соединения является сложной, с учетом того, что изменение твердой формы может влиять на различные физические и химические свойства, которые могут обеспечивать преимущество или недостатки свойств переработки, составления композиции, стабильности и биодоступности, среди других важных фармацевтических характеристик. Недостатки использования аморфной формы лекарства могут включать возможность того, что аморфные формы обладают более низкой химической и физической стабильностью, а также риск превращения форм из аморфного в кристаллический материал в любое время в процессе производства и/или хранения. Кроме того, в некоторых случаях кристаллические соли активного лекарства не могут быть образованы просто и/или не являются стабильными, что возможно является результатом низких значений pKa. Значение pKa выражает силу кислот и оснований, то есть склонность кислоты отщеплять протон или основания - присоединять протон (Bronsted J.N., Rec. Trav. Chim. (1923) 47: 718).
Сохраняется необходимость в фармацевтической композиции, пригодной для лечения пролиферативных заболеваний, таких как МДС.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины, обладающей повышенным воздействием и повышенной относительной биодоступностью.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, обладающей сниженной вариабельностью в фармакокинетических профилях у разных пациентов.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, обладающей по существу одинаковыми фармакокинетическими профилями при введении млекопитающему не натощак, по сравнению с состоянием натощак.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, для которой необходимы меньшие дозы композиции для получения такого же фармакологического эффекта.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, обладающей приемлемыми фармакокинетическими свойствами при более высоких дозах.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, обладающей повышенной скоростью растворения.
Сохраняется также необходимость в фармацевтической композиции, содержащей форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, которая является химически и физически стабильной при условиях ее переработки, применения и хранения.
Краткое описание изобретения
Открыты новые композиции, содержащие новую физическую форму 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины, в частности, кристаллический полиморф 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В, который пригоден для лечения пролиферативных расстройств, таких как миелодиспластические синдромы, который обладает следующими неожиданными свойствами:
Фармацевтические композиции, описанные в настоящем документе, содержащие 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, обладают увеличенным воздействием и повышенной относительной биодоступностью.
Фармацевтические композиции, описанные в настоящем документе, содержащие 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, обеспечивают уменьшенную вариабельность в фармакокинетических профилях у разных пациентов.
Фармацевтические композиции, описанные в настоящем документе, содержащие 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, обладают по существу одинаковыми фармакокинетическими профилями при введении млекопитающему не натощак, по сравнению с состоянием натощак.
Фармацевтические композиции, описанные в настоящем документе, содержащие 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, обеспечивают введение более низких доз с получением такого же фармакологического эффекта.
Фармацевтические композиции, описанные в настоящем документе, содержащие 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, обладают приемлемыми фармакокинетическими свойствами при более высоких дозах.
Фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, обладает увеличенной скоростью растворения.
Фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, химически и физически стабильна при условиях ее переработки, применения и хранения.
В частности, были открыты композиции, содержащие 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, которые обеспечивают одно или более из описанных выше преимуществ, по сравнению с формой аморфного свободного основания 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины в форме порошка в капсуле.
В настоящем документе представлен также кристаллический полиморф 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В.
В настоящем документе представлены также способы получения 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В.
В настоящем документе представлена также фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, суспендированный в матрице носителя, при этом указанная матрица носителя содержит по меньшей мере одно масло и по меньшей мере одно поверхностно-активное вещество.
В настоящем документе представлена также фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, суспендированный в матрице носителя, при этом указанная матрица носителя содержит по меньшей мере одно масло, по меньшей мере одно поверхностно-активное вещество и по меньшей мере один модификатор высвобождения.
В настоящем документе представлена также фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, суспендированный по меньшей мере в одном поверхностно-активном веществе.
В настоящем документе представлена также фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, суспендированный по меньшей мере в одном поверхностно-активном веществе, при этом указанная композиция дополнительно содержит по меньшей мере один модификатор высвобождения.
В настоящем документе представлена также фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, суспендированный по меньшей мере в одном масле.
В настоящем документе представлена также фармацевтическая композиция, содержащая 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, суспендированный по меньшей мере в одном масле, при этом указанная композиция дополнительно содержит по меньшей мере один модификатор высвобождения.
В настоящем документе представлены также способы лечения пролиферативных расстройств, таких как миелодиспластические синдромы, включающие введение пациенту, нуждающемуся в этом, фармацевтической композиции, описанной в настоящем документе.
В настоящем документе представлены также способы лечения воспаления, остеоартрита, ревматоидного артрита, аутоиммунных заболеваний и других заболеваний, опосредованных цитокинами, включающие введение пациенту, нуждающемуся в этом, фармацевтической композиции, описанной в настоящем документе.
В настоящем документе представлены также фармацевтические композиции для применения при лечении пролиферативных расстройств, таких как миелодиспластические синдромы, у млекопитающего.
В настоящем документе представлены также фармацевтические композиции для применения при лечении воспаления, остеоартрита, ревматоидного артрита, аутоиммунных заболеваний и других заболеваний, опосредованных цитокинами.
В настоящем документе представлено также применение фармацевтической композиции, описанной в настоящем документе, в производстве лекарственного средства для лечения пролиферативных расстройств, таких как миелодиспластические синдромы, у млекопитающего.
В настоящем документе представлено также применение фармацевтической композиции, описанной в настоящем документе, в производстве лекарственного средства для лечения воспаления, остеоартрита, ревматоидного артрита, аутоиммунных заболеваний и других заболеваний, опосредованных цитокинами.
В настоящем документе представлены также способы получения фармацевтических композиций, описанных в настоящем документе.
В настоящем документе представлены также фармацевтические композиции, полученные по способам, описанным в настоящем документе.
В настоящем документе представлен также кристаллический полиморф 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы А.
В настоящем документе представлены также способы получения 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы А.
Краткое описание графических материалов
Сопровождающие чертежи, которые включены в настоящий документ и образуют часть настоящего описания, иллюстрируют не ограничивающие варианты реализации настоящего изобретения и вместе с этим описанием служат для объяснения принципов настоящего изобретения.
Фигура 1 иллюстрирует диаграмму порошковой рентгеновской дифракции для не микронизированного кристаллического полиморфа 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы А.
Фигура 2 иллюстрирует ДСК термограмму не микронизированного кристаллического полиморфа 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы А.
Фигура 3 иллюстрирует диаграмму порошковой рентгеновской дифракции для не микронизированного кристаллического полиморфа 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В.
Фигура 4 иллюстрирует ДСК термограмму для не микронизированного кристаллического полиморфа 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В.
Фигура 5 иллюстрирует профили геометрических средних значений концентрации в плазме в зависимости от времени для 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины для различных препаратов, введенных в состоянии не натощак и натощак, представленные на полулогарифмической шкале как концентрация в плазме 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины в зависимости от времени, где не закрашенные ромбы представляют Препарат 1, введенный в состоянии натощак, не закрашенные круги представляют Препарат 2, введенный в состоянии натощак, открытые квадраты представляют аморфный PIC, введенный в состоянии натощак, закрашенные круги представляют Препарат 1, введенный в состоянии не натощак, и не закрашенные треугольники представляют Препарат 2, введенные в состоянии не натощак.
Фигура 6 иллюстрирует профили концентрации в плазме в зависимости от времени для 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины (в виде свободного основания) при лечении препаратом в состоянии натощак, что представлено на полулогарифмической шкале как концентрация в плазме 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины в зависимости от времени, где не закрашенные треугольники представляют Препарат 1, а не закрашенные круги представляют Препарат 2.
Фигура 7 иллюстрирует профили концентрации в плазме в зависимости от времени для 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины (в виде свободного основания) при лечении препаратом в состоянии не натощак, что представлено на полулогарифмической шкале как концентрация в плазме 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины в зависимости от времени, где не закрашенные треугольники представляют Препарат 1, а не закрашенные круги представляют Препарат 2.
Подробное описание изобретения
Определения
Термин «около» используется в настоящем документе для обозначения примерного значения, или в диапазоне, или грубо, или около. При использовании термина «около» в сочетании с числовым диапазоном, он модифицирует этот диапазон, расширяя границы выше и ниже указанных числовых значений. Как правило, термин «около» используется в настоящем документе для изменения числового значения выше и ниже указанного значения на разницу 20%.
При использовании в настоящем документе, перечисление числового диапазона для какой-либо переменной предназначено для обозначения того, что настоящее изобретение может быть осуществлено на практике с использованием этой переменной, равной любому из значений в пределах этого диапазона. Так, для переменной, которая по своей сути является дискретной, эта переменная может быть равной любому целому значению в пределах числового диапазона, включая конечные точки этого диапазона. Аналогично, для переменной, которая по своей сути является непрерывной, эта переменная может быть равной любому реальному значению в пределах числового диапазона, включая конечные точки этого диапазона. Например, переменная, описанная как имеющая значения от 0 до 2, может быть равной 0, 1 или 2 для переменных, которые по своей сути являются дискретными, и может быть равной 0,0, 0,1, 0,01, 0,001 или любому другому реальному значению для переменных, которые по своей сути являются непрерывными.
Термин «около», стоящий перед одним или более пиковыми положениями на диаграмме рентгеновской порошковой дифракции, означает, что все пики этой группы, перед которыми он стоит, записаны в выражении угловых положений (два тета) с допустимым отклонением ± 0,3°. Отклонение ± 0,3° предусмотрено для применения при сравнении двух диаграмм рентгеновской порошковой дифракции. На практике, если пик диаграммы дифракции из одной диаграммы обозначен диапазоном угловых положений (два тета), который представляет собой измеренное положение пика ± 0,3°, и если эти диапазоны положений пиков перекрываются, то эти два пика считаются имеющими одинаковое угловое положение. Например, если пик из одной диаграммы определен как имеющий положение 11,0°, то для целей сравнения допустимое отклонение позволяет определять этот пик в положении в диапазоне 10,7°-11,3°.
Термин «аморфный» обозначает твердое вещество в твердом состоянии, которое не является кристаллическим состоянием. Аморфные твердые вещества обладают неупорядоченным расположением молекул и, следовательно, не имеют отличительной кристаллической решетки или элементарной ячейки, и поэтому не имеют определенного дальнего порядка структуры. Форма твердого состояния твердого вещества может быть определена с помощью микроскопии в поляризованном свете, рентгеновской порошковой дифракции («РПД»), дифференциальной сканирующей калориметрии («ДСК») или другими стандартными приемами, известными специалистам в данной области.
Термин «AUC» относится к площади под кривой концентрации в плазме в зависимости от времени.
Термин «AUCбеск» относится к площади под кривой концентрации-времени со времени 0, экстраполированного до бесконечности.
Термин «AUCпосл» относится к площади под кривой концентрации в плазме в зависимости от времени со времени 0 до времени последней поддающейся количественному определению концентрации.
Термин «биодоступность» относится к измерению скорости и степени, в которой активный ингредиент абсорбируется из лекарственного продукта и становится доступным на месте его действия. По фармакокинетической перспективе данные о биодоступности для данного препарата дают прогноз относительной доли перорально введенной дозы, которая абсорбирована в системный кровоток, по сравнению с данными о биодоступности для внутривенной лекарственной формы.
Термин «Смакс» относится к максимальной наблюдаемой концентрации в плазме.
Термин «Форма А», используемый отдельно, подразумевается взаимозаменяемым с 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины гидрохлоридом Формы А.
Термин «Форма В», используемый отдельно, подразумевается взаимозаменяемым с 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины гидрохлоридом Формы В.
Термин «доза» или «дозировка», используемый в настоящем документе, относится к определенному количеству фармацевтического агента, обеспеченного при однократном введении. В некоторых вариантах реализации доза может быть введена в виде одной капсулы, одной таблетки или одного жидкого объема. В некоторых вариантах реализации доза может быть введена, например, двумя или более капсулами, таблетками или жидкими объемами. Например, в некоторых вариантах реализации при необходимости перорального введения, заданная доза должна содержать такое количество соединения, которое трудно уместить в одной капсуле. В таких вариантах реализации для достижения заданной дозы может быть использовано две или более капсул.
Термин «млекопитающее» обозначает теплокровное животное с риском развития заболевания, описанного в настоящем документе и включает, но не ограничиваясь этим, морских свинок, собак, кошек, крыс, мышей, хомяков и приматов, включая людей.
Термин «микронизированный» используется для описание способов уменьшения размеров частиц, в результате которых получают частицы с Dv90 менее 10 мкМ. Dv представляет собой меру, используемую в данной области техники для определения распределения частиц по размеру (то есть объемное распределение). Например, Dv50 представляет собой размер в микронах, который делит распределение две половины, выше и ниже определенного диаметра сфер, то есть Dv50 представляет собой медиану для объемного распределения. Dv90, равный 10 мкМ, означает, что 90% частиц имеют размер частиц менее 10 мкМ. Контролирование уменьшения размера частиц может быть выполнено с помощью способов, известных специалистам в данной области, например, с использованием лазерной дифракции.
Термин «миронизированные» относится к частицам, имеющим Dv90, меньшим или равным 10 мкМ.
Выражение «фармацевтически приемлемые», используемое в настоящем документе, относится к соединениям, материалам, композициям и/или лекарственным формам, которые, в рамках тщательной медицинской клинической оценки, пригодны для применения в контакте с тканями млекопитающего, такого как человека (например, не вызывают неблагоприятных, аллергических или других нежелательных реакций при введении млекопитающему).
Термины «полиморф» и «полиморфная форма» относятся к различным кристаллическим формам одного соединения. То есть полиморфы представляют собой разные твердые вещества, имеющие одинаковую молекулярную формулу, при этом каждый полиморф может обладать различными физическими свойствами в твердом состоянии. Следовательно, одно соединение может образовывать различные полиморфные формы, каждая из которых обладает различными и отдельными физическими свойствами в твердом состоянии, такими как различные профили растворимости, скорости растворения, температуры плавления, текучесть и/или различные пики рентгеновской дифракции. Различия в физических свойствах могут влиять на фармацевтические параметры, такие как стабильность при хранении, прессуемость и плотность (что может быть важно при составлении композиции и в производстве продуктов), а также скорости растворения (которая может быть важным фактором для биодоступности). Приемы описания полиморфных форм включают, но не ограничиваясь этим, рентгеновскую порошковую дифрактометрию (РПД), дифференциальную сканирующую калориметрию (ДСК), термический гравиметрический анализ (ТГА), рентгеновскую дифрактометрию монокристалла (РДМ), вибрационную спектроскопию, например, инфракрасную (ИК) и рамановскую спектроскопию, спектроскопию ядерного магнитного резонанса (ЯМР) в твердом состоянии и в растворе, оптическую микроскопию, оптическую микроскопию в горячем состоянии, сканирующую электронную микроскопию (СЭМ), электронную кристаллографию и количественные анализы, анализ размера частиц (АРЧ), анализ площади поверхности, измерения растворимости, измерения скорости растворения, элементный анализ и анализ Карла-Фишера.
Используемый в настоящем документе термин «модификатор высвобождения» относится к вспомогательному веществу, которое замедляет или задерживает скорость высвобождения 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В из фармацевтической композиции или матрицы носителя, по сравнению со скоростью высвобождения 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы В из фармацевтической композиции или матрицы носителя, которая не содержит указанное вспомогательное вещество.
Используемый в настоящем документе термин «сольват» относится к кристаллической форме вещества, которая содержит растворитель. Термин «гидрат» относится к сольвату, в котором растворитель содержит воду.
Выражение «по существу чистая» означает полиморфную форму, которая содержит менее чем около 15% по весу примесей, включая другие полиморфные и аморфные формы. В некоторых вариантах реализации по существу чистая полиморфная форма содержит менее чем около 10% по весу примесей, включая другие полиморфные и аморфные формы. В некоторых вариантах реализации по существу чистая полиморфная форма содержит менее чем около 5% по весу примесей, включая другие полиморфные и аморфные формы. В некоторых вариантах реализации по существу чистая полиморфная форма содержит менее чем около 1% по весу примесей, включая другие полиморфные и аморфные формы.
Выражение «по существу в форме», в отношении конкретной полиморфной формы, означает, что полиморфная форма содержит менее чем около 15% по весу других форм, включая другие полиморфные формы и аморфные формы. В некоторых вариантах реализации по существу чистая полиморфная форма содержит менее чем около 10% по весу других форм, включая другие полиморфные формы и аморфные формы. В некоторых вариантах реализации по существу чистая полиморфная форма содержит менее чем около 5% по весу других форм, включая другие полиморфные формы и аморфные формы. В некоторых вариантах реализации по существу чистая полиморфная форма содержит менее чем около 1% по весу других форм, включая другие полиморфные формы и аморфные формы.
Термин «суспензия», используемый в настоящем документе, относится к гетерогенной или гомогенной смеси твердых частиц в жидкости или матрице носителя, в которой указанные частицы диспергированы, но не растворены в жидкости или матрице носителя, и при этом твердые частицы вероятно оседают из жидкости или матрицы носителя в какое-либо время, если смесь не встряхивать. Для суспензий, содержащих микронизированные частицы, скорость осаждения обычно замедлена, по сравнению с не микронизированными частицами. Например, для фармацевтических композиций, описанных в настоящем документе, содержащих микронизированный 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид Формы В, осаждение может быт замедлено по меньшей мере на 1 день для жидких суспензий и по меньшей мере на один год для суспензий в полутвердой или твердой форме. Матрица носителя может быть жидкой, полутвердой или твердой, в зависимости от температуры и состава носителя.
Выражения «терапевтически эффективное количество» или «эффективное количество» означают такое количество соединения или композиции, описанной в настоящем документе, которое при введении млекопитающему, нуждающемуся в таком лечении, является достаточным для (i) лечения конкретного заболевания, состояния или расстройства, (ii) облегчения, улучшения или исключения одного или более симптомов конкретного заболевания, состояния или расстройства, или (iii) предупреждения или отсрочки возникновения одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в настоящем документе. Количество соединения, которое соответствует такому количеству, варьируется в зависимости от факторов, таких как конкретное соединение или композиция, состояние заболевания и его тяжесть, и свойства (например, вес) млекопитающего, нуждающегося в лечении, но, тем не менее, может быть определено обычными способами специалистами в данной области.
При использовании в настоящем документе, термины «лечить» или «лечение» относятся к терапевтическим или паллиативным мерам. Преимущественные или желаемые клинические результаты включают, не ограничиваясь, облегчение симптомов, уменьшение степени заболевания, стабилизацию состояния (то есть не ухудшение) заболевания, отсрочку или замедление прогрессирования заболевания, улучшение или ослабление болезненного состояния и ремиссию (частичную или полную), явные или не явные. «Лечение» также может означать продление продолжительности жизни, по сравнению с ожидаемой продолжительностью жизни без лечения.
Термин «Тмакс» относится к времени наблюдения максимальной концентрации в плазме.
Гидрохлоридные соли
В настоящем документе представлена гидрохлоридная соль 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины. Эта соль может быть в разных формах, все из которых включены в рамки настоящего изобретения. Эти формы включают безводные формы, а также сольваты. Дополнительная форма может быть получена десольватированием сольватов. В конкретном варианте реализации соль представляет собой безводную гидрохлоридную соль 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины.
В некоторых вариантах реализации 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорид является кристаллическим. Кристаллические соли обычно обладают улучшенными свойствами обработки с точки зрения производства, по сравнению с аморфной формой свободного основания. Получение кристаллической формы 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида также обеспечивает способы очистки, поскольку производственные примеси могут быть исключены на стадии выделения соли.
В одном варианте реализации в настоящем документе представлены полиморфные формы 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида, которые обозначены как полиморфные Формы А и В. В одном варианте реализации полиморфы, описанные в настоящем документе, существуют в безводных формах. В другом варианте реализации полиморфы, описанные в настоящем документе, представляют собой сольваты, включая гидраты.
Форма А
В одном варианте реализации в настоящем документе представлен кристаллический полиморф 1-(3-трет-бутил-1-п-толил-1H-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1H-индазол-5-илокси)бензил)мочевины гидрохлорида Формы А. В одном варианте реализации указанный кристаллический полиморф Формы А находится в бе