Производные стеринов и их применение для лечения заболеваний, связанных с трансформированными астроцитными клетками, или для лечения злокачественных заболеваний крови
Иллюстрации
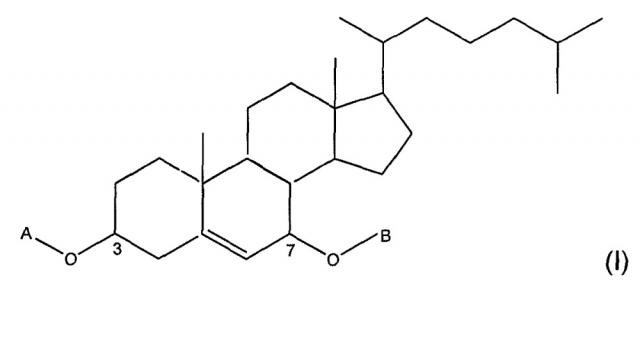
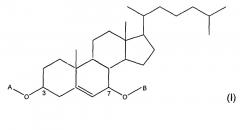
Показать всеИзобретение относится к соединению формулы (I), имеющему основную структуру 7 бета-гидроксихолестерола
в которой А представляет собой группу -(R1)n, в которой R1 представляет собой аминокислотный остаток глицина или аланина, присоединенный его С-концом, и n=1 или 2, причем R1 являются одинаковыми или разными и N-конец указанной аминокислоты замещен группой -C(O)-R2, в которой R2 представляет собой бензилоксигруппу, или группу -(R1)n, в которой R1 представляет собой остаток аминокислоты глицина или аланина, n=1 или 2 и N-конец указанной аминокислоты замещен бензилоксикарбонилом; или группу -C(O)-R6, в которой R6 представляет собой пятичленный гетероцикл, включающий 2 гетероатома кислорода, незамещенный или замещенный по меньшей мере одним неразветвленным или разветвленным C1-С6алкилом; В представляет собой группу -C(O)-R7, в которой R7 представляет собой C1-С6алкил, неразветвленный или разветвленный; или R7 представляет собой OR8, где R8 означает C1-С6алкил, неразветвленный или разветвленный. Изобретение также относится к индивидуальным соединениям, способу получения соединения формулы (I) и к фармацевтической композиции, обладающей активностью в отношении трансформированных астроцитных клеток. Технический результат: получены новые соединения формулы (I), которые могут применяться для лечения заболеваний, связанных с трансформированными астроцитами. 4 н. и 11 з.п. ф-лы, 4 табл., 16 пр.
Реферат
Изобретение относится к новым производным стеринов, способу их получения, содержащим их фармацевтическим композициям и их применению для лечения заболеваний, связанных с астроцитными клетками, трансформированными в раковые клетки, в частности, для лечения мультиформной глиобластомы, или для лечения злокачественных заболеваний крови, в частности, связанных с трансформированными миелоидными клетками, или для лечения лимфом.
Клеточная трансформация соответствует переходу от нормальной эукариотической клетки к иммортализованной клетке и/или раковой эукариотической клетке. Термины «трансформированная клетка" или "раковая клетка" будут использоваться в контексте в дальнейшем как синонимы.
Мультиформная глиобластома (GBM), известная также как астроцитома IV степени, является опухолью головного мозга, характеризующейся трансформацией астроцитных клеток в раковые клетки, в частности, проходящей через глиомы степени I, степени II и степени III.
Несмотря на значительные научные и терапевтические достижения в области онкологии, GBM до сих пор является неизлечимым раком. В лучшем случае, исследователи и врачи удовлетворены, когда средняя продолжительность жизни пациентов может быть продлена на несколько месяцев, самое большее на пятнадцать месяцев.
Одной из проблем, возникающих при лечении GBM, является рецидив, вызванный стволовыми клетками. В самом деле, даже когда существующие способы лечения достигают успеха в ликвидации большей части опухоли, стволовые клетки часто вызывают развитие новой опухоли (1, 2).
Современные способы терапии всегда состоят из резекции опухоли, если ее расположение позволяет это сделать, с последующей лучевой терапией и/или химиотерапией в случае необходимости. В химиотерапии, одним из ведущих способов лечения является битерапия, которая состоит из введения авастина (ингибирование связывания VEGF с его рецептерами) и иринотекана (ингибитор топоизомеразы I). Тритерапия типа PCV, которая представляет собой комбинацию прокарбазина (алкилирующий ДНК агент), ломустина (CCNU; неспецифический алкилирующий агент) и винкристина (ингибирование полимеризации микротрубочек), является в настоящее время весьма спорным способом лечения. Темозоломид, алкилирующий гуанин агент, в комбинации с лучевой терапией, показывает увеличение средней выживаемости, особенно для пациентов с гиперметилированой ДНК. В настоящее время проводятся клинические испытания (фаза III), тестирование действий циленгитида (ингибирование некоторых рецепторов интегрина) и талампанела (блокирование глутаматных каналов типа АМРА).
Исследования иммунотерапии и клинические испытания относятся к двум типам:
- Адаптивная иммунотерапия, в которой пациенту инъецируют клетки, активированные in vitro, такие как лимфокин-активированные киллер-клетки (LAK; фаза II клинических испытаний) или цитотоксические Т-лимфоциты (CTL; фаза I клинических испытаний), инъецированные интракраниально. Исследования в настоящее время показывают выживаемость 20 месяцев, которая является очень незначительной.
- Активная иммунотерапия, которая заключается в использовании вакцин (фаза I) и дендритных клеток (фаза II). Такая терапия не показывает значительное улучшение в выживаемости пациентов. Эти испытания были прекращены.
Генные терапии, которые состоят из использования аденовирусов, ретровирусов или вирусов кори в качестве векторов молекул с противораковым потенциалом, показывают повышение выживаемости только от 6 до 11 месяцев. Клеточная терапия, которая предлагает использование нейронных стволовых клеток в качестве переносчиков лекарственных средств в GBM, все еще находится на стадии демонстрации в фундаментальном исследовании.
Подход, которым несколько пренебрегали в последние десятилетия и который снова рассматривается, состоит из действия на уровне гликолиза и окислительного фосфорилирования. Раковые клетки увеличивают свое потребление глюкозы, поскольку они имеют тенденцию изменять свой метаболизм в сторону анаэробного метаболизма, даже если подача кислорода не является ограничивающим фактором. Этот феномен, наблюдаемый Warburg (3), является результатом избыточной экспрессии HIF (фактор, индуцированный гипоксией) и про-онкогена Myc. HIF повышает превращение пирувата в лактат анаэробно инактивацией пируват-дегидрогеназы, которая является ключевым ферментом в аэробном дыхании. Myc стимулирует биосинтез глутамина, который участвует в анаэробном дыхании (4).
В данном контексте выполняются клинические испытания агентов, действующих на энергетический метаболизм. В качестве примеров можно указать (4):
- метформин: ингибитор митохондриального дыхательного комплекса I, который, в свою очередь, индуцирует AMPK, который замедляет пролиферацию клеток;
- форетин: агент для снижения введенной извне глюкозы;
- фенилацетат: агент для снижения уровня глутамина;
- дихлорацетат: ингибитор пируватдегидрогеназы.
Все эти соединения, кроме дихлорацетата, проходят испытания (фаза II клинических испытаний) и в настоящее время экспериментальные данные еще не известны.
В настоящее время обнаружено, что производные стеринов, нацеливаемые на конкретный аспект энергетического метаболизма астроцитов, тип клеток происхождения GBM, можно применять для лечения мультиформной глиобластомы.
Исходный аспект настоящего изобретения заключается в использовании конкретного энергетического метаболизма астроцитной клетки (глиального происхождения), превращение которой, в конечном счете, приводит к образованию GBM.
Действительно, астроцитная клетка одновременно использует подачу энергии в форме АТФ посредством окислительного фосфорилирования (цикл Кребса, связанный с переносом электронов в митохондрию) и посредством гликолиза: в последнем случае пируват не входит в цикл Кребса, но восстанавливается в лактат ферментом лактатдегидрогеназа (LHD) типа 5. Помимо подачи АТФ астроцит использует гликолиз, посредством продуцирования лактата, для снабжения соседней клетки, нейрона, нейротрансмиттером (глутаматом).
В следующей таблице энергетический метаболизм астроцита, нормального или ракового, сравнивается схематически с энергетическим метаболизмом других клеток:
| Астроциты | Другие клетки | |||
| Митохондриальноеокислительное фосфорилирование | Гликолиз | Митохондриальноеокислительное фосфорилирование | Гликолиз | |
| Нормальные клетки | 50% | 50% | 90% | 10% |
| Раковые клетки | GBM 1% | GBM 99% | 1% | 99% |
Энергетический метаболизм астроцитов является особым: фактически, митохондриальное окислительное фосфорилирование и функция гликолиза находятся в согласии.
Именно это является специфической метаболической двойственностью нормальной астроцитной клетки, а именно митохондриальное окислительное фосфорилирование, с одной стороны, и гликолиз, с другой стороны, что образует основу для стратегии получения производных стеринов согласно изобретению.
Фактически, авторами изобретения выдвинута рабочая гипотеза, согласно которой производные стеринов согласно изобретению могут направлять энергетический метаболизм раковых астроцитных клеток из гликолиза в митохондриальное окислительное фосфорилирование, процесс, который может привести к их гибели.
Молекула 7β-гидроксихолестерина (7β-ОНСН) с высоким противораковым потенциалом (5, 6) проявляет замечательную цитотоксичность на иммортализованных (спонтанно трансформированных) линиях астроцитов крыс (7, 8) и GBM (линия С6 крыс) "in vitro" (9). Исследования показывают, что этерификация 7β-OHCH у С3-OH внутриклеточными жирными кислотами (образование 7β-OHCH-С3-эфира) в значительной степени была причастна к токсическому действию “родительской” молекулы 7β-OHCH (7, 8, 10).
Тем не менее, механизм действия 7β-OHCH, независимо от того, этерифицирован ли он у C3-ОН или нет, на GBM "in vitro" был далек от выяснения. В последнее время исследования, проведенные на линиях С6, показали, что 7β-OHCH модулирует структуру и динамику скоплений, микродоменов в плазматической мембране, сайтах инициации определенных клеточных мессенджеров, включая мессенджер протеинкиназы Akt, ключевого фермента в клеточном энергетическом метаболизме (11). Фактически, нарушением структуры скоплений оксистерина можно последовательно влиять на активность Akt, в частности, во время превращения нормальных клеток в раковые клетки: Akt регулирует захват глюкозы и активность гликолиза в этих клетках.
Неожиданно было обнаружено, что производные стеринов согласно изобретению, имеющие 7бета-гидроксихолестериновую основную структуру, содержащую заместители в положении 3 и защитные группы в положении 7, могут одновременно разрешать ингибирование гликолиза, необходимого для подачи энергии в высокой степени раковых астроцитов и, в то же время, восстановить митохондриальное окислительное фосфорилирование, которое также является "летальным" для этой клетки.
Фактически такое двойное действие приводит к "перегреву" раковой клетки, приводящему к ее гибели.
Более того, было показано, что производные стеринов согласно изобретению обладают также активностью в отношении к стволовым клеткам, тем самым приводя к полному разрушению клеток глиобластомы.
Активность производных стеринов согласно изобретению в отношении к глиобластоме также означает, что их использование может быть предусмотрено при лечении злокачественных заболеваний крови миелоидного типа вследствие сходства клеточного метаболизма миелоидной клетки с клеточным метаболизмом астроцита; при лечении нейробластомы, причем нейроны имеют такое же эмбриональное и клеточное происхождение, как и астроциты; и при лечении меланомы, поскольку меланоциты имеют такое же эмбриональное происхождение, как и астроциты, как будет объясняться позже.
Кроме того, тот факт, что миелоидная линия и лимфоидная линия имеют общее происхождение, а именно, плюрипотентные кроветворные стволовые клетки, означает, что также можно предусмотреть использование производных стеринов согласно изобретению для лечения лимфом.
Таким образом, изобретение относится к соединениям формулы (I)
в которой
- А представляет собой
группу -(R1)n-, в которой R1 представляет собой аминокислотный остаток, присоединенный его С-концевой частью и n=1 или 2, причем остатки R1 являются одинаковыми или разными, и N-концевая часть указанной аминокислоты может быть замещена группой -C-(O)-R2, в которой R2 представляет собой моно- или полициклическую C6-C14арилалкильную группу, или группой R3-C(O)-O- или R3C(O)-, в которой R3 представляет собой C1-C6алкил, который является незамещенным или замещенным по меньшей мере одной группой, выбранной из OR, NHR и SR, где R представляет собой водород, неразветвленный C1-C12алкил или незамещенный C6-C14арил; или R3 представляет собой С6-С14арильную или C5-C14гетероарильную группу, которая является незамещенной или замещенной по меньшей мере одним неразветвленным или разветвленным C1-C6алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или
моно- или полициклическую C5-C14гетероарилалкильную группу, которая может содержать один или несколько гетероатомов, которые могут быть одинаковыми или разыми, которые являются незамещенными или замещенными по меньшей мере одним неразветвленным или разветвленным С1-С4 алкилом; моно- или полициклическую С6-С14арилалкилоксигруппу или моно- или полициклическую С5-С14гетероарилалкилоксигруппу, которая может содержать один или несколько гетероатомов, которые могут быть одинаковыми или разными, которые являются незамещенными или замещенными по меньшей мере одним неразветвленным или разветвленным С1-С4алкилом, или
группу -C(O)-NH-R4 или -C(S)-NH-R4, в которой R4 представляет собой водород; С1-С12алкильную группу, неразветвленную или разветвленную, незамещенную или замещенную по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; С6-С14арильную группу, незамещенную или замещенную по меньшей мере одним неразветвленным или разветвленным С1-С6 алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; ацильную группу; формильную группу; сульфонильную группу; сульфинильную группу; или же R4 представляет собой аллильную группу или остаток сахара;
группу -C(O)-OR5, в которой R5 представляет собой С1-С12алкил, неразветвленный или разветвленный, незамещенный или замещенный по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше;
группу -C(O)-R6, в которой R6 представляет собой насыщенный С5-С14гетероцикл, содержащий 1 или 2 гетероатома, незамещенный или замещенный по меньшей мере одним неразветвленным или разветвленным С1-C6 алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или R6 представляет собой неразветвленную или разветвленную С1-С12алкильную группу, незамещенную или замещенную по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; С6-С14арильную группу или С5-С14гетероарильную группу, которые являются незамещенными или замещенными по меньшей мере одним неразветвленным или разветвленным С1-С6алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или же остаток сахара;
- B представляет собой группу -C(O)-R7, в которой R7 представляет собой водород; С1-С12-, предпочтительно С1-С6алкил, неразветвленный или разветвленный, незамещенный или замещенный по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; С6-С14арильную группу, незамещенную или замещенную по меньшей мере одним неразветвленным или разветвленным С1-C6алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или R7 представляет собой OR8, где R8 представляет собой неразветвленный или разветвленный С1-С12-, предпочтительно С1-С6алкил.
Алкильная группа означает неразветвленную или разветвленную С1-С12алкильную группу, такую как метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, втор-бутильная, трет-бутильная, пентильная, изопентильная, втор-пентильная, трет-пентильная, неопентильная, гексильная, изогексильная, втор-гексильная, трет-гексильная, гептильная, октильная, нонильная, децильная, ундецильная или додецильная группа, причем неразветвленные или разветвленные С1-С6алкильные группы являются предпочтительными.
Арильная группа означает ненасыщенную моноциклическую или полициклическую, карбоциклическую, С6-С14арильную группу, такую как фенильная, нафтильная, инденильная, антраценильная группы, и более конкретно фенильная группа.
Гетероарильная группа означает ненасыщенную, моноциклическую или полициклическую, С5-С14гетероарильную группу, содержащую один или несколько гетероатомов, которые могут быть одинаковыми или различными, и более конкретно, группу пуринового или пиримидинового основания.
"Гетероатом" означает атом кислорода, азота или серы.
"Остаток сахара" означает, например, звено типа глюкозы, рибозы или арабинозы.
Подходящими остатками аминокислот являются, например, остатки метионил, глицинил или аланил.
Предпочтительными соединениями формулы (I) являются соединения, у которых выполняется по меньшей мере одно из следующих условий:
- А представляет собой группу -(R1)n-, в которой R1 представляет собой остаток аминокислоты и n=1 или 2;
- А представляет собой группу -(R1)n-, в которой R1 представляет собой остаток аминокислоты, n=1 или 2 и N-концевая часть указанной аминокислоты замещена арилалкоксикарбонильной группой, в частности, бензилоксикарбонилом; или группой R3-C(O)-O- или R3-C(O)-, в которой R3 представляет собой С1-С6 алкил, незамещенный или замещенный по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или R3 представляет собой С1-С6арильную или С5-С14гетероарильную группу, которая является незамещенной или замещенной по меньшей мере одним неразветвленным или разветвленным С1-С6алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше;
- А представляет собой радикал аланил, связанный с радикалом глицинил, необязательно замещенный у его N-концевой части арилалкоксикарбонильной группой, в частности, бензилоксикарбонилом;
- А представялет собой радикал метионил, связанный с радикалом глицинил, необязательно замещенный у его N-концевой части арилалкоксикарбонильной группой, в частности, бензилоксикарбонилом;
- А представляет собой группу -C(O)-R6, в которой R6 представляет собой 2,2-диметил-1,3-диоксолановую группу или неразветвленную или разветвленную С1-С6алкильную группу, незамещенную и замещенную по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; С6-С14арильную группу или С5-С14гетероарильную группу, которая не замещена или замещена по меньшей мере одним неразветвленным или разветвленным С1-С6алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или же остаток сахара.
Преимущественно, В представляет собой ацильную группу, у которой алкильная группа является C1-С6алкилом, в частности, ацетильную или алкоксикарбонильную группу, в которой алкильная группа представляет собой C1-C6алкил, в частности, трет-бутоксикарбонильную группу.В может также, в частности, представлять собой C1-C6алкильную группу, незамещенную или замещенную по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше; или С6-С14арильную группу, незамещенную или замещенную по меньшей мере одним неразветвленным или разветвленным С1-С6алкилом или по меньшей мере одной группой, выбранной из OR, NHR и SR, как указано выше.
Предпочтительными соединениями формулы (I) являются следующие соединения:
- 7-((трет-бутоксикарбонил)окси)-10,13-диметил-17-(6-метилгептан-2-ил)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-тетрадекагидро-1Н-циклопента[а]фенантрен-3-ил-2-(2-(((бензилокси)карбонил)амино)ацетамидо)пропаноат (соединение 1.а);
- 7-ацетокси-10,13-диметил-17-(6-метилгептан-2-ил)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-тетрадекагидро-1Н-циклопента[а]фенантрен-3-ил-2-(2-(((бензилокси)карбонил)амино)-ацетамидо)пропаноат (соединение 1.b);
- 7-((трет-бутоксикарбонил)окси)-10,13-диметил-17-(6-метилгептан-2-ил)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-тетрадекагидро-1Н-циклопента[а]фенантрен-3-ил-2,2-диметил-1,3-диоксолан-4-карбоксилат (соединение 2.а);
- 7-ацетокси-10,13-диметил-17-(6-метилгептан-2-ил)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-тетрадекагидро-1Н-циклопента[а]фенантрен-3-ил-2,2-диметил-1,3-диоксолан-4-карбоксилат (соединение 2.b).
Соединения формулы (I) можно получить из холестерина способом, содержащим следующие стадии:
- защиту гидроксильной функциональной группы в положении 3 холестерина защитной группой, такой как, например, ацилоксигруппа R9-C(O)-, в которой группа R9 представляет собой замещенную или незамещенную C1-C6алкильную или замещенную или незамещенную арильную группу, в частности, арилалкоксикарбонильную группу,
- введение функциональной кетоновой группы в положение 7,
- восстановление функциональной кетоновой группы в гидроксильную функциональную группу,
- введение защитной группы в гидроксильную функциональную группу в положении 7, соответствующей группе B, такой как, например, ацильная, арильная или алкоксикарбонильная группа или ацилоксигруппа R10-С(О), в которой R10 представляет собой замещенный или незамещенный С1-С6алкил, арил, незамещенный или замещенный по меньшей мере одним неразветвленным или разветвленным С1-С6алкилом, или С5-С14гетероарил, незамещенный или замещенный по меньшей мере одним неразветвленным или разветвленным С1-С6 алкилом или по меньней мере одной группой, выбранной из OR, NHR и SR, как указано выше,
- удаление защитной группы у функциональной гидроксильной группы в положении 3.
После удаления защиты у функциональной гидроксильной группы в положении 3 указанную функциональную гидроксильную группу можно заместить нужной группой А.
Введение функциональной кетоновой группы в положение 7 можно проводить обычными методами окисления.
Восстановление функцииональной кетоновой группы в гидроксильную функциональную группу, селективно в положении β, можно проводить, например, методом Luche посредством применения NaBH4 в присутствии гептагидрата хлорида церия (12).
Изобретение относится также к фармацевтическим композициям или лекарственным средствам, содержащим по меньшей мере одно соединение формулы (I) и фармацевтически приемлемый наполнитель.
Фармацевтическая композиция в соответствии с изобретением может состоять из липосомного препарата, содержащего по меньшей мере одно соединение формулы (I). Липосомы можно получить различными способами, известными специалисту в данной области. Можно применять различные липиды, входящие в состав липосом [Медицинское применение липосом (1986) под редакцией Kunio Yagi, Japan Scientific Societies Press, Tokyo, Karger].
Альтернативно, указанная липосома может состоять из так называемой "улучшенной" липосомы, имеющей распределение размеров преимущественно между 40 и 80 нм и имеющей состав, который является стабильным в течение времени, или из так называемой "концентрированной" липосомы, имеющей такое же распределение размеров, но содержащей более высокую концентрацию активных молекул, в частности, 50% выше, чем "улучшенная" липосома.
"Улучшенную" липосому можно получить методом получения, содержащим следующие стадии:
- контактирование активной молекулы, которую нужно включить в липосому, и фосфолипида в органическом растворителе,
- выпаривание растворителя в потоке азота, чтобы получить липидную пленку,
- растворение липидной пленки в органическом растворителе,
- выпаривание указанного растворителя в потоке азота и перенос липидной пленки в водный буфер,
- обработка ультразвуком в ультразвуковой ванне,
- получение везикул экструзией.
Предпочтительно, обработку ультразвуком предпочтительно проводят в течение 10 импульсов на одну мин при температуре приблизительно 20°С. Экструзию можно проводить на мембране типа PVDF, имеющей размер пор 200 нм.
"Концентрированые" липосомы можно получить методом, содержащим следующие стадии:
- контактирования активной молекулы, которая должна быть включена в липосому, и количества фосфолипида, которое выше, чем количество, используемое в обычных методах, в частности в два раза выше обычного количества, в органическом растворителе,
- выпаривания растворителя при пониженном давлении так, чтобы получить липидную пленку,
- растворения липидной пленки в органическом растворителе,
- выпаривания указанного растворителя при пониженном давлении и перенос липидной пленки в водный буфер,
- обработки ультразвуком в ультразвуковой ванне,
- получения везикул экструзией.
Предпочтительно обработку ультразвуком проводят в течение 20 импульсов на одну мин при температуре приблизительно 20°С. Экструзию можно проводить на мембране типа PVDF, имеющей размер пор 200 нм.
Выпаривание предпочтительно проводят при давлении ниже приблизительно 3 кПa (30 мбар) и при температуре бани 25°С. Предпочтительно используют ротационный испаритель.
Количество активной молекулы относительно фосфолипида может быть, например, приблизительно 15%, выраженное в масс. %.
Предпочтительный лекарственный препарат по настоящему изобретению состоит из липосом, загруженных по меньшей мере одним соединением формулы (I).
Соединение(я) формулы (I) предпочтительно является единственным активным ингредиентом(ами), содержащимся в фармацевтической композиции согласно изобретению, в частности, когда указанная фармацевтическая композиция представляет собой липосому. Указанную липосому, содержащую по меньшей мере одно соединение формулы (I), можно вводить, например, пероральным или парентеральным путем.
Альтернативно, соединение формулы (I) можно применять в сочетании с другим активным ингредиентом, таким как, например противораковый агент, в частности, авастин, иринотекан, темозоломид или производные таксола.
Фармацевтические композиции согласно изобретению может быть в любой подходящей форме для перорального введения или для парентерального введения, в частности, инъекцией, инфузией или ингаляцией, известной специалисту в данной области.
В частности, указанная фармацевтическая композиция может быть фармацевтически приемлемым раствором, в частности, спиртовым раствором только по меньшей мере одного соединения формулы (I), или комбинацией его с другим активным ингредиентом, который можно вводить пациенту внутривенным вливанием или инфузией.
Указанная фармацевтическая композиция может, в частности, быть пригодной для введения пероральным или сублингвальным путем. Кроме обычных фармацевтических форм, например, таблеток, капсул, порошков, гранул, растворов, эмульсий, пероральных суспензий, капель, сиропов и т.д., пероральные фармацевтические композиции согласно изобретению могут содержать комплексы соединений формулы (I) с солями желчных кислот или, например, комбинации соединений формулы (I) с фосфолипидами, такими как фосфатидилхолин, в липосомальной или не липосомальной форме.
Объектом настоящего изобретения также являются соединения формулы (I) для применения при лечении заболеваний, связанных с трансформированными астроцитными клетками, в частности, при лечении мультиформной глиобластомы или астроцитомы IV стадии (GBM). В частности, соединения формулы (I) можно вводить инъекцией непосредственно в кору головного мозга, в место лечения.
Изобретение также относится к лечению заболеваний, связанных с трансформированными астроцитными клетками, в частности, лечению мультиформной глиобластомы или астроцитомы IV стадии (GBM), введением эффективного количества по меньшей мере одного соединения формулы (I).
Изобретение также относится к лечению других видов рака, а именно, злокачественных заболеваний крови миелоидного типа и лимфом, нейробластом и меланом.
Объектом настоящего изобретения также являются соединения формулы (I) для применения при лечении злокачественных заболеваний крови миелоидного типа.
Изобретение также относится к лечению злокачественных заболеваний крови миелоидного типа введением эффективного количества по меньшей мере одного соединения формулы (I).
Злокачественные патологии миелоидного типа развиваются из нормальной миелоидной клетки. Теперь клетка этого типа в нормальном состоянии имеет энергетический метаболизм, довольно сходный с энергетическим метаболизмом астроцитов: она продуцирует свою энергию из митохондриального окислительного фосфорилирования и из гликолиза (лактатный путь; LDH) (13). В случае раковых заболеваний миелоидного происхождения раковые клетки продуцируют свою энергию из гликолиза. Что касается GBM, противораковая активность соединений формулы (I) была бы обусловлена ингибированием LDH (гликолиза) и, следовательно, перегревом клетки, вызванным высоким всплеском митохондриального окислительного фосфорилирования.
Объектом изобретения также являются соединения формулы (I) для применения при лечении лимфом.
Изобретение также относится к лечению лимфом введением эффективного количества по меньшей мере одного соединения формулы (I).
Фактически, поскольку миелоидная линия и лимфоидная линия имеют общее происхождение, которой является плюрипотентная гемопоэтическая стволовая клетка, активность соединений формулы (I) в отношении злокачественных заболеваний крови миелоидного типа означает, что может быть предусмотрено их применение также для лечения лимфом.
Соединения формулы (I) для применения при лечении нейробластом также являются объектом настоящего изобретения.
Изобретение также относится к лечению нейробластом введением эффективного количества по меньшей мере одного соединения формулы (I).
Что касается нейробластом, которые поражают главным образом экстракраниальную симпатическую нервную систему, соединения формулы (I) проявляют противоопухолевую активность, поскольку как астроцит, так и нейрон имеют одинаковое эмбриональное происхождение, с одной стороны, а именно, эктодерму, и клеточное происхождение, с другой стороны, а именно, нейроэпителиальные клетки (14). Короче говоря, астроцит и нейрон, оба являются нервными клетки и в равной степени чувствительными к соединениям формулы (I).
Объектом настоящего изобретения также являются соединения формулы (I) для применения при лечении меланомы.
Изобретение относится также к лечению меланомы введением эффективного количества по меньшей мере одного соединения формулы (I).
Фактически, меланоциты, которые имеются в начале меланомы, образуются из нервного гребешка, который сам образован из эктодермы (14). Так как астроциты и нейроны также образуются из эктодермы и соединения формулы (I) обнаруживают анти-GBM и антинейробластомную активность, эти соединения также могут иметь противораковые свойства в отношении к меланомам.
Согласно альтернативе, указанное лечение является последовательным лечением, которое содержит по меньшей мере одну стадию введения первого соединения формулы (I) и по меньшей мере одну стадию введения второго соединения формулы (I), отличного от первого.
Следующие примеры иллюстрируют изобретение, но не ограничивают его.
Раздел I относится к химическому синтезу.
Примеры 1 и 2 относятся к получению промежуточных продуктов синтеза, используемых для получения соединений формулы (I). Примеры 3-6 относятся к получению соединений формулы (I).
Раздел II относится к биологической активности соединений формулы (I).
I/ Химический синтез
Пример 1: Получение 7бета-ацетилхолестерина (соединение 1.4)
Схема реакции показана на фигуре 1.
1) Получение соединения 1.1
Применяли следующие реагенты:
| Мол. масса | Nb, моль | Экв. | Масса или объем | |
| Холестерилбензоат | 490,78 | 100 ммоль | - | 50 г |
| Хлорит натрия | 90,44 | 300 ммоль | 3 экв. | 28 г |
| N-Гидроксифталимид | 163,13 | 10 ммоль | 0,1 экв. | 1,7 г |
| Диоксан/вода, 3/1 | 500 мл |
Холестерилбензоат, смесь диоксан/вода, хлорит натрия и N-гидроксифталимид помещают в указанном порядке в 1-литровую трехгорлую колбу, снабженную обратным холодильником. Эту смесь нагревают при 50°C в течение 6 час. Ход реакции контролируют ТСХ на пластинке диоксида кремния (силикагель ТСХ 60 F254, Merck) в смеси гексан/Et2О, 8/2.
Когда скорость образования достигает приемлемого значения, сырую реакционную смесь выливают в 10% раствор сульфита натрия (500 мл) и затем экстрагируют эфиром. Полученную органическую фазу промывают насыщенным раствором гидрокарбоната натрия, затем водой и, наконец, насыщенным раствором соли. Эту органическую фазу сушат над сульфатом натрия, фильтруют и затем выпаривают при пониженном давлении.
Полученный окрашенный маслянистый остаток затем очищают перекристаллизацией из этанола. Когда полученное белое твердое вещество является недостаточно чистым, его снова очищают хроматографией на силикагеле (диоксид кремния SDS 60А, 35-70 мкм). Твердый осадок получают перенесением этого масла в дихлорметан. Очистку проводят с применением в качестве элюента смеси гексан/этилацетат состава от 98/2 до 90/10. Продукт получают в виде белого твердого вещества.
Выход: 23%.
Анализы: Анализ 1H HMR в CDCl3, BRUKER 400 МГц. Колонка ВЭЖХ с нормальной фазой CHIRALCEL O-DH (колонка ODH0CE-CE026), элюент гексан/iProH, 9/1, 20 мин, длина волны 190 нм.
Время удерживания 6,682 мин, чистота по ВЭЖХ 99,2%.
1H ЯМР (CDCl3, 400,13 МГц): δ 0,71 (с, 3H, CH3), 0,89 (дд, 6H, 2CH3), 0,94 (д, 3H, СН3), 1,02-2,78 (м, 26H), 1,27 (с, 3H, CH3), 4,99 (м, 1H, CH), 5,76 (д, 1H, CH), 7,44-8,05 (м, 5H, CHAr).
2) Получение соединения 1.2
Были использованы следующие реагенты:
| Мол. масса | Nb, моль | Экв. | Масса или объем | |
| Кетохолестерилбензоат | 504,76 | 15,8 ммоль | - | 8 г |
| NaBH4 | 37,83 | 7,9 ммоль | 0,5 экв. + 0,5 экв. | 0,3 г + 0,3 г |
| CeCl3.7H2O | 372,60 | 14,2 ммоль | 0,9 экв. | 5,3 г |
| ТГФ/MeOH, 1:1 | 200 мл |
Кетохолестерилбензоат, смесь растворителей ТГФ/MeOH и гидратированный хлорид церия помещают в колбу объемом 500 мл. Сырую реакционную смесь охлаждают до 0°C на ледяной бане перед медленным добавлением борогидрида натрия. Наблюдается выделение газа, ледяную баню сохраняют в течении 1 час, затем смесь перемешивают при температуре окружающей среды в течение 18 час. Развитие реакции контролируют ТСХ (силикагель для ТСХ 60 F254, Merck) в элюенте гексан/EtOAc, 80/20. Если скорость образования является недостаточной, добавляют 0,5 экв борогидрида натрия.
50 мл воды и 200 мл дихлорметана добавляют к сырой реакционной смеси. После переноса смеси в делительную воронку получают органическую фазу. Водную фазу снова экстрагируют DCM. Органические фазы объединяют, промывают 1 н раствором хлористоводородной кислоты и затем насыщенным раствором NaCl.
Органическую фазу затем сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении, получая при этом слабоокрашенное масло, которое самопроизвольно кристаллизуется.
Твердый осадок получают переносом остатка в DCM. Этот сырой продукт очищают на колонке с силикагелем (диоксид кремния SDS 60А, 35-70 мкм) в элюенте гексан/EtOAc, 9/1. Продукт получают в виде белого