Методология прогнозирования in vitro времени абсорбции in vivo биологически абсорбируемых полимерных имплантатов и устройств
Иллюстрации
Показать всеГруппа изобретений относится к медицине и представляет собой способ прогнозирования поведения in vivo биологически разлагаемых полимерных имплантатов и медицинских устройств, такого как время абсорбции или время гидролиза. Настоящее изобретение предлагает новую методологию in vitro, определение профиля гидролиза, предназначенную для исследования разложения абсорбируемых полимеров. Данные, полученные с помощью данного способа in vitro, коррелируют с данными абсорбции in vivo, что позволяет прогнозировать точное поведение материала in vivo, например время абсорбции. Осуществление изобретения обеспечивает более точное прогнозирование абсорбции in vivo. 2 н. и 34 з.п. ф-лы, 9 пр., 9 табл., 10 ил.
Реферат
Перекрестные ссылки на смежные заявки
Настоящая заявка испрашивает приоритет по предварительной заявке на патент № 61/565856, поданной 1 декабря 2011 г.
Область техники
Область, к которой относится настоящая заявка на патент, относится к способам прогнозирования времени абсорбции in vivo биологически абсорбируемых полимерных имплантатов и медицинских устройств, более конкретно - к способам испытаний in vitro, предназначенным для прогнозирования времени абсорбции in vivo биологически абсорбируемых полимерных имплантатов и медицинских устройств у человека и млекопитающих.
Предпосылки создания изобретения
Известно, что биологически абсорбируемые полимеры широко применяются в медицине. Они особенно подходят для применения в качестве хирургических имплантатов и медицинских устройств. Биологически абсорбируемые полимерные материалы выполнены с возможностью придания соответствующей прочности и сохранения механических свойств in vivo, что способствует выполнению функции имплантата или медицинского устройства в процессе заживления при одновременном разложении с контролируемой и желательной скоростью таким образом, что устройство по существу удаляется из тела пациента после естественного заживления, когда имплантат или устройство больше не требуется. Хирургические имплантаты и медицинские устройства, полученные из биологически абсорбируемых полимеров, часто обеспечивают наилучший исход заболевания у пациента.
Синтетические абсорбируемые полимеры являются важным классом материалов, применяемых в составе различных имплантируемых медицинских устройств. Многие из данных устройств, такие как хирургический шовный материал и хирургические сетки, используют для закрытия мягких тканей раны. Кроме того, такие полимеры применяют в ортопедии для твердых тканей (например, костной ткани), включая устройства фиксации, такие как штифты, винты, пластины, шовные фиксаторы и шовные материалы с более длительным периодом эксплуатации.
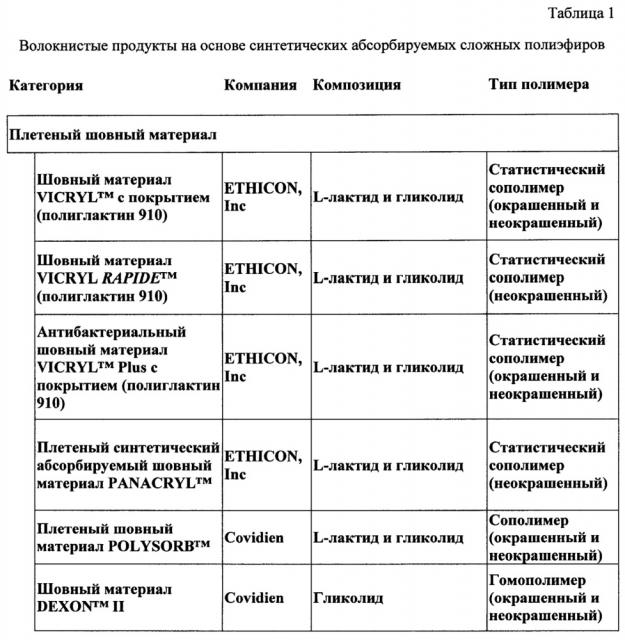
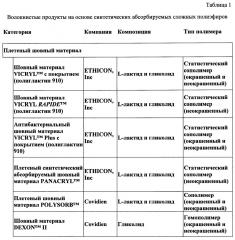
Медицинские устройства, полученные из синтетических абсорбируемых полимеров, можно разделить на волокнистые и неволокнистые продукты. Волокнистые продукты включают шовные материалы (как в монофиламентной форме, так и в мультифиламентной форме) и продукты из сетки (на основе трикотажных, тканых и нетканых структур). В таблице 1 (представленной ниже в настоящем документе) перечислены некоторые из разнообразных продуктов на основе волокна, полученные из синтетических абсорбируемых полимеров. Данные волокна по существу получены способами стандартной экструзии расплава и ориентации.
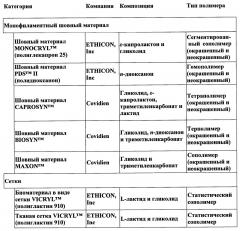
Другой класс (неволокнистые продукты) часто получают способом литья под давлением. В таблице 2 (представленной ниже в настоящем документе) перечислены многие из данных типов неволокнистых устройств. Они включают шовные фиксаторы, костные штифты и пластины, легирующие скобы и заклепки. В дополнение к устройствам, ценность которых заключается в высоких механических свойствах, существуют устройства, ценность которых основана на характеристиках диффузии, такие как носители и защитные слои, применяемые в устройствах контролируемой доставки лекарственного средства, часто в качестве покрытий, микросфер или микрокапсул.
Мировой рынок медицинских устройств, в основе которых лежит данный класс полимеров, огромен и продолжает расширяться, что сопровождается появлением новых перспективных сфер применения, отвечающих неудовлетворенным потребностям пациентов. Данные новые сферы могут включать применение указанных материалов в качестве каркасов для клеточной трансплантации и культивирования тканей в регенеративной медицине. Существующие материалы могут не отвечать всем требованиям, которые будут возникать перед данной областью в будущем. Ученые-материаловеды продолжают работать над улучшением эксплуатационных характеристик данных биологически абсорбируемых материалов и устройств и стремятся придать им более эффективные механические свойства, такие как усиленная прочность и/или жесткость, или обеспечить более длительное сохранение данных механических свойств и срок эксплуатации in vivo.
По ряду причин важно уметь прогнозировать время абсорбции in vivo биологически разлагаемых полимерных имплантатов и медицинских устройств. Между периодом времени, в течение которого имплантаты могут сохранять свою прочность и механические свойства in vivo, и периодом времени, в течение которого процесс заживления достигает состояния, когда ткань способна восстановить свое нормальное функционирование, должна существовать определенная степень корреляции. Преждевременная абсорбция и утрата механической прочности и других механических свойств может привести к катастрофическим последствиям, которые повлекут за собой причинение вреда здоровью пациента или возникновение опасного для жизни последствия, что потребует немедленного медицинского вмешательства. Кроме того, целесообразно разработать имплантат или устройство, имеющее минимальную массу, необходимую для корректного функционирования в процессе заживления.
При разработке новых абсорбируемых полимеров для медицинских устройств и имплантатов ключевым вопросом является продолжительность периода времени, необходимого для того, чтобы материал исчез в теле пациента, т. е. абсорбировался. С решением данного вопроса связано стремление к созданию медицинских устройств и имплантатов из биологически абсорбируемых полимеров, которые имеют желательные характеристики абсорбции in vivo. Окончательный ответ на данный вопрос обычно дают доклинические исследования с использованием материалов, меченных радиоактивным изотопом, которые позволяют отследить абсорбцию, распределение, метаболизм и экскрецию данных материалов и продуктов разложения. Побочные продукты гидролиза могут превращаться в CO2 и выдыхаться, либо выводиться с мочой или фекалиями. Материалы, меченные радиоактивным изотопом, также можно использовать для определения метаболических путей или расположения материалов, т. е. выявления того, действительно ли побочные продукты выводятся или секвестрируются в органах-мишенях. Другие важные средства исследования биологической абсорбции включают гистологические исследования, в ходе которых выполняют измерение площади сечения имплантата в зависимости от времени. Конечно, гистологические исследования также дают важную информацию о реакции ткани, которую вызывает имплантат.
Традиционные способы оценки скорости биологической абсорбции in vivo являются дорогими, занимают много времени и определенно требуют использования лабораторных животных. Для получения одобрения регулирующих органов, а также для демонстрации безопасности и эффективности может быть достаточно доклинических испытаний; однако возможны случаи, когда потребуются клинические исследования с участием человека. В случае исследований с применением радиоактивных меток, как правило, необходимо синтезировать и тщательно очистить мономер C14, меченный соответствующим образом. Затем мономер следует подвергнуть безопасной полимеризации, а полученный радиоактивный полимер превратить в образец для испытания, обладающий соответствующими механическими свойствами. В случае шовного материала потребуется, как правило, прочное, правильно ориентированное волокно.
В целом, принимая во внимание гуманистический аспект, испытания in vitro являются более предпочтительными, чем исследования на животных, при условии получения подходящих достоверных данных. Кроме того, хотя данные, полученные при испытаниях in vitro, могут быть собраны в условиях, имитирующих физиологические, также желательно получать такие данные ускоренным образом. В некоторых случаях испытания можно ускорить посредством изменения температуры, pH, других параметров или их комбинаций для более быстрого получения данных, чем при испытаниях в режиме реального времени. Продолжительность цикла разработки продукта потенциально можно сократить, получив ранние сведения об эксплуатационных характеристиках независимо от того, касаются они композиции полимера или производственных условий, в которых осуществляется получение продукта.
Очевидно, возможность оценить скорость разложения нового биологически абсорбируемого материала, будь то иной химический состав или измененная морфология полимера, без необходимости применения радиоактивных меток или гистологических исследований является преимущественной. Известно, что биологическое разложение абсорбируемых сложных полиэфиров, используемых в медицинских устройствах, происходит путем гидролиза сложноэфирных связей с образованием побочного продукта в виде кислоты. Образование кислотных групп может быть безвредным для окружающей ткани, если биологические механизмы организма способны соответствующим образом нейтрализовать их по мере их образования. Однако если материал подвергают слишком быстрому гидролизу, ткани в месте расположения имплантата могут не справляться с поддержанием соответствующего pH, таким образом вызывая чрезмерное воспаление (1).
Как отмечено выше, химический состав и морфология полимера влияют на эксплуатационные характеристики устройства. Важно отметить, что клинически значимые характеристики включают стабильность размеров, механические свойства, скорость утраты механических свойств после имплантации и скорость абсорбции. Химический состав играет определяющую роль в определении скорости гидролиза; в свою очередь скорость гидролиза существенно влияет на характеристики абсорбции ткани и биологическую совместимость.
Однако химический состав не является единственным фактором, который влияет на эксплуатационные характеристики. Образцы одного и того же полимера, неразличимые по всем своим химическим свойствам, с одинаковым распределением молекулярной массы могут вести себя совершенно по-разному с точки зрения биологических и механических характеристик, если они имеют разную морфологию полимера. Морфология полимера относится к форме или характеру сборки макромолекулярных цепей; в очень упрощенном варианте под морфологией может пониматься степень кристалличности. Однако в дополнение к относительному количеству кристаллической и аморфной фаз морфологическая характеристика полукристаллического полимера включает величину имеющейся молекулярной ориентации (как кристаллической, так и аморфной), характер кристаллической структуры и распределение кристаллов по размеру. На данные характеристики обычно влияют термические, механические условия или напряжение, которым подвергался полимер при обработке и производстве устройства.
Следует признать, что описанные взаимосвязи являются сложными: химический состав и обработка влияют на морфологию; химический состав и морфология влияют на скорость гидролиза, а скорость гидролиза влияет на биологическую эффективность. Таким образом, очень важно в полной мере охарактеризовать абсорбируемое медицинское устройство или имплантат в отношении композиции и морфологии и выяснить влияние данных факторов на время абсорбции in vivo.
На протяжении многих лет для отслеживания разложения абсорбируемых сложных полиэфиров использовали различные стандартные методики. Некоторые исследования in vivo были направлены на изучение утраты механических свойств с течением времени после имплантации. Особое значение в отношении шовного материала имели исследования утраты прочности на разрыв с течением времени; их часто упоминают как исследования сохранения прочности на разрыв (BSR). Кроме исследований BSR in vivo описаны и известны испытания в режиме реального времени (а также проводимые ускоренным образом) in vitro. Однако с помощью данных способов невозможно прогнозировать время абсорбции in vivo. Для изучения вопросов абсорбции посредством методологий in vitro ученые проводили исследования потери массы. Недостатком данного подхода является снижение точности в случаях, когда материал утрачивает механическую целостность и начинает рассасываться на все более мелкие фрагменты, что приводит к сложностям оценки фильтрования и массы. Другие используемые способы включают отслеживание изменений молекулярной массы в зависимости от времени (2). Однако применение данного подхода на постоянной основе является обременительным. Авторы Sawhney и Hubble (3) описали способ, специфичный в отношении растворимых продуктов разложения молочной кислоты.
Хорошо известно, что отлеживать сложноэфирный гидролиз органических соединений можно путем титрования в водной среде (4-11). Также титрование используют для получения информации о гидролизе ряда полифосфатов (12). Tunc и соавторы (13) описали применение ускоренного титрования рН-статом in vitro для оценки времени абсорбции альфа-гидроксиэфирных полимеров in vivo. Однако их методология не позволяла сравнивать результаты испытаний in vitro с абсорбцией in vivo разнообразных абсорбируемых материалов. Они исследовали только полимеры и сополимеры лактида и гликолида. В отсутствие пластификатора температуры стеклования полимеров и сополимеров лактида и гликолида (включая остаточный мономер) находятся в диапазоне от приблизительно 40°C до 65°C, что существенно превышает температуру тела. Авторы ограничили свой способ испытаний температурами ниже температуры стеклования исследованных полимеров. Данное ограничение температуры испытаний до низких значений существенно снижает возможность ускоренного сбора данных. Чтобы компенсировать данный недостаток, Tunc и соавторы использовали линейную экстраполяцию данных, соответствующих начальному времени гидролиза, для уменьшения продолжительности испытаний. Сбор данных только на раннем этапе гидролиза может оказаться неприемлемым для абсорбируемых материалов, имеющих сложную морфологию, когда желательно спрогнозировать общее время абсорбции. Другая проблема, связанная с использованием только тех данных, которые были собраны на ранних этапах гидролиза, возникает, когда образец для испытания содержит полимер со сложным распределением последовательностей. Для примера можно рассмотреть блок-сополимер A-B эпсилон-капролактона и гликолида в соотношении 80/20 (% мол.). В данном случае связаны все последовательности капролактона, а также последовательности гликолида. Оценка времени абсорбции способом, предложенным Tunc, привела бы к существенному преуменьшению количества времени, необходимого для полной абсорбции in vivo. Это происходит из-за того, что последовательности гликолида подверглись бы гидролизу значительно раньше последовательностей эпсилон-капролактона, оставив массу поли(эпсилон-капролактона) относительно целой.
Ограничение условий испытания температурами ниже температуры стеклования (Tg) полимеров было бы затруднительным в случае абсорбируемых полимеров с низкими температурами стеклования, такими как поли-п-диоксанон. Поскольку все монофиламентные шовные материалы имеют температуры стеклования ниже комнатной температуры, данный важный класс продуктов невозможно было бы испытать способом, предложенным Tunc, с учетом его ограничений.
Другую известную методику титрования используют для исследования ферментативного расщепления полигидроксибутиратов (14), а также для исследования гидролиза сложных полиэфиров с короткими цепями (15).
Хотя стандартные способы испытаний in vitro используют для приблизительного предсказания биологической абсорбции материала in vivo, существуют различия, связанные с их применением. С помощью некоторых существующих способов невозможно ускоренно собрать данные. Это особенно затруднительно в отношении полимеров, имеющих длительное время абсорбции. Примером данного класса материалов являются продукты на основе полимеризованного лактида; соответствующие устройства часто применяют в ортопедии. Готовый способ оценки времени абсорбции ускоренным образом сокращает время разработки и способствует оптимизации продукта. Очевидно, что с точки зрения гуманности испытания in vitro являются более предпочтительными, чем испытания in vivo, так как существенно уменьшают или даже устраняют необходимость использования животных. Затраты, связанные с испытаниями in vivo, значительно больше затрат, связанных с испытаниями in vitro. Как указано выше, существующие способы испытаний in vitro чреваты возникновением сложностей при проведении экспериментов и характеризуются низкой точностью.
Соответственно, в данной области существует потребность в новых способах испытаний in vitro биологически абсорбируемых имплантатов и медицинских устройств, которые быстро, гуманно, экономично, точно и воспроизводимо прогнозируют время биологической абсорбции in vivo.
Изложение сущности изобретения
В настоящем документе описана новая методология in vitro прогнозирования времени абсорбции in vivo биологически абсорбируемых полимерных имплантатов и медицинских устройств. Способ обеспечивает прогнозирование времени абсорбции in vivo синтетических абсорбируемых полимеров, образованных из них имплантатов и медицинских устройств, которые содержат гидролизуемые связи в полимерной цепи, на основании исследования in vitro. Способ включает следующие стадии:
(a) проведение гидролиза известного количества образца для испытания при известном времени абсорбции in vivo, при по существу постоянном значении pH и по существу постоянной температуре испытаний, которая равна или больше температуры тела, с использованием известной концентрации титрующего основания, и регистрация объема титрующего основания в зависимости от времени;
(b) регистрация времени, необходимого для достижения постоянного уровня степени гидролиза образца для испытания, где указанная степень гидролиза составляет 70 процентов или более;
(c) повторение стадий (a) и (b) при условиях испытания, выбранных для стадий (a) и (b), с использованием по меньшей мере одного отличного образца для испытания с другим известным временем абсорбции in vivo;
(d) построение корреляционной кривой in vivo - in vitro, отражающей зависимость времени абсорбции in vivo от времени гидролиза in vitro, зарегистрированного на стадии (b);
(e) проведение гидролиза известного количества образца для испытания с неизвестным временем абсорбции in vivo при условиях испытания, выбранных для стадий (a) и (b), с использованием известной концентрации титрующего основания, и регистрация объема титрующего основания в зависимости от времени; и
(f) прогнозирование времени абсорбции in vivo по корреляционной кривой, построенной на стадии (d), и времени гидролиза in vitro, зарегистрированного на стадии (e).
Другим аспектом настоящего изобретения является новая методология in vitro прогнозирования времени абсорбции in vivo биологически абсорбируемых полимерных имплантатов и медицинских устройств. Способ обеспечивает прогнозирование времени абсорбции in vivo синтетических абсорбируемых полимеров, образованных из них имплантатов и медицинских устройств, которые содержат гидролизуемые связи в полимерной цепи, на основании исследования in vitro. Способ включает следующие стадии:
(a) проведение гидролиза известного количества образца для испытания при известном времени абсорбции in vivo, при по существу постоянном значении pH и по существу постоянной температуре испытаний, которая равна или больше температуры тела, с использованием известной концентрации титрующего основания, и регистрация объема титрующего основания в зависимости от времени;
(b) регистрация времени, необходимого для достижения постоянного уровня степени гидролиза образца для испытания, где указанная степень гидролиза составляет 70 процентов или более;
(c) построение корреляционной кривой in vivo - in vitro, отражающей зависимость времени абсорбции in vivo от времени гидролиза in vitro, зарегистрированного на стадии (b);
(d) проведение гидролиза известного количества образца для испытания с неизвестным временем абсорбции in vivo при условиях испытания, выбранных для стадии (a) и (b), с использованием известной концентрации титрующего основания, и регистрация объема титрующего основания в зависимости от времени; и
(e) прогнозирование времени абсорбции in vivo по корреляционной кривой, построенной на стадии (c), и времени гидролиза in vitro, зарегистрированного на стадии (d).
Данные и другие аспекты и преимущества настоящего изобретения станут более понятными после изучения следующего описания и прилагаемых чкртежей.
Краткое описание чертежей
На фиг. 1 представлен график точности определения профиля гидролиза: шесть повторов гидролиза 80 мг мономера гликолида. Экспериментальные условия: pH 7,27, 75 мл воды, 0,05 N NaOH и 75°C. График динамики титрования, или «профиль гидролиза».
На фиг. 2 представлены профили гидролиза 100 мг гликолида в 75 мл воды при pH 7,27 с 0,05 N NaOH и выбранных температурах.
На фиг. 3 представлен график кинетики гидролиза гликолида при pH 7,27 и выбранных температурах.
На фиг. 4 представлен график Аррениуса константы скорости гидролиза линейных димеров гликолевой кислоты.
На фиг. 5 представлены профили гидролиза мономеров гликолида и лактида при pH 7,27 и температуре 75°C.
На фиг. 6 представлен график, отражающий температурную зависимость полупериода гидролиза шовных материалов VICRYL™ и VICRYL RAPIDE™.
На фиг. 7 представлены профили гидролиза выбранных шовных материалов ETHICON (100 мг каждого шовного материала).
На фиг. 8 представлена корреляция между временем абсорбции in vivo и in vitro для выбранных шовных материалов ETHICON.
На фиг. 9 представлена зависимость времени гидролиза шовного материала при температуре 75°C от диаметра волокна монофиламентного шовного материала MONOCRYL.
На фиг. 10 представлен график зависимости сохранения прочности на разрыв (BSR) шовного материала от степени образования группы карбоновой кислоты.
Подробное описание изобретения
Следует отметить, что в настоящем документе термины «абсорбируемый» и «биологически абсорбируемый» применительно к синтетическим полимерам являются взаимозаменяемыми. Способ получения профиля гидролиза предполагает регистрацию количества основания, необходимого для поддержания водной среды при выбранном значении pH, в зависимости от времени в ходе сложноэфирного гидролиза. Таким образом, его можно использовать для определения времени, необходимого для получения относительной доли гидролиза, включая полный гидролиз. Специалистам в данной области будет понятно, что для осуществления способа, составляющего предмет настоящего изобретения, можно использовать стандартное оборудование. Оборудование может включать, например, pH-зонд, стеклянные сосуды с регулируемой температурой, автоматические дозирующие системы, возможность регистрации данных и удаленного управления приборами и т. п., а также их эквиваленты. Управление, сбор данных, а также анализ и презентацию можно осуществлять с помощью стандартных и/или персонализированных компьютеров и стандартного и/или персонализированного программного обеспечения и их эквивалентов.
Способ заключается в гидролитическом разложении образца для испытания при поддержании значения pH. Этого достигают путем титрования стандартным основанием и измерения количества использованного основания в зависимости от времени. Измерение и титрование автоматизированы для удобства пользователя.
В рамках нового способа, составляющего предмет настоящего изобретения, манипуляции in vitro проводят для полного гидролиза абсорбируемого сложнополиэфирного хирургического имплантируемого устройства, такого как шовный материал, при постоянном значении pH и повышенной температуре. Также необходимо признать, что проведение полного гидролиза не всегда необходимо, однако предпочтительными являются степени гидролиза более приблизительно 90%. Этого можно достичь с использованием стандартной круглодонной колбы с несколькими горловинами, оборудованной pH-зондом, регулятором температуры и управляемым устройством подачи разбавленного раствора гидроксида натрия через трубку Teflon®. В данный реактор, первоначально содержащий только дистиллированную воду, добавляют абсорбируемый сложнополиэфирный хирургический шовный материал (или другой абсорбируемый образец для испытания). Данные можно регистрировать вручную или с помощью компьютера. В предпочтительном варианте осуществления установка включает электронный регулятор, который принимает сигнал от измерителя pH и заставляет клапан с тефлоновым покрытием магистрали Teflon® открываться для титрования реакции с сохранением постоянного, заранее определенного значения pH. В ходе гидролиза абсорбируемого сложнополиэфирного шовного материала (или биологически абсорбируемого полимерного образца для испытания) образуются кислотные группы, поступательно снижающие значение pH, что отражено в показаниях pH-зонда. Затем регулятор открывает электронно-управляемый клапан с тефлоновым покрытием, обеспечивая подачу основания для титрования смеси, что приводит к восстановлению заданного значения pH. Контейнер с разбавленным раствором гидроксида натрия устанавливают на электронных весах с возможностью мониторинга снижения массы по мере поглощения раствора NaOH во время гидролиза. Таким образом, посредством наблюдений и ручной регистрации данных можно отслеживать степень гидролиза в зависимости от времени. Благодаря применению компьютерного управления основная методология была усовершенствована для удобства пользователя, а также точности и стандартизации. Специалистам в данной области будет понятно, что при желании процедуру можно выполнять вручную без автоматических регуляторов, хотя это и не является предпочтительным вариантом.
Методологии, составляющие предмет настоящего изобретения, можно применять в отношении полимеров, содержащих сложные эфиры в главной цепи. В модифицированном виде указанные способы также можно применять для получения представления о разложении потенциальных полимерных систем, например таких, которые содержат сложные эфиры в боковых группах. Гидролиз сложного эфира боковой группы может привести к растворению сегмента цепи или в других случаях (в зависимости от химического состава) - к разложению основной цепи из-за локальных изменений pH, т. е. к так называемому «эффекту соседней группы».
Способ определения профиля гидролиза, представленный в настоящем документе, применим к стандартным синтетическим абсорбируемым сложным полиэфирам, полиангидридам и другим полимерам со связями, подверженными гидролитическому разложению, а также их эквивалентам, которые образуют кислотные продукты разложения.
Биологически абсорбируемые полимеры, пригодные для получения устройств, которые можно испытывать в соответствии со способом, составляющим предмет настоящего изобретения, включают стандартные биологически совместимые, биологически абсорбируемые полимеры, включая полимеры, выбранные из группы, состоящей из алифатических сложных полиэфиров, поли(аминокислот), сополимеров сложных и простых эфиров, полиалкиленовых оксалатов, полиалкиленовых эфиров дигликолевой кислоты, полиамидов, полученных из тирозина поликарбонатов, поли(иминокарбонатов), полиортоэфиров, полиоксиэфиров, полиамидоэфиров, полиоксиэфиров, содержащих аминогруппы, полиангидридов, полифосфазенов, полипропиленфумаратов, абсорбируемых сложных полиэфируретанов и их комбинаций и смесей, а также эквивалентов. Полиоксиэфиры включают полимеры на основе 3,6-диоксиоктандикарбоновой кислоты, 3,6,9-триоксиундекандикарбоновой кислоты и двухосновной кислоты, известной как двухосновная полигликолевая кислота, которые можно получить путем окисления низкомолекулярного полиэтиленгликоля.
Подходящие полимеры могут быть гомополимерами или сополимерами (статистическими, блочными, сегментированными, сужающимися блочными, привитыми, трехблочными и т. п.), имеющими линейную, разветвленную или звездообразную структуру. Подходящие мономеры для получения подходящих полимеров могут содержать один или более следующих мономеров: молочную кислоту (включая L-молочную кислоту и D-молочную кислоту), лактид (включая L-, D-, мезо- и D, L-смеси), гликолевую кислоту, гликолид, ε-капролактон, п-диоксанон (1,4-диоксан-2-он), триметиленкарбонат (1,3-диоксан-2-он), δ-валеролактон, ε-декалактон, 2,5-дикетоморфолин (морфолиндион), пивалактон, α,α-диэтилпропиолактон, этиленкарбонат, этиленоксалат, 3-метил-1,4-диоксан-2,5-дион, 3,3-диэтил-1,4, диоксан-2,5-дион, γ-бутиролактон, 1,4-диоксепан-2-он, 1,5-диоксепан-2-он, 6,6- диметилдиоксепан-2-он, 6,8-диоксибициклоктан-7-он или их комбинации. Следует понимать, что способы, составляющие предмет настоящего изобретения, можно применять и в отношении смесей полимеров.
В альтернативном варианте осуществления биологически абсорбируемые полимеры могут быть компонентом поперечносшитой сети. Другими словами, подходящие полимеры также включают поперечносшитые полимеры и гидрогели, содержащие гидролизуемые сложноэфирные или ангидридные группы. Следует понимать, что типовые биологически абсорбируемые, биологически совместимые полимеры могут быть по существу синтезированы методом полимеризации с раскрытием цикла соответствующих мономеров лактона или поликонденсации соответствующих гидроксикислот, либо с помощью комбинаций двух данных методологий полимеризации.
При разработке новых абсорбируемых полимеров для медицинских устройств и имплантатов ключевым вопросом является продолжительность периода времени, необходимого для того, чтобы материал исчез в теле пациента, т. е. абсорбировался. С решением данного вопроса связано стремление к созданию медицинских устройств и имплантатов из биологически абсорбируемых полимеров, которые имеют желательные характеристики абсорбции in vivo. И хотя окончательный ответ на данный вопрос обычно дают доклинические исследования с использованием материалов, меченных радиоактивным изотопом, которые позволяют отследить абсорбцию, распределение, метаболизм и экскрецию данных материалов и продуктов разложения, другие важные средства изучения биологической абсорбции включают гистологические исследования, в ходе которых выполняют измерение площади сечения имплантата в зависимости от времени. Например, в статье под названием «Monocryl® Suture, a New Ultra-Pliable Absorbable Monofilament Suture», авторы Rao S. Bezwada, Dennis D. Jamiolkowski, In-Young Lee, Vishvaroop Agarwal, Joseph Persivale, Susan Trenka-Benthin, Modesto Erneta, Jogendra Suryadevara, Alan Yang и Sylvia Liu, опубликованной в Biomaterials, том 16, издание 15, октябрь 1995 г., стр. 1141-1148, описаны биологические характеристики монофиламентного шовного материала на основе капролактона и гликолида. Другим примером таких исследований является работа Craig, P. H., Williams, J. A., Davis, K. W., Magoun, A. D., Levy, A. J., Bogdansky, S. и Jones, J. P. Jr., описанная в статье под названием «A Biologic Comparison of Polyglactin 910 and Polyglycolic Acid Synthetic Absorbable Sutures» в Surg. Gynecol. Obstet., 141:1-10, 1975 г. Обе данные статьи включены в настоящий документ путем ссылки.
Как правило, характеристики абсорбируемых медицинских устройств in vivo получают в ходе доклинических исследований на крысах. Как описано выше, для описания характеристик шовного материала in vivo используют крыс Лонг-Эванс, причем шовный материал имплантируют в ягодичные мышцы, а затем удаляют в выбранные моменты времени после имплантации, препарируют и окрашивают для гистологической оценки. Таким образом, оценку абсорбции in vivo, как правило, выполняют с помощью данных моделей, отслеживая исчезновение имплантата в срезах тканей на гистологических препаратах.
Механические характеристики абсорбируемых медицинских устройств изменяются in vivo с течением времени. Характер разрушения данных устройств может зависеть от одной и более механических характеристик, например, от удлинения при растяжении на разрыв, модуля Юнга, разрывной нагрузки, характеристик восстановления или прочности на разрыв. Поскольку механические характеристики зависят от молекулярной массы, а молекулярная масса в свою очередь зависит от степени гидролиза, способ, составляющий предмет настоящего изобретения, можно использовать для прогнозирования механических свойств.
Хотя циклы определения профиля гидролиза, представленные в примерах ниже, по существу выполняли при температуре 75°C, можно применять и исследовать другие достаточно эффективные условия, включающие температуру, pH и прочие параметры, а также проводить поиск корреляций с характеристиками, демонстрируемыми in vivo (такими как время абсорбции или утрата механических свойств). Возможен широкий ряд корреляций при условии отсутствия существенных изменений основных механизмов разложения. Как правило, температурный диапазон может превышать приблизительно 37°C, более характерно - составлять от приблизительно 60°C до приблизительно 95°C, предпочтительно - от приблизительно 70°C до приблизительно 75°C, а наиболее предпочтительно - приблизительно 70°C. Как правило, диапазон pH может варьироваться от значений, превышающих приблизительно 2, до приблизительно 11, более характерно - от приблизительно 6,3 до приблизительно 8,3, а предпочтительно - приблизительно 7,3. Как правило, концентрация водного раствора титрующего основания, а именно гидроксида натрия, будет составлять от приблизительно 0,0001 N до приблизительно 1,0 N, более характерно - приблизительно 0,05 N. Как правило, постоянный уровень степени гидролиза образца для испытания будет составлять от приблизительно 90% до приблизительно 100%, более характерно - от приблизительно 95% до приблизительно 100%, предпочтительно - от приблизительно 98% до приблизительно 100%, а еще более предпочтительно - приблизительно 100%.
Предполагается, что изменения физических свойств заданного материала (таких как сохранение прочности шовного материала на разрыв) связаны с его профилем гидролиза, поскольку химическое разложение влияет на механические характеристики.
Учитывая, что несущая способность полукристаллических полимеров зависит от так называемых «связанных молекул», присутствующих в аморфной фазе, но соединяющих кристаллиты, расщепление данных молекул (а не сегментов цепей в кристаллитах) отвечает за сохранение прочности. Следовательно, предполагается, что степень гидролиза, необходимая для влияния на разрывную нагрузку полукристаллических полимеров, будет очень мала - в диапазоне нескольких первых процентов после гидролиза любого остаточного мономера. Чтобы получить данную информацию экспериментально, необходимо применять более разбавленный титрующий раствор и/или более низкую температуру испытаний, а также потенциально увеличить скорость сбора данных на ранних этапах определения профиля гидролиза. Для соотнесения ранней фазы профиля гидролиза и механических характеристик in vivo необходимо сгенерировать новый набор корреляционных кривых.
Следует понимать, что высокие температуры испытаний могут быть ограничены температурой кипения воды. В случаях, когда необходимо добиться существенного ускорения, можно использовать герметичную систему, которая позволяет создать давление, превышающее одну атмосферу.
Также следует понимать, что можно применять относительно низкие температуры испытаний при условии, что они превышают температуру тела. Данные температуры могут особенно подходить в случае легкоплавких полимеров. Дополнительно следует понимать, что в условиях, когда известна энергия активации гидролиза, данные можно собирать при заданной температуре испытаний, а прогнозирование гидролиза in vivo выполнять с помощью корреляционных кривых на основании данных, собранных in vitro при другой температуре.
Следует понимать, что образец должен быть достаточно большого размера, чтобы эффективно минимизировать отклонения в ходе эксперимента. Если размер образца слишком мал, будет наблюдаться нестабильность результатов. Следует отметить, что образцы очень больших размеров могут потребовать применения очень больших реакторов для гидролиза.
Следует понимать, что заданная корреляционная кривая должна быть построена при использовании тех же условий испытания, в которых оценивают образец для испытания.
Следует понимать, что для эффективного покрытия образца для испытания в гидролизере потребуется достаточный первоначальный объем воды. Гидролизер должен иметь свободный объем, достаточный для размещения образца для испытания, первоначального количества воды и конечного объема раствора титрующего основания.
Следует по