Эстрогенные компоненты для применения в лечении неврологических расстройств
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине. Предложено применение эстетрола для лечения повреждения головного мозга в области гиппокампа. Технический результат: эстетрол уменьшает раннюю утрату серого вещества и стимулирует нейро- и васкулогенез после перинатальной или неонатальной асфиксии. 4 з.п. ф-лы, 16 ил.
Реферат
Область техники
Настоящее изобретение принадлежит к области медицины. Более конкретно изобретение относится к новым медицинским применениям определенных эстрогенных компонентов, таких как эстетрол (1,3,5(10)-эстратриен-3,15α,16α,17β-тетрол).
Предшествующий уровень техники
Неврологические расстройства, в частности расстройства центральной нервной системы (ЦНС), охватывают многочисленные поражения, включая среди прочего острое повреждение ЦНС (например, гипоксически-ишемические энцефалопатии, удар, травматическое повреждение головного мозга, повреждение спинного мозга, церебральный паралич), нейродегенеративные заболевания (например, болезнь Альцгеймера, болезнь Паркинсона, лобно-височную деменцию) и большое число дисфункций центральной нервной системы (например, депрессию, эпилепсию и шизофрению).
Гипоксически-ишемическая энцефалопатия (ГИЭ) новорожденных представляет собой неврологическое расстройство, вызывающее повреждение клеток в головном мозге новорожденных вследствие неадекватного снабжения кислородом. Гипоксия и ишемия головного мозга вследствие системной гипоксемии и уменьшенного церебрального кровотока (CBF - cerebral blood flow) является основной причиной, ведущей к ГИЭ новорожденных, сопровождающейся повреждениями серого и белого вещества, происходящими у новорожденных. ГИЭ новорожденных может вызвать смерть в период новорожденности или привести в результате к явлениям, впоследствии распознаваемым как задержка развития, задержка умственного развития или церебральный паралич (ЦП). Даже, несмотря на то, что в недавнее время разработаны различные терапевтические стратегии, ГИЭ новорожденных остается серьезным состоянием, вызывающим значительную смертность и заболеваемость у недоношенных и доношенных новорожденных и, следовательно, остается проблемой для перинатальной медицины.
В течение последних нескольких лет модель гипоксически-ишемического повреждения головного мозга на крысах стала чаще всего применяемой моделью в перинатальной медицине. На сутки 7 после рождения (Р7; сутки рождения = Р1) головной мозг крыс гистологически подобен головному мозгу плода человека на 32-34 неделе беременности или новорожденного ребенка, то есть формирование нейронного слоя коры головного мозга завершено, происходит инволюция зародышевого матрикса, и произошла небольшая миелинизация белого вещества. Чтобы вызвать гипоксически-ишемическое повреждение головного мозга у крысят 7-дневного возраста, проводят одностороннюю лигатуру головной артерии с последующей системной гипоксией, полученной в результате вдыхания 8% баланса кислорода/азота при постоянной температуре (37°С) (Vanucci et al. 2005. Dev Neurosci, vol. 27, 81-86).
Доказано, что модель на крысах обеспечивает важную информацию, касающуюся механизмов, лежащих в основе перинатального гипоксически-ишемического повреждения головного мозга, а также о том, как можно предотвратить или свести к минимуму повреждение тканей посредством терапевтического вмешательства. В частности, к модели перинатального гипоксически-ишемического повреждения головного мозга у крысят применены физиологические и терапевтические манипуляции, чтобы оценить потенциальные способы лечения, включающие гипотермию, обработку ксеноном и введение эритропоэтина.
Перспективные нейропротективные агенты включают противоэпилептические лекарственные средства, эритропоэтин, мелатонин и ксенон. Кроме того, данные, полученные на моделях асфиксии на животных, позволяют предположить, что неврологический исход после ГИЭ можно улучшить путем добавления вспомогательных терапий к гипотермии, начиная в течение от часов до суток после поражения. Теперь эти перспективные способы лечения необходимо оценивать в клинических испытаниях. Клинические исследования фазы 1-2 с использованием биомаркерных результатов, например, фосфорной магнитно-резонансной спектроскопии, и включающие небольшое число новорожденных, являются ключевыми для оценки безопасности и потенциальной эффективности, прежде чем новые способы лечения принимают к практическим клиническим испытаниям. Испытания фазы 1-2 ксенона и эритропоэтина уже планируются или проходят.
Способы терапии неврологических расстройств, в частности, повреждений ЦНС или нейродегенеративных заболеваний, могут быть основаны на защите от повреждения головного или спинного мозга или восстановлении активности нервных клеток, например, посредством применения нейротрофических факторов. Нейротрофические факторы, такие как, например, эпидермальный фактор роста (EGF - epidermal growth factor) и трансформирующий фактор роста альфа (TGF-α - transforming growth factor), представляют собой полипептиды, которые разнообразными путями поддерживают выживание, пролиферацию, дифференциацию, размер и функцию нервных клеток. Лечение неврологических расстройств может также включать введение стволовых клеток для замены нервных клеток, утраченных в результате естественной гибели клеток, повреждения или заболевания.
Проблемой, с которой сталкиваются при введении таких нейротрофических факторов или стволовых клеток, является гематоэнцефалический барьер, который может препятствовать их переносу из кровотока в ЦНС. Следовательно, терапевтические методы часто требуют прямого применения нейротрофического фактора или инфузии стволовых клеток в место травмы или повреждения ЦНС у субъекта, нуждающегося в таком лечении.
С учетом малочисленности успешных способов лечения неврологических расстройств в целом, существует потребность в дополнительных терапевтических агентах и способах, предпочтительно не основанных на инвазивных внутричерепных способах, или в веществах, обладающих улучшенным прохождением через гематоэнцефалический барьер.
Краткое описание изобретения
Настоящее изобретение направлено на одну или более обсуждаемых выше потребностей в данной области техники.
Как показано в экспериментальном разделе, авторы изобретения обнаружили, что определенные эстрогенные компоненты, примером которых является эстетрол, обладают нейропротективными эффектами. Например, авторы изобретения неожиданно продемонстрировали, что получение крысятами эстетрола защищало их от повреждения головного мозга вследствие гипоксии-ишемии. Также примечательно, что, как было показано, получение крысятами определенных эстрогенных компонентов, примером которых является эстетрол, после (то есть впоследствии) гипоксии-ишемии приводит в результате к меньшему повреждению головного мозга, что подтверждает, что данные соединения проявляют благоприятные терапевтические эффекты. Кроме того, было показано, что получение крысятами определенных эстрогенных компонентов, примером которых является эстетрол, стимулирует нейрогенез и васкулогенез.
Эстетрол (Е4) представляет собой эстрогенное стероидное вещество, синтезируемое исключительно фетальной печенью во время беременности у женщин и попадающее в кровообращение матери через плаценту. Вещество обнаруживается в моче матери уже на 9 неделе беременности, постепенно возрастая по мере увеличения срока беременности (Holinka et al. 2008. J Steroid Biochem Mol Biol, vol. 1 10, 138-143). Неконъюгированный E4 также обнаруживается в амниотической жидкости. Эстетрол является основным метаболитом эстрадиола (Е2), образованного из его предшественников в результате гидроксилирования.
Считают, что Е4 менее эффективен по сравнению с Е2 в связи с его низким сродством связывания с рецептором эстрогена по сравнению с Е2. В исследованиях конкурентного связывания выявлено низкое сродство связывания Е4 с ядерным и цитоплазматическим рецепторами эстрогена относительно сродства Е2, показывающее значения связывания с цитоплазматическим рецептором эстрогена 1,0 и 0,015 для Е2 и Е4 соответственно (Holinka et al., см. выше). Е4 действует как слабый эстроген при стимуляции роста культивируемых клеток MCF-7, реагирующих на эстроген, по сравнению с Е2: было показано, что эффективность Е2 в 50 раз выше, чем Е4.
В Warmerdam et al. 2008 (Climacteric, vol. 11 (suppl. 1), 59-63) раскрыт коэффициент распределения этанол/вода (Pow - octanol-water partition), который является мерой липофильных или гидрофильных свойств соединения, выраженный в виде логарифма Pow или “Pow Log“, эстетрола, Pow Log=1,47 или 1,695 в зависимости от условий эксперимента. Поскольку Pow Log, равный 2,0, считают оптимальным, чтобы дать возможность прохождения соединений через гематоэнцефалический барьер (Warmerdam et al. 2008, см. выше), сильное нейропротективное действие эстетрола в крысиной модели ГИЭ новорожденных удивительно.
Недавние фармакологические и клинические данные подтверждают потенциальное клиническое применение Е4 для таких применений, как гормонотерапия, контрацепция, предупреждение остеопороза и менопаузальных горячих приливов, терапия рака и лечение или предупреждение сердечно-сосудистых патологий. Насколько известно, эффекты эстрогенных компонентов, иллюстративным примером которых является Е4, в центральной нервной системе до сих пор не описаны.
Соответственно, в аспекте изобретения предложен эстрогенный компонент, выбранный из группы, состоящей из следующих веществ:
эстрогенных веществ, имеющих формулу (I):
где R1, R2, R3, R4 каждый независимо представляет собой атом водорода, гидроксильную группу или алкоксигруппу, имеющую от 1 до 5 атомов углерода; где каждый из R5, R6, R7 представляет собой гидроксильную группу; и где не более чем 3 из R1, R2, R3, R4 представляют собой атомы водорода;
предшественников эстрогенных веществ; и
смесей одного или более эстрогенных веществ и/или предшественников;
для применения при лечении неврологического расстройства.
Предпочтительно в изобретении предложен эстрогенный компонент, выбранный из группы, состоящей из следующих веществ:
эстрогенных веществ, имеющих формулу (I):
где R1, R2, R3, R4 каждый независимо представляет собой атом водорода, гидроксильную группу или алкоксигруппу, имеющую от 1 до 5 атомов углерода; где каждый из R5, R6, R7 представляет собой гидроксильную группу; и где не более чем 3 из R1, R2, R3, R4 представляет собой атомы водорода;
предшественников эстрогенных веществ, являющихся производными эстрогенных веществ, в которых атом водорода по меньшей мере одной из гидроксильных групп замещен ацильным радикалом углеводородной карбоновой, сульфоновой или сульфаминовой кислоты имеющим от 1 до 25 атомов углерода; тетрагидрофуранил; тетрагидропиранил; либо гликозидный остаток с прямой или разветвленной цепью, содержащий от 1 до 20 гликозидных звеньев на остаток; и
смесей одного или более эстрогенных веществ и/или предшественников;
для применения при лечении неврологического расстройства.
В изобретении также предложен способ лечения неврологического расстройства у пациента, нуждающегося в этом, включающий введение этому пациенту терапевтически эффективного количества эстрогенного компонента, раскрытого в настоящем изобретении.
В изобретении также предложено применение эстрогенного компонента, раскрытого в настоящем изобретении, для получения лекарственного средства для лечения неврологического расстройства.
В предпочтительных воплощениях изобретения R3 представляет собой гидроксильную группу или алкоксигруппу, имеющую от 1 до 5 атомов углерода, более предпочтительно R3 представляет собой гидроксильную группу.
В предпочтительных воплощениях изобретения по меньшей мере 2, более предпочтительно 3 из R1, R2, R3 и R4 представляет собой атомы водорода. В особенно предпочтительных воплощениях изобретения радикалы R1, R2 и R4 представляют собой атомы водорода.
В определенных воплощениях изобретения R3 представляет собой гидроксильную группу или алкоксигруппу, имеющую от 1 до 5 атомов углерода, более предпочтительно R3 представляет собой гидроксильную группу, и по меньшей мере 1, более предпочтительно по меньшей мере 2 и еще более предпочтительно все 3 группы R1, R2 и R4 представляют собой атомы водорода.
В следующих предпочтительных воплощениях изобретения R1, R2 и R4 представляют собой атомы водорода, a R3, R5, R6 и R7 представляют собой гидроксильные группы; следовательно, эстрогенное вещество или эстрогенный компонент представляет собой 1,3,5(10)-эстратриен-3,15,16,17-тетрол. В особенно предпочтительном воплощении изобретения эстрогенное вещество или эстрогенный компонент представляет собой 1,3,5(10)-эстратриен-3,15α,16α,17β-тетрол (эстетрол).
В предпочтительных воплощениях изобретения предшественники представляют собой производные эстрогенных веществ, где атом водорода по меньшей мере одной из гидроксильных групп замещен ацильным радикалом углеводородной карбоновой, сульфоновой или сульфаминовой кислоты, имеющим от 1 до 25 атомов углерода; тетрагидрофуранил; тетрагидропиранил; либо гликозидным остатком с прямой или разветвленной цепью, содержащим 1-20 гликозидных звеньев на остаток.
Как отмечено, в настоящем изобретении предложен эстрогенный компонент, раскрытый в настоящем изобретении, применяемый при лечении неврологического расстройства.
В предпочтительных воплощениях изобретения в изобретении предложен эстрогенный компонент, раскрытый в настоящем изобретении, применяемый при терапевтическом лечении неврологического расстройства, то есть при лечении неврологического расстройства, где эстрогенный компонент вводят субъекту, у которого диагностировано неврологическое расстройство.
Под термином “неврологическое расстройство“ обычно подразумевают расстройство, поражающее нервную систему, включая центральную нервную систему и периферическую нервную систему.
В предпочтительных воплощениях изобретения неврологическое расстройство представляет собой повреждение, предпочтительно повреждение центральной нервной системы, более предпочтительно повреждение головного мозга, либо представляет собой нейродегенеративное заболевание. Предпочтительно неврологическое расстройство, таким образом, выбрано из группы, включающей повреждение головного мозга, повреждение спинного мозга и нейродегенеративное заболевание, или состоящей из этих расстройств. Более предпочтительно неврологическое расстройство выбрано из группы, включающей повреждение головного мозга и нейродегенеративное заболевание, или состоящей из этих расстройств.
В предпочтительных воплощениях изобретения неврологическое расстройство выбрано из группы, включающей гипоксическое повреждение головного мозга, аноксическое повреждение головного мозга, травматическое повреждение головного мозга, болезнь Альцгеймера и болезнь Паркинсона, или состоящей из этих расстройств.
В определенных воплощениях изобретения болезнь Альцгеймера представляет собой болезнь Альцгеймера ранней стадии, то есть доклинической стадии, или самые ранние клинические стадии болезни Альцгеймера.
В определенных воплощениях изобретения болезнь Паркинсона представляет собой болезнь Паркинсона ранней стадии без деменции или болезнь Паркинсона с умеренными когнитивными нарушениями.
Под терминами “гипоксическое повреждение“ или “аноксическое повреждение“ в данном изобретении подразумевают повреждение головного мозга в результате кислородного голодания, за счет либо гипоксического (то есть уменьшенного снабжения головного мозга кислородом), либо аноксического (то есть полного отсутствия поступления кислорода к головному мозгу) механизма соответственно. Гипоксические/аноксические повреждения могут поражать локализованную область (области) головного мозга или весь головной мозг. В определенных предпочтительных воплощениях изобретения гипоксические/аноксические/травматические повреждения головного мозга поражают по меньшей мере гиппокамп или кору головного мозга, например, по меньшей мере гиппокамп и кору головного мозга, предпочтительно по меньшей мере гиппокамп.
В предпочтительных воплощениях изобретения неврологическое расстройство представляет собой гипоксически-ишемическую энцефалопатию (ГИЭ).
Под терминами “гипоксически-ишемическая энцефалопатия“ или “ГИЭ“ в данном изобретении конкретно подразумевают состояние, встречающееся, когда весь головной мозг лишен адекватного снабжения кислородом, но это лишение является неполным. Неадекватное снабжение кислородом может быть гипоксическим по происхождению, то есть вследствие сниженного доступа кислорода, и/или ишемическим по происхождению, то есть вследствие кислородного голодания в результате прерывания кровотока. В определенных предпочтительных воплощениях изобретения ГИЭ поражает по меньшей мере гиппокамп или кору головного мозга, например, по меньшей мере гиппокамп и кору головного мозга, предпочтительно по меньшей мере гиппокамп.
В особенно предпочтительных воплощениях изобретения эстрогенный компонент, раскрытый в данном изобретении, применяют для лечения гипоксически-ишемической энцефалопатии (ГИЭ) новорожденных.
Как употреблено в данном описании, выражение “лечение ГИЭ новорожденных“ может включать защиту от повреждения головного мозга, и может дополнительно включать предупреждение, ослабление симптомов, облегчение ассоциированных симптомов или уменьшение степени расстройств, относящихся к ГИЭ новорожденных, таких как, например, задержка развития, задержка умственного развития или церебральный паралич (ЦП) (ослабление ЦП включает, например, улучшение двигательной, поведенческой и/или когнитивной функции). Как употреблено в данном описании, термин “церебральный паралич“ относится к группе состояний, характеризующихся хроническими расстройствами движения или позы. Церебральный паралич может сопровождаться судорожными расстройствами, сенсорными нарушениями и/или когнитивными ограничениями.
Описанные выше и дополнительные аспекты, предпочтительные воплощения и признаки изобретения раскрыты в приведенных ниже разделах и в прилагаемой формуле изобретения. Каждый аспект, воплощение или признак изобретения, раскрытый в данном описании, можно объединять с любым другим аспектом (аспектами), воплощением (воплощениями) или признаком (признаками) изобретения, если нет явных противоречащих указаний. В частности, любой признак, указанный в данном описании, и, в частности, любой признак, указанный как предпочтительный или преимущественный, может быть объединен с любым другим признаком (признаками), указанным в данном описании, и, в частности, с любым признаком, указанным как предпочтительный или преимущественный. Сущность прилагаемой формулы изобретения, таким образом, конкретно включена в данное описание.
Краткое описание графических материалов
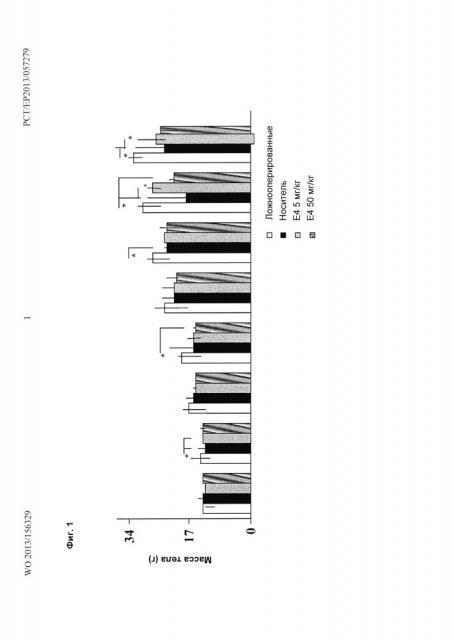
Фиг. 1. Послеоперационные массы тела крысят. Послеоперационные массы тела крысят, которым инъецировали интраперитонеально с суток 4 по сутки 7 включительно после рождения: носитель (физиологический раствор) (Носитель), либо 5 мг/кг Е4 (Е4 5 мг/кг) или 50 мг/кг Е4 (Е4 50 мг/кг), либо не инъецировали (ложнооперированные). Показано среднее ± стандартная ошибка среднего (SEM) масс тела 7 крысят из группы ложнооперированных, 11 крысят из группы носителя, 7 крысят из группы Е4 5 мг/кг и 5 крысят из группы Е4 50 мг/кг.
Фиг. 2. Масса головного мозга крысят. Масса головного мозга крысят, которым инъецировали интраперитонеально с суток 4 по сутки 7 включительно после рождения: носитель (физиологический раствор) (Носитель), либо 5 мг/кг Е4 (Е4 5 мг/кг) или 50 мг/кг Е4 (Е4 50 мг/кг), либо не инъецировали (ложнооперированные). Показано среднее ± стандартная ошибка среднего (SEM) после умерщвления на сутки 14 после доставки 7 крысят из группы ложнооперированных, 11 крысят из группы носителя, 7 крысят из группы Е4 5 мг/кг и 5 крысят из группы Е4 50 мг/кг. Масштабная полоска: 2 мм.
Фиг. 3. Окрашивание гематоксилином-эозином срезов головного мозга области гиппокампа крысят. Головной мозг крысят извлекали после умерщвления на сутки 14 после доставки и фиксировали параформальдегидом, и образцы, заключенные в парафин, обрабатывали для получения срезов области гиппокампа и окрашивания гематоксилином-эозином. Крысятам инъецировали интраперитонеально с суток 4 по сутки 7 включительно после рождения: носитель (физиологический раствор) (Носитель), либо 5 мг/кг Е4 (Е4 5 мг/кг) или 50 мг/кг Е4 (Е4 50 мг/кг), либо не инъецировали (ложнооперированные).
Фиг. 4. Подсчет интактных клеток в срезах головного мозга крысят, окрашенных гематоксилином-эозином. Интактные клетки считали в гиппокампе в зоне зубчатой извилины (DG - dentate gyrus zone), субгранулярной зоне (SGZ - subgranular zone) и зоне Аммонова рога (СА1, СА2/СА3 - cornu ammonis) и в коре головного мозга на срезах головного мозга крысят, окрашенных гематоксилином-эозином. Интактные клетки считали при увеличении 400× в 3 полях соответствующей области головного мозга, и среднее выражали как число интактных клеток в поле зрения. Показано среднее ± SEM числа интактных клеток/поле зрения 7 крысят из группы ложнооперированных, 11 крысят из группы носителя, 7 крысят из группы Е4 5 мг/кг и 5 крысят из группы Е4 50 мг/кг.
Фиг. 5. Послеоперационные массы тела крысят, которые предварительно получали эстетрол. На каждые указанные сутки после рождения (ось X) 6 столбиков представляют собой, слева направо, послеоперационную массу тела (в г) крысят, которые были соответственно: не инъецированы ни носителем, ни Е4 (группа ложнооперированных, n=24), инъецированы интраперитонеально с суток 4 до суток 7 включительно после рождения: носителем (группа носителя, n=14), инъецированы интраперитонеально с суток 4 до суток 7 включительно после рождения 1 мг/кг Е4 (n=11), инъецированы интраперитонеально с суток 4 до суток 7 включительно после рождения 5 мг/кг Е4 (n=14), инъецированы интраперитонеально с суток 4 до суток 7 включительно после рождения 10 мг/кг Е4 n=(14) или инъецированы интраперитонеально с суток 4 до суток 7 включительно после рождения 50 мг/кг Е4 (n=19). На сутки 7 после рождения, через 30 минут после последней инъекции крысят подвергали гипоксически-ишемическому повреждению. Ложнооперированных крысят подвергали таким же процедурам без гипоксически-ишемического повреждения. Измерения выражены в виде среднего ± SEM.
Фиг. 6. Масса головного мозга крысят, которые предварительно получали эстетрол. Масса головного мозга (в г) крысят, которые не были инъецированы ни носителем, ни Е4 (группа ложнооперированных, n=24), или инъецированы интраперитонеально с суток 4 до суток 7 включительно после рождения носителем (группа носителя, n=14), 1 мг/кг Е4 (n=11), 5 мг/кг Е4 (n=14), 10 мг/кг Е4 (n=14) или 50 мг/кг Е4 (n=19). На сутки 7 после рождения, через 30 минут после последней инъекции, крысят подвергали гипоксически-ишемическому повреждению. Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения. Измерения выражены в виде среднего ± SEM.
Фиг. 7. Окрашивание гематоксилином-эозином коронарных срезов головного мозга и подсчет интактных клеток у крысят, предварительно получавших эстетрол. Крысят (а) не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=14), либо инъецировали интраперитонеально с суток 4 до суток 7 включительно после рождения: (b) носителем (группа носителя, n=16), (с) 1 мг/кг Е4 (n=10), (а) 5 мг/кг Е4 (n=13), (е) 10 мг/кг Е4 n=(10) или (f) 50 мг/кг Е4 (n=14). На сутки 7 после рождения, через 30 минут после последней инъекции, крысят подвергали гипоксически-ишемическому повреждению. Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения. Головной мозг извлекали после умерщвления на сутки 14 после рождения и фиксировали формальдегидом, и из образцов головного мозга, заключенных в парафин, получали коронарные срезы в области гиппокампа. Показано окрашивание гематоксилином-эозином (А) коронарных срезов головного мозга (масштабная полоска: 2 мм), (В) области гиппокампа (масштабная полоска: 100 мкм) и (С) коры головного мозга (масштабная полоска: 100 мкм) подопытных групп. (D) Интактные клетки подсчитывали в гиппокампе в зоне зубчатой извилины (DG), субгранулярной зоне (SGZ) и зоне Аммонова рога (СА1, СА2/СА3) и в коре головного мозга на коронарных срезах головного мозга крысят, окрашенных гематоксилином-эозином. Интактные клетки считали при увеличении 400× в 3 полях соответствующей области головного мозга, и среднее выражали как число интактных клеток в поле зрения. Для каждой указанной области головного мозга крысят (DG, SGZ, СА1, СА2/3, кора головного мозга на оси X) 6 столбиков представляют собой, слева направо, число интактных клеток в поле зрения, соответственно, крысят группы ложнооперированных, группы носителя, крысят, получавших 1 мг/кг Е4, крысят, получавших 5 мг/кг Е4, крысят, получавших 10 мг/кг Е4, или крысят, получавших 50 мг/кг Е4. Все измерения показаны в виде среднего ± SEM.
Фиг. 8. Окрашивание коронарных срезов головного мозга белком 2, ассоциированным с микротрубочками (МАР2 - microtubule-associated protein 2), крысят, предварительно получавших эстетрол. Крысят (а) не инъецировали ни носителем, ни Е4 (группа ложнооперированных), либо инъецировали интраперитонеально с суток 4 до суток 7 включительно после рождения (b) носителем (группа носителя), (с) 1 мг/кг Е4, (d) 5 мг/кг Е4, (е) 10 мг/кг Е4 или (f) 50 мг/кг Е4. На сутки 7 после рождения, через 30 минут после последней инъекции, крысят подвергали гипоксически-ишемическому повреждению. Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения. Головной мозг извлекали после умерщвления на сутки 14 после рождения и фиксировали формальдегидом, и из образцов головного мозга, заключенных в парафин, получали коронарные срезы в области гиппокампа. Для обнаружения нарушений цитоскелета нейронов срезы обрабатывали иммунологическим окрашиванием с антителом к МАР2. (А) Показано окрашивание МАР2 коронарных срезов головного мозга (масштабная полоска: 2 мм). (В) Долю МАР2-положительных областей вычисляли как площадь МАР2-положительной области ипсилатерального полушария, деленную на площадь МАР2-положительной области контралатерального полушария. Было проанализировано 10 образцов из каждой подопытной группы. Долю МАР2-положительной области в группе ложнооперированных по умолчанию считали равной 1.
Фиг. 9. Окрашивание даблкортином (DCX - Doublecortine) и фактором роста эндотелия сосудов (VEGF - Vascular Endothelial Growth Factor) в гиппокампе и коре головного мозга крысят, предварительно получавших эстетрол. Крысят не инъецировали ни носителем, ни Е4 (группа ложнооперированных), либо инъецировали интраперитонеально с суток 4 до суток 7 включительно после рождения носителем (группа носителя), 1 мг/кг Е4, 5 мг/кг Е4, 10 мг/кг Е4 или 50 мг/кг Е4. На сутки 7 после рождения, через 30 минут после последней инъекции, крысят подвергали гипоксически-ишемическому повреждению. Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения. Головной мозг извлекали после умерщвления на сутки 14 после рождения и фиксировали формальдегидом, и из образцов головного мозга, заключенных в парафин, получали коронарные срезы в области гиппокампа. Срезы подвергали двойному окрашиванию антителом к DCX и антителом к VEGF. Процент клеток, положительных по DCX (А) и VEGF (В), количественно определяли как сумму клеток, положительно окрашенных либо DCX, либо VEGF, деленную на суммарное число клеток, положительно окрашенных 4',6-диамидин-2-фенилиндолом (ДАПИ). Количественные определения проводили в различных областях гиппокампа ((зубчатой извилины (DG), Аммонова рога (СА1), Аммонова рога 2/3 (СА2/СА3)) и в коре головного мозга. Было проанализировано 10 образцов в группах ложнооперированных, 1 мг/кг Е4, 5 мг/кг Е4, 10 мг/кг Е4, 50 мг/кг Е4 и сравнивали с 12 образцами из группы носителя. Для каждой указанной области головного мозга (DG, СА1, СА2/3, кора головного мозга на оси X) 6 столбиков представляют собой, слева направо, процент клеток, положительных по DCX (А) или VEGF (В), соответственно, в группе ложнооперированных, в группе носителя, в группе 1 мг/кг Е4, в группе 5 мг/кг Е4, в группе 10 мг/кг Е4 или в группе 50 мг/кг Е4. Все измерения показаны в виде среднего ± SEM.
Фиг. 10. Экспрессия S100B и глиофибриллярного кислого белка (GFAP - Glial Fibrillary Acidic Protein) в сыворотке крови крысят, предварительно получавших эстетрол. Крысят не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=20 и n=21 для S100B и GFAP, соответственно), или инъецировали интраперитонеально с суток 4 до суток 7 включительно после рождения носителем (группа носителя, n=13 и n=15 для S100B и GFAP, соответственно), 1 мг/кг Е4 (n=10 и n=11 для S100B и GFAP, соответственно), 5 мг/кг Е4 (n=11 и n=11 для S100B и GFAP, соответственно), 10 мг/кг Е4 (n=13 и n=10 для S100B и GFAP, соответственно) или 50 мг/кг Е4 (n=19 и n=18 для S100B и GFAP, соответственно). На сутки 7 после рождения, через 30 минут после последней инъекции, крысят подвергали гипоксически-ишемическому повреждению. Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения. Образцы крови брали после умерщвления на сутки 14 после рождения. Для исследования концентрации S100B (А) и GFAP (В) в сыворотке крови проводили твердофазный иммуноферментный анализ (ELISA) на белки S100B и GFAP. Все измерения показаны в виде среднего ± SEM.
Фиг. 11. Послеоперационная масса тела крысят, которые получали эстетрол. На сутки 7 после рождения крысят подвергали гипоксически-ишемическому повреждению. После вывода из гипоксии крысят инъецировали интраперитонеально однократной дозой носителя (группа носителя, n=20), 1 мг/кг Е4 (n=16), 5 мг/кг Е4 n=19), 10 мг/кг Е4 (n=17) или 50 мг/кг Е4 (n=15). Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения и не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=29). На каждые указанные сутки после рождения (ось X) 6 столбиков представляют собой, слева направо, послеоперационную массу тела (в г) крысят, соответственно, из группы ложнооперированных, группы носителя, группы 1 мг/кг Е4, группы 5 мг/кг Е4, группы 10 мг/кг Е4 или группы 50 мг/кг Е4. Измерения выражены в виде среднего ± SEM.
Фиг. 12. Масса головного мозга крысят, получавших эстетрол. На сутки 7 после рождения крысят подвергали гипоксически-ишемическому повреждению. После вывода из гипоксии крысят инъецировали интраперитонеально однократной дозой носителя (группа носителя, n=20), 1 мг/кг Е4 (n=16), 5 мг/кг Е4 n=19), 10 мг/кг Е4 (n=17) или 50 мг/кг Е4 (n=15). Ложнооперированных животных подвергали таким же процедурам без гипоксически-ишемического повреждения, и их не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=29). Показана масса головного мозга крысят (в г). Измерения выражены в виде среднего ± SEM.
Фиг. 13. Окрашивание гематоксилином-эозином коронарных срезов головного мозга и подсчет интактных клеток у крысят, которые получали эстетрол. На сутки 7 после рождения крысят подвергали гипоксически-ишемическому повреждению. После вывода из гипоксии крысят инъецировали интраперитонеально однократной дозой (b) носителя (группа носителя, n=10), (с) 1 мг/кг Е4 (n=10), (а) 5 мг/кг Е4 (n=10), (е) 10 мг/кг Е4 (n=10) или (f) 50 мг/кг Е4 (n=10). Ложнооперированных животных (а) подвергали таким же процедурам без гипоксически-ишемического повреждения и не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=10). Головной мозг извлекали после умерщвления на сутки 14 после рождения и фиксировали формальдегидом, и образцы, заключенные в парафин, обрабатывали для получения коронарных срезов в области гиппокампа с последующим окрашиванием гематоксилином-эозином. Показано окрашивание гематоксилином-эозином (А) коронарных срезов головного мозга (масштабная полоска: 2 мм), (В) области гиппокампа (масштабная полоска: 100 мкм) и (С) коры головного мозга (масштабная полоска: 100 мкм). (D) Интактные клетки подсчитывали в различных областях гиппокампа: зубчатой извилины (DG), субгранулярной зоны (SGZ) и Аммонова рога (СА1, СА2/СА3) и в коре головного мозга на срезах головного мозга, окрашенных гематоксилином-эозином. Интактные клетки подсчитывали при увеличении 400х в 3 полях зрения соответствующей области головного мозга, и среднее значение выражено в виде числа интактных клеток на поле зрения. Для каждой указанной области головного мозга (DG, SGZ, СА1, СА2/3, кора головного мозга на оси X) 6 столбиков представляют собой, слева направо, число интактных клеток на поле зрения крысят, соответственно, из группы ложнооперированных, группы носителя, крысят, получавших 1 мг/кг Е4, крысят, получавших 5 мг/кг Е4, крысят, получавших 10 мг/кг Е4, или крысят, получавших 50 мг/кг Е4. Все измерения показаны в виде среднего ± SEM.
Фиг. 14. Окрашивание коронарных срезов головного мозга белком 2, ассоциированным с микротрубочками (МАР2), крысят, которые предварительно получали эстетрол. На сутки 7 после рождения крысят подвергали гипоксически-ишемическому повреждению. После вывода из гипоксии крысят инъецировали интраперитонеально однократной дозой (b) носителя (группа носителя, n=10), (с) 1 мг/кг Е4 (n=10), (а) 5 мг/кг Е4 (n=10), (е) 10 мг/кг Е4 (n=10) или (f) 50 мг/кг Е4 (n=10). Ложнооперированных животных (а) подвергали таким же процедурам без гипоксически-ишемического повреждения и не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=10). Головной мозг извлекали после умерщвления на сутки 14 после рождения и фиксировали формальдегидом, и из образцов головного мозга, заключенных в парафин, получали коронарные срезы в области гиппокампа. Для обнаружения нарушений цитоскелета нейронов срезы иммунологически окрашивали с антителом к МАР2. (А) Показано окрашивание МАР2 коронарных срезов головного мозга (масштабная полоска: 2 мм). (В) Долю МАР2-положительных областей вычисляли как площадь МАР2-положительной области ипсилатерального полушария, деленную на площадь МАР2-положительной области контралатерального полушария. Было проанализировано 10 образцов из каждой подопытной группы. Долю МАР2-положительной области в группе ложнооперированных по умолчанию считали равной 1,0.
Фиг. 15. Окрашивание даблкортином (DCX) и фактором роста эндотелия сосудов (VEGF) в гиппокампе и коре головного мозга крысят, предварительно получавших эстетрол. На сутки 7 после рождения крысят подвергали гипоксически-ишемическому повреждению. После вывода из гипоксии крысят инъецировали интраперитонеально однократной дозой носителя (группа носителя, n=10), 1 мг/кг Е4 (n=10), 5 мг/кг Е4 (n=10), 10 мг/кг Е4 (n=10) или 50 мг/кг Е4 (n=10). Ложнооперированных животных (а) подвергали таким же процедурам без гипоксически-ишемического повреждения и не инъецировали ни носителем, ни Е4 (группа ложнооперированных, n=10). Головной мозг извлекали после умерщвления на сутки 14 после рождения и фиксировали формальдегидом, и из образцов головного мозга, заключенных в парафин, получали коронарные срезы в области гиппокампа. Срезы подвергали двойному окрашиванию антителом к DCX и антителом к VEGF. Процент клеток, положительных по DCX (А) и VEGF (В), количественно определяли как сумму клеток, положительно окрашенных либо DCX, либо VEGF, деленную на суммарное число клеток, положительно окрашенных 4',6-диамидин-2-фенилиндолом (ДАПИ). Количественные определения проводили в различных областях гиппокампа ((зубчатой извилины (DG), Аммонова рога (СА1), Аммонова рога 2/3 (СА2/CA3)) и в коре головного мозга. Было проанализировано 10 образцов для каждой подопытной группы. Для каждой указанной области головного мозга (DG, СА1, СА2/3, кора головного мозга на оси X) 6 столбиков представляют собой, слева направо, процент клеток, положительных по DCX (А) или VEGF (В), соответственно, в группе ложнооперированных, в группе носителя, в группе 1 мг/кг Е4, в группе 5 мг/кг Е4, в группе 10 мг/кг Е4 или в группе 50 мг/кг Е4. Все измерения показаны в виде среднего ± SEM.
Фиг. 16. Экспрессия S100B и глиофибриллярного кислого белка (GFAP) в сыворотке крови крысят, которые получали эстетрол. На сутки 7 после рождения крысят подвергали гипоксически-ишемическому повреждению. После вывода из гипоксии крысят инъецировали интраперитонеально однократной дозой носителя (группа носителя, n=14 и n=16 для S100B и GFAP, соответственно)), 1 мг/кг Е4 (n=13 и n=15 для S100B и GFAP, соответственно), 5 мг/кг Е4 (n=16 и n=15 для S100B и GFAP, соответственно), 10 мг/кг Е4 (n=13 и n=13 для S100B и GFAP, соответственно) или 50 мг/кг Е4 (n=15 и n=14 для S100B и GFAP, соответственно). Ложнооперированных животных (а) подвергали таким же процедурам без гипоксически-ишемического повреждения и н