Композиция с противомикробным действием для хранения днк или днк-содержащих препаратов (варианты) и её применение
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии, а именно к буферным жидким композициям, предназначенным для хранения препаратов ДНК в жидком виде, а также для пропитки пористых носителей, используемых для сбора и хранения биологического материала. Композиции включают 0,5-4% N-лаурилсаркозина, 5-20 мМ ЭДТА, 30-200 мМ Трис (гидроксиметил) аминометана, 0,04-0,4% NaN3, а также эффективное количество антибактериального препарата и/или фунгицида, который представляет собой дифеноконазол, и воду. Антибактериальный препарат выбран из пефлоксацина, офлоксацина и кларитромицина. Композиции обладают усиленным противомикробным действием, не вызывают потерю композицией ДНК стабилизирующих свойств на протяжении 15, 30 и 60 минут инкубирования при +80°С по сравнению с водными растворами противомикробных препаратов с аналогичной концентрацией. 5 н. и 25 з.п. ф-лы, 5 ил., 8 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к буферной жидкой композиции, предназначенной для хранения препаратов ДНК в жидком виде, а также для пропитки пористых носителей, используемых для сбора и хранения биологического материала, обладающей противомикробным действием, обеспечивающей стабильность ДНК биообразцов в широком диапазоне температур в течение длительных периодов времени.
Уровень техники
Сбор и хранение биологического материала, в том числе, осуществляется для прямой и непрямой ДНК-идентификации в молекулярной генетике. Уничтожение биоматериала после его генотипирования представляется нецелесообразным, поскольку на сегодняшний день отсутствует единый российский стандарт генетических маркеров для ДНК-идентификации. Панель локусов имеет неуклонную тенденцию к расширению.
Хранение биологического материала, в частности сухой крови, на бумажном носителе является наиболее простым и экономически выгодным способом, поскольку в таком виде биообразцы могут находиться в условиях комнатной температуры без использования дорогостоящей техники. Бумажные носители с биообразцом должны быть хорошо высушены перед хранением, защищены от действия солнечного света, высокой температуры и влажности воздуха, поскольку наличие влаги, а также возможное развитие микробной флоры, ведет к деградации активной ДНК-матрицы. В судебно-медицинской практике ДНК-анализа широкой популярностью пользуются карточки FTA и FITZCO, Whatman Technology (патенты US 7498133 B2 и US 6645717). Фирмы производители этих карт используют специальный FTA-матрикс, позволяющий стабилизировать ДНК и оказывать антимикробный эффект. FTA-матрикс представляет собой смесь растворов (2% SDS (додецилсульфат натрия), 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан): 1 мл 20% SDS, 200 мкл 0,5 М ЭДТА, 600 мкл 1 М Трис довести до 10 мл стерильной деионизованной воды. SDS является мощным детергентом, за счет которого достигается антимикробный эффект. Однако авторами настоящего изобретения экспериментально доказан сильный ингибирующий эффект на ПЦР SDS, входящего в состав FTA-матрикса.
Применение в качестве твердого носителя бумаги зарубежного производства с FTA-матриксом (Whatman FTA Technology) позволяет хранить архивные образы крови и очищать ДНК от примесей белков и железосодержащих соединений. Связанная с FTA-матриксом ДНК освобождается от гема и других ингибиторов ПЦР простым отмыванием, после чего FTA-бумага с иммобилизованной на ней ДНК вводится непосредственно в соответствующую амплификационную смесь.
Однако проведенные авторами настоящего изобретения исследования показали, что очистка FTA-реагентом 15-летних образцов сухой крови на FTA-картах происходила гораздо хуже по сравнению с 2-дневными образцами. В 18% случаях после стандартной очистки FTA очищающим реагентом (FTA Purification Reagent (Fitzco, Inc), приготовление 500 мл: 0,29 г NaCl; 5 мл 1 М Трис рН 7,5; 1 мл 0,5 М ЭДТА; 2,5 мл Тритона-Х-100 (t-Dctylphenoxypolyethoxyethanol)) (патент US 6645717) 15-летних FTA-карт с кровью получены неполные генетические профили, в которых наблюдали не только отсутствие ПЦР-продуктов ряда локусов и выпадение аллелей, но и включение лишних аллелей.
Фирма производитель гарантирует срок хранения сухой крови на FTA-картах не менее 22 лет с сохранением качества ДНК. С другой стороны, ряд исследователей показал малую эффективность FTA-карт при длительном хранении биологических образцов. Так, Margaret С.Kline (2005) показала, что при 7-летнем хранении цельной крови на FTA-картах при +37°С происходит деградация высокомолекулярных STR-локусов. Alice J. Sigurdson и соавторы, показали, что ДНК буккального эпителия после его 7-летнего хранения при комнатной температуре на обработанных бумажных носителях не сохраняет свои качественные и количественные характеристики. При этом успешных амплификаций фрагмента гена β-глобина размером 268 н.п. удалось осуществить в 92,9% случаев, тогда как ПЦР-продукт того же гена, но размером 536 н.п., удалось получить только в половине случаев. Steven Wilkinson и соавторы также показали малую эффективность FTA-карт для длительного хранения ДНК.
По результатам исследований ряда авторов деградация высокомолекулярной ДНК-матрицы пятен крови, которым уже более 15 лет, на FTA-картах может препятствовать не только NGS-анализу (Next Generation Sequencing) (Sigurdson A.J., Ha M., Cosentino М., Franklin Т., Haque K.А., Qi Y., Glaser C., Reid Y., Vaught J.В., Bergen A.W. Long-term storage and recovery of buccal cell DNA from treated cards // Cancer Epidemiol Biomarkers Prev. 2006. Vol. 15. P. 385-388.), (Lee S.B., Crouse C.A., Kline M.C. Optimizing Storage and Handling of DNA Extracts // Forensic Science Review. 2010. Vol. 22. N 2. P. 131-144.) - будущему судебно-медицинскому «золотому стандарту», позволяющему одновременно исследовать большое количество ДНК-маркеров (Roewer L. DNA fingerprinting in forensics: past, present, future // Investig. Genet. 2013. Vol. 4. N 1. P. 22-31).
В патенте RU 2322058 предлагается способ консервации биологических образцов, обеспечивающий сохранность нуклеиновых кислот. Представляет собой способ выделения нуклеиновых кислот, включающий получение лизата смешиванием биологического материала с консервирующим раствором, содержащим соединение гуанидина. Консервирующий раствор стабилен при +20°С только в течение 2 месяцев, однако при понижении температуры ниже +20°С из раствора выпадают кристаллы, которые растворимы нагреванием. Образование кристаллов и необходимое нагревание раствора способствует разрушению активной ДНК-матрицы.
В заявках RU 2006139643 и RU 2006139035 предлагаются способ сбора, хранения и транспортировки биологических образцов и устройство для его осуществления и объединение процессов хранения образцов и управление образцами в медико-биологических науках, включающие в себя этап регидратации биологического образца на матрице с помощью восстанавливающего буфера, который содержит однократный физиологический раствор с фосфатным буфером (PBS) или воду без нуклеазы, куда может быть добавлен азид натрия. Однако такой восстанавливающий буфер может ингибировать ПЦР, образуя нерастворимый в воде фосфат магния (Mg3(PO4)2), либо малорастворимый гидроортофосфат магния (MgHPO4) Фосфатные соли магния растворимы только в сильных неорганических кислотах, что неизбежно приведет к деградации ДНК. Предлагается объединение процессов хранения образцов и управление образцами в медико-биологических науках (заявка RU 2008126716 A), представляя собой способ хранения биологического материала только в сухом виде. Матрица содержит различные ингибиторы, поливиниловый спирт.
Предлагаются композиции и способ для выделения нуклеиновых кислот из любых комплексных исходных материалов и последующий комплексный генный анализ (заявка RU 2001118287), что представляет собой способ экстракции ДНК, не обеспечивая ее длительного хранения.
Ранее авторами предложены буферные жидкие композиции, предназначенные для хранения препаратов ДНК в жидком виде, а также для пропитки пористых носителей, используемых для сбора и хранения биологического материала, обеспечивающие стабильность ДНК биообразцов в широком диапазоне температур в течение длительных периодов времени (патент RU 2567145). Данные буферные композиции обладали противомикробным действием за счет содержания 0,04-0,4% NaN3 (натрия азида), оказывающего выраженный антимикробный и антимикотический эффект без ингибирования ПЦР.
Раскрытие изобретения
В настоящем изобретении предложены:
(1) Композиция для хранения ДНК или ДНК-содержащих препаратов, содержащая буферный раствор, включающий 0,5-4% N-лаурилсаркозина, 5-20 мМ ЭДТА, 30-200 мМ Трис (гидроксиметил) аминометана, 0,04-0,4% NaN3 (азида натрия), а также эффективное количество антибактериального препарата и/или фунгицида, вода - остальное.
(2) Композиция (1), где антибактериальный препарат выбран из пефлоксацина, офлоксацина и кларитромицина.
(3) Композиция (3), где офлоксацин представляет собой левофлоксацин.
(4) Композиция (1) или (2), где количество антибактериального препарата составляет от 0,01 до 5%.
(5) Композиция (1) или (2), где количество антибактериального препарата составляет от 0,01 до 0,8%.
(6) Композиция (1) или (2), где количество антибактериального препарата составляет от 0,05% до 5%.
(7) Композиция (1), где фунгицид представляет собой дифеноконазол.
(8) Композиция (1) или (7), где количество фунгицида составляет от 0,01 до 2,5%.
(9) Композиция (1), где ДНК-содержащий препарат представляет собой биообразец.
(10) Композиция (9), где соотношение буфера и биообразца составляет 10:1.
(11) Композиция (9) или (10), где биообразец представляет собой жидкую кровь или слюну.
(12) Композиция для хранения ДНК-содержащих препаратов или ДНК, содержащая буферный раствор, включающий 0,5-4% N-лаурилсаркозина, 5-20 мМ ЭДТА, 30-200 мМ Трис (гидроксиметил) аминометана, 0,04-0,4% NaN3 (азида натрия), 0,01-0,8% пефлоксацина, 0,01-2,5% дифеноконазола, вода - остальное.
(13) Композиция (12), где буферный раствор представляет собой смесь растворов: 1 мл 20%-ного N-лаурилсаркозина, 200 мкл 0,5М ЭДТА (этилендиамин-N,N,N',N'-тетраацетата), 600 мкл 1М Трис, 1 мл 10 мг/мл NaN3 (азида натрия), 80 мг пефлоксацина, 250 мг дифеноконазола, доведенную до 10 мл стерильной деионизованной водой.
(14) Композиция (12), где ДНК-содержащий препарат представляет собой биообразец.
(15) Композиция (14), где соотношение буфера и биообразца составляет 10:1.
(16) Композиция (14) или (15), где биообразец представляет собой жидкую кровь или слюну.
(17) Композиция для хранения ДНК-содержащих препаратов или ДНК, содержащая буферный раствор, включающий 0,5-4% N-лаурилсаркозина, 5-20 мМ ЭДТА, 30-200 мМ Трис (гидроксиметил) аминометана, 0,04-0,4% NaN3 (азида натрия), 0,01-0,8% офлоксацина (левофлоксацина), 0,01-2,5% дифеноконазола, вода - остальное.
(18) Композиция (17), где буферный раствор представляет собой смесь растворов: 1 мл 20%-ного N-лаурилсаркозина, 200 мкл 0,5М ЭДТА (этилендиамин-N,N,N',N'-тетраацетата), 600 мкл 1М Трис, 1 мл 10 мг/мл NaN3 (азида натрия), 20 мг офлоксацина (левофлоксацина), 250 мг дифеноконазола, доведенную до 10 мл стерильной деионизованной водой.
(19) Композиция (17), где ДНК-содержащий препарат представляет собой биообразец.
(20) Композиция (19), где соотношение буфера и биообразца составляет 10:1.
(21) Композиция (19) или (20), где биообразец представляет собой жидкую кровь или слюну.
(22) Композиция для хранения ДНК-содержащих препаратов или ДНК, содержащая буферный раствор, включающий 0,5-4% N-лаурилсаркозина, 5-20 мМ ЭДТА, 30-200 мМ Трис (гидроксиметил) аминометана, 0,04-0,4% NaN3 (азида натрия), 0,05-5% кларитромицина, 0,01-2,5% дифеноконазола, вода - остальное.
(23) Композиция (22), где буферный раствор представляет собой смесь растворов: 1 мл 20% N-лаурилсаркозина, 200 мкл 0,5М ЭДТА (этилендиамин-N,N,N',N'-тетраацетата), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азида натрия), 500 мг кларитромицина, 250 мг дифеноконазола, доведенную до 10 мл стерильной деионизованной водой.
(24) Композиция (22), где ДНК-содержащий препарат представляет собой биообразец.
(25) Композиция (24), где соотношение буфера и биообразца составляет 10:1.
(26) Композиция (24) или (25), где биообразец представляет собой жидкую кровь или слюну.
(27) Применение композиций (1)-(26) для пропитки пористых носителей для хранения и/или транспортировки ДНК-содержащих препаратов или ДНК.
(28) Применение (27), где пористый носитель представляет собой бумагу.
(29) Применение (27), где ДНК-содержащий препарат представляет собой жидкий биообразец.
(30) Применение (27), где ДНК-содержащий препарат или ДНК находятся в сухом виде.
I. Объекты настоящего изобретения представляют собой композиции, обладающие противомикробной активностью, предназначенные для пропитки пористых носителей, например, бумаги, сохраняющие ДНК биообразцов в сухом виде в широком диапазоне температур (вплоть до +70°С) в течение длительных периодов времени.
Знак «%» как используется в настоящем изобретении, означает процентное содержание по массе указанного компонента в указанной композиции, буфере.
Одним из постоянных составляющих буферных композиций является 0,5-4% N-лаурилсаркозин, являющийся наиболее мягким детергентом, не приводящим к ингибированию ПЦР.
Также, постоянным составляющим композиций является 5-20 мМ ЭДТА (этилендиамин-N,N,N',N'-тетраацетат). В животных тканях в больших количествах присутствуют ионы Fe2+ и Fe3+ в составе гемоглобина и высвобождающиеся при его денатурации. Константа связывания ЭДТА с ионами железа составляет ≈ 10-14 М-1 (Fe2+) и ≈ 10-24 М-1 (Fe3+) (Sillen, L.G., Martell, А.Е. Stability Constants of Metallon Complexes. The Chemical Society, London, 1964). Таким образом, благодаря наличию ЭДТА в составе буфера устраняется ингибиторный эффект ионов железа, оказываемый на ПЦР.
Слабощелочная среда наиболее оптимальна для хранения препаратов ДНК. Поэтому для создания буферной емкости и поддержания слабощелочного значения рН использовался раствор Триса (30 - 200 мМ Трис (гидроксиметил) аминометан).
0,04-0,4% NaN3 (азид натрия), входящий в состав буферных композиций, оказывает выраженный антимикробный и антимикотический эффект без ингибирования ПЦР.
К офлоксацину, обладающему выраженным антимикробным эффектом, чувствительны следующие патогенные бактерии: Staphylococcus aureus, Staphylococcus epidermidis, Neisseria gonorrhoeae, Neisseria meningitidis, Neisseria flavescens, Escherichia coli, Citrobacter, Klebsiella spp. (включая Klebsiella pneumonia), Enterobacter spp., Hafnia, Proteus spp. (включая Proteus mirabilis, Proteus vulgaris - индол-положительные и индол-отрицательные), Salmonella spp., Shigella spp.(включая Shigella sonnei), Yersinia enterocolitica, Campilobacter jejuni, Aeromonas hydrophila, Plesiomonas aeruginosa, Vibrio cholerae, Vibrio parahaemolyticus, Haemophilus influenzae, Chlamydia spp., Legionella spp., Serratia spp., Providencia spp., Haemophilis ducreyi, Bordetella parapertussis, Bordetella pertussis, Moraxella catarrhalis, Propionibacterium acnes, Staphylococcus spp., Brucella spp.Многие из данных бактерий входят в состав микрофлоры кожи и слизистых человека, а также встречаются в окружающей среде. В связи с этим они могут привести к контаминации ДНК образца в буферной композиции.
Офлоксацин является достаточно стабильным препаратом. Кристаллическая форма имеет температуру плавления около +250°С. Его водные растворы стабильны как минимум в течение 14 дней (Mohammed A. Al-Omar, Ofloxacin. In Harry G. Brittain editor: Profiles of Drug Substances, Excipients, and Related Methodology, Vol. 34. Burlington: Academic Press, 2009, pp. 265-298.).
В связи с тем, что офлоксацин является рацемической смесью, известно, что идентичным по физико-химическим свойствам, но более высокой антимикробной активностью обладает левофлоксацин. Таким образом, в композициях замена офлоксацина на левофлоксацин приведет к увеличению антимикробных свойств, при сохранении поведения вещества в буферной композиции.
Пефлоксацин активен в отношении большинства аэробных грамотрицательных бактерий: Escherichia coli, Klebsiella spp., индол-положительных и индол-отрицательных Proteus spp., в том числе, Proteus mirabilis, Enterobacter spp., Morganella morganii, Yersinia enterocolitica, Vibrio cholerae, Vibrio parahaemolyticus, Neisseria gonorrhoeae, Neisseria meningitidis, Haemophilus influenzae, Pseudomonas aeruginosa, Moraxella catarrhalis, Pasteurella multocida, Campylobacter spp., Serratia spp., Citrobacter spp., Salmonella spp., Shigella spp., Haemophilus spp., в отношении аэробных грамположительных бактерий - Staphylococcus spp.(в том числе, продуцирующие и не продуцирующие пенициллиназу и метициллинрезистентные), Streptococcus spp., в том числе, Streptococcus pyogenes, Streptococcus agalactiae, Corynebacterium diphtheriae, Listeria monocytogenes, в отношении внутриклеточных бактерий: Legionella pneumophila, Brucella spp., Chlamydia spp., а также в отношении бактерий, вырабатывающих бета-лактамазы. Подавляет жизнедеятельность Mycoplasma spp., Helicobacter. Аналогично офлоксацину является производным фторхинолонов, в связи с чем проявляет схожую физико-химическую устойчивость.
Кларитромицин активен в отношении многих микроорганизмов, в том числе, внутриклеточных (Mycoplasma pneumoniae, Legionella pneumophila, Chlamydia trachomatis и Chlamydia pneumoniae, Ureaplasma urealyticum), грамположительных -Staphylococcus spp., Streptococcus spp.(в том числе, Streptococcus pyogenes, Streptococcus pneumoniae), Listeria monocytogenes, Corynebacterium spp., и грамотрицательных бактерий (Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus ducreyi, Moraxella catarrhalis, Bordetella pertussis, Neisseria meningitidis, Borrelia burgdorferi, Pasteurella multocida, Campylobacter spp., Helicobacter pylori), некоторых анаэробов (Eubacterium spp., Peptococcus spp., Propionibacterium spp., Clostridium perfringens, Bacteroides melaninogenicus), Toxoplasma gondii, Mycoplasma pneumoniae, микобактерий (Mycobacterium avium complex, включающий Mycobacterium avium и Mycobacterium intracellulare).
Кларитромицин относится к наиболее стабильным среди макролидов препаратам (его стабильность в 100 раз выше, чем у эритромицина).
Дифеноконазол является фунгицидом широкого спектра действия, активным в отношении грибов классов аскомицетов, базидиомицетов и дейтеромицетов. Препарат обладает крайне высокой стабильностью (до +300°С) (Андреева Е.И., Зинченко В.А. Системные фунгициды - ингибиторы биосинтеза эргостерина.// «АгроXXI», №4, 2002, с. 14-15).
Настоящее изобретение представляет собой комбинации вышеперечисленных компонентов в буфере:
1. Буферная жидкая композиция (1) представляет собой смесь растворов (0,5-4% N-лаурилсаркозин, предпочтительно 2%, 5-20 мМ ЭДТА, предпочтительно 10 мМ, 30-200 мМ Трис (гидроксиметил) аминометан, предпочтительно 60 мМ, 0,04-0,4% NaN3 (азид натрия), предпочтительно 0,1%, 0,01-0,8% пефлоксацин, предпочтительно 0,1%, 0,01-2,5% дифеноконазол, предпочтительно 0,1%). Например, смесь 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, 250 мг дифеноконазол, доведенную до 10 мл стерильной деионизованной водой.
2. Буферная жидкая композиция (2) представляет собой смесь растворов (0,5-4% N-лаурилсаркозин, предпочтительно 2%, 5-20 мМ ЭДТА, предпочтительно 10 мМ, 30-200 мМ Трис (гидроксиметил) аминометан, предпочтительно 60 мМ, 0,04-0,4% NaN3 (азид натрия), предпочтительно 0,1%, 0,01-0,8% офлоксацин (левофлоксацин), предпочтительно 0,1%, 0,01-2,5% дифеноконазол, предпочтительно 0,1%). Например, смесь 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), 250 мг дифеноконазол, доведенную до 10 мл стерильной деионизованной водой.
3. Буферная жидкая композиция (3) представляет собой смесь растворов (0,5-4% N-лаурилсаркозин, предпочтительно 2%, 5-20 мМ ЭДТА, предпочтительно 10 мМ, 30-200 мМ Трис (гидроксиметил) аминометан, предпочтительно 60 мМ, 0,04-0,4% NaN3 (азид натрия), предпочтительно 0,1%, 0,05-5% кларитромицин, предпочтительно 0,1%, 0,01-2,5% дифеноконазол, предпочтительно 0,1%). Например, смесь 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 500 мг кларитромицин, 250 мг дифеноконазол, доведенную до 10 мл стерильной деионизованной водой.
Пористый предмет-носитель замачивается в одной из трех вышеуказанных буферных жидких композициях путем полного погружения на 3 минуты, после чего высушивается при комнатной температуре. На предмет-носитель наносится биологическая жидкость (кровь, слюна и т.д.) в количестве 50-100 мкл в пересчете на площадь от 3 см2 до 12 см2 при толщине бумажного носителя от 0,15 до 1,0 мм, после чего также подвергается высушиванию при комнатной температуре.
Таким образом, настоящее изобретение относится к композициям, сохраняющим стабильной ДНК биообразцов на пористых носителях, обеспечивая наиболее длительное хранение препаратов ДНК в широком температурном диапазоне (не менее 40 лет хранения при температуре до +20°С).
II. Еще одним объектом настоящего изобретения является способ хранения препаратов ДНК в стабильной форме в жидкой композиции для хранения, включающий в себя:
(i) добавление буферной жидкой композиции по настоящему изобретению в качестве разбавителя на заключительном этапе выделения ДНК;
(ii) смешивание очищенного образца ДНК и буферного раствора по настоящему изобретению в соотношении 1:10; и
(iii) хранение препарата ДНК.
Объекты настоящего изобретения представляет собой жидкие буферные композиции для хранения препаратов ДНК в жидком виде в широком диапазоне температур (до +70°С) в течение длительных периодов времени.
Настоящее изобретение представляет собой комбинации вышеперечисленных компонентов в буфере:
1. Буферная жидкая композиция (1) представляет собой смесь растворов (0,5-4% N-лаурилсаркозин, предпочтительно 2%, 5-20 мМ ЭДТА, предпочтительно 10 мМ, 30-200 мМ Трис (гидроксиметил) аминометан, предпочтительно 60 мМ, 0,04-0,4% NaN3 (азид натрия), предпочтительно 0,1%, 0,01-0,8% пефлоксацин, предпочтительно 0,1%, 0,01-2,5% дифеноконазол, предпочтительно 0,1%): 1 мл 20% N-лаурилсаркозина, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетата), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азида натрия), 80 мг пефлоксацина, 250 мг дифеноконазола, доведенную до 10 мл стерильной деионизованной водой.
2. Буферная жидкая композиция (2) представляет собой смесь растворов (0,5-4% N-лаурилсаркозин, предпочтительно 2%, 5-20 мМ ЭДТА, предпочтительно 10 мМ, 30-200 мМ Трис (гидроксиметил) аминометан, предпочтительно 60 мМ, 0,04-0,4% NaN3 (азид натрия), предпочтительно 0,1%, 0,01-0,8% офлоксацин (левофлоксацин), предпочтительно 0,1%, 0,01-2,5% дифеноконазол, предпочтительно 0,1%): 1 мл 20% N-лаурилсаркозина, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетата), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азида натрия), 20 мг офлоксацина (левофлоксацина), 250 мг дифеноконазола, доведенную до 10 мл стерильной деионизованной водой.
3. Буферная жидкая композиция (3) представляет собой смесь растворов (0,5-4% N-лаурилсаркозин, предпочтительно 2%, 5-20 мМ ЭДТА, предпочтительно 10 мМ, 30-200 мМ Трис (гидроксиметил) аминометан, предпочтительно 60 мМ, 0,04-0,4% NaN3 (азид натрия), предпочтительно 0,1%, 0,05-5% кларитромицин, предпочтительно 0,1%, 0,01-2,5% дифеноконазол, предпочтительно 0,1%): 1 мл 20% N-лаурилсаркозина, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетата), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азида натрия), 500 мг кларитромицина, 250 мг дифеноконазола, доведенную до 10 мл стерильной деионизованной водой.
Таким образом, настоящее изобретение относится к жидкой композиции, сохраняющей стабильной ДНК, содержащей ДНК и один из трех вышеперечисленных буферных растворов в соотношении 1:10, обеспечивая противомикробную защиту и наиболее длительное хранение препаратов ДНК в широком температурном диапазоне.
Дополнительные объекты и преимущества изобретения указаны в следующем далее разделе описания и частично становятся очевидными из описания или могут быть изучены при применении изобретения. Объекты и преимущества изобретения понимают и реализуют при помощи подробно перечисленных в прилагаемой формуле изобретения элементов и сочетаний.
Следует понимать, что в рамках заявленного изложенное выше общее описание и следующее далее подробное описание являются лишь иллюстративными и поясняющими и не ограничивают объем изобретения. Дополняющие включенные и составляющие часть данного описания Фигуры иллюстрируют некоторые варианты преимущества изобретения и вместе с описанием помогают объяснить принципы изобретения.
Краткое описание чертежей
На Фиг. 1 показаны результаты электрофореза в 0,8% геле агарозы препаратов ДНК в жидких буферных композициях, иллюстрирующие сохранение композициями стабилизирующих свойств без потери ДНК при инкубировании.
На Фиг. 2 показаны результаты электрофореза в 0,8% геле агарозы препаратов ДНК в жидких буферных композициях, иллюстрирующие отсутствие усиления деградации ДНК относительно контрольного образца, при введении в композицию однократного и двукратного буфера противомикробных препаратов.
На Фиг. 3 и Фиг. 4 показаны результаты сравнительного исследования противомикробной активности жидких буферных композиций в отношении St. Aureus (1), St. Epidermidis (2), E.Coli (3), дрожжей рода Candida (4), плесневых грибов p. Penicillium (5) и Asp. Niger (6).
На Фиг. 5 показано отсутствие ингибиторного действия на ПЦР «в реальном времени» антибиотиков (пефлоксацина, офлоксацина (левофлоксацина), кларитромицина) (1) и фунгицида (дифеноконазола) (2).
Осуществление изобретения
Пример 1.
Проводили сравнительное исследование деградации ДНК в жидких буферных композициях: композиции (10), описанной в патенте RU 2567145, в комбинациях противомикробных препаратов, растворенных в композиции (10) и в водном растворе, при помощи электрофореза в 0,8% геле агарозы.
Состав жидкой буферной композиции 1 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% офлоксацин (левофлоксацин)): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 2 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% офлоксацин (левофлоксацин), 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 3 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% пефлоксацин): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 4 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% пефлоксацин, 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 5 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% кларитромицин, 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 500 мг кларитромицин, 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 6 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 7 (буферная жидкая композиция (10), описанная в патенте RU 2567145) (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия)): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), доведенная до 10 мл стерильной деионизованной водой.
Готовили соответствующие шесть водных растворов противомикробных препаратов, в которых композиция (10), описанная в патенте RU 2567145), заменена стерильной деионизованной водой (смеси 8-13).
Состав смеси 8 (0,1% офлоксацин (левофлоксацин)): 20 мг офлоксацин (левофлоксацин), доведенной до 10 мл стерильной деионизованной водой.
Состав смеси 9 (0,1% офлоксацин (левофлоксацин), 0,1% дифеноконазол): 20 мг офлоксацин (левофлоксацин), 250 мг дифеноконазол, доведенной до 10 мл стерильной деионизованной водой.
Состав смеси 10 (0,1% пефлоксацин): 80 мг пефлоксацин, доведенной до 10 мл стерильной деионизованной водой.
Состав смеси 11 (0,1% пефлоксацин, 0,1% дифеноконазол): 80 мг пефлоксацин, 250 мг дифеноконазол, доведенной до 10 мл стерильной деионизованной водой.
Состав смеси 12 (0,1% кларитромицин, 0,1% дифеноконазол): 500 мг кларитромицин, 250 мг дифеноконазол, доведенной до 10 мл стерильной деионизованной водой.
Состав смеси 13 (0,1% дифеноконазол): 250 мг дифеноконазол, доведенной до 10 мл стерильной деионизованной водой.
Контрольная проба 14 представляет собой деионизованную воду.
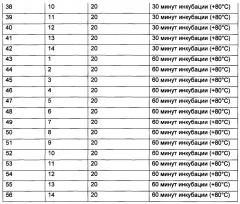
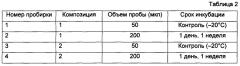
В отдельные стерильные ПЦР-пробирки объемом 0,2 мл помещали по 20 мкл соответствующей смеси (1-14) (табл. 1).
В качестве генетического материала использовали стандартную ДНК K562 (Promega) в концентрации 500 нг/мкл. В пробирки с каждым буфером добавляли ДНК в количестве, необходимом для создания конечной концентрации ДНК 25 нг/мкл. Смеси тщательно перемешивали на вортексе при низких оборотах (примерно 500-1.200g) 5 секунд, затем кратко центрифугировали. Контрольные препараты (номера пробирок 1-14) оставляли при +20°С. Остальные смеси инкубировали при +80°С в термоциклере GeneAmp® PCR System 9700 (Applied Biosystems) с нагревающейся до +103°С крышкой, что исключало образование конденсата на внутренних поверхностях крышек пробирок, в течение 15 минут (15-28), 30 минут (29-42) и 60 минут (43-56).
Готовили однократный ТВЕ-буфер в объеме, достаточном для заполнения камеры электрофореза и приготовления геля. Добавляли к однократному ТВЕ-буферу порошок агарозы (Agarose helicon) в количестве, необходимом для получения 0,8% раствора и нагревали в микроволновой печи до полного ее расплавления. Полученный жидкий раствор охлаждали до +50…+60°С, добавляли бромистый этидий до конечной концентрации 0,5 мкг/мл и осторожно перемешивали, избегая появления в геле пузырьков воздуха. Теплую агарозу выливали в соответствующую форму и следили за тем, чтобы она равномерно распределилась по форме. Вертикально вставляли гребенку так, чтобы ее зубцы не доставали до дна примерно 1 мм. Оставляли кювету с агарозным гелем на 30 минут, затем осторожно удаляли гребенку. Кювету с гелем помещали в электрофорезную камеру, содержащую необходимое количество однократного ТВЕ-буфера. Подготавливали к электрофорезу исследуемые образцы, смешивая их с шестикратным буфером для нанесения (5:1, о/о), содержащим бромфеноловый синий и ксиленцианол в 30% растворе глицерина. Аккуратно вносили образцы в соответствующие лунки геля. В качестве размерного стандарта использовали ДНК фага Л, обработанную рестриктазой Hindi II (маркер молекулярных масс Lambda DNA/HindIII) (дорожки L). Электрофорез проводили при постоянном напряжении (5-7 В/см) в течение 40 минут (до тех пор пока бромфеноловый синий не дойдет до конца геля). Помещали гель в УФ-трансиллюминатор и фотографировали.
Результаты электрофореза препаратов ДНК в жидких буферных композициях в 0,8% геле агарозы представлены на Фиг. 1.
Неожиданно было обнаружено, что введение в композицию, описанную в патенте RU 2567145 как буферная жидкая композиция (10), антибактериальных препаратов (пефлоксацин, офлоксацин (левофлоксацин), кларитромицин) и фунгицидов (дифеноконазол), а также их комбинаций не вызывает потерю композицией ДНК стабилизирующих свойств на протяжении 15, 30 и 60 минут инкубирования при +80°С по сравнению с водными растворами данных противомикробных препаратов с аналогичной концентрацией.
Пример 2.
Проводили сравнительное исследование деградации ДНК в жидких буферных композициях: однократной и двукратной композиции (10), описанной в патенте RU 2567145, в комбинации с противомикробными препаратами, при помощи электрофореза в 0,8% геле агарозы.
Состав жидкой буферной композиции 1 (буферная жидкая композиция (10), описанная в патенте RU 2567145) (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия)): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 2 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% пефлоксацин): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 3 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% кларитромицин): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 500 мг кларитромицин, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 4 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% офлоксацин (левофлоксацин)): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 5 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 6 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% пефлоксацин, 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 7 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% офлоксацин (левофлоксацин), 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 8 (2% N-лаурилсаркозин, 10 мМ ЭДТА, 60 мМ Трис (гидроксиметил) аминометан, 0,1% NaN3 (азид натрия), 0,1% кларитромицин, 0,1% дифеноконазол): смесь растворов 1 мл 20% N-лаурилсаркозин, 200 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 600 мкл 1 М Трис, 1 мл 10 мг/мл NaN3 (азид натрия), 500 мг кларитромицин, 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 9 (двукратная буферная жидкая композиция (10), описанная в патенте RU 2567145) (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия)): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 10 (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия), 0,1% пефлоксацин): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 11 (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия), 0,1% кларитромицин): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), 500 мг кларитромицин, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 12 (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия), 0,1% офлоксацин (левофлоксацин)): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 13 (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия), 0,1% дифеноконазол): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 14 (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия), 0,1% пефлоксацин, 0,1% дифеноконазол): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), 80 мг пефлоксацин, 250 мг дифеноконазол, доведенная до 10 мл стерильной деионизованной водой.
Состав жидкой буферной композиции 15 (4% N-лаурилсаркозин, 20 мМ ЭДТА, 120 мМ Трис (гидроксиметил) аминометан, 0,2% NaN3 (азид натрия), 0,1% офлоксацин (левофлоксацин), 0,1% дифеноконазол): смесь растворов 2 мл 20% N-лаурилсаркозин, 400 мкл 0,5 М ЭДТА (этилендиамин-N,N,N',N'-тетраацетат), 1200 мкл 1 М Трис, 2 мл 10 мг/мл NaN3 (азид натрия), 20 мг офлоксацин (левофлоксацин), 250 м