Комбинированная терапия иммуноцитокинами
Иллюстрации
Показать всеИзобретение относится к области биохимии. Заявлен способ лечения опухоли кожи у пациента путем инъекционного введения однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2 в место локализации опухоли, причем инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 осуществляют одновременно. Иммуноконъюгат ФНОα содержит ФНОα, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина. Иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина. Также изобретение относится к композициям для лечения опухоли кожи, содержащим указанный иммуноконъюгат ФНОα и/или указанный иммуноконъюгат ИЛ-2. Изобретение обеспечивает стимулирование полного уничтожения больших подкожных опухолей однократным локальным введением комбинации иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2. 4 н. и 38 з.п. ф-лы, 4 ил.
Реферат
Область техники
Данное изобретение относится к комбинированной терапии опухолей, в которой непосредственно в место локализации опухоли вводят иммуноконъюгат ФНОα (фактор некроза опухоли-альфа, TFNα) и иммуноконъюгат ИЛ-2 (интерлейкин-2, IL2).
Предшествующий уровень техники
Фактор некроза опухоли альфа (ФНОα) представляет собой цитокин, вырабатываемый многими типами клеток, в первую очередь активированными моноцитами и макрофагами. Он экспрессируется в виде интегрального трансмембранного белка-предшественника массой 26 кДа, из которого в результате протеолитического расщепления высвобождается зрелый белок массой приблизительно 17 кДа. Растворимый, биологически активный ФНОα представляет собой гомотример, который связывается с рецепторами поверхности клеток. Было показано, что ФНОα индуцирует некроз солидных опухолей. Он оказывает свое действие главным образом на эндотелий ассоциированной с опухолью сосудистой системы, увеличивая проницаемость, повышая уровень тканевого фактора, способствуя отложению фибрина, тромбозу и массовому разрушению эндотелиальных клеток.
Интерлейкин-2 (ИЛ-2), цитокин из пучка четырех a-спиралей, вырабатываемый Т-хэлперами 1, играет существенную роль в фазах активации как адаптивного, так и врожденного иммунных ответов. Несмотря на то, что не считают, что он оказывает прямой цитотоксический эффект на раковые клетки, сообщалось, что он вызывает регрессию опухоли за счет стимулирования клеточно-опосредованного иммунного ответа.
Внутриопухолевые инъекции ИЛ-2 испытали на пациентах с метастатической меланомой [1]. В том исследовании средство лечения вводили три раза в неделю в течение по меньшей мере 2 недель, и сообщалось, что у 69% общего числа пациентов достигался полный ответ.
В WO 01/66298 описаны иммуноконъюгаты, содержащие ФНОα и ИЛ-2 соответственно, слитые с антителом L19. L19 специфично связывается с доменом ED-B изоформы фибронектина B-FN, которая является одним из самых известных маркеров ангиогенеза (США 10/382107; WO 01/62298). ED-B является дополнительным доменом, состоящим из 91 аминокислоты, присутствующем в изоформы B-FN, и является идентичным у мыши, крысы, кролика, собаки и человека. B-FN накапливается вокруг неоваскулярных структур в быстрорастущих опухолях и других тканях, где происходит ангиогенез, таких как эндометрий в фазе пролиферации, и вокруг некоторых структур глаза в патологических условиях, но в иных случаях не детектируется в нормальных тканях у взрослых.
Carnemolla et al. [2] описали усиление противоопухолевых свойств ИЛ-2 в результате его направленной доставки во внеклеточной матрикс кровеносных сосудов опухоли в виде иммуноконъюгата L19-ИЛ-2.
Christ et al. [3] описали внутриопухолевое введение иммуноконъюгата ИЛ-2, иммуноконъюгата ФНОα или антитела отдельно. Используемое антитело представляло собой антитело против EGFR (рецептора эпидермального фактора роста), обладающее противоопухолевым эффектом. Противоопухолевый иммунный ответ был описан после многократных инъекций каждого из слитых белков.
Borsi et al. [4] сообщали об исследовании, в котором мышам внутривенно вводили иммуноконъюгаты L19-ФНОα и L19-ИЛ-2 в дни 7 и 10 после имплантации опухолевых клеток. L19 применяли для концентрирования и максимизации противоопухолевых эффектов системно доставляемых цитокинов. Сообщалось, что комбинация иммуноцитокинов обладает синергическим действием на объем опухоли. У мышей, которые получали комбинированное лечение, объем опухоли был значительно ниже, чем у мышей, которые получали только один иммуноцитокин.
Краткое описание изобретения
Здесь описаны неожиданные эффекты на опухоли, происходящие в результате локального введения в место локализации опухоли комбинации иммуноцитокинов, ФНОα-L19 и ИЛ-2-L19. Однократное введение двух данных иммуноцитокинов стимулировало полное уничтожение больших подкожных опухолей у мышей.
Мыши получали одну внутриопухолевую инъекцию ФНОα-L19, одну внутриопухолевую инъекцию ИЛ-2-L19 или комбинацию. Дополнительных средств лечения не применяли. Объем опухоли измеряли ежедневно, и наблюдали, что опухоли у мышей, которые получали комбинированную терапию, быстро уменьшались в размере, и, по-видимому, полностью устранялись в течение периода продолжительностью несколько дней, возобновления роста не наблюдалось. По сравнению с контрольными мышами, которым вводили физиологический раствор, мыши, получавшие лечение только одним цитокином, также демонстрировали ингибирование роста опухоли, но, тем не менее, опухоли у данных мышей продолжали медленно увеличиваться в размере. Данные результаты демонстрируют синергический эффект комбинированной терапии цитокинами и заметный терапевтический эффект, при котором опухоли уничтожались после всего лишь однократной дозы каждого цитокина.
Соответственно, первым аспектом настоящего изобретения является способ лечения опухоли у пациента путем инъекционного ведения в место локализации опухоли однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2.
Иммуноконъюгат содержит цитокин, связанный с молекулой антитела, которая направляет (нацеливает) цитокин в место поражения. Молекула антитела связывается со сплайс-изоформой компонента внеклеточного матрикса, которая селективно экспрессируется внеклеточным матриксом в опухолевой ткани. В результате объединения данного эффекта адресной доставки с непосредственным введением иммуноконъюгата в место локализации опухоли, достигается высоко локализованное введение, которое концентрирует эффект цитокинов в месте опухоли и уменьшает побочные эффекты и токсичность, связанную с системным применением цитокинов.
Известен ряд сплайс-изоформ компонентов внеклеточного матрикса опухоли, и молекулы антител, нацеленные на любые такие изоформы, можно применять для селективного нацеливания на опухоль. Данные сплайс-изоформы включают сплайс-изоформы фибронектина, такие как B-FN. B-FN включает дополнительный домен ED-В, и молекулы антитела согласно настоящему изобретению предпочтительно нацелены на данный домен. Предпочтительная молекула антитела содержит гипервариабельные участки (CDR) антитела L19. Они представляют собой участки, показанные на Фигуре 3:
Иммуноконъюгат ФНОα предпочтительно содержит ФНОα, связанный с молекулой антитела, содержащей участки CDR L19. Иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, которая может быть такой же, как в иммуноконъюгате ФНОα, или другой молекулой антитела. Молекулы антитела в каждом иммуноконъюгате могут связываться с одним и тем же компонентом внеклеточного матрикса, возможно с одной сплайс-изоформой, например, они могут связываться одним доменом. Предпочтительно, иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, содержащей участки CDR L19.
В предпочтительном варианте молекула антитела (иммуноконъюгата ФНОα и/или ИЛ-2) содержит домен VH L19 и/или домен VL L19. Аминокислотные последовательности доменов VH и VL L19 представляют собой SEQ ID NO: 7 и SEQ ID NO: 9 соответственно (Фигура 3).
В предпочтительном варианте молекула антитела представляет собой одноцепочечный Fv (scFv) или другой фрагмент антитела с низкой молекулярной массой и/или отсутствием области Fc. Данные свойства способствуют направленной доставке и проникновению в ткань иммуноконъюгата в месте локализации опухоли. Предпочтительной молекулой антитела является scFv-L19, которая представляет собой scFv, содержащее домен VH L19 и домен VL L19, где VH и VL соединены в одну полипептидную цепь последовательностью пептидного линкера. Домен VH содержит последовательности CDR1, CDR2 и CDR3 VH, и домен VL содержит последовательности CDR1, CDR2 и CDR3 VL. Домен VH может иметь аминокислотную последовательность, показанную на Фигуре 3 (SEQ ID NO: 7). Домен VL может иметь аминокислотную последовательность, показанную на Фигуре 3 (SEQ ID NO: 9). Домены VH и VL обычно соединены пептидным линкером, таким как линкер из 12 остатков, показанный на Фигуре 3 (SEQ ID: 8). В предпочтительном варианте scFv-L19 содержит аминокислотной последовательности, показанной на Фигуре 3 (SEQ ID: 10) или состоит из нее.
Молекулярный линкер, такой как пептид, можно применять для соединения цитокина с молекулой антитела, облегчая экспрессию всего или части иммуноцитокина в виде слитого белка. В случае, когда молекула антитела представляет собой также одноцепочечную молекулу, такую как scFv, всю полипептидную цепь иммуноцитокина можно с удобством получать в виде слитого белка. Для иммуноконъюгата ФНОα слитые белки затем собираются в тримеры, что обеспечивает ФНОα возможность принимать его нормальную тримерную форму [4].
Возможно, иммуноцитокин несет детектируемую и/или функциональную метку, такую как радиоактивный изотоп. L19, меченное радиоактивным изотопом, и его применение в раковой терапии было описано ранее.
Обычно для удобства иммуноконъюгат ИЛ-2 и иммуноконъюгат ФНОα представлены в виде отдельных молекул. Они могут быть представлены в виде комбинированного препарата или в виде отдельных композиций для того, чтобы обеспечивать либо одновременное, либо последовательное введение. Врач-клиницист может определить наиболее подходящий способ введения пациенту однократной дозы каждого иммуноцитокина. Например, способ лечения может включать осуществление инъекции иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 в форме отдельных инъекций, одновременно или последовательно. В том случае, когда применяют последовательное введение, и иммуноцитокины предпочтительно инъецируют с промежутком в пределах 24 часов, 12 часов, 1 часа или более, предпочтительно в пределах 30 минут. Два иммуноцитокина можно инъецировать в место локализации опухоли в ту одну точку или в разные точки. Можно осуществлять комбинированную инъекцию обоих иммуноцитокинов. Может быть предпочтительным вводить дозу в виде многократных инъекций, например, делать инъекции в нескольких участках опухоли или вокруг сайта локализации опухоли, или облегчать введение большего объема иммуноцитокина.
Доза представляет собой количество цитокина, вводимое в один момент времени, эффективное для лечения от опухоли при комбинированной терапии согласно изобретению. Однократную дозу можно вводить в течение периода лечения продолжительностью 1 час или менее, предпочтительно в течение периода продолжительностью 30 минут или менее, например, 15, 10, 5 или 1 минуту или менее.
Наряду с другими факторами, вводимое количество ФНОα или ИЛ-2 будет зависеть от размера и природы опухоли. Например, доза иммуноконъюгата ФНОα-scFv может находиться в интервале 2-20 мкг, например, 5-10 мкг. Доза иммуноконъюгата ИЛ-2-scFv может находиться в интервале 10-100 мкг, например, 20-40 мкг. Соответствующие дозы при использовании других форм иммуноконъюгатов можно рассчитывать непосредственно для введения соответствующего количества цитокина. Они представляют собой лишь примеры и, безусловно, можно применять разные дозы. Врач-клиницист определит терапевтически эффективное количество для введения.
Однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2, в том виде, как здесь описано, было достаточно для терапии опухоли. Не требовалось многократных доз, и лечение от опухоли согласно настоящему изобретению не включает повторной комбинированной терапии. Помимо преимуществ, которые это дает пациентам, схема с однократной дозой обеспечивает значительное преимущество для врачей-клиницистов и значительную экономию средств.
Соответственно, при лечении определенной опухоли, способ согласно изобретению не применяют повторно. Способ лечения от опухоли может включать:
(а) введение путем инъекции в место локализации опухоли однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2, и
отсутствие повтора стадии (а).
Опухоль лечат без какого-либо повторного введения комбинации иммуноцитокинов в место локализации опухоли. Как показано в настоящей заявке, опухоль можно лечить без какой-либо последующей инъекции иммуноконъюгата ФНОα или иммуноконъюгата ИЛ-2. На практике, лечение опухоли можно осуществлять без введения пациенту какого-либо дополнительного противоракового агента. Возможно, пациенту ранее не давали ни ФНОα, ни ИЛ-2 для лечения опухоли, хотя в некоторых случаях пациент возможно получал предшествующую терапию только одним из ИЛ-2, ФНОα и иммуноконъюгата, включающего один из указанных цитокинов, которая не обеспечивала полного лечения опухоли.
Соответственно, способ согласно изобретению может включать лечение опухоли у пациента путем инъекционного введения в место локализации опухоли дозы иммуноконъюгата ФНОα и дозы иммуноконъюгата ИЛ-2, причем лечение опухоли осуществляют без введения в место локализации опухоли какой-либо последующей дозы иммуноконъюгата ФНОα или иммуноконъюгата ИЛ-2.
Безусловно, способ согласно изобретению можно применять для лечения множественных опухолей у пациента путем осуществления предложенного способа для каждой опухоли.
Другие виды лечения, которые можно применять в комбинации с изобретением, включают введение подходящих доз обезболивающих лекарственных средств, таких как нестероидные противовоспалительные лекарственные средства (например, аспирин, парацетамол, ибупрофен или кетопрофен) или опиаты, такие как морфин, или противорвотные средства.
Иммуноцитокины вводят инъекционным путем в место локализации опухоли, предпочтительно путем внутриопухолевой инъекции. Перитуморальная инъекция, например, местная внутрикожная инъекция, представляет собой другой подходящий способ местного введения иммуноцитокина в место локализации опухоли.
Опухоль, которую лечат, может представлять собой первичную опухоль или метастатическую опухоль. Изобретение, в частности, подходит для лечения опухолей кожи, например, злокачественной опухоли кожи, меланомы или карциномы, так как их положение поддается прямой местной инъекции. Также можно лечить другие опухоли в организме, и инъекции можно направлять в опухоли в мягкой ткани или внутренних органах, например, с применением сонографии [1]. Способы согласно изобретению можно также применять в условиях хирургического вмешательства, когда инъекцию осуществляют перед, во время и после хирургического лечения опухоли.
Лечение опухоли согласно настоящему изобретению может включать полное уничтожение опухоли. Исчезновение всех признаков жизнеспособной опухоли после прекращения инъекций свидетельствует о полном излечении опухоли. Исчезновение опухоли может быть определено по отсутствию заметного объема опухоли или в случае, когда опухоль не визуализируется. Лечение может включать лечение для уничтожения опухоли и предотвращения возобновления роста опухоли.
Способ лечения опухоли согласно настоящему изобретению может включать введение путем инъекции однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2 в место локализации опухоли, и наблюдение за исчезновением опухоли. Можно также наблюдать отсутствие возобновления роста опухоли.
Пациенты предпочтительно наблюдаются в течение периода наблюдения продолжительностью по меньшей мере один месяц, предпочтительно по меньшей мере шесть месяцев или по меньшей мере год после применения комбинированной терапии иммуноцитокинами. В период последующего наблюдения можно наблюдать исчезновение опухоли и отсутствие возобновления роста опухоли.
В случае рецидива опухоли после периода наблюдения или развития других опухолей пациенты могут получать дополнительное лечение с применением комбинированной терапии иммуноцитокинами согласно изобретению для удаления другой опухоли.
Например, способ согласно изобретению может включать уничтожение опухоли у пациента посредством инъекционного введения в место локализации опухоли однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2, причем опухоль исчезает в отсутствие дополнительных доз иммуноконъюгата ФНОα и/или иммуноконъюгата ИЛ-2.
Другие аспекты изобретения относятся к иммуноконъюгатам ФНОα и ИЛ-2 для применения в любом из способов согласно изобретению, описанных в настоящей заявке. Может быть предложена композиция, содержащая иммуноконъюгат ФНОα и/или иммуноконъюгат ИЛ-2, для применения в способе. Композиции могут дополнительно содержать дополнительные компоненты, такие как фармацевтически приемлемые вспомогательные вещества. Композиция может содержать иммуноцитокины в виде отдельных композиций (например, отдельно упакованные, возможно в наборе) или в виде комбинированной композиции. Композиция может быть приспособлена для внутриопухолевого введения. Применение иммуноконъюгата ФНОα и/или иммуноконъюгата ИЛ-2 для изготовления лекарственного средства для применения в способе, описанном в настоящей заявке, представляет собой другой аспект изобретения.
Могут быть предложены молекулы нуклеиновой кислоты, кодирующие иммуноконъюгаты. Нуклеиновые кислоты могут присутствовать в клетках-хозяевах. Способ получения иммуноконъюгата может включать экспрессию нуклеиновой кислоты в культивируемых клетках-хозяевах, возможно с последующей очисткой иммуноконъюгата из культуры клеток-хозяев. Иммуноконъюгаты ИЛ-2 и ФНОα предпочтительно продуцируют в отдельных клеточных культурах. Затем они могут быть раздельно приготовлены в виде лекарственных средств для введения, как описано.
Подробное описание изобретения
Некоторые аспекты изобретения представляют собой аспекты, охарактеризованные в прилагаемой формуле изобретения, которые можно объединять с любой другой частью настоящего описания.
Молекула антитела представляет собой иммуноглобулин как природного происхождения, так и частично или полностью синтезированный. Этот термин также охватывает любой полипептид или белок, содержащий антигенсвязывающий сайт антитела. Таким образом, данный термин охватывает фрагменты антитела и производные, включая любой полипептид, содержащие антигенсвязывающий сайт антитела, как природного происхождения, так и частично или полностью синтезированные. Соответственно, включены химерные молекулы, содержащие антигенсвязывающий сайт антитела, или его эквивалент, слитый с другим полипептидом. Клонирование и экспрессия химерных антител хорошо известны (ЕР 0120694, ЕР 0125023).
Дополнительные методики, доступные в области конструирования антител, сделали возможным выделение человеческих и гуманизированных антител. Например, гибридомы человека могут быть получены, как описано ранее [5]. Фаговый дисплей представляет собой другую устоявшуюся методику [5, WO 92/01047]. Трансгенные мыши, у которых гены мышиных антител инактивированы и функционально заменены генами человеческих антител, в то время как другие компоненты иммунной системы мыши остаются интактными, могут быть использованы для выделения человеческих антител [6].
Молекулы синтетических антител могут быть получены путем экспрессии генов, образованных из олигонуклеотидов, синтезированных и собранных в подходящие экспрессионные векторы [7, 8].
Показано, что фрагменты целого антитела могут выполнять функцию связывания антигенов. Фрагменты антитела предпочтительны в конъюгатах согласно изобретению по причине их небольшого размера и сведенного к минимуму взаимодействия с другими молекулами и рецепторами (например, рецептор Fc). В частности, предпочтительными являются одноцепочечные молекулы Fv (scFv), в которых домен VH и домен VL связаны пептидным линкером, который позволяет двум доменам ассоциировать с образованием антигенсвязывающего сайта [9, 10]. scFv можно стабилизировать путем включения дисульфидных мостиков, связывающих домены VH и VL [11].
Другим небольшим антигенсвязывающим фрагментом антитела является dAb (доменное антитело), а конкретно, вариабельная область тяжелой или легкой цепи антитела [12]. dAb, содержащие VH, встречаются в природе у камелид (например, верблюд, лама), и они могут быть получены посредством иммунизации камелид антигеном-мишенью, выделения антиген-специфичных В-лимфоцитов и прямого клонирования генов dAb из отдельных В- лимфоцитов. dAb также могут продуцироваться в клеточной культуре. Их небольшой размер, хорошая растворимость и термостабильность делает их особенно физиологически полезными и подходящими для отбора и созревания аффинности.
Антигенсвязывающий сайт представляет собой часть молекулы, которая специфично связывается с целым антигеном-мишенью или его частью и комплементарна им. В молекуле антитела она обозначается как антигенсвязывающий сайт антитела и содержит часть антитела, которая специфично связывается с целым антигеном-мишенью или его частью и комплементарна им. В случае крупного антигена антитело может связываться только с определенной частью антигена, которая называется эпитопом. Антигенсвязывающий сайт антитела может быть образован одним или большим числом вариабельных областей антитела. В предпочтительном варианте антигенсвязывающий сайт антитела содержит вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH).
Термин «специфичный» можно использовать в отношении ситуации, в которой один член пары специфичного связывания не демонстрирует сколь-либо существенного связывания с молекулами, отличными от его партнера по специфичному связыванию. Термин также применим в случае, когда, например, антигенсвязывающий сайт специфичен в отношении определенного эпитопа, который содержится в ряде антигенов, и в этом случае антитело, несущее антигенсвязывающий сайт, будет способно связываться с различными антигенами, несущими данный эпитоп.
В иммуноконъюгатах согласно изобретению молекула антитела связывается с компонентом внеклеточного матрикса, который является маркером опухолевого роста. Внеклеточный матрикс (ЕСМ) модифицируется во время роста опухоли, и альтернативные сплайс-варианты компонентов ЕСМ могут селективно экспрессироваться в участке поражения.
Одним примером является фибронектин. Например, изоформа B-FN фибронектина содержит дополнительный домен ED-B. Молекула антитела предпочтительно специфично связывается с ED-B изоформы B-FN фибронектина. Молекула антитела может содержать CDR L19. Например, молекула антитела может представлять собой scFv, содержащей домен VH с аминокислотной последовательностью, содержащей CDR1 VH, CDR2 VH и/или CDR3 VH L19, и домен VL с аминокислотной последовательностью, содержащей CDR1 VL, CDR2 VL и/или CDR3 VL L19. Молекула антитела может содержать домен VH, имеющий аминокислотную последовательность, характеризующуюся по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью последовательности с аминокислотной последовательностью домена VH L19, представленной в SEQ ID NO: 7, и/или содержит домен VL, имеющий аминокислотную последовательность, характеризующуюся по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичностью с аминокислотной последовательностью домена VL L19, представленной в SEQ ID NO: 9. В предпочтительном варианте молекула антитела представляет собой scFv(L19), содержащий домен VH L19 (SEQ ID NO: 7) и домен VL L19 (SEQ ID NO: 9). В предпочтительном варианте реализации молекула антитела представляет собой scFv(L19), имеющий аминокислотную последовательность SEQ ID NO: 10 (Фигура 3).
В иммуноконъюгатах согласно изобретению могут быть использованы модифицированные формы домена VH и/или VL L19, например, молекула антитела может содержать домен VH L19 или VL L19, в котором было сделано 1, 2, 3, 4 или 5 аминокислотных замен в CDR и/или каркасном участке, при сохранении специфичного связывания с ED-B фибронектина. В предпочтительном варианте такие аминокислотные замены являются консервативными, например, замена одного гидрофобного остатка на другой, одного полярного остатка на другой, аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин.
Другим примером является тенасцин-С (TnC), который существует в разных изоформах, образующихся в результате альтернативного сплайсинга. В неопластических тканях TnC, содержащие дополнительные домены, экспрессируются на большей площади, чем в нормальных тканях, особенно изоформы, содержащие домен С (cTN-C) (WO 00/63699). Таким образом, молекула антитела может связываться со сплайс-изоформой тенасцина-С, например, она может связываться с доменом С.
Молекулы нуклеиновой кислоты, кодирующие иммуноконъюгаты и их части, также составляют часть изобретения. Молекула нуклеиновой кислоты может представлять собой вектор, например, плазмиду, подходящую для экспрессии нуклеотидной последовательности. Обычно нуклеотидная последовательность функционально связана с регуляторным элементом, таким как промотор для транскрипции.
Молекулы нуклеиновой кислоты могут содержаться в клетке-хозяине, которая может представлять собой клетку, совместно трансфицированную молекулами нуклеиновой кислоты, или дочернюю клетку такой клетки. Клетки, в частности, эукариотические клетки, например, клетки НЕК (клетка почки эмбриона человека) и СНО (клетка яичника китайского хомяка), или бактериальные клетки, например, Escherichia coli, содержащие молекулы нуклеиновой кислоты, также составляют часть изобретения.
Иммуноконъюгаты согласно изобретению могут быть получены с использованием методов генной инженерии, например, путем экспрессии целого иммуноконъюгата или его части в виде слитого белка. Обычно экспрессию осуществляют в клетке-хозяине, содержащей нуклеиновую кислоту, описанной выше. Соответственно, экспрессия может включать культивирование такой клетки-хозяина. В случае слитых белков ФНОα тримеризация субъединиц может происходить в клетке или во время выделения слитых белков из клетки.
В предпочтительном варианте молекула антитела конъюгирована с цитокином пептидной связью, например, в составе слитого белка, содержащего ФНОα или ИЛ-2 и молекулу антитела, или его полипептидную цепь. Для дополнительной информации о получении иммуноконъюгатов, содержащих ФНОα или ИЛ-2, см. WO 01/66298 и Boris et al. [4]. Дополнительную информацию о последовательности ИЛ-2, полезную для получении слитого полипептида, содержащего ИЛ-2, можно найти в Carnemolla et al. [2], Taniguchi et al. [13], Maeda et al. [14] или Devos et al. [15].
ФНОα, используемый в иммуноконъюгатах согласно изобретению, предпочтительно представляет собой человеческий ФНОα. ИЛ-2 предпочтительно представляет собой человеческий ИЛ-2. Молекулы антитела предпочтительно представляют собой молекулы человеческих или гуманизированных антител.
Также описан способ, включающий приготовление иммуноконъюгата в виде фармацевтической композиции. Обычно данный способ включает очистку иммуноконъюгата и его объединение с физиологически приемлемым носителем.
Композиции согласно настоящему изобретению и для применения согласно настоящему изобретению могут, помимо активного ингредиента (иммуноконъюгата), содержать фармацевтически приемлемый вспомогательный компонент, носитель, буфер, стабилизатор или другие вещества, хорошо известные специалистам в данной области. Такие вещества должны быть нетоксичными и не должны препятствовать эффективности активного ингредиента. Для инъекции в место локализации опухоли иммуноконъюгат может быть представлен в форме парентерально приемлемого водного раствора, который является апирогенным и имеет подходящие pH, изотоничность и стабильность.
Краткое описание графических материалов
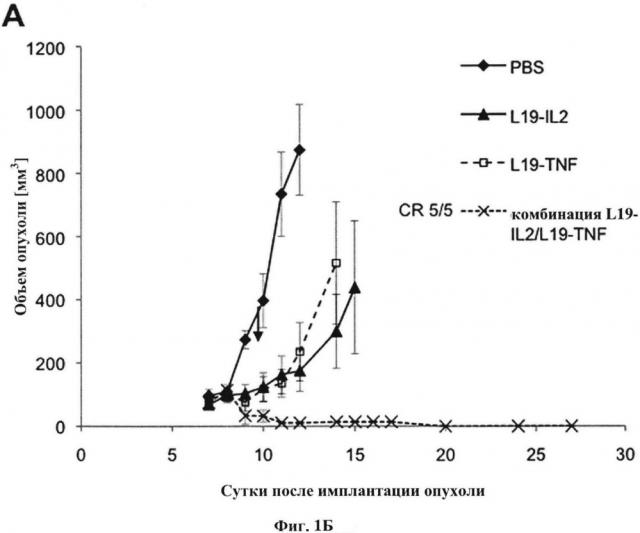
На фигуре 1А показана динамика объема опухоли в эксперименте, описанном в Примере 1.
На фигуре 1Б показаны данные за период наблюдения, в дополнение к Фигуре 1А.
На фигуре 2 показана динамика средней массы мышей в эксперименте, описанном в Примере 1.
На фигуре 3 показана аминокислотная последовательность scFv(L19) (SEQ ID NO: 10). Домены VH и VL показаны отдельно (SEQ ID NO: 7 и SEQ ID NO: 9 соответственно). Последовательности CDR 1, 2 и 3, как в домене VH, так и VL, выделены подчеркиванием. Домены VH и VL разделены пептидной линкерной последовательностью из 12 остатков (SEQ ID NO: 8).
Эксперименты
Эксперимент 1 - Внутриопухолевая комбинация L19-ИЛ-2 и L19-muФНО
Методика
Линия мышей: самки, иммунокомпетентные мыши 129SVE, в возрасте 10 недель.
Имплантировали 20 миллионов клеток F9.
Лечение начинали в сутки 7 после имплантации опухоли.
В сутки 7 мыши получали однократную внутриопухолевую инъекцию 30 мкг L19-ИЛ-2, 7 мкг L19-muФНО, комбинации или PBS (фосфатно-солевой буферный раствор). Общий инъецированный объем составлял 90 мкл.
Дополнительных инъекций не давали.
Объем опухоли измеряли ежедневно.
Результаты
Объем опухоли, измеряемый с дня 7 до дня 12 (Фигура 1А) - средние результаты.
Опухоли у мышей, которые получали только физиологический раствор, увеличились в размере, начиная примерно с дня 8.
Опухоли у мышей, которые получали один иммуноцитокин, начали медленно увеличиваться в размере примерно с дня 10.
Опухоли у мышей, которые получили комбинацию иммуноцитокинов, уменьшались в размере с дня 9. К дням 11 и 12 объем опухоли был едва измерим. Роста опухоли не наблюдали в измерениях за период наблюдения, проводимых до дня 20, когда был зафиксирован нулевой объем опухоли.
Также регистрировали изменение массы мышей (Фигура 2).
Визуальные наблюдения в день 10 после имплантации опухоли:
Большие подкожные опухоли образовались у мышей (n=4 мыши), получавших ФБР (контроль). Умышей, получавших L19-ИЛ-2 и L19-ФНО, присутствовали видимые опухоли, но заметно меньшего размера, чем опухоли у контрольных мышей, и у мышей, получавших комбинацию комбинацией опухоли были едва видимыми или не видимыми (n=5 мышей в каждой группе).
Результаты показывают, что однократное введение комбинации иммуноцитокинов было эффективным для достижения полного уничтожения обработанной опухоли. У мышей не наблюдали повторного роста опухолей.
Другие подробности
Когда опухоли достигали размера 70 мм3, мышей случайным образом делили на группы, и начинали лечение. Мыши получали однократную внутриопухолевую инъекцию L19-ИЛ-2 (30 мкг), L19-ФНО (7 мкг) или комбинации в ФБР, объемом 90 мкл. Мышей наблюдали ежедневно, объем опухоли измеряли с помощью штангенциркуля, используя формулу: объем = длина × ширина2 × 0,5.
На Фигуре 1Б показано продолжение данных, показанных на Фигуре 1А. У мышей, получавшие комбинацию, не наблюдали измеримой опухоли при дальнейших измерениях в период наблюдения до дня 27. Пять из пяти мышей в данной группе достигли клинического ответа.
Источники
1 Weide et al. Cancer 1 September 2010:4139-4146.
2 Carnemolla et al. Blood 99:1659-1665 2002.
3 Christ et al. Clin Cancer Res 7(5):1385-97 2001.
4 Borsi et al. Blood 102:4384-4392 2003.
5 Kontermann, R & Dubel, S, Antibody Engineering, Springer-Verlag New York, LLC; 2001, ISBN: 3540413545.
6 Mendez, M. et al. Nature Genet, 15(2):146-156 1997.
7 Knappik et al. J. Mol. Biol. (2000) 296, 57-86.
8 Krebs et al. Journal of Immunological Methods 254 2001 67-84.
9 Bird et al, Science, 242, 423-426, 1988.
10 Huston et al, PNAS USA, 85, 5879-5883, 1988.
11 Reiter, Y. et al, Nature Biotech, 14, 1239-1245, 1996.
12 Holt et al Trends in Biotechnology 21, 484-490 2003.
13 Taniguchi et al. Nature 302:305-310 1983.
14 Maeda et al. Biochem Biophys Res Comm. 115:1040-1047 1983.
15 Devos et al. Nucl Acids Res 11:4307-4323 1983.
1. Способ лечения опухоли кожи у пациента путем инъекционного введения однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2 в место локализации опухоли, причем инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 осуществляют одновременно, где
иммуноконъюгат ФНОα содержит ФНОα, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина, и
иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина.
2. Способ по п.1, где молекула антитела в иммуноконъюгате ФНОα и молекула антитела в иммуноконъюгате ИЛ-2 являются идентичными молекулами антитела.
3. Способ по п.2, где молекула антитела содержит гипервариабельные участки (CDR) L19,
где CDR L19 представляют собой:
4. Способ по п.3, где молекула антитела содержит последовательность SEQ ID NO: 7, соответствующую домену VH L19, и последовательность SEQ ID NO: 9, соответствующую домену VL L19.
5. Способ по п. 1, где молекула антитела представляет собой scFv.
6. Способ по п.5, где молекула антитела представляет собой scFv-L19, имеющее последовательность SEQ ID NO: 10.
7. Способ по п.1, где один или оба иммуноконъюгата несут детектируемую метку.
8. Способ по п.1, где инъекция представляет собой внутриопухолевую инъекцию.
9. Способ по п.1, где способ включает инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 в отдельных инъекциях.
10. Способ по п.1, где способ включает инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 в комбинированной инъекции.
11. Способ по п.1, где дозу иммуноконъюгата ФНОα вводят в виде однократной инъекции.
12. Способ по п.1, где дозу иммуноконъюгата ИЛ-2 вводят в виде однократной инъекции.
13. Способ по п.1, включающий инъекционное введение однократной дозы 10-100 мкг иммуноконъюгата ИЛ-2-scFv в место локализации опухоли.
14. Способ по п.1, включающий инъекционное введение однократной дозы 2-20 мкг иммуноконъюгата ФНОα-scFv в место локализации опухоли.
15. Способ по п.1, включающий лечение множественных опухолей у пациента путем инъекционного введения однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2 в место локализации каждой опухоли.
16. Способ по п.1, где опухоль кожи представляет собой первичную опухоль.
17. Способ по п.1, где опухоль кожи представляет собой меланому.
18. Способ по п.1, где опухоль кожи представляет собой карциному.
19. Способ по п.1, где пациент представляет собой пациента, который не получал ранее лечение с применением ИЛ-2 или ФНОα.
20. Способ по п.1, где лечение опухоли включает уничтожение опухоли.
21. Композиция, содержащая комбинацию иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2, для применения в способе лечения опухоли кожи у пациента путем инъекционного введения однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2 в место локализации опухоли, причем инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 осуществляют одновременно, где
иммуноконъюгат ФНОα содержит ФНОα, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина, и
иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина.
22. Композиция, содержащая иммуноконъюгат ФНОα, для применения в способе лечения опухоли кожи у пациента путем инъекционного введения однократной дозы иммуноконъюгата ФНОα и однократной дозы иммуноконъюгата ИЛ-2 в место локализации опухоли, причем инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 осуществляют одновременно, где
иммуноконъюгат ФНОα содержит ФНОα, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина, и
иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина.
23. Композиция, содержащая иммуноконъюгат ИЛ-2, для применения в способе лечения опухоли кожи у пациента путем инъекционного введения однократной дозы иммуноконъюгата ИЛ-2 и однократной дозы иммуноконъюгата ФНОα в место локализации опухоли, причем инъекционное введение иммуноконъюгата ФНОα и иммуноконъюгата ИЛ-2 осуществляют одновременно, где
иммуноконъюгат ФНОα содержит ФНОα, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина, и
иммуноконъюгат ИЛ-2 содержит ИЛ-2, связанный с молекулой антитела, которая связывается с дополнительным доменом ED-B сплайс-изоформы B-FN фибронектина.
24. Композиция по любому из пп.21-23, где молекула антитела в иммуноконъюгате ФНОα и молекула антитела в иммуноконъюгате ИЛ-2 являются идентичными молекулами антитела.
25. Композиция по п.24, где молекула антитела содержит гипервариабельные участки (CDR) L19,
где CDR L19 представляют собой:
26. Композиция по п.25, где молекула антитела содержит последовательность SEQ ID NO: 7, соответствующую домену VH L19, и последовательность SEQ ID NO: 9, соответствующую домену VL L19.
27. Композиция по любому из пп.21-23, где молекула антитела представляе