Способ оценки чувствительности биоплёнок холерных вибрионов к антибактериальным препаратам
Иллюстрации
Показать всеИзобретение относится к медицинской микробиологии. Предложен способ оценки чувствительности биопленок холерных вибрионов к антибактериальным препаратам, включающий получение биопленки на стекляных цилиндрах. Цилиндры с полученной биопленкой устанавливают на агар в чашке Петри, в середину цилиндра вносят растворы антибактериального препарата в разных концентрациях. Результаты учитывают через 18-20 ч инкубации при 37°С по наличию или отсутствию роста холерных вибрионов в отпечатках цилиндров. Чувствительность биопленки холерных вибрионов к антибактериальным препаратам оценивают по индексу активности, рассчитанному по формуле:
, где ИА - индекс активности антибактериального препарата; МПКч - максимальное значение МПК данного антибактериального препарата для чувствительных штаммов в соответствии с МУК 4.2.2495-09; МПКб - значение МПК данного антибактериального препарата в отношении биопленки исследуемого штамма. Чувствительность биопленки исследуемого штамма прямо пропорциональна индексу ИА. Способ обеспечивает точность оценки чувствительности биопленки штаммов холерных вибрионов к антибактериальному препарату. 2 ил., 4 табл., 2 пр.
Реферат
Изобретение относится к медицинской микробиологии, а именно к формированию биопленок холерных вибрионов на твердом носителе для проведения тестирования антибактериальных препаратов на их эффективность в отношении биопленок.
Способность холерных вибрионов к образованию биопленки (1) затрудняет проведение мероприятий по профилактике и борьбе с холерой. Чувствительность бактерий, включенных в структуру биопленки, к антибактериальным препаратам может снижаться в 10-1000 раз по сравнению с планктонными формами (2, 3, 4), что создает трудности в терапии инфекционных заболеваний.
В связи с этим оценка чувствительности к антибиотикам холерных вибрионов, находящихся в составе биопленок, является одной из важных проблем эффективности этиотропной терапии.
В настоящее время в практике клинических микробиологов активно используются стандартизированные методы изучения антибиотикорезистентности микроорганизмов, в том числе холерных вибрионов, включающие два основных способа: диско-диффузионный способ с применением дисков, содержащих определенное количество (5, 10, 15, 30, 150, 300 мкг-Ед) антибактериального препарата, и метод серийных разведений в жидкой либо твердой питательной среде (5), с помощью которого можно определить минимальную подавляющую концентрацию - МПК антибактериального препарата.
Вышеперечисленные методы разработаны для определения антибиотикорезистентности отдельно существующих планктонных клеток микроорганизмов. Способы определения чувствительности биопленок микроорганизмов к антибактериальным препаратам, в основу которых положены указанные методы, требуют на первом этапе получения биопленок на поверхности пробирки или флакона с последующим удалением жидкой фракции, двукратным промыванием дистиллированной водой и снятием при помощи урологического зонда с поверхности стекла адгезированной биопленочной культуры. Затем требуется центрифугирование, десятикратные разведения и высев на агар с последующим определением антибиотикочувствительности путем оценки жизнеспособности высвободившихся биопленочных бактерий (6).
Известен способ определения антибиотикочувствительности биопленок микрометодом серийных разведений в жидкой питательной среде в полистироловых планшетах, основанный на определении оптической плотности бактериальной культуры по количеству красителя, связавшегося с клетками микроорганизма (7, 8), либо визуально по наличию или отсутствию кольца образования биопленки на стенке лунки (9). Однако при работе с возбудителями особо опасных инфекций человека в соответствии с СП 1.3.3118-13 "Безопасность работы с микроорганизмами I-II групп патогенности (опасности)" использовать полистироловые пластины открытым способом не допускается.
Высокая трудоемкость указанных способов, необходимость наличия дополнительного оборудования, специального красителя, их многоэтапность сопряжены с затруднением соблюдения принципов биологической безопасности и не могут быть применены к возбудителю холеры, относящемуся ко II группе патогенности. Кроме того, удлинение времени исследования снижает эффективность выбора средств этиотропной терапии холеры у конкретного больного.
За прототип выбран способ оценки антибактериальных препаратов в отношении биопленок, образованных холерными вибрионами Эль Тор (10), заключающийся в том, что биопленки получают на пластиковых пластинках, помещенных в пенициллиновые флаконы, содержащие по 5 мл кипяченой водопроводной воды и суспензию холерных вибрионов в концентрации n×104 м.кл. по отраслевому стандартности мутности Л.А. Тарасевича, затем флаконы с пластиковыми пластинками выдерживают при 37°C до 4 сут, после этого в них добавляют двукратные разведения антибактериальных препаратов и проводят инкубирование в течение 24 ч в термостате при 37°C с последующим высевом биопленки и 0,1 мл планктонной культуры на пластинки с агаром Мартена рН 7,7, затем проводят учет результатов через 24 ч по наличию или отсутствию роста холерных вибрионов.
Недостатком прототипа является то, что для изучения чувствительности к большому числу антибактериальных препаратов в разных концентрациях необходимо большое число пластиковых пластинок, пенициллиновых флаконов, а также бактериальной суспензии. Кроме того, многоэтапность способа увеличивает трудоемкость и время исследования.
Техническая задача предлагаемого изобретения состояла в разработке способа, позволяющего с высокой достоверностью просто и быстро оценивать чувствительность биопленок холерных вибрионов к антибактериальным препаратам для отбора наиболее эффективных средств этиотропной терапии холеры.
Поставленная техническая задача достигается тем, что в способе оценки чувствительности биопленок холерных вибрионов к антибактериальным препаратам, включающем получение биопленки на твердом носителе, который помещают в суспензию холерных вибрионов в конечной концентрации n×104 м.к./мл и выдерживают в термостате при 37°C не менее 4-х сут с последующим посевом на агар Мартена, отличие заключается в том, что биопленку получают на стеклянных цилиндрах длиной 10 мм и диаметром 8 мм, которые размещают во флаконе объемом 50 мл с водопроводной автоклавированной водой, в последний вносят суспензию холерных вибрионов, выдерживают 5 сут в термостате, после этого стеклянные цилиндры достают пинцетом из флакона и трехкратно промывают в физиологическом растворе, затем устанавливают цилиндры на агар в чашке Петри, не более 6 штук на одинаковом удалении друг от друга, после этого вносят в середину цилиндра 0,05 мл раствора антибактериального препарата в разных концентрациях, позволяя определять минимальную подавляющую рост биопленки концентрацию МПКб антибактериального препарата, учет результатов осуществляют через 18-20 часов инкубации при 37°C по наличию или отсутствию роста холерных вибрионов в отпечатках цилиндров, при этом оценивают чувствительность биопленки холерных вибрионов к антибактериальным препаратам по индексу активности, который определяют по формуле
,
где ИА - индекс активности антибактериального препарата в отношении исследуемого штамма;
МПКч - максимальное значение МПК данного антибактериального препарата для чувствительных штаммов;
МПКб - значение МПК данного антибактериального препарата в отношении биопленки исследуемого штамма,
чем выше ИА, тем более чувствителен данный штамм к антибактериальному препарату.
Предлагаемый способ реализуется следующим образом.
На первом этапе создают биопленки, для этого в качестве твердого носителя используют стеклянные цилиндры длиной 10 мм и имеющие внешний диаметр 8 мм, внутренний - 6 мм. Цилиндры помещают во флакон (50 мл) с водопроводной автоклавированной водой (до 40 цилиндров в один флакон), куда вносят суспензию холерных вибрионов, последняя приготовленна из 18-часовой агаровой культуры по отраслевому стандарту мутности ГИСК им. Л.А. Тарасевича (ОСО-42-25-59-86 П), в конечной концентрации n×104 м.кл/мл., и выдерживают в термостате в течение 5 суток.
Цилиндры с полученными на них биопленками пинцетом достают из флакона и после трехкратного промывания в физиологическом растворе ставят на агар не более 6 на одну чашку Петри на одинаковом удалении друг от друга и от края чашки (см. фото 1) и в середину цилиндра добавляют по 0,05 мл раствора антибактериального препарата в разных концентрациях (см. табл. 1) с указанием нумерации на дне чашки. В контрольный цилиндр антибиотик не добавляют. Через 18-20 ч учитывают результаты по наличию или отсутствию роста холерных вибрионов в отпечатках цилиндров (см. фото 2).
На фото 2 видно наличие роста в кольце-отпечатке поверхности цилиндра под номерами 26 и 27 и отсутствие роста холерных вибрионов штамма V. cholerae El Tor 18904 в отпечатках под номерами 28-30.
Таким образом, антибиотик диффундирует в агар из стеклянных полых цилиндров, установленных вертикально на поверхность засеянного агара, в результате чего холерные вибрионы, находящиеся в составе биопленки, которая образовалась на стороне цилиндра, обращенной к агару, дают или не дают рост, в зависимости от их чувствительности к данной концентрации антибактериального препарата. За минимальную подавляющую рост биопленки концентрацию (МПКб) принимается наименьшая концентрация антибактериального препарата, воздействие которой вызывает гибель холерных вибрионов и отсутствие их роста на агаре, что можно наблюдать визуально.
На следующем этапе производят расчет индексов активности антибактериальных препаратов, что позволяет дать количественную оценку чувствительности биопленки к любому антибактериальному препарату, сравнивать индексы активности к двум и более препаратам с целью выбора наиболее оптимального из них для конкретного больного, контролировать чувствительность биопленки к препарату в динамике и при необходимости проводить своевременную его замену на более эффективный.
Расчет индекса активности антибактериального препарата в отношении исследуемого штамма производят по формуле
,
где ИА - индекс активности антибактериального препарата в отношении исследуемого штамма,
МПКч - максимальное значение МПК данного антибактериального препарата для чувствительных штаммов в соответствии с МУК 4.2.2495-09 (5) (представлено в таблице 2),
МПКб - значение МПК данного антибактериального препарата в отношении биопленки исследуемого штамма.
Чем выше ИА, тем более чувствителен данный штамм к антибактериальному препарату.
Пример 1
От больного выделена культура Vibrio cholerae El Tor 5879. Проведена оценка чувствительности к антибактериальным препаратам данного штамма V. cholerae в биопленочной форме для выбора средств этиотропной терапии вновь предлагаемым способом с вычислением индексов активности антибактериальных препаратов (ИА).
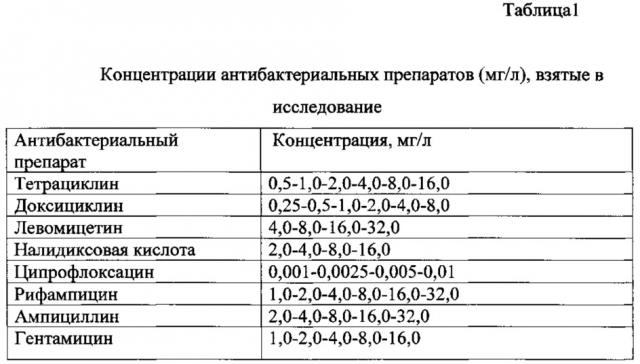
Готовили разведения антибактериальных препаратов (мг/л) (таблица 1).
Для получения биопленок в качестве твердого носителя использовали стеклянные цилиндры длиной 10 мм, имеющие внешний диаметр 8 мм и внутренний диаметр 6 мм (±0,1 мм), которые помещали во флакон с водопроводной автоклавированной водой 50 мл (до 40 цилиндров в один флакон), содержащей суспензию V. cholerae El Tor 5879, приготовленную из 18-часовой агаровой культуры по отраслевому стандарту мутности ГИСК им. Л.А. Тарасевича (ОСО-42-25-59-86 П), в конечной концентрации n×101-104 м.кл/мл. Флакон с цилиндрами выдерживали при 37°C 5 сут. Затем, цилиндры с полученными на них биопленками пинцетом доставали из флакона, трижды промывания в физиологическом растворе и ставили на агар Мартена не более 6 на одну чашку Петри на одинаковом удалении друг от друга и от края чашки. В середину каждого цилиндра добавляли по 0,05 мл раствора антибактериального препарата в разных концентрациях (таблица 1) с указанием нумерации на дне чашки. В контрольный цилиндр антибиотик не добавляли. Через 18-20 ч инкубации при 37°C цилиндры снимали пинцетом, опускали их в дезраствор и учитывали результаты по наличию или отсутствию роста холерных вибрионов в отпечатках цилиндров, записывая при этом минимальные подавляющие концентрации антибактериальных препаратов для биопленок МПКб при положительном контроле (таблица 3).
Для сравнения оценивали чувствительность к антибактериальным препаратам планктонной культуры штамма V. cholerae El Tor 5879 методом двукратных серийных разведений в соответствии с МУК 4.2.2495-09 (5).
Результаты представлены в таблице 3,
где ИА - индекс активности антибактериального препарата в отношении исследуемого штамма,
МПКп - значение МПК данного антибактериального препарата в отношении исследуемого штамма в планктонной форме,
МПКб - значение МПК данного антибактериального препарата в отношении биопленки исследуемого штамма.
МПКч - максимальное значение МПК данного антибактериального препарата для чувствительных штаммов в соответствии с МУК 4.2.2495-09 (5).
Как показывает таблица 3, планктонная культура штамма V. cholerae El Tor 5879 оказалась чувствительна ко всем антибактериальным препаратам, взятым в исследование.
Вывод: при сравнении антибиотикочувствительности планктонной и биопленочной культур указанного штамма установлено, что значения МПК антибактериальных препаратов в отношении его биопленок увеличились в 2-16 раз. Наибольшим индексом в отношении биопленок данного штамма обладают ципрофлоксацин, доксициклин, которые можно рекомендовать данному больному.
Пример 2
Проводили оценку чувствительности к антибактериальным препаратам биопленок, образованных клиническими изолятами Vibrio cholerae El Tor 18826, 19667, Vibrio cholerae O139 16077, 16063, V. cholerae non O1 / non O139 16150, 19190.
Осуществляли оценку чувствительности по технологии, описанной в примере 1. Учитывают результаты по наличию или отсутствию роста холерных вибрионов в отпечатках цилиндров, регистрируя при этом минимальные подавляющие концентрации антибактериальных препаратов для биопленок (МПКб) при положительном контроле (см. таблицу 4).
Как показало исследование, наибольшей активностью в отношении биопленок штамма V. cholerae El Tor 18826 обладают гентамицин и доксициклин. В отношении биопленок V. cholerae El Tor 19667 - гентамицин, стрептомицин, ципрофлоксацин. Наибольшую активность в отношении биопленок штамма V. cholerae O139 16063 продемонстрировали гентамицин, тетрациклин и ципрофлоксацин, а в отношении биопленок V. cholerae O139 16077 - гентамицин, доксициклин, тетрациклин, ципрофлоксацин, налидиксовая кислота. В отношении биопленок штамма V. cholerae non O1 / non O139 16150 наиболее активными оказались ципрофлоксацин и рифампицицн, а 19190 - ципрофлоксацин и доксициклин.
Самый высокий индекс активности у доксициклина оказался в отношении штамма V. cholerae non O1 / non O13919190, тетрациклина - штаммов V. cholerae O13916063, 16077, V. cholerae non O1 / non O139 19190, левомицетина и ципрофлоксацина - V. cholerae non O1 / non O139 116150 и 19190, налидиксовой кислоты - V. cholerae O139 16077, стрептомицина - V. cholerae non O1 / non O13916160 и V. cholerae El Tor 19667, гентамицина - V. cholerae El Tor 19667, рифампицина - V. cholerae non O1 / non O13916150.
Использование предлагаемого изобретения за счет устранения многочисленных этапов исследования, изменения самого способа получения биопленок, а также оценки чувствительности биопленок большого числа штаммов V. cholerae к большому числу антибактериальных препаратов в различных концентрациях позволяет с высокой достоверностью просто и быстро оценивать по индексу активности наиболее эффективные антибиотики для лечения заболевания у конкретного больного.
Источники информации
1. Татаренко О.А., Алексеева Л.П., Телесманич Н.Р., Шестиалтынова И.С., Чемисова О.С., Маркина О.В., Непомнящая Н.Б., Ускова Н.Н. Влияние некоторых факторов на формирование биопленки токсигенными и атоксигенными холерными вибрионами эль-тор // Эпидемиология и инфекционные болезни. - 2012. - №5. - С. 36-40.
2. Чеботарь И.В., Маянский А.Н., Кончакова Е.Д. и др. Антибиотикорезистентность биопленочных бактерий. Клиническая микробиология и антимикробная химиотерапия. 2012; 14 (1): 51-58.
3. Ryder MA. Catheter-Related Infections: It’s All About Biofilm. // Topics in Advanced Practice Nursing Journal. - 2005; 5 (3);
4. Olson ME et al. Biofilm bacteria: formation and comparative susceptibility of antibiotics. Can J Vet Res 2002 April; 66 (2): 86-92.
5. Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам. Метод, указ. МУК 4.2.2495-09. М.; 2009.
6. Фролова Я.Н., Харсеева Г.Г., Миронов А.Ю. Чувствительность к антибиотикам биопленочных культур токсигенных штаммов Corynebacterium diphtheriae. // Клиническая лабораторная диагностика. - 2014. - Т. 59, №6. - С. 51-53.
7. Кам Ань Ха, Грамматикова Н.Э., Василенко И.А., Кедик С.А. Сравнительная оценка антибактериальной активности полигексаметиленгуанидина гидрохлорида и полигексаметиленгуанидина сукцината в опытах in vitro // Антибиотики и химиотерапия. - 2013. - 58 (1-2). - С. 3-7.
8. Пат. РФ 2491348, МПК C12Q 1/04 G01N 33/569. Способ определения минимальной подавляющей концентрации антибактериального препарата / Харсеева Г.Г., Миронов А.Ю., Фролова Я.Н., Садовниченко Е.О.; - №2011140540; заявл. 06.10.2011 г.; опубл. 27.08.2013 г.
9. Сидашенко О.И., Воронкова О.С., Сирокваша Е.А., Винников А.И. Влияние цефтриаксона и тетрациклина на формирование биопленки штаммами Staphylococcus epidermidis // Ser. Med. - 2014. - 5 (1). - С. 7-11.
10. Селянская H.A., Титова С.В., Кирилова О.Д., Веркина Л.М. // Влияние некоторых антимикробных препаратов на биопленки холерных вибрионов // Холера и патогенные для человека вибрионы // Материалы проблемной комиссии, г. Ростов-на-Дону, 2014 г., вып. 27, с. 136-138.
Примечания
ИА - индекс активности антибактериального препарата,
МПКБ - значение МПК данного антибактериального препарата в отношении биопленки исследуемого штамма,
МПКЧ - максимальное значение МПК данного антибактериального препарата для чувствительных штаммов в соответствии с МУК 4.2.2495-09.
Способ оценки чувствительности биопленок холерных вибрионов к антибактериальным препаратам, включающий получение биопленки на твердом носителе, который помещают в суспензию холерных вибрионов в конечной концентрации n×104 м.к./мл и выдерживают в термостате при 37°C не менее 4-х суток с последующим посевом на агар Мартена, отличающийся тем, что биопленку получают на стеклянных цилиндрах длиной 10 мм и диаметром 8 мм, которые размещают во флаконе объемом 50 мл с водопроводной автоклавированной водой, в последний вносят суспензию холерных вибрионов, выдерживают 5 сут в термостате, после этого стеклянные цилиндры достают пинцетом из флакона и трехкратно промывают в физиологическом растворе, затем устанавливают цилиндры на агар в чашке Петри, не более 6 штук на одинаковом удалении друг от друга, после этого вносят в середину цилиндра 0,05 мл раствора антибактериального препарата в разных концентрациях, позволяя определять минимальную подавляющую рост биопленки концентрацию МПКб антибактериального препарата, учет результатов осуществляют через 18-20 ч инкубации при 37°C по наличию или отсутствию роста холерных вибрионов в отпечатках цилиндров, при этом оценивают чувствительность биопленки холерных вибрионов к антибактериальным препаратам по индексу активности, который определяют по формуле
,
где ИА - индекс активности антибактериального препарата в отношении исследуемого штамма;
МПКч - максимальное значение МПК данного антибактериального препарата для чувствительных штаммов;
МПКб - значение МПК данного антибактериального препарата в отношении биопленки исследуемого штамма,
чем выше ИА, тем более чувствителен данный штамм к антибактериальному препарату.