Фосфор-калий-азотсодержащее npk-удобрение и способ получения гранулированного фосфор-калий-азотсодержащего npk-удобрения
Иллюстрации
Показать всеИзобретения относятся к сельскому хозяйству. Сложное азотно-фосфорно-калийное удобрение (NPK) содержит нитрат аммония, сульфат кальция безводный, дигидрофосфат калия, причем массовая доля общего азота от 13-15%, массовая доля общих фосфатов в пересчете на P2O5 от 9-10%, массовая доля калия в пересчете на K2O от 13-15%. Способ получения сложного удобрения NPK из твердой фосфатной соли, представляющей собой смесь фторапатита Ca5(PO4)3F и дикальций фосфата CaHPO4×nH2O, где n - от 0 до 2, а содержание фторапатита Ca5(PO4)3F от 27 до 99% включает: стадию разложения указанной твердой фосфатной соли серной кислотой полусухим методом, стадии добавления сульфата калия в качестве источника калия, нитрата аммония в качестве источника азота, стадию приготовления сларри NPK, а также стадию грануляции и сушки готового продукта. Изобретения позволяют обеспечить улучшение свойств NPK-удобрения, повысить прочность гранул, решить проблему, связанную с пластичностью гранулированных сложных удобрений, повысить водорастворимость фосфора, содержащегося в удобрении, на 98% и тем самым улучшить потребительские свойства NPK-удобрений. 2 н. и 10 з.п. ф-лы, 1 ил., 3 табл., 3 пр.
Реферат
Изобретение относится к химической промышленности и находит применение в технологии производства сложных минеральных NPK-удобрений. NPK-удобрение (азофоска, нитроаммофоска) - это высокоэффективное экономическое комплексное удобрение, предназначенное для внесения под различные сельскохозяйственные культуры и практически в любые грунты. Тип NPK характеризуется массовыми долями азота, калия и фосфора в удобрении.
Современная агрохимическая наука предполагает применение удобрений с диапазоном соотношения питательных веществ N:P:K, а именно N:P2O5:K2O в разнообразных пределах, что требует создания технологических процессов, обеспечивающих возможность получения удобрений с регулируемым соотношением питательных веществ в соответствии с запросом потребителей.
Настоящее изобретение относится к получению гранулированных NPK-удобрений из фосфатной соли с содержанием фторапатита до 99%, в частности данная фосфатная соль представляет собой смесь CaHPO4×nH2O (дикальций фосфата) и Ca5(PO4)3F (фторапатита), где n - от 0 до 2, содержание фторапатита Ca5(PO4)3F в фосфатной соли 27% до 99%, при этом способ позволяет использовать различные соли калия и аммония в качестве источников питательных веществ в удобрении.
Также изобретение относится к непрерывному способу получения гранулированного NPK-удобрения из вышеуказанной фосфатной соли, состоящего в значительной степени из фторапатита. В качестве источника калия применяют соли калия, доступное на рынке сырье, в частности сульфат калия K2SO4. В качестве источника азота применяют аммиачную селитру (нитрат аммония) NH4NO3
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ:
Из RU 2216526 известен способ получения сложного NPK-удобрения с регулируемым соотношением N:P2O5:K2O, включающий кислотное разложение фосфатного сырья азотной кислотой, добавку азотсодержащего компонента, нейтрализацию аммиаком, смешение NP-пульпы с хлоридом или сульфатом калия, грануляцию и сушку целевого продукта.
Из патентов RU 2439039 и RU 2223933 также известны способы разложения фосфатных руд азотной кислотой с нейтрализацией пульпы аммиаком и добавлением солей калия.
Недостатком способов является использование в качестве кислоты дорогого и дефицитного компонента - азотной кислоты, неудовлетворительные потребительские свойства гранул из-за низкой прочности гранул и выделение соляной кислоты при хранении при использовании в качестве сырья хлорида калия. Стадия упаривания продукта до остаточной влажности ведет к дополнительным энергетическим затратам на процесс, а использование аммиака для нейтрализации остаточной кислоты приводит к снижению содержания растворимых солей фосфора в продукте.
Из патента RU 2107055 известен способ получения сложных удобрений с помощью разложения фосфатных руд смесью фосфорной и серной кислот с нейтрализацией смеси щелочной калийной солью, например карбонатом калия, а затем нейтрализацию аммиаком. Недостатком данного способа является применение экстракционной фосфорной кислоты, которая является дорогим продуктом, при производстве которого появляется большое количество отходов - фосфогипса, кроме того, с фосфорной кислотой в систему вводится большое количество воды, что приводит к необходимости проведения процесса выпарки для получения готового продукта. Использование аммиака для нейтрализации смеси приводит к снижению водорастворимой части фосфора ниже 60%.
Для процесса получения сложных удобрений из растворимых фосфатных солей также существуют некоторые исследованные способы.
Приготовление удобрения с содержанием азота и фосфора описывает китайский патент CN 1113900 (1994), где удобрение приготовляется из фосфатной руды и азотной кислоты, а результатом является Ca(H2PO4)2, который кристаллизируется, смешиванием нитрата аммония с маточным раствором получают NH4H2PO4, барботированием полученного маточного раствора аммиаком получают CaHPO4. К недостаткам такого способа можно отнести наличие стадии упаривания в процессе, фосфор в продукте находится не в водорастворимой форме дикальцийфосфата, не раскрыт способ введения калия в удобрение.
Патент GB 662079 раскрывает получение удобрений, содержащих растворимые соли фосфора на основе пульпы при разложении природных фосфатов, DCP (дикальцийфосфат) или TCP (трикальцийфосфат). Фосфаты разлагают действием серной кислоты, далее на смесь действуют азотной кислотой так, чтобы образовался MAP и нитрат кальция. Продукт стабилизируют добавлением сульфата аммония, в результате чего из нитрата кальция образуется гипс и нитрат аммония. Дополнительное количество добавленного сульфата аммония оказывает благоприятное влияние на удобрение, так как образуется двойная соль сульфата аммония с двумя молекулами нитрата аммония. В конце к смеси добавляют газообразный аммиак для того, чтобы достичь образования цитраторастворимого фосфата - DCP из остатков присутствующего MCP. К недостаткам можно отнести наличие в системе гигроскопичного нитрата калия, из-за чего смесь трудно обрабатывать для получения гранулированного продукта, а также наличие дикальцийфосфата в продукте, что снижает содержание водорастворимой формы фосфора.
В патенте Великобритании GB 702860 описано получение гранулированных NPK удобрений на основе сырья, полученного разложением фосфата. В соответствии с описанным, (монокальций фосфат) MCP получают путем разложения фосфатной руды азотной кислотой. Разложение осуществляется в два этапа. Одним из недостатков гранулированных сложных NP удобрений, в соответствии с описанием, является их пластичность, эту проблему не смогли решить в процессе производства.
Патент CN 1220236 (1997) описывает процесс, который включает смешивание гашеной извести с одним или обоими веществами, порошкообразными Ca3(PO4)2 и CaHPO4, добавлением фосфорной кислоты с концентрацией 62-85% при перемешивании при 80°C в течение 20-60 с с получением (монокальций фосфата) MCP, далее следует отверждение в течение 8-100 часов, естественная сушка и измельчение с получением продукта. Соотношения H3PO4/Ca3(PO4)2, или H3PO4/CaHPO4 одинаковы (7-16):100. Порошкообразный Ca(H2PO4)2 реагирует с порошкообразным Ca(OH)2 с образованием CaHPO4 и соотношение Ca(OH)2/Ca(H2PO4)2 составляет (10-22):100. К недостаткам данного способа можно отнести использование гашеной извести, для производства которой необходимы дополнительные энергетические затраты, процесс является периодическим (существует стадия созревания продукта).
Другими способами получения MCP являются процессы разложения апатитов фосфорной кислотой. Реакция апатита с фосфорной кислотой
Ca5(PO4)3F+7H3PO4→5Ca(H2PO4)2+HF
Процесс, способ и формы основных продуктов изменяются в зависимости от того, какие кислоты HCl, HNO3, H2SO4 и смеси кислот используют в качестве исходного материала.
Получение монокальций фосфата (MCP) из фосфорита описывает китайский патент CN 1305946. Этот способ включает реакцию фосфорита и серной кислоты при температурах от 70° до 95°C в течение 2-8 часов; фильтрование с получением от 10 до 30% фосфорной кислоты; добавление CaCO3 в фосфорной кислоты и удаления примесей; нейтрализацию с Ca(OH)2 и фильтрацию; добавление CaHPO4 и CaO; и распылительную сушку с получением Ca(H2PO4)2 и продукта с высоким содержанием фосфора (ядра кальциевых солей фосфорной кислоты, 19-22% фосфора). Недостаток данного процесса заключается в том, что одной из стадий проведения процесса является производство водного раствора фосфорной кислоты, поэтому необходимость выпарки воды приводит к дополнительным затратам на проведение процесса.
Изменения монокальцийфосфата (MCP), содержащегося в суперфосфатах кальция, рассматривают авторы в патенте MX NL03000044 (2003). При получении используется 98% серная кислота, безводный аммиак, оксид кальция и MCP, DCP или TCP. В первой фазе монокальцийфосфат и фосфорная кислота выделяют с водой из исходного суперфосфата, а твердые нерастворимые компоненты (сульфат кальция, фосфат кальция, фосфат железа и фосфат алюминия, соединения фтора, непрореагировавшие фосфорные исходные материалы и другие нерастворимые вещества, такие как диоксид кремния и силикаты) отделяются декантацией в воде. Очищенный раствор вступает в реакцию с суспензией гидроксида кальция с образованием суспензии кристаллов DCP, которые отделяют декантированием. Полученные кристаллы затем подвергают взаимодействию с кислым сульфатом аммония с образованием раствора моноаммонийфосфата, нерастворимые кристаллы дигидрата сульфата кальция отделяют фильтрованием. При реакции на последней стадии к суспензии с DCP добавляют концентрированную соляную кислоту и аммиак. По фильтрации получают раствор с концентрацией больше 48% MCP. Недостатком является - технологическая сложность проведения процесса, использование большого количества реагентов, потери продукта с осадком при фильтрации и декантации, а также получение MCP в виде раствора, что затрудняет его дальнейшую переработку.
Мексиканский патент MX NL0500002 описывает способ получения монокальций фосфата MCP, фосфата натрия, калия и MAP, при котором в качестве исходных материалов используются фосфатная руда, серная кислота, оксид кальция, сульфат аммония или сульфат калия. Важным является способ получения фосфатных солей, которые получают по реакции (дикальций фосфата) DCP с соответствующими кислыми сульфатами соответствующих солей (магния, аммония, калия). Полученный MAP или другие соли после фильтрации гипса концентрируются в испарителе и кристаллизируются. Недостаток способа - наличие стадии получения раствора солей и фильтрации гипса, что приводит к дополнительным затратам для перевода продукта в твердую форму выпариванием. Использование для разложения природной фосфорной руды приводит к образованию большого количества отходов - фосфогипса.
MCP (монокальций фосфат) в промышленной практике получают, главным образом, реакцией солей кальция с фосфорной кислотой. Примером может служить реакция H3PO4 с соединениями, содержащими кальций, такими как известковое молоко, при низкой температуре. Кроме того, существует возможность получения реакцией тонкоизмельченного известняка и фосфорной кислоты.
Другой метод состоит в приготовлении из ортофосфата кальция Ca3(PO4)2, известный как фосфат кальция, путем обработки серной кислотой смеси сульфата кальция и фосфорной кислоты, или с помощью реакции серной кислоты со смесью сульфата кальция и монокальцийфосфата Ca(H2PO4)2.
Фактически приготовление NPK происходит преимущественно разложением природных фосфатов кислотами. Уровень техники описывает приготовление материала, которым является простой суперфосфат (SSP) или тройной суперфосфат (TSP), полученный в результате реакции фосфатов с серной или фосфорной кислотой. Растворимая часть состоит в основном из монофосфата кальция, а нерастворимой частью является гипс в случае SSP (и другие нерастворимые примеси, кроме тех, которые содержатся в гипсе).
Во время переработки в сложные удобрения исходное сырье гранулируют в барабанных грануляторах, с добавлением небольшого количества щелочи (напр. аммиака). Содержание свободной фосфорной кислоты, содержание которой в порошковом суперфосфате доходит до 5%, снижается нейтрализацией при грануляции на 1-2%. Но одновременно снижается и содержание водорастворимой части, которая при таких способах достигает уровня около 60%.
Вышеприведенный уровень техники позволяет выявить основные аспекты и недостатки поведения реакционных систем грануляции сложных минеральных удобрений.
К недостаткам известных способов можно отнести то, что на текущем этапе развития технологии остаются проблематичными или не решенными следующие проблемы получения сложных удобрений NPK:
- Сложные удобрения на основе (монокальцийфосфата) MCP и нитрата аммония технологически проблематичны, актуальны проблемы со слеживаемостью. Гранулят получается эластичным, что затрудняет его производство по обычным технологическим процессам грануляции,
- MCP при нагревании может раствориться в "собственной" воде.
В настоящее время не известно производство в промышленных масштабах сложных удобрений, где фосфатная часть входит или присутствует в качестве монокальций фосфата MCP, то есть на базе суперфосфата или на базе тройного суперфосфата.
Таким образом, целью настоящего изобретения явилась разработка нового типа сложного NPK-удобрения с высокой водорастворимостью P2O5.
Поставленная задача решается за счет того, что NPK-удобрение производится с использованием K2SO4 в качестве источника калия, и нитрата аммония в качестве источника азота, в присутствии (монокальций фосфата) MCP и гипса.
Поскольку одним из требований к получаемому удобрению является высокая водорастворимость P2O5, важно, чтобы весь продукт, полученный в результате разложения сложной фосфатной соли по существу был в виде монокальций фосфата MCP, или другой соли фосфорной кислоты, которая обеспечит водорастворимость. При этом MCP должен остаться стабильным, чтобы предотвратить его конверсию в дикальций фосфат и фосфорную кислоту.
Необходимо также отметить, что в настоящее время сера рассматривается как один из важных питательных элементов в удобрениях заявленного типа. Согласно настоящему изобретению в целевом продукте присутствует безводный мелкодисперсный гипс (сульфат кальция), обеспечивающий доступность (для растений) такого элемента, как сера, необходимого и присутствующего в целевом, вносимом в почву удобрении.
Таким образом, заявленное изобретение обеспечивает улучшение свойств NPK-удобрения, а способ его получения позволяет повысить прочность гранул, решить проблему, связанную с пластичностью гранулированных сложных удобрений и тем самым улучшить потребительские свойства NPK-удобрений.
Следствием решения поставленной задачи является эффективность получаемого продукта, снижение себестоимости конечного продукта и значительное расширение сырьевой базы.
Согласно настоящему изобретению получают сложное азотно-фосфорно-калийное удобрение (NPK), содержащее нитрат аммония, сульфат кальция безводный, дигидрофосфат калия, причем массовая доля общего азота от 13-15%, массовая доля общих фосфатов в пересчете на P2O5 от 9-10%, массовая доля калия в пересчете на K2O от 13-15%.
Поставленная техническая задача получения такого удобрения решается тем, что способ получения сложного удобрения NPK из твердой фосфатной соли, представляющей собой смесь фторапатита и дикальций фосфата, включает разложение указанной твердой фосфатной соли серной кислотой полусухим методом, добавление сульфата калия в качестве источника калия, нитрата аммония в качестве источника азота, приготовление сларри (пульпы) NPK, а также грануляцию и сушку готового продукта.
При этом твердая фосфатная соль представляет собой смесь фторапатита Ca5(PO4)3F и дикальций фосфата CaHPO4×nH2O, где n - от 0 до 2, с содержанием фторапатита Ca5(PO4)3F от 27 до 99%.
Технический результат осуществления такого способа состоит в том, что водорастворимая форма P2O5 достигает 98%, иными словами фосфор, содержащийся в удобрении, растворим в воде на 98%. Важным моментом решения технической задачи являлся факт того, что в результате проводимого технологического процесса (монокальций фосфат) MCP, получаемый по реакции взаимодействия, был сформирован в виде моногидрата (т.е. оставался стабильным), с этой целью, температура при разложении дикальций фосфата не должна превышать 120°C. Именно при этой температуре начинает происходить обезвоживание.
Важным аспектом осуществления заявленного способа является добавление на одной из стадий технологического процесса сульфата калия к MCP, что существенным образом позволяет получить безводный гипс в определенных условиях проведения процесса. А именно взаимодействие MCP с сульфатом калия при температурном режиме не ниже 120°C позволяет получить преимущественно безводный гипс.
Также следует подчеркнуть, что условия предложенной технологии, а именно после приготовления MCP и подачи в реактор, приготовления сларри (пульпы) температура должна быть не ниже 120°C, это позволяет избежать образования полугидрата гипса (что крайне нежелательно для получаемого удобрения).
Технологические условия получения безводного гипса в мелкодисперсной форме в дальнейшем обеспечивают доступность важного в удобрении элемента - серы, уже непосредственно при внесении в почву.
Иными словами важным аспектом является то, что способ получения подразумевает использование MCP в виде моногидрата при температурном режиме, не превышающем 120°C, что в свою очередь позволяет избежать разложения MCP на дикальций фосфат и фосфорную кислоту.
СУЩНОСТЬ ЗАЯВЛЕННОГО ИЗОБРЕТЕНИЯ
Процесс разложения дикальций фосфата (DCP)
При контакте концентрированной серной кислоты и дикальций фосфата образуется (монокальций фосфат) MCP. Ингредиенты смешивают в эквимолярном соотношении по отношению к кальцию в (дикальций фосфате) DCP (эквимолярное количество серной кислоты рассчитывается в соответствии с составом DCP по химическим реакциям (1) и (4)).
Этот метод выбирается с учетом того, что DCP в качестве исходного материала не является чистым веществом, а смесью, в которой присутствует кроме DCP по меньшей мере фторапатит.
Процессы, происходящие при смешивании, можно выразить следующей системой уравнений:
Более конкретно, значение энтальпии реакции относится к следующему суммарному уравнению:
2CaHPO4⋅2H2O+H2SO4=CaSO4+Ca(H2PO4)2⋅H2O+3H2O
С точки зрения минералогии DCP, как правило, называют «brushite», что и есть дигидрат дикальций фосфата. В соответствии с результатами RTG измерений поставленного образца DCP, он присутствует в безводной форме («monetite»), поэтому в уравнении (1) DCP показан в безводной форме. В соответствии с RTG записью после реакции приготовления MCP, получающийся гипс находится в виде ангидрида, а реакция является экзотермической.
В итоге реакция 1, образование MCP протекает в два этапа:
Параллельно со стадией разложения фосфатной соли происходит взаимодействие серной кислоты и фторапатита.
Данная реакция сильно экзотермическая, в отличие от преобразования DCP.
В соответствии с механизмом реакция разложения фосфатов происходит в два этапа, второй этап на практике происходит медленнее и не совсем до конца:
Образовавшийся MCP подвергается «деградации» в присутствии воды с образованием DCP и фосфорной кислоты, из которых в свою очередь в результате обратной реакции образуется опять MCP. Эта обратная реакция протекает в присутствии воды, поэтому трудно достичь высокого уровня содержания водорастворимого фосфора (MCP) в реакционной смеси. На практике это решается способом проведения разложения при низком содержании воды в системе.
Необходимо, чтобы MCP был сформирован в виде моногидрата, из-за этого температура при разложении DCP не должна превышать 120°C, при этой температуре начинает происходить обезвоживание. В случае образования безводного MCP в условиях недостатка воды или высокой температуры реакционной смеси, гидратация протекает при приготовлении пульпы с отрицательным воздействием на баланс воды и вязкость реакционной среды, в условиях трудно контролируемых сопутствующих температурных изменений.
Осуществление получения NPK-удобрения с использованием сульфата калия в качестве источника калия:
При взаимодействии MCP с сульфатом калия образуется гипс и дигидрофосфат калия:
Реакция протекает в условиях насыщенного раствора нитрата аммония, который при высокой температуре содержит мало воды. В системе находится молярный избыток сульфата калия, в системе не остается свободного MCP. Образовавшийся гипс при температуре окружающей среды присутствует в безводной форме.
Продукт NPK, приготовленный с использованием DCP, серной кислоты, нитрата аммония и сульфата калия, в основном содержит следующие компоненты:
- Нитрат аммония
- Сульфат кальция безводный
- Дигидрофосфат калия.
Технологический процесс производства заявленного NPK-удобрения согласно изобретению состоит из следующих стадий:
1. Мокрая часть - приготовление сларри (пульпы)
2. Сухая часть - грануляция
3. Переработка абгазов и сточных вод.
Мокрая часть представляет собой систему процессов, в результате которых производится сларри NPK, который пригоден для грануляции:
- разложение фосфатной соли (в частности смеси DCP со фторапатитом) с помощью серной кислоты в монокальцийфосфат (MCP), процесс проводится в смесителе с псевдоожиженным слоем для достижения оптимального контакта частиц при проведении реакций. Проведение реакции в псевдоожиженном слое позволяет избежать обезвоживания моногидрата MCP. После проведения реакции в смесителе окончание реакции и выделение абгазов происходит в дозревателе.
Дальнейшее приготовление сларри происходит в каскаде из трех реакторов, снабженных мешалками.
При использовании сульфата калия как источника калия в процессе получения NPK, дальнейшая схема проведения способа следующая:
- в первом реакторе происходит реакция MCP (монокальцийфосфат) с аммиачной селитрой с образованием монофосфата аммония. Дозирование аммиачной селитры производится в виде расплава или в виде гранул через дозатор;
- во второй реактор через дозатор подается сульфат калия, достаточно мелкий, для полного протекания реакции;
- третий реактор каскада является дозревателем перед грануляцией продукта.
Из мокрой части процесса сларри поступает в грануляцию, которая осуществляется в грануляторе подходящей конструкции путем агломерации и наслаивания в псевдоожиженном слое. Ретур вводится в переднюю часть гранулятора. Сушку осуществляют горячим воздухом. После проведения следующих операций: грохочения, дробления, охлаждения, поверхностной обработки антислеживающей добавкой, получают готовый продукт, пригодный для хранения и транспортировки.
Абгазы, содержащие пыль продуктов и сырья, используемого в производстве, а также газы, выделяющиеся в процессе производства, улавливают в мокрых скрубберах с добавлением в абсорбент нейтрализующих реагентов.
Таким образом, основной целью заявленного изобретения является приготовление NPK-удобрения с использованием K2SO4, в качестве источника калия, и нитрата аммония, в качестве источника азота в присутствии MCP и гипса. В связи с высокими требованиями к водорастворимости P2O5, необходимо, чтобы, по существу, все фосфорное сырье было в виде MCP, или другой соли фосфорной кислоты, которая обеспечит водорастворимость. MCP должен остаться стабильным, чтобы предотвратить его конверсию в DCP и фосфорную кислоту.
В отличие от остальных макропитательных элементов, для фосфорных соединений, вносимых в почву, основной вопрос состоит в их полезности для питания растений. Исходя из этого, все удобрения, содержащие фосфор, редко оценивают по общему содержанию фосфора. Однако всегда приводят критерий относительной растворимости, установленный при определенных условиях - в воде (самая быстродействующая форма), в слабых кислотах (2%-ная лимонная кислота или муравьиная кислота) или в растворах, которые могут моделировать условия в почве (например, в нейтральном или щелочном растворе цитрата аммония).
Из фосфатов кальция в воде растворяется только кислый фосфат кальция - монокальций фторфосфат (MCP), который находится в качестве безводной соли Ca(H2PO4)2 или как моногидрат Ca(H2PO4)2×H2O. Средний фосфат кальция - дикальций фосфат (DCP) не растворяется в воде и встречается в виде дигидрата CaHPO4×2H2O или в виде безводной соли CaHPO4. Точно также трикальцийфосфат Ca3(PO4)2 является нерастворимым в воде.
Таким образом, весь предлагаемый процесс производства NPK можно разделить на 2 основных этапа - процесс получения водорастворимой фосфатной соли и процесс получения из этой соли сложных удобрений.
Согласно данному изобретению настоящее производство сложного удобрения NPK состоит из двух основных процессов - мокрого (производство сарри NPK) и сухого (гранулирование, помол, грохочение и охлаждение готового продукта).
Более подробно рассматривается следующая стадия проведения процесса:
1. Мокрая часть
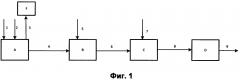
На фиг. 1 представлена схема мокрого процесса для получения сларри NPK при использовании в качестве источника калия в продукте, сульфата калия K2SO4.
Фосфатная соль, представляющая собой смесь фосфатов кальция с фторапатитом, (поток 1) совместно с серной кислотой (поток 2) поступают в проточный аппарат (блок А), представляющий собой смеситель с быстроходно вращающимися лопастями и дозреватель реакционной массы. Дозировка серной кислоты производится в эквимолярном соотношении к фосфатной соли. В результате проведения процесса в реакционной массе блока А происходят следующие химические процессы:
В обоих случаях реакции происходят в 2 этапа - реакция фосфата с серной кислотой и выделение фосфорной кислоты, реакция фосфорной кислоты с фосфатной солью с образованием (монокальцийфосфата) MCP. Реакция образования MCP может происходить не до конца, в том числе из-за разложения MCP в присутствии воды.
Реакции 1 и 2 являются экзотермическими, особенно реакция 2. Техническое решение по отведению тепла реакции является комплексным - реактор оснащен водяной рубашкой, также часть тепла выводится из системы отходящими газами часть с парами воды. Для обеспечения отвода паров и газов смеситель блок А работает под вакуумом. Параметры системы отведения тепла должны быть подобраны таким образом, чтобы температура реакционной смеси не превышала 120°C.
После смесителя реакционная смесь подается в дозреватель, входящий в состав блока А, представляющий собой аппарат с мешалкой. В дозревателе происходят следующие процессы:
- идет завершение реакционных процессов;
- происходит окончательное освобождение реакционной смеси от газов;
- происходит усреднение химических и физических свойств реакционной массы.
Дальнейшее приготовление сларри осуществляется в каскаде из трех реакторов (Блок В, С, D) с мешалкой и рубашкой для обогрева, оснащенных переливом.
Первый реактор сларри (блок В):
Основным агентом процесса в реакторе является аммиачная селитра. Она поставляется в гранулированном виде. Для ее внесения в систему можно применить два подхода:
1. Селитру до внесения в систему расплавляют в отдельном реакторе, получают расплав, раствор в воде с содержанием селитры 93-97% при температуре примерно 158°C и это дозировуют в первый сларри реактор.
2. Селитру вносят в систему в виде гранул, дозатором в первый сларри-реактор.
В реактор блок В подается аммиачной селитра в виде гранул или расплава (поток 5), в зависимости от состава продукта подается MCP моногидрат (вместе с образовавшимся гипсом) и в нужном количестве вода в виде пара (поток 4). Смесь в реакторе поддерживается при температуре не выше 160°C. Тепло подается паром рубашкой и прямым паром. В реакторе не протекают химические процессы, в результате смешения образуется однородная сларри в насыщенном растворе аммиачной селитры. MCP отчасти растворяется, а часть остается не растворимой, гипс остается безводным, в системе не растворяется.
Второй реактор сларри:
В реактор (Блок С) через перелив поступает сларри из первого реактора (поток 6) и дозатором подается сульфат калия (поток 7). При взаимодействии MCP с сульфатом калия происходит образование гипса и дигидрофосфата калия:
Для достижения полного протекания реакции, исчезновения MCP и образования продуктов реакции замещения и получения смеси с низкой вязкостью нужно, чтобы процесс протекал при температуре, препятствующей образованию полугидрата гипса, мин 120°C, и размер частиц поступающего сульфата был достаточно мелким.
Третий реактор сларри
Сларри из второго реактора (поток 8) поступает переливом в третий реактор (блок D). Этот реактор для данного продукта исполняет роль компенсатора перед грануляцией. Температура поддерживается в пределах 125-145°C. После третьего реактора сларри поступает в сухой процесс (поток 9).
Улавливание фтористого водорода происходит в блоке F.
Поток пара и газов низкого давления из смесителя (поток 3) поступает в абсорбционную колону, где на улавливание фторводорода применяется основной раствор (сларри карбоната кальция или гидроксид кальция, растворы гидроксидов щелочных металлов). Конечный продукт, фториды металлов, промывается и в зависимости от применения, или утилизируется, или сушится и упаковывается, и поступает на склад.
Такой продукт NPK, приготовленный с использованием фосфатной соли, серной кислоты, нитрата аммония и сульфата калия, в основном, содержит следующие компоненты:
- Нитрат аммония
- Сульфат кальция безводный
- Дигидрофосфат калия.
При этом диапазон соотношений питательных веществ в получаемом типе NPK-удобрения иллюстрируется в нижеприведенных примерах.
2. Сухая часть
Сларри с температурой 125-145°C поступает самотеком из третьего реактора в гранулятор, типа лопастного смесителя. В его переднюю часть поступает ретур. Сларри распределяется по материалу в грануляторе распределителем. Грануляция осуществляется за счет агломерации и наслаивания в псевдоожиженном слое, который создается лопастями, установленными на двух валах. В гранулятор может подаваться пар 0,3-0,4 МПа для подстройки оптимальных условий работы гранулятора (температура, влажность), который соответствует выпускаемому качеству комбинированного удобрения. Влажные гранулы, с температурой в пределах 90-110°C, в зависимости от состава удобрения и содержанием воды 1,5-3 масс.%, прямо из лотка гранулятора удобрение через желоб падает в сушильный барабан. При грануляции и суше могут протекать последние химические реакции.
Примеры:
Пример 1
За основу проведения принят процесс, описанный выше, согласно схеме на фиг. 1
Получаемое сложное азотно-фосфорно-калийное удобрение (NPK) содержит нитрат аммония, сульфат кальция безводный, дигидрофосфат калия, причем массовая доля общего азота от 13-15%, массовая доля общих фосфатов в пересчете на P2O5 от 9-10%, массовая доля калия в пересчете на K2O от 13-15%.
Технологические условия осуществления процесса позволяют получить сложное NPK-удобрение типа 15:10:15, что подразумевает массовую долю общего азота, массовую долю общих фосфатов в пересчете на P2O5 и массовую долю калия в пересчете на K2O.
Согласно варианту осуществления изобретения, производство указанного выше NPK на основе твердой фосфатной соли, представляющей собой смесь фторапатита Ca5(PO4)3F и дикальций фосфата CaHPO4×nH2O, где n - от 0 до 2, а содержание фторапатита Ca5(PO4)3F от 27 до 99% позволяет использовать сульфат калия и аммиачную селитру.
В качестве сырья используется фосфатная соль, полученная путем солянокислого разложения фосфорной руды, отделением нерастворимого осадка с последующим высаждением твердой фосфатной соли с помощью сларри карбоната кальция. Для производства фосфатной соли использовалась руда месторождения Кейсик состава:
В результате процесса получена смесь фторапатита Ca5(PO4)3F и дикальций фосфата CaHPO4×nH2O, где n - от 0 до 2, используемая в дальнейшем для процесса производства NPK состава:
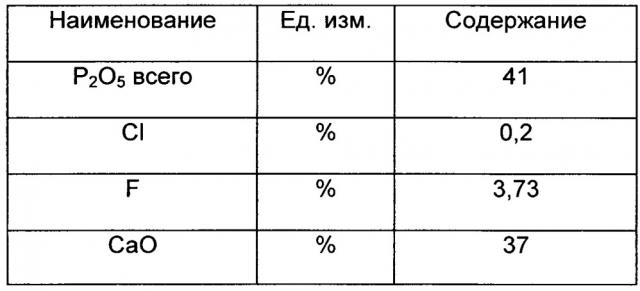
Фтор, содержащийся в фосфатной соли, произведенной солянокислым разложением фосфатной руды, существует в смеси в качестве фторапатита, что подтверждено аналитическим контролем образцов. Фосфатная соль с содержанием фторапатита 27%, используемая в дальнейшем для процесса производства NPK, а именно:
При температуре 115°С проводят стадию разложения указанной твердой фосфатной соли серной кислотой полусухим методом, где разложение осуществляется при низком содержании воды. Это необходимое условие обусловлено подбором эквимолярных соотношений в системе таким образом, чтобы МСР оставался в виде моногидрата стабильным. Более конкретно в фосфатную соль [100 кг/ч] в смесителе с псевдоожиженным слоем подается 96-98% серная кислота [38 кг/ч] в эквимолярном соотношении. Процесс проводится под вакуумом для лучшего удаления выделившихся газов, главным образом фтористого водорода. Реакционная масса через дозреватель подается в каскад реакторов с мешалкой. Газ, в основном фтористый водород, поступает на абсорбцию. Процесс проводится при температуре не более 120°С.
Далее в каскад реакторов в первый реактор подается аммиачная селитра [106 кг/ч], процесс проводится при температуре 125°С, во второй ректор подается сульфат калия [161 кг/ч]. После завершения процесса в третьем реакторе смесь подается в сухую часть процесса, в результате грануляции и сушки произведено сложное удобрение NPK компонентного состава N:P2O5:K2O=15:10:15 с содержанием серы в виде безводного мелкодисперсного гипса.
Пример 2
За основу проведения принят процесс, описанный выше, согласно схеме на фиг. 1
Получаемое сложное азотно-фосфорно-калийное удобрение (NPK) содержит нитрат аммония, сульфат кальция безводный, дигидрофосфат калия, причем массовая доля общего азота от 13-15%, массовая доля общих фосфатов в пересчете на P2O5 от 9-10%, массовая доля калия в пересчете на K2O от 13-15%.
Согласно варианту осуществления изобретения, производство указанного выше NPK на основе твердой фосфатной соли, представляющей собой смесь фторапатита Ca5(PO4)3F и дикальций фосфата CaHPO4×nH2O, где n - от 0 до 2, а содержание фторапатита Ca5(PO4)3F от 27 до 99%, позволяет использовать сульфат калия и аммиачную селитру.
В качестве сырья используется фосфатная соль, полученная путем солянокислого разложения фосфорной руды, аналогично примеру 1.
В результате процесса получена смесь фторапатита Са5(PO4)3F и дикальций фосфата CaHPO4×nH2O, где n - от 0 до 2, используемая в дальнейшем для процесса производства NPK состава:
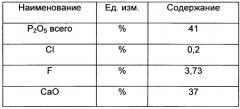
Фтор, содержащийся в фосфатной соли, произведенной солянокислым разложением фосфатной руды, существует в смеси в качестве фторапатита, что подтверждено аналитическим контролем образцов. Фосфатная соль с содержанием фторапатита 99%, используемая в дальнейшем для процесса производства NPK, а именно:
При температуре 115°С проводят стадию разложения указанной твердой фосфатной соли серной кислотой полусухим методом, где разложение осуществляется при низком содержании воды. Это необходимое условие обусловлено подбором эквимолярных соотношений в системе таким образом, чтобы МСР оставался в виде моногидрата стабильным. Более конкретно в фосфатную соль [100 кг/ч] в смесителе с псевдоожиженным слоем подается 96-98% серная кислота [38 кг/ч] в эквимолярном соотношении. Процесс проводится под вакуумом для лучшего удаления выделившихся газов, главным образом фтористого водорода. Реакционная масса через дозреватель подается в каскад реакторов с мешалкой. Газ, в основном фтористый водород, поступает на абсорбцию. Процесс проводится при температуре не бо