Композиция антибактериальная для профилактики или лечения госпитальных инфекций (варианты), штаммы бактериофагов, используемые для получения такой композиции
Иллюстрации
Показать всеГруппа изобретений относится к вариантам антибактериальной композиции для профилактики или лечения госпитальных инфекций, штаммам бактериофага и молекулам нуклеиновой кислоты, соответствующим геному бактериофага. Предложенная композиция включает 7 штаммов бактериофага, каждый из которых представлен комбинацией фильтратов фаголизатов бактерий с литической активностью не ниже 10-4 по Аппельману в отношении тест-штаммов и выделенных из организма человека изолятов бактерий, а также целевые добавки в количестве 0,01±99,99 мас.% от массы композиции. При этом используют фильтрат фаголизата Staphylococcus aureus, полученный с использованием штамма бактериофага Staphylococcus aureus SCH1, депонированного в коллекции ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-105, фильтрат фаголизата Staphylococcus aureus, полученный с использованием штамма бактериофага Staphylococcus aureus SCH111, депонированного в коллекции ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-95, фильтрат фаголизата Klebsiella pneumoniae, полученный с использованием штамма бактериофага Klebsiella pneumoniae KPV15, депонированного в коллекции ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-90, фильтрат фаголизата Klebsiella pneumoniae, полученный с использованием штамма бактериофага Klebsiella pneumoniae KPV811, депонированного в ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-91, фильтрат фаголизата Pseudomonas aeruginosa, полученный с использованием штамма бактериофага Pseudomonas aeruginosa РА5, депонированного в ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-88, фильтрат фаголизата Pseudomonas aeruginosa, полученный с использованием штамма бактериофага Pseudomonas aeruginosa РА10, депонированного в коллекции ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-89, фильтрат фаголизата Acinetobacter baumannii, полученный с использованием штамма бактериофага Acinetobacter baumannii АМ24, депонированного в коллекции ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-106. Вариант композиции содержит также фильтрат фаголизата Acinetobacter baumannii, полученный с использованием штамма бактериофага Acinetobacter baumannii АР22, депонированного в коллекции ФБУН ГНЦ ПМБ Роспотребнадзора под номером Ph-42. Предложены также соответствующие штаммы бактериофагов. Предложены также молекулы нуклеиновой кислоты, соответствующие геному указанных бактериофагов. Группа изобретений позволяет расширить ассортимент средств, содержащих в качестве основного действующего начала высокоселективные природные антибактериальные компоненты (бактериофаги), обеспечить биологическую стабильность и активность бактериофагов в составе композиции средства. Кроме того, композиция обладает низким риском токсических и побочных эффектов, позволяет расширить варианты и способы практического применения средств, содержащих бактериофаги, обеспечивает стабильность при хранении и эффективность применения в широком диапазоне температур. 16 н. и 12 з.п. ф-лы, 1 ил., 4 табл., 24 пр.
Реферат
Изобретение относится к биотехнологии и может быть использовано в производстве продукции лечебно-профилактического назначения на основе бактериофагов.
Распространение антибиотикоустойчивых бактерий, а также открытие роли биопленок, устойчивых к антибиотикам, в развитии хронических инфекций, возродило интерес к использованию бактериофагов.
В настоящее время антибиотики широко используются как для лечения, так и для профилактики различных заболеваний. Однако частота и тяжесть течения гнойно-септических инфекций не имеют тенденции к снижению. Одной из причин этого является возрастание этиологической роли микроорганизмов, резистентных к большинству антибиотиков. Применение антибиотиков сопровождается нарушением состава нормальной микрофлоры, аллергизацией и быстрой адаптацией микроорганизмов к окружающей среде.
По данным Центров США по контролю и профилактике заболеваний (CDC) 1 из каждых 20 госпитализированных больных встречается с госпитальной инфекцией. Это соответствует примерно 1,7 млн больничных инфекций в год и является причиной 99000 смертей в год. Оценки CDC показывают, что прямые затраты на внутрибольничные инфекции с поправкой на инфляцию превышают 30 миллиардов долларов ежегодно.
Около 16% госпитальных инфекций связаны с множественной лекарственной устойчивостью патогенов:
метициллин-резистентных Staphylococcus aureus(8%)
ванкомицин-резистентных Enterococcifaecium (4%)
карбапенем-резистентных P. aeruginosa (2%)
цефалоспорин-резистентных K. pneumonia (1%)
карбапенем-резистентных А. baumannii (0,5%)
Метициллин-устойчивый золотистый стафилококк (MRSA) вызывает целый ряд заболеваний: от кожных и раневых инфекций до пневмонии и инфекций кровотока, что может привести к сепсису и смерти. Стафилококковые бактерии, в том числе MRSA, являются одной из наиболее распространенных причин инфекционных заболеваний человека. Устойчивость к метициллину и аналогичных антибиотиков (нафциллин, оксациллин) и устойчивость к цефалоспоринам по оценкам CDC в 2011 году привела к возникновению 80461 случая заболевания, вызванного MRSA и 11 285 смертным случаям.
K. pneumonia является важной причиной внутрибольничных инфекций. В 1998 году на K. pneumonia и K. oxytoca приходилось 8% внутрибольничных бактериальных инфекций в США и в Европе, в том числе инфекции мочевыводящих путей, пневмонии, септицемии и инфекции мягких тканей. K. pneumonia считается госпитальным оппортунистическим патогеном, который обычно поражает пациентов с имплантированными медицинскими устройствами. K. pneumonia продуцирует расширенный спектр β-лактамаз и вызванные им инфекции не поддаются лечению цефалоспоринами третьего поколения. Это резко ограничивает терапевтические возможности.
P. aeruginosa часто является причиной инфекции, особенно у больных с нарушенной иммунной защитой, включая пневмонию, инфекции кровотока, инфекции мочевыводящих путей и хирургических инфекций. Это наиболее распространенный возбудитель, выделенный от больных, находящихся на госпитализации более 1 недели. Некоторые штаммы P. aeruginosa устойчивы почти ко всем антибиотикам, включая аминогликозиды, цефалоспорины, фторхинолоны, карбапенемы.
В связи с вышесказанным перспективным направлением в усовершенствовании профилактики и лечения инфекций, в т.ч. гнойно-септических, является использование лечебных бактериофагов, которые могут воздействовать и на устойчивые к антибиотикам штаммы бактерий. Они сами или в комплексе с другими антибактериальными препаратами повышают эффективность этиотропной терапии. Кроме того, препараты бактериофагов не токсичны, не вызывают развития дисбактериозов и других побочных эффектов.
Преимущества бактериофагов перед антибиотиками достаточно очевидны и заключаются в следующем: бактериофаги способны уничтожать бактерии, устойчивые к антибиотикам, т.к. они действуют лишь на определенные бактерии; свободно проникают в ткани организма человека и животного, не нарушая баланса высшего организма; практически не вызывают побочных эффектов; не подавляют рост нормофлоры; не ослабляют иммунитет; не развивают устойчивость бактерий; сочетаются с любыми лекарственными препаратами; оказывают иммуностимулирующее действие.
Многие специалисты включают бактериофаги в комплекс лечебных мероприятий и убеждаются в их высокой эффективности как при местном, так и при пероральном применении. В ряде случаев бактериофаги применяли без антибиотиков. При этом отмечено, что клиническое улучшение происходило в среднем на 3-6 суток быстрее, чем в контрольной группе. Значительно сокращался срок пребывания больных на койке.
Установлено, что, несмотря на способ применения (местное или общее), фаги проникают в кровь и лимфу и попадают в очаг воспаления, оказывая положительное влияние на иммунный статус. Бактериофаги способны быстро проникать в кровь и лимфу и выводиться через почки с мочой. Активность лечебно-профилактических бактериофагов в отношении возбудителей гнойно-септических и энтеральных заболеваний достаточно высока - от 72 до 90%, в т.ч. и в отношении штаммов госпитального происхождения, характеризующихся множественной устойчивостью к антибиотикам. Соответствие препаратов бактериофагов современной этиологической структуре возбудителей достигается за счет их постоянной адаптации к циркулирующим штаммам путем обновления фаговых рас и производственных бактериальных штаммов. Эта особенность выгодно отличает фаги от других антимикробных препаратов - антибиотиков, эубиотиков или вакцин, где производственные штаммы (штаммы-продуценты) или синтезированное вещество не подлежат каким-либо модификациям. Под воздействием фага в первую очередь происходит активация фагоцитоза, повышается активность нейтрофилов и их метаболическая активность, что препятствует рецидивированию инфекции и хронизации воспалительного процесса. Отмечено снижение числа лейкоцитов и нейтрофилов, а уровень лимфоцитов повышается при лечении хронических воспалительных заболеваний на фоне иммунодепрессивных состояний, бактерионосительства.
Современные лечебно-профилактические препараты бактериофагов составлены из поликлональных вирулентных бактериофагов широкого диапазона действия, активных и в отношении бактерий, устойчивых к антибиотикам.
В настоящее время в России для фаготерапии и фагопрофилактики госпитальных инфекций производятся и используются:
- поливалентный сальмонеллезный бактериофаг;
- моновалентные бактериофаги - брюшнотифозный, дизентерийный, протейный, синегнойный, холерный, стафилококковый, стрептококковый, колифаг (кишечной палочки);
- комбинированные препараты поливалентных бактериофагов, среди которых наиболее известны:
- Пиобактериофаг комбинированный (Пиополифаг) способен лизировать стафило-, стрептококки (в т.ч. энтерококки), протея, синегнойную и кишечную палочки.
Предназначен для профилактики и лечения гнойно-воспалительных заболеваний уха, горла, носа, пазух носа, дыхательных путей, легких; хирургических инфекций (нагноений, абсцесса, флегмоны, остеомиелита, перитонита), урогенитальных инфекций (уретрита, цистита, пиелонефрита); гинекологических инфекций (кольпита, эндометрита, сальпингоофорита); энтеральных инфекций (гастроэнтероколита, холецистита, дисбактериоза); гнойно-септических заболеваний новорожденных.
- Пиобактериофаг поливалентный (Секстафаг) обладает способностью специфически лизировать стафило-, стрептококки (в т.ч. энтерококки), кишечную палочку, протея, синегнойную палочку и клебсиеллупневмония. Предназначен для профилактики и лечения различных форм гнойно-воспалительных и энтеральных заболеваний: гнойно-воспалительных заболеваний уха, горла, носа, дыхательных путей, легких и плевры; хирургических, урогенитальных и энтеральных инфекций; генерализированных септических заболеваний, в т.ч. гнойно-септических заболеваний новорожденных и детей грудного возраста.
- Пиобактериофаг комплексный жидкий представляет собой смесь фаголизатов стафило-, стрепто-, энтерококков, кишечной палочки, протея (мирабилис и вульгарис), синегнойной палочки и клебсиелл (пневмония и окситока). Применяют для лечения и профилактики гнойно-воспалительных и кишечных заболеваний: заболеваний уха, горла, носа, дыхательных путей и легких; хирургических, урогенитальных, энтеральных инфекций; генерализованных и септических заболеваний; гнойно-воспалительных заболеваний новорожденных, для обработки послеоперационных и свежеинфицированных ран.
Недостатком данных комплексных препаратов является тот факт, что бактериофаги, входящие в их состав в качестве активного начала, а также коллекционные штаммы чувствительных микроорганизмов, на которых они культивируются, не имеют полной биологической и молекулярно-генетической характеристики. Коллекция штаммов чувствительных микроорганизмов пополняется и постоянно обновляется циркулирующими возбудителями (Функнер Е.В. Микробиологические и технологические аспекты разработки комплексного препарата бактериофагов. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. - Пермь, 2007. - 24 с.). В результате при регламентируемых пассажах и обновлениях штаммов бактериофагов в препаратах могут появиться умеренные бактериофаги, в коллекцию могут быть включены потенциально лизогенные бактерии, что в совокупности влияет на безопасность и эффективность данных препаратов.
Кроме того, ни один из вышеперечисленных препаратов не содержит штаммов бактериофага против внутрибольничных инфекций, вызванных A. baumannii, являющимся наиболее клинически значимым видом рода Acinetobacter, который вызывает 2-10% грамотрицательных инфекций в Европе и США, до 1% всех нозокомиальных инфекций. В патентной литературе описан штамм бактериофага A. baumannii, депонированный в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером АР22, который используется для идентификации микроорганизмов этого вида и для разработки комплексных лечебных препаратов против внутрибольничных инфекций, но на практике данные препараты не используются (патент РФ №2439151).
В качестве общих факторов риска инфекций, вызванных A. baumannii, выделяют: мужской пол; пожилой возраст; наличие сопутствующих заболеваний (злокачественные заболевания крови, сердечно-сосудистая или дыхательная недостаточность, диссеминированное внутрисосудистое свертывание крови); длительность использования инвазивных методов лечения и мониторинга (ИВЛ более 3 дней; ингаляционное введение лекарственных препаратов; введение назогастрального зонда; трахеостомия; катетеризация мочевого пузыря, центральной вены, артерии, оперативное вмешательство); длительное нахождения в стационаре или отделении реанимации и интенсивной терапии (ОРИТ); предшествующая антибактериальная терапия с использованием цефалоспоринов, фторхинолонов или карбапенемов.
Предшествующее госпитализации в ОРИТ хирургическое вмешательство повышает риск инфицирования примерно в 5 раз.
A. baumannii в большинстве случаев вызывает заболевания у тяжелобольных иммуноскомпрометированных пациентов. Данный микроорганизм может являться причиной инфекций дыхательных путей (синусит, трахеобронхит, пневмония), кровотока (сепсис, эндокардит естественных и искусственных клапанов), мочевыводящих путей, раневой и хирургической инфекций, инфекций кожи и мягких тканей (включая некротизирующий фасциит), нервной системы (менингит, вентрикулит, абсцесс мозга), интраабдоминальных (абсцессы различной локализации, перитонит), опорно-двигательного аппарата (остеомиелит, артрит).
Главной задачей, решаемой изобретением, является расширение спектра специфической активности композиции лечебно-профилактического назначения на основе бактериофагов за счет включения в ее состав активных ингредиентов вирулентных бактериофагов с неперекрывающимся или частично перекрывающимся спектром литической активности и подбора целевых добавок, обеспечивающих стабилизацию активности бактериофагов, входящих в состав композиции и ее назначение в зависимости от применяемой лекарственной формы (далее по тексту описания, формулы и реферата изобретения - целевые добавки).
Поставленная задача реализуется за счет того, что композиция антибактериальная включает комбинацию фильтратов фаголизатов бактерий с литической активностью не ниже 10-4 по Аппельману в отношении тест-штаммов и выделенных из клинического материала изолятов бактерий: фильтрат фаголизата Staphylococcus aureus, полученный с использованием штамма бактериофага Staphylococcus aureus SCH1, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-105, фильтрат фаголизата Staphylococcus aureus, полученный с использованием штамма бактериофага Staphylococcus aureus SCH111, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-95, фильтрат фаголизата Klebsiella pneumoniae, полученный с использованием штамма бактериофага Klebsiella pneumoniae KPV15, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-90, фильтрат фаголизата Klebsiella pneumoniae, полученный с использованием штамма бактериофага Klebsiella pneumoniae KPV811, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-91, фильтрат фаголизата Pseudomonas aeruginosa, полученный с использованием штамма бактериофага Pseudomonas aeruginosa РА5, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-88, фильтрат фаголизата Pseudomonas aeruginosa, полученный с использованием штамма бактериофага Pseudomonas aeruginosa РА10, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-89, фильтрат фаголизата Acinetobacter baumannii, полученный с использованием штамма бактериофага Acinetobacter baumannii АМ24, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-106, и/или фильтрат фаголизата Acinetobacter baumannii, полученный с использованием штамма бактериофага Acinetobacter baumannii АР22, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-42. Композиция может включать целевые добавки в количестве 0,01÷99,99 мас. % от массы композиции в виде смеси ингредиентов, выбранных в зависимости от применяемой лекарственной формы. Данная композиция в связи с достаточным спектром стабильной литической активности может быть использована для профилактики и лечения госпитальных инфекций и представлена в виде различных лекарственных форм: суспензии, мази, суппозитория, порошка, таблетки, капсулы, геля, спрея и т.д.
Заявлены 2 варианта антибактериальной композиции с использованием в качестве активного начала фильтратов фаголизатов 7 либо 8 бактериофагов.
Отбор 8 штаммов вирулентных бактериофагов осуществляли в процессе работы с 40 штаммами Staphylococcus aureus, 46 штаммами Pseudomonas aeruginosa), 40 штаммами Klebsiella pneumoniae и 80 штаммами Acinetobacter baumannii.
Среды и условия культивирования бактерий
Бактериальные культуры выращивали на плотных и жидких питательных средах: ГРМ-бульон - на основе препарата «питательный бульон для культивирования микроорганизмов сухой (ГРМ-бульон)» (ФБУН ГНЦ ПМБ, Оболенск), ГРМ-агар на основе препарата «питательный агар для культивирования микроорганизмов сухой (ГРМ-агар)» (ФГУН ГНЦ ПМБ, Оболенск).
Оценка литической активности бактериофагов.
Спектр литической активности бактериофагов оценивали несколькими способами:
а) Микрометод. Готовили последовательные десятикратные разведения фаголизатов в SM-буфере в 96-луночном планшете. Аликвоты из разведений переносили репликатором на газоны бактериальных штаммов, нанесенных на поверхность питательного агара в полужидкой (0,6%-ной) агарозе. Результаты учитывали после инкубации чашек при 37°С в течение ночи. Штаммы, на которых негативные зоны наблюдались в нескольких разведениях, считали чувствительными. Штаммы, на которых зоны лизиса наблюдались при нанесении нативного препарата фага (не разведенного), относили к условно чувствительным. Штаммы, на которых зоны лизиса отсутствовали, считали резистентными. Таким способом одновременно на одном газоне оценивали литическую активность нескольких бактериофагов.
б) По 10 мкл из последовательных десятикратных разведений фаголизата наносили на газон бактериального штамма в полужидкой (0,6%-ной) агарозе. Результаты учитывали после инкубации чашек при 37°С в течение ночи. Интерпретация результатов аналогична той, которая указана в первом способе. Данный способ позволяет оценить не только спектр литической активности фага, но и подсчитать количество бляшкообразующих единиц в единице объема фаголизата.
Штаммы вирулентных бактериофагов, используемые для получения фильтратов фаголизатов
1. Штамм бактериофага Staphylococcus aureus SCH1 выделен из клинических образцов и перевязочного материала больниц Москвы и Челябинска на культуре бактерий штамма Staphylococcus aureus 2004 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-105.
Штамм бактериофага Staphylococcus aureus SCH1 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют мелкие негативные прозрачные колонии диаметром 1-2 мм с ровными краями без ореола.
Нуклеотидная последовательность генома штамма представлена в графической части.
2. Штамм бактериофага Staphylococcus aureus SCH111 выделен из клинических образцов и перевязочного материала больниц Москвы и Челябинска на культуре бактерий штамма Staphylococcus aureus 2004 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-95.
Штамм бактериофага Staphylococcus aureus SCH111 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют мелкие негативные прозрачные колонии диаметром 1-2 мм с ровными краями без ореола.
Нуклеотидная последовательность генома штамма представлена в графической части.
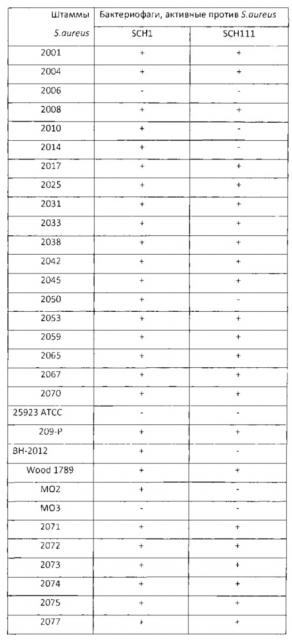
Оценку спектра литических свойств фагов определяли на 40 индикаторных клинических штаммах S. aureus методом спот-теста. Наработанные фаголизаты стерилизовали хлороформом и наносили на свежезасеянные газоны S. aureus. О чувствительности штаммов S. aureus к фагам судили по появлению стерильного пятна на выросшем через 16-18 часов газоне индикаторного штамма. Результаты изучения спектра литического действия стафилококковых бактериофагов представлены в табл. 1.
Таблица 1. Спектр литического действия стафилококковых бактериофагов в отношении клинических штаммов S. aureusino (результатам спот-теста).
Как следует из полученных данных, наиболее широким спектром литического действия в отношении индикаторных культур обладает бактериофаг SCH1: он подавляет рост 92,5% стафиликокковых штаммов; в меньшей степени активен бактериофаг бактериофаги SCH111 (72%). Следует отметить, что на чувствительных культурах S. aureus в спот-тесте бактериофаги SCH1 и SCH111 образовывали стерильные пятна лизиса при разведении их в 10000 раз.
Два бактериофага S. aureus устойчивы к действию хлороформа: титр их в фаголизатах, стерилизованных фильтрованием через фильтр с диаметром пор 0,45 мкм, не превышал титр в аналогичных фаголизатах, обработанных хлороформом.
При изучении жизнеспособности стафилококковых фагов выявлена их чувствительность к сравнительно невысоким температурам: нагревание препаратов бактериофагов до температуры выше 56°С полностью инактивирует их за 15 минут. Оптимальная температура для поддержания исходного титра фагов в течение нескольких месяцев составляет от 4 до 10°С.
3. Штамм бактериофага Klebsiella pneumoniae KPV15 выделен из образцов сточных вод Москвы на культуре бактерий штамма Klebsiella pneumoniae В-716 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-90.
Штамм бактериофага Klebsiella pneumoniae KPV15 характеризуется следующими свойствами: образует мелкие непрозрачные негативные колонии диаметром 1-2 мм со слабым ореолом (1-2 мм) или без него.
Нуклеотидная последовательность генома штамма представлена в графической части.
4. Штамм бактериофага Klebsiella pneumoniae KPV811 выделен из образцов сточных вод Москвы на культуре бактерий штамма Klebsiella pneumoniae В-811 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-91.
Штамм бактериофага Klebsiella pneumoniae KPV811 характеризуется следующими свойствами: образует мелкие непрозрачные негативные колонии диаметром 1-2 мм со слабым ореолом (1-2 мм) или без него.
Нуклеотидная последовательность генома штамма представлена в графической части.
Оба фага устойчивы к хлороформу: титры их в фаголизатах, стерилизованных фильтрованием через фильтр с диаметром пор 0,45 мкм, не превышал титр в аналогичных фаголизатах, стерилизованных хлороформом. При нагревании препаратов бактериофагов KPV15 и KPV811 до температуры выше 60°С в течение 30 минут они полностью инактивировались. Оптимальная температура для поддержания исходного титра фагов в течение четырех месяцев (срок наблюдения) составляет от 4 до 10°С.
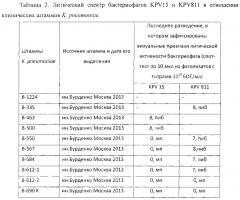
Литический спектр бактериофагов KPV15 и KPV811 в отношении штаммов K. pneumoniae, выделенных в клинических учреждениях в последние 5 лет, представлены в табл. 2.
Как следует из данных таблицы 2, бактериофаг KPV15 активно размножается и лизирует 14 из 40 клинических индикаторных штаммов K. pneumoniae: чувствительные к нему культуры K. pneumonia лизируются при разведении фаголизата до титра 1×10-7 - 1×10-8. На газоне чувствительных культур фаг KPV15 образует прозрачные бляшки. Кроме того, фаголизат бактериофага KPV15 в нулевом разведении лизирует еще 20 индикаторных штаммов K. pneumoniae, образуя на их газоне мутные пятна. Таким образом, из 40 индикаторных штаммов бактериофаг KPV15 с разной степенью активности лизирует 34 штамма (85%).
Бактериофаг KPV811 активно размножается (бляшкообразование наблюдается при разведении фаголизата до 10-7-10-8) и лизирует 7 из 40 индикаторных культур K. pneumoniae, причем бактериофаг реплицируется на тех штаммах, на которых не реплицируется бактериофаг KPV15, т.е. два бактериофага, KPV15 и KPV811 лизируют с разной степенью активности 92,5% клинических штаммов K. pneumoniae. Следует особо отметить, что в набор индикаторных штаммов входят культуры K. pneumoniae, выделенные в основном в 2012-2014 годах в крупных клинических центрах г. Москвы.
5. Штамм бактериофага Pseudomonas aeruginosa РА5 выделен из сточных вод Москвы и Серпухова на культуре бактерий штамма Pseudomonas aeruginosa В-1304 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-88.
Штамм бактериофага Pseudomonas aeruginosa РА5 характеризуется следующими свойствами: Бактериофаг РА5 на газоне штамма P. aeruginosa В1304 образует прозрачные негативные колонии диаметром 1-2 мм.
Нуклеотидная последовательность генома штамма представлена в графической части.
6. Штамм бактериофага Pseudomonas aeruginosa РА10 выделен из сточных вод Москвы и Серпухова на культуре бактерий штамма Pseudomonas aeruginosa 176 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-89.
Штамм бактериофага Pseudomonas aeruginosa РА10 характеризуется следующими свойствами: бактериофаг РА10 на хозяйском штамме P. aeruginosa 176 формирует колонии диаметром 4-5 мм с прозрачным центром и ореолом на периферии.
Нуклеотидная последовательность генома штамма представлена в графической части.
Оба бактериофага устойчивы к хлороформу и чувствительны к нагреванию: при температуре 55°С они инактивируются в течение 15 минут. Хорошо сохраняются в лиофильно высушенном состоянии при температуре 4-8°С. Максимальный титр бактериофагов РА5 и РА10 при размножении их на жидких и плотных питательных средах составляет около 1010 фаговых частиц в 1 мл фаголизата.
Спектр литической активности псевдомонадных бактериофагов в отношении клинических штаммов P. aeruginosa представлен в табл. 3.
Таблица 3. Спектр литической активности псевдомонадных фагов в отношении клинических штаммов P. aeruginosa, выделенных в г.г. Серпухове, Челябинске, Вологде и Москве.
Как следует из таблицы, выделенные бактериофаги имеют сравнительно узкий спектр литической активности: для фагов РА5, РА10 он составляет соответственно 27, 29%. Однако смесь этих фагов обусловливает лизис 52% индикаторных штаммов Р. aeruginosa.
7. Штамм бактериофага Acinetobacter baumannii АР22 выделен из образцов клинического материала больниц г. Москвы на культуре бактерий штамма Acinetobacter baumannii 1053 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-42. Штамм защищен патентом РФ №2439151.
Штамм бактериофага Acinetobacter baumannii АР22 характеризуется следующими свойствами: Бактериофаг АР22 на газоне чувствительного штамма Acinetobacter baumannii 1053 формирует круглые прозрачные негативные колонии диаметром около 2-3 мм с ровными краями, окруженные непрозрачным ореолом.
8. Штамм бактериофага Acinetobacter baumannii АМ24 выделен из образцов клинического материала больниц г. Москвы на культуре бактерий штамма Acinetobacter baumannii В-05 и депонирован в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-106.
Штамм бактериофага Acinetobacter baumannii АМ24 характеризуется следующими свойствами: Бактериофаг АМ24 на газоне чувствительного штамма В-05 формирует круглые прозрачные негативные колонии с ровными краями диаметром около 1 мм, окруженные непрозрачным ореолом. Диаметр ореола - от 2 до 6 мм.
Нуклеотидная последовательность генома штамма представлена в графической части.
Оба бактериофага устойчивы к хлороформу и чувствительны к нагреванию: при температуре 55°С они инактивируются в течение 15 минут. Хорошо сохраняются в лиофильно высушенном состоянии при температуре 4-8°С. Максимальный титр бактериофага АР22 при размножении его в жидких и на плотных питательных средах составляет 5×1010 БОЕ/мл, титр бактериофага АМ24 не превышает 7×109 БОЕ/мл. Спектр литической активности ацинетобактерных бактериофагов в отношении 80 клинических штаммов Acinetobacter baumannii представлен в табл. 4.
В основу заявляемого изобретения положена обеспечивающая решение поставленной задачи новая совокупность оригинальных отличительных признаков: впервые предложено использование двух вариантов композиций из семи или восьми штаммов бактериофагов, дополняющих спектр литической активности в отношении тест-штаммов и выделенных из организма человека изолятов бактерий - возбудителей госпитальных инфекций при впервые подобранной смеси целевых добавок, обеспечивающих стабилизацию активности бактериофагов при использовании их в различных лекарственных формах.
Сущность изобретения поясняется на следующих примерах.
Пример 1. Получение отдельных фаголизатов и их комбинации
Бактериальную культуру штамма-хозяина в титре 108-109 КОЕ/мл засевают в сосуд для культивирования - стеклянный микробиологический матрац на скошенную плотную питательную среду с толщиной слоя от 10 мм до 25 мм, культивируют в течение 3-3,5 часов при оптимальной температуре для роста культуры штамма-хозяина, затем на полученный газон культуры штамма-хозяина засевают маточный бактериофаг в титре 105-106 БОЕ/мл, герметично закрывают сосуд для культивирования, культивируют в течение 13-15 часов при оптимальной температуре для роста культуры штамма бактериофага и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм, получают фаголизат при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором или буферным раствором с pH 7,0-7,2 в количестве 0,04-0,045 мл на 1 см2 поверхности плотной питательной среды, отсасывают фаголизат в стерильную емкость, добавляют хлороформ, выдерживают в течение 30-45 минут при непрерывном шуттелировании, центрифугируют в течение 30-45 минут при 5000-6000 об/мин, стерилизуют надосадочную жидкость фильтрацией через фильтр с диаметром пор 0,2-0,22 мкм и пропускают полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину. После центрифугирования смешивают надосадочные жидкости, содержащие бактериофаги (7 или 8), затем стерилизуют смесь надосадочных жидкостей фильтрацией через фильтр с диаметром пор 0,2-0,22 мкм и пропускают полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину.
Пример 2. Получена композиция антибактериальная для профилактики или лечения госпитальных инфекций (1 вариант) с литической активностью не ниже 10-4 по Аппельману в отношении тест-штаммов и выделенных из организма человека изолятов бактерий, включающая фильтрат фаголизата Staphylococcus aureus, полученный с использованием штамма бактериофага Staphylococcus aureus SCH1, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-105, фильтрат фаголизата Staphylococcus aureus, полученный с использованием штамма бактериофага Staphylococcus aureus SCH111, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-95, фильтрат фаголизата Klebsiella pneumoniae, полученный с использованием штамма бактериофага Klebsiella pneumoniae KPV15, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-90, фильтрат фаголизата Klebsiella pneumoniae, полученный с использованием штамма бактериофага Klebsiella pneumoniae KPV811, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-91, фильтрат фаголизата Pseudomonas aeruginosa, полученный с использованием штамма бактериофага Pseudomonas aeruginosa РА5, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-88, фильтрат фаголизата Pseudomonas aeruginosa, полученный с использованием штамма бактериофага Pseudomonas aeruginosa РА10, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-89, и фильтрат фаголизата Acinetobacter baumannii, полученный с использованием штамма бактериофага Acinetobacter baumannii АМ24, депонированного в коллекции музея микроорганизмов Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ Роспотребнадзора) под номером Ph-106. Композиция включает целевые добавки в количестве 0,01÷99,99 мас. % от массы композиции в виде смеси ингредиентов.
Проведены исследования стабильности поливалентной активности отдельных штаммов бактериофагов, входящих в состав заявляемой композиции в образцах композиции, хранящихся в течение года, и тестирование всех бактериофагов композиции на лизогению. Литическая активность всех штаммов бактериофагов композиции составляла не ниже 10-4 по Аппельману. Тесты на лизогению были отрицательные. Для испытания биодоступности полученной композиции ее образец массой 0,6 г вносился в среду 199. Отмечалось равномерное диспергирование препарата в водной среде и сохранение в растворе не менее 99% литической активности композиции.
Пример 3. Получена композиция антибактериальная для профилактики или лечения госпитальных инфекций (2 вариант) с литической активностью не ниже 10-4 по Аппельману в отношении тест-штаммо