Лечение нарушений свертываемости крови путем введения рекомбинантного фв
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа лечения болезни Виллебранда или гемофилии А у нуждающегося в лечении пациента, включающего введение пациенту рекомбинантного фактора Виллебранда (рФВ) таким образом, что время полужизни фактора VIII продлевается по сравнению с пациентом, которому вводили фактор Виллебранда, полученный из плазмы крови, где рФВ не модифицирован водным растворимым полимером, при этом рФВ является составом из высокомолекулярных мультимеров ФВ, содержащим как минимум 20% декамеров ФВ или мультимеров высших порядков, причем рФВ обладает более высокой специфической активностью, чем фактор Виллебранда, полученный из плазмы крови. Группа изобретений также касается способа лечения гемофилии А или болезни Виллебранда у нуждающегося в лечении пациента, который включает введение пациенту рекомбинантного фактора Виллебранда (рФВ), при этом время полужизни ФVIII как минимум в 1.5 раза выше по сравнению со временем полужизни ФVIII у пациента, которому вводили фактор Виллебранда, полученный из плазмы крови. Группа изобретений обеспечивает увеличение времени полужизни ФVIII при лечении болезни Виллебранда или гемофилии А у субъекта. 2 н. и 27 з.п. ф-лы, 5 пр., 22 ил., 34 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ
[0001] Нарушения свертываемости крови такие, как болезнь Виллебранда (БВ) и гемофилия, обычно возникают из-за нарушений в системе свертывания. "Болезнь Виллебранда" относится к группе заболеваний, вызываемых дефицитом фактора Виллебранда. Фактор Виллебранда способствует накоплению и прикреплению тромбоцитов к стенкам кровеносных сосудов, что необходимо для нормального свертывания крови. Гемофилия A обусловлена недостаточной активностью фактора VIII, в то время как гемофилия B обусловлена дефицитом фактора IX. Современное лечение данных коагулопатий включает заместительную терапию с применением фармацевтических препаратов, содержащих нормальный фактор свертывания крови.
[0002] Заместительная терапия у больных БВ и гемофилией включает многократное введение препаратов, которые содержат нормальные факторы свертывания крови, путем внутривенной инфузии, что может оказаться большой нагрузкой для жизни этих больных, в особенности, когда доступ к венам затруднен. Было бы желательно, чтобы частоту инфузий можно было уменьшить. Одной из потенциально осуществимых методик является стабилизация фактора VIII путем его ассоциации со второй молекулой такой, как фактор Виллебранда (ФВ), в результате чего увеличивается время полужизни фактора VIII в плазме крови.
[0003] ФВ является гликопротеином, циркулирующим в плазме крови в виде групп мультимеров, имеющих размеры от 500 до 20000 кДа. Была клонирована полноразмерная кДНК ФВ; полипептид соответствует аминокислотным остаткам в количестве от 23-х до 764-х полноразмерного пре-про-ФВ (Eikenboom et al (1995) Haemophilia 1, 77 90). Мультимерные формы ФВ состоят из полипептидных субъединиц размером 250 кДа, соединенных между собой дисульфидными связями. ФВ опосредует первичную адгезию тромбоцитов к субэндотелию стенки поврежденного сосуда, при этом большие мультимеры проявляют усиленную гемостатическую активность. Мультимеризированный ФВ связывает гликопротеин Gplbα с тромбоцитарной поверхностью через взаимодействие в A1 домене ФВ, обеспечивая адгезию тромбоцитов. Другие сайты ФВ опосредуют прикрепление к стенке кровеносного сосуда. Таким образом, ФВ формирует мост между тромбоцитом и стенкой сосуда, что является существенным для тромбоцитарной адгезии и первичного гемостазиса в условиях сильного гемодинамического удара. Обычно эндотелиальные клетки секретируют крупные полимерные формы ФВ, а формы ФВ, имеющие более низкий молекулярный вес, возникают при протеолитическом расщеплении. Мультимеры с исключительно высокими молекулярными массами накапливаются в тельцах Вейбеля-Палада эндотелиальных клеток и высвобождаются при стимуляции агонистами такими, как тромбин и гистамин.
[0004] То, что фармакокинетика ФVIII является функцией уровней ФВ, подтверждается несколькими предыдущими наблюдениями. Снижение связывающей активности ФVIII при болезни Виллебранда (БВ) вследствие как пониженного уровня протеинов ФВ, так и пониженной связывающей способности ФVIII, приводит к снижению уровня стационарных состояний эндогенного ФVIII (кратко изложено в Castaman et al., Disorders of Hemostasis 88(1):94-108 (2003)), а увеличение продолжительности существования ФВ было предложено в качестве практически осуществимой стратегии по увеличению стабильности ФVIII (Denis et al., Thromb Haemost. 2008 Feb; 99(2):271-8; Turecek et al., Blood, 2006, 108(11): Abstract 1002). Корреляция между доинфузионным уровнем ФВ и временем полужизни инфузионного ФVIII у тяжелых больных гемофилией A была продемонстрирована Финвандраатом и коллегами (Fijnvandraat, et al., Br J Haematol. 1995 Oct; 91(2):474-6). В этом исследовании у пациентов с уровнем ФВ, который составлял 200-300% от обычного, наблюдали 15-29-часовое время полужизни ФVIII по сравнению со средним временем в 12,5 часов у пациентов с нормальным уровнем ФВ. В другом исследовании было продемонстрировано, что у пациентов с 1-й группой крови уровень ФВ значительно ниже, а времена полужизни ФVIII короче (15,3 часов) по сравнению с теми, кто имеет II-ю группу крови (19,7 часов) (Vlot, et al. Thromb Haemost. 2000 Jan; 83(1):65-9). Было показано, что химически модифицированный ФВ продлевает время существования рФVIII (Turecek et al., J. Thromb. Haemost. 2007 Jul 9; 5(2) abstract available at: http/www.blackwellpublishing.com/isth2007/abstract.asp?id=64898). В таком случае, совместное введение рФВ и рФVIII является практически осуществимой стратегией при лечении нарушений свертываемости крови таких, как болезнь Виллебранда и гемофилия А.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] Соответственно, в настоящем изобретении предложены способы и комбинации для лечения нарушений свертываемости крови путем введения нуждающемуся в лечении пациенту рекомбинантного фактора Виллебранда (рФВ) как отдельно, так и в сочетании с рекомбинантным фактором VIII (рФVIII), что приводит in-vivo к возрастанию времени полужизни фактора VIII.
[0006] В одном из вариантов осуществления, в настоящем изобретении предложен способ лечения болезни Виллебранда и гемофилии A у нуждающегося в лечении пациента, и этот способ включает: введение испытуемому рекомбинантного фактора Виллебранда (рФВ) таким образом, что время полужизни фактора VIII продлевается по сравнению с испытуемым, которому вводили фактор Виллебранда, полученный из плазмы крови, при этом рФВ является композицией из высокомолекулярных мультимеров рФВ, которая содержит как минимум 20% декамеров ФВ либо мультимеров высших порядков, и рФВ обладает более высокой специфической активностью, чем полученный из плазмы крови фактор Виллебранда.
[0007] В дополнительных осуществлениях изобретения и согласно предыдущему пункту, способы изобретения включают совместное введение рекомбинантного фактора Виллебранда (рФВ) и рекомбинантного фактора VIII (pФVIII).
[0008] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ и pФVIII вводятся совместно в одном составе.
[0009] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 1.0 МЕ/кг ФВ:РКо до 150 МЕ/кг ФВ:РКо на дозу.
[0010] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 2 МЕ/кг ФВ:РКо до 50 МЕ/кг ФВ:РКо на дозу.
[0011] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 5 МЕ/кг ФВ:РКо до 40 МЕ/кг ФВ:РКо на дозу.
[0012] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 10 МЕ/кг ФВ:РКо до 20 МЕ/кг ФВ:РКо на дозу.
[0013] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ, который применяют в описанных в изобретении способах, созревает in vitro при обработке фурином.
[0014] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ образуется путем экспрессии в яичниках китайского хомячка (клеточная культура СНО).
[0015] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, pФVIII и рФВ образуются путем экспрессии в одной клеточной культуре.
[0016] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ вводят испытуемому не чаще, чем раз в два дня.
[0017] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ вводят испытуемому не чаще, чем дважды в неделю.
[0018] В других вариантах осуществления и согласно любому из предыдущих пунктов, в композиции из высокомолекулярных мультимеров ФВ сохраняется как минимум 20% декамеров ФВ либо мультимеров высших порядков на протяжении, по крайней мере, 3-х часов после введения.
[0019] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни фактора VIII продлевается как минимум на 5 часов.
[0020] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни фактора VIII продлевается как минимум на 12 часов.
[0021] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни фактора VIII продлевается как минимум на 24 часа.
[0022] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни фактора VIII продлевается как минимум на 36 часов.
[0023] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни фактора VIII продлевается как минимум на 48 часов.
[0024] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни фактора VIII продлевается как минимум на 72 часа.
[0025] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности ФVIII (ME ФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет от 2:1 до 1:4.
[0026] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности ФVIII (ME ФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет от 3:2 до 1:3.
[0027] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности ФVIII (ME ФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет от 1:1 до 1:2.
[0028] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, 23 отношение прокоагулирующей активности ФVIII (ME ФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет примерно 3:4.
[0029] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ обладает специфической активностью приблизительно в 20-150 мЕ/мкг.
[0030] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, композиция из высокомолекулярных мультимеров ФВ содержит как минимум 30% декамеров ФВ либо мультимеров высших порядков.
[0031] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, композиция из высокомолекулярных мультимеров ФВ содержит как минимум 40% декамеров ФВ либо мультимеров высших порядков.
[0032] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, композиция из высокомолекулярных мультимеров ФВ содержит как минимум 50% декамеров ФВ либо мультимеров высших порядков.
[0033] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, композиция из высокомолекулярных мультимеров ФВ содержит как минимум 60% декамеров ФВ либо мультимеров высших порядков.
[0034] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, композиция из высокомолекулярных мультимеров ФВ содержит как минимум 70% декамеров ФВ либо мультимеров высших порядков.
[0035] В дополнительных вариантах осуществления и согласно любому из предыдущих пунктов, в настоящем изобретении предложен способ лечения болезни Виллебранда и гемофилии A у нуждающегося в лечении пациента, и этот способ включает: введение испытуемому рекомбинантного фактора Виллебранда (рФВ) таким образом, что время полужизни фактора VIII продлевается по сравнению с испытуемым, которому вводили фактор Виллебранда, полученный из плазмы крови, при этом: (а) рФВ обладает более высокой специфической активностью, чем полученный из плазмы крови фактор Виллебранда, а специфическая активность рФВ составляет приблизительно 20-150 мЕ/мкг; и (б) время полужизни ФVIII как минимум в 1.5 раз выше, чем время полужизни ФVIII у испытуемого, которому вводили фактор Виллебранда, полученный из плазмы крови.
[0036] В дополнительных вариантах осуществления и согласно любому из предыдущих пунктов, в настоящем изобретении предложен способ лечения болезни Виллебранда и гемофилии A у нуждающегося в лечении пациента, и этот способ включает: введение испытуемому рекомбинантного фактора Виллебранда (рФВ) таким образом, что время полужизни фактора VIII продлевается по сравнению с испытуемым, которому вводили фактор Виллебранда, полученный из плазмы крови, при этом: (а) рФВ является композицией из высокомолекулярных мультимеров ФВ, которая содержит как минимум 20% декамеров ФВ либо мультимеров высших порядков, (б) рФВ обладает более высокой специфической активностью, чем полученный из плазмы крови фактор Виллебранда, а специфическая активность рФВ составляет как минимум 20-150 мЕ/мкг; и (в) время полужизни ФVIII как минимум в 1.5 раз выше, чем время полужизни ФVIII у испытуемого, которому вводили фактор Виллебранда, полученный из плазмы крови.
[0037] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:K) в плазме крови испытуемого через 24 часа после введения рФВ составляет как минимум 90% от уровня активности ФVIII:K, который присутствует в плазме крови через 1 час после введения.
[0038] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:K) в плазме крови испытуемого через 24 часа после введения составляет как минимум 100% от уровня активности ФVIII:K, который присутствует в плазме крови через 1 час после введения.
[0039] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:K) в плазме крови испытуемого через 36 часов после введения составляет как минимум 80% от уровня активности ФVIII:K, который присутствует в плазме крови через 1 час после введения.
[0040] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:K) в плазме крови испытуемого через 48 часов после введения составляет как минимум 50% от уровня активности ФVIII:K, который присутствует в плазме крови через 1 час после введения.
[0041] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 6 часов после введения.
[0042] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 12 часов после введения.
[0043] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 18 часов после введения.
[0044] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 24 часов после введения.
[0045] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 36 часов после введения.
[0046] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 48 часов после введения.
[0047] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны на протяжении как минимум 72 часов после введения.
[0048] В дополнительных вариантах осуществления и согласно любому из предыдущих пунктов, в настоящем изобретении предложен способ лечения гемофилии A или болезни Виллебранда у нуждающегося в лечении пациента, и этот способ включает: введение испытуемому рекомбинантного фактора Виллебранда (рФВ).
[0049] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, заявленный способ включают совместное введение испытуемому рекомбинантного фактора VIII (pФVIII) и рекомбинантного фактора Виллебранда (рФВ).
[0050] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, pФVIII и рФВ вводят совместно в одном составе.
[0051] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности pФVIII (ME pФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет от 2:1 до 1:4.
[0052] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности pФVIII (ME pФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет от 3:2 до 1:3.
[0053] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности pФVIII (ME pФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет от 1:1 до 1:2.
[0054] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, отношение прокоагулирующей активности pФVIII (ME pФVIII:K) к ристоцетин-кофакторной активности рФВ (ME рФВ:РКо), который вводят испытуемому, составляет примерно 3:4.
[0055] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ созревает in vitro при обработке фурином.
[0056] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ экспрессируется в клеточной культуре млекопитающего.
[0057] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, pФVIII экспрессируется в клеточной культуре млекопитающего.
[0058] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, культура млекопитающего содержит клетки СНО.
[0059] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФVIII и рФВ экспрессируются совместно в одной культуре.
[0060] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФVIII и рФВ очищают совместно.
[0061] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФVIII и рФВ очищают раздельно.
[0062] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, комплекс рФVIII/рФВ перерастворяют перед введением.
[0063] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ обрабатывают фурином перед перерастворением комплекса рФVIII/рФВ.
[0064] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, перерастворенный комплекс рФVIII/рФВ обрабатывают фурином.
[0065] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, фурин является рекомбинантным фурином.
[0066] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ вводят испытуемому не чаще, чем один раз в день.
[0067] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ вводят испытуемому не чаще, чем раз в два дня.
[0068] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ вводят испытуемому не чаще, чем раз в три дня.
[0069] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, рФВ вводят испытуемому не чаще, чем раз в четыре дня.
[0070] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 1.5 МЕ/кг ФVIII:К до 150 МЕ/кг ФVIII:К на дозу.
[0071] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 10 МЕ/кг ФVIII:К до 100 МЕ/кг ФVIII:К на дозу.
[0072] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 25 МЕ/кг ФVIII:К до 75 МЕ/кг ФVIII:К на дозу.
[0073] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, испытуемому вводят от 40 МЕ/кг ФVIII:К до 60 МЕ/кг ФVIII:К на дозу.
[0074] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:К) в плазме крови испытуемого через 24 часа после введения составляет как минимум 90% от уровня активности ФVIII:К, который присутствует в плазме крови через 1 час после введения.
[0075] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:К) в плазме крови испытуемого через 24 часа после введения составляет как минимум 100% от уровня активности ФVIII:K, который присутствует в плазме крови через 1 час после введения.
[0076] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:K) в плазме крови испытуемого через 36 часов после введения составляет как минимум 80% от уровня активности ФVIII:К, который присутствует в плазме крови через 1 час после введения.
[0077] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, уровень прокоагулирующей активности фактора VIII (ФVIII:K) в плазме крови испытуемого через 48 часов после введения составляет как минимум 50% от уровня активности ФVIII:K, который присутствует в плазме крови через 1 час после введения.
[0078] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, вводимый испытуемому рФВ содержит композицию из высокомолекулярных мультимеров ФВ, которая содержит как минимум 10% декамеров ФВ либо мультимеров высших порядков.
[0079] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, вводимый испытуемому рФВ содержит композицию из высокомолекулярных мультимеров ФВ, которая содержит как минимум 20% декамеров ФВ либо мультимеров высших порядков.
[0080] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, вводимый испытуемому рФВ содержит композицию из высокомолекулярных мультимеров ФВ, которая содержит как минимум 30% декамеров ФВ либо мультимеров высших порядков.
[0081] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, вводимый испытуемому рФВ содержит композицию из высокомолекулярных мультимеров ФВ, которая содержит как минимум 40% декамеров ФВ либо мультимеров высших порядков.
[0082] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, вводимый испытуемому рФВ содержит композицию из высокомолекулярных мультимеров ФВ, которая содержит как минимум 50% декамеров ФВ либо мультимеров высших порядков.
[0083] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 3 часов после введения.
[0084] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 6 часов после введения.
[0085] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, при этом мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 12 часов после введения.
[0086] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, при этом мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 18 часов после введения.
[0087] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 24 часов после введения.
[0088] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 36 часов после введения.
[0089] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, при этом мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 48 часов после введения.
[0090] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, мультимеры рФВ высших порядков стабильны in vitro на протяжении как минимум 72 часов после введения.
[0091] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, эндогенная активность ФVIII стабилизируется на протяжении как минимум 12 часов.
[0092] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, эндогенная активность ФVIII стабилизируется на протяжении как минимум 24 часов.
[0093] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, эндогенная активность ФVIII стабилизируется на протяжении как минимум 36 часов.
[0094] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, эндогенная активность ФVIII стабилизируется на протяжении как минимум 48 часов.
[0095] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, эндогенная активность ФVIII стабилизируется на протяжении как минимум 72 часов.
[0096] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, активность вводимого совместно рФVIII стабилизируется на протяжении как минимум 12 часов.
[0097] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, активность вводимого совместно рФVIII стабилизируется на протяжении как минимум 24 часов.
[0098] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, активность вводимого совместно pФVIII стабилизируется на протяжении как минимум 36 часов.
[0099] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, активность вводимого совместно pФVIII стабилизируется на протяжении как минимум 48 часов.
[00100] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, активность вводимого совместно pФVIII стабилизируется на протяжении как минимум 72 часов.
[00101] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, активность вводимого совместно pФVIII стабилизируется путем продления времени полужизни pФVIII in vivo.
[00102] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, время полужизни ФVIII продлевается приблизительно на пять часов по сравнению с пациентами, которым вводили пФVIII.
[00103] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, по крайней мере, 1% активности совместно вводимого pФVIII сохраняется на протяжении как минимум 36 часов у пациента, которому вводили указанный pФVIII.
[00104] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, по крайней мере, 1% активности совместно вводимого pФVIII сохраняется на протяжении как минимум 48 часов у пациента, которому вводили указанный pФVIII.
[00105] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, по крайней мере, 1% активности совместно вводимого pФVIII сохраняется на протяжении как минимум 72 часов у пациента, которому вводили указанный pФVIII.
[00106] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, по крайней мере, 1% активности совместно вводимого pФVIII сохраняется на протяжении как минимум 90 часов у пациента, которому вводили указанный pФVIII.
[00107] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, по крайней мере, 1% активности совместно вводимого pФVIII сохраняется на протяжении как минимум 120 часов у пациента, которому вводили указанный pФVIII.
[00108] В дополнительных осуществлениях и согласно любому из предыдущих пунктов, по крайней мере, 1% активности совместно вводимого pФVIII сохраняется на протяжении как минимум 168 часов у пациента, которому вводили указанный pФVIII.
КРАТКОЕ ОПИСАНИЕ ФИГУР
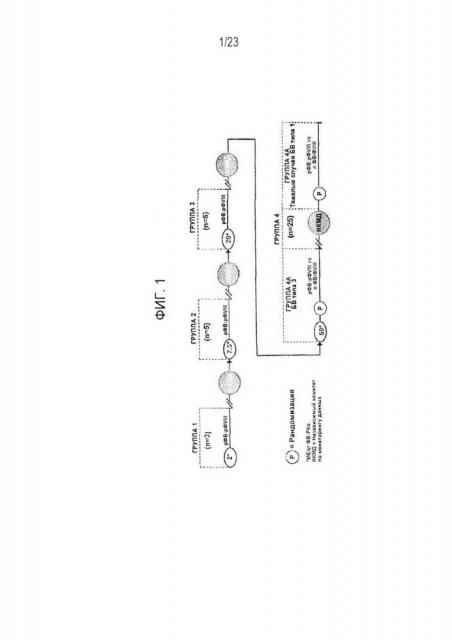
[00109] Фигура 1. Схематическое изображение дизайна клинического исследования, в котором оценивается переносимость и безопасность после введения единичной дозы рФВ:рФVIII.
[00110] Фигура 2. Фармакокинетические данные. На (А) приведены ФК данные по рФВ/рФVIII и пФВ/пФVIII. На (Б) приведены данные по прогрессирующей потере высокомолекулярного рФВ при воздействии металлопротеиназы ADAMTS13.
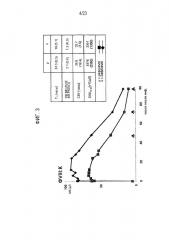
[00111] Фигура 3. Фармакокинетические данные, иллюстрирующие ФК ФVIII для рФВ/рФVIII и пФВ/пФVIII.
[00112] Фигура 4. Обобщающая таблица персональных данных пациентов данного исследования.
[00113] Фигура 5. Фармакокинетические данные терапии рФВ/рФVIII и пФВ/пФVIII по группе 4А.
[00114] Фигура 6. Данные ДСН-ПААГ-электрофореза по расщеплению мультимеров ФВ металлопротеиназой ADAMTS13.
[00115] Фигура 7. Фармакокинетические данные терапии рФВ/рФVIII и пФВ/пФVIII по группе 4А.
[00116] Фигура 8. Обобщенные данные по побочным эффектам в данном исследовании.
[00117] Фигура 9. Данные по ФК параметрам рФВ в данном исследовании.
[00118] Фигура 10. Данные по ФК рФВ Пациента 1.
[00119] Фигура 11. Данные по ФК рФВ Пациента 2.
[00120] Фигура 12. Данные по ФК рФВ Пациента 3.
[00121] Фигура 13. Сравнение ФК рФВ Пациентов 1, 2 и 3 - сравнение параметров рФВ и активности ФVIII.
[00122] Фигура 14. Активность ФVIII среди всех групп данного исследования.
[00123] Фигура 15. ФК рФВ пациентов группы 2 - сравнение параметров ФВ и активности ФVIII.
[00124] Фигура 16. Обобщенные результаты фармакокинетических параметров прокоагулирующей активности фактора VIII (ФVIII:К) у пациентов группы 2.
[00125] Фигура 17. ФК рФВ всех пациентов группы 3 - сравнение параметров плазмы крови для ФВ и ФVIII.
[00126] Фигура 18. Обобщенные результаты фармакокинетических параметров прокоагулирующей активности фактора VIII (ФVIII:K) у пациентов группы 3.
[00127] Фигура 19. Данные по пациентам группы 4.
[00128] Фигура 20. Обобщенные результаты фармакокинетических
параметров прокоагулирующей активности фактора VIII (ФVIII:K) у пациентов группы 4А.
[00129] Фигура 21. Фармакокинетические данные по ФVIII:К, в которых сравниваются совместно применяемые рФВ и рФVIII по отношению к Advate Pivotal.
[00130] Фигура 22. Обобщенные результаты по наличию антител у испытуемого, который получал совместно пФВ/пФVIII или рФВ/рФVIII.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обзор
[00131] В настоящем изобретении предложены составы и способы для лечения нарушений свертываемости крови у пациента путем введения рекомбинантного фактора Виллебранда (рФВ) как отдельно, так и в сочетании с фактором VIII (который может быть рекомбинантным или полученным из плазмы крови). В некоторых вариантах осуществления составы и способы настоящего изобретения применяют для лечения нарушений свертываемости крови, таких как болезнь Виллебранда (БВ) или гемофилия А.
[00132] Согласно одному варианту осуществления, вводимый испытуемому рФВ обеспечивает повышенную стабильность активности in vivo фактора VIII (ФVIII) по сравнению со стабильностью ФVIII, обусловленной полученным из плазмы крови ФВ, что позволяет применять более низкие дозы и/или периодичность лечения, чем при традиционном лечении нарушений свертываемости крови. Повышенная стабильность активности ФVIII и уровней ФVIII могут быть определены с помощью известных в данной области техники и описанных здесь методов, которые включают стандартную аналитику такую, как одностадийный анализ коагулирующей активности, хромогенный анализ и иммуноанализ (смотрите, например, статьи Lippi et al., Blood Coagulation & Fibrinolysis, 2009, 20(1):1-3 и Chandler et al., Am J. Clin. Pathol., 2003, 120:34-39, каждая из которых в полном объеме включена в настоящую заявку посредством ссылки для всестороннего изучения, в особенности того, что касается методов анализа уровня и активности ФVIII). Как показано на Фиг. 20, среднее время полужизни ФVIII было увеличено с помощью рФВ на 5.2 часа по сравнению со временем полужизни у пациентов, которые получали пФВ. Фиг. 2 и 7 также иллюстрируют возрастание активности ФVIII у пациентов, которым вводили рФВ по сравнению с теми, которым вводили пФВ. Фиг. 2 иллюстрирует, что среднее время полужизни ФVIII у пациентов, которым вводили рФВ, было увеличено на 4.7 часа по сравнению пациентами, которым вводили пФВ, а данные по Группе 4А на Фиг. 7 показывают возрастание времени полужизни ФVIII на 5.3 часа у пациентов, которым вводили рФВ, по сравнению пациентами, которым вводили пФВ. Вдобавок, как показано на Фиг. 21, время полужизни плазменного ФVIII у больных БВ, которые получали рФВ в комбинации с рФVIII, возрастает на 12.27 часов по сравнению с пациентами, которые получали только ФVIII (то есть Advate).
[00133] В дополнительном варианте осуществления, введение рФВ стабилизирует эндогенную активность и/или активность совместно вводимого ФVIII, что приводит в возрастанию in vivo времени полужизни и/или активности ФVIII. В тех осуществлениях изобретения, в которых рФВ и ФVIII вводили совместно, рФВ и ФVIII можно вводить испытуемому в одном составе. В дополнительных осуществлениях, ни рФВ, ни ФVIII не являются модифицированными с помощью водорастворимого полимера. В других осуществлениях, либо рФВ, либо ФVIII, либо оба являются модифицированными с помощью водорастворимого полимера. Следует принимать во внимание, что в осуществлениях, в которых рФВ вводили совместно с ФVIII, ФVIII может быть рекомбинантным или полученным из плазмы.
[00134] В дополнительных вариантах осуществления и согласно с предыдущими пунктами, вводимый испытуемому рФВ является составом из высокомолекулярных мультимеров, который содержит декам еры либо высшие мультимеры рФВ. Как обсуждалось выше, применение заявленных в изобретении составов рФВ обеспечивает вариативность терапевтической дозировки (или повторной дозировки) с или без ФVIII (рекомбинантным либо полученным из плазмы крови). В дополнительных осуществлениях изобретения вводимый испытуемому рФВ является составом из высокомолекулярных мультимеров ФВ, который содержит как минимум 20% декамеров либо высших мультимеров ФВ. В отдельных осуществлениях вводимый испытуемому рФВ не модифицирован с помощью водорастворимого полимера.
[00135] В других дополнительных вариантах осуществления вводимый испытуемому рФВ обладает более высокой специфической активностью, чем пФВ.
[00136] В других дополнительных вариантах осуществления рФВ как в отдельности, так и в комбинации с пФVIII или рФVIII, вводят испытуемому не чаще, чем дважды в неделю.
[00137] В других дополнительных вариантах осуществления перед введением испытуемому рФВ обрабатывают фурином. В отдельных осуществлениях рФВ обрабатывают рекомбинантным фурином.
[00138] В дополнительных вариантах осуществления применяемый в настоящем изобретении рФВ получен в соответствии со способами, известными в данной области техники и описанным, например, в US 2012/0035110, зарегистрированном 8 июля 2011 г., и US Patent No. 8,173,597, опубликованном 8 мая 2012 г., каждый из которых в полном объеме включен в настоящую заявку посредством ссылки для всестороннего изучения, в особенности того, что касается рФВ-составов и способов получения данных составов.
[00139] Согласно любому из предыдущих пунктов рФВ как в отдельности, так и в комбинации с ФVIII, применяют для лечения нарушений свертываемости крови, таких как болезнь БВ или гемофилия А. У больных БВ существует определенный уровень ФVIII, но стабильность ФVIII в общем случае снижена, так как у этих пациентов наблюдается недостаток ФВ. Лечение больных БВ в некоторых осуществлениях включает предварительную терапию рФВ и рФVIII, за которой следует повторное введение только рФВ. В других осуществлениях предварительная терапия может осуществляться с помощью одного рФВ, в то время как последующие повторные введения включают рФВ и рФVIII, либо и предварительное и последующие повторные введения могут включать рФВ и рФVIII. Аналогично, больные гемофилией А (страдающие недостатком ФVIII) могут проходить предварительную терапию рФВ и рФVIII, а последующее повторное лечение может включать введение только pФVIII или только рФВ. В других осуществлениях предварительная терапия может осуществляться с помощью одного рФVIII, в то время как последующее повторное лечение включает совместное введение рФВ и рФVIII.
Определения
[00140] Используемый здесь термин "рФВ" обозначает рекомбинантный ФВ.
[00141] Используемый здесь термин "рФVIII" обозначает рекомбинантный ФVIII.
[00142] Термин "рекомбинантный" при применении к чему-либо, например, к клетке или нуклеиновой кислоте, протеину или вектору, указывает на то, что клетка, нуклеиновая кислота, протеин или вектор были модифицированы путем введения гетерологичной нуклеиновой кислоты либо протеина, или путем изменения нативной нуклеиновой кислоты либо протеина, или на то, что клетки получены из клеток, модифицированных подобным образом. Таким образом, к примеру, рекомбинантные клетки экспрессируют гены, которых нет у нативной (нерекомбинантной) формы клеток, или экспрессируют нативные гены, которые в иных случаях экспрессируются чрезмерно, экспрессируются мало или вообще не экспрессируются.
[00143] Используемый здесь термин "рекомбинантный ФВ" включает в себя ФВ, полученный путем рекомбинантной ДНК-технологии. В отдельных осуществлениях протеины ФВ, заявленные в данном изобретении, могут содержать компонент, например, приготовленный как в WO 1986/06096, опубликованном 23 октября 1986 г. и U.S. patent application Ser. No. 07/559,509, зарегистрированном 23 июля 1990 г. на имя Ginsburg et al., которые включены в настоящую заявку посредством ссылок относительно способов получения рекомбинантного ФВ. Заявленный в настоящем изобретении ФВ может содержать все возможные формы, включая мономерные и мультимерные формы. Также следует понимать, что настоящее изобретение охватывает разные формы ФВ для применения их в комбинации. Например, заявленный в настоящем изобретении ФВ может содержать различные мультимеры, различные производные и, как биологически активные, так и не являющиеся биологически активными производные.
[00144] В контексте настоящего изобретения термин рекомбинантный ФВ объединяет любые ФВ, полученные, например, от млекопитающих, таких как приматы, человек, обезьяны, кролики, свиньи, грызуны, мыши, крысы, хомяки, песчанки, собачьи, кошачьи, а также их биологически активные производны