Соли и кристаллические формы индуцирующего апоптоз агента
Иллюстрации
Показать всеИзобретение относится к соединению, имеющему систематическое название 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)бензамид (соединение 1) в форме ангидрата свободного основания кристаллической формы, гидрата свободного основания кристаллической формы, сольвата кристаллической формы, гидрохлоридной соли кристаллической формы или сульфатной соли кристаллической формы. Также изобретение относится к фармацевтической композиции, имеющей ингибирующую активность по отношению к антиапоптотическим белкам семейства Bcl-2, содержащей терапевтически эффективное количество соединения по изобретению и один или несколько фармацевтически приемлемых наполнителей. Технический результат – кристаллические формы соединения 1, подходящие для применения в качестве активного фармацевтического ингредиента. 4 н. и 17 з.п. ф-лы, 14 ил., 14 табл., 17 пр.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки № 61/416656, поданной 23 ноября 2010, которая включена таким образом посредством ссылки, как если бы она была изложена во всей ее полноте.
Сделана также перекрестная ссылка, без претензии на преимущество приоритета или признания в качестве статуса известного уровня техники, на следующую, находящуюся на рассмотрении заявку на патент США, содержащую объект изобретения, связанный с настоящей заявкой: серийный номер 12/787682 (опубликованной как заявка на патент США 2010/0305122), озаглавленной «Apoptosis-inducing Agents for the Treatment of Cancer and Immune and Autoimmune Diseases,» полное описание которой включено в данный контекст в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к солям и кристаллическим формам индуцирующего апоптоз агента, к фармацевтическим лекарственным формам, содержащим такие соли и кристаллические формы, к способам получения солей и кристаллических форм и к способам их применения для лечения заболеваний, характеризующихся избыточной экспрессией антиапоптотических белков семейства Be1-2.
Уровень техники изобретения
Избыточная экспрессия белков Bc1-2 коррелирует с резистентностью к химиотерапии, клиническим исходом заболевания, прогрессирующим развитием заболевания, общим прогнозом или их комбинациями при различных раковых заболеваниях и нарушениях иммунной системы.
Нарушение апоптоза является признаком рака (Hanahan & Weinberg (2000) Cell 100:57-70). Раковые клетки должны преодолевать постоянные “бомбардировки” клеточными стрессами, такими как повреждение ДНК, активация онкогенов, аберрантное прогрессирующее развитие клеточного цикла и неблагоприятные окружающие микросреды, которые могут заставить нормальные клетки подвергаться апоптозу. Одним из основных способов, посредством которых раковые клетки избегают апоптоз, является позитивная регуляция антиапоптотических белков семейства Be1-2.
Конкретным типом опухолевого заболевания, для которого необходимы улучшенные терапии, является неходжкинская лимфома (NHL). NHL является шестым, наиболее преобладающим типом нового рака в США и встречается в основном у пациентов возраста 60-70 лет. NHL является не одним заболеванием, а семейством родственных заболеваний, которые классифицируют на основе нескольких характеристик, включающих в себя клинические признаки и гистологию.
Один метод классификации разделяет различные гистологические подтипы на две основные категории на основе естественного развития заболевания, то есть в зависимости от того, является ли заболевание невыраженным развитием или интенсивно развивающимся. В общем, подтипы с невыраженным развитием развиваются медленно и обычно являются неизлечимыми, тогда как интенсивно развивающиеся подтипы развиваются быстро и потенциально являются излечимыми. Фолликулярные лимфомы являются наиболее распространенным подтипом с невыраженным развитием, и диффузные крупноклеточные лимфомы составляют наиболее распространенный интенсивно развивающийся подтип. Онкопротеин Bc1-2 был впервые описан в неходжкинской В-клеточной лимфоме.
Лечение фолликулярной лимфомы обычно состоит из химиотерапии на биологической основе или комбинированной химиотерапии. Комбинированную терапию с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP) применяют в установленном порядке, как и комбинированную терапию с ритуксимабом, циклофосфамидом, винкристином и преднизоном (RCVP). Применяют также монотерапию с ритуксимабом (“нацелен” на CD20, фосфопротеин, равномерно экспрессируемый на поверхности В-клеток) или также применяют флударамин. Добавление ритуксимаба к химиотерапии может обеспечить улучшенную скорость ответной реакции и повышенную выживаемость без прогрессирования заболевания.
Агенты радиоиммунотерапии, химиотерапию с высокими дозами и трансплантацию стволовых клеток можно применять для лечения резистентной или рецидивирующей NHL. В настоящее время не имеется утвержденной лечебной схемы, которая обеспечивает курс лечения, и современные руководящие принципы рекомендуют, чтобы пациентов лечили в контексте клинического испытания, даже при установлении терапии первого выбора.
Терапия первого выбора для пациентов с агрессивной В-крупноклеточной лимфомой обычно состоит из применения ритуксимаба, циклофосфамида, доксорубицина, винкристина и преднизолона (R-CHOP), или применения индивидуально подобранной дозы этопозида, преднизолона, винкристина, циклофосфамида, доксорубицина и ритуксимаба (DA-ЕРОСН-R).
Большинство лимфом реагирует вначале на любую из этих терапий, но опухоли обычно рецидивируются и в результате становятся резистентными. Поскольку число схем лечения пациентов увеличивается, заболевание становится более устойчивым к химиотерапии. Средняя ответная реакция на терапию первого выбора составляет примерно 75%, 60% на терапию второго выбора, 50% на терапию третьего выбора и около 35-40% на терапию четвертого выбора. Показатели ответных реакций, приближающиеся к 20% при применении одного агента в случае установления многих рецидивов, считаются положительными и оправдывают дальнейшее исследование.
Другие, относящиеся к новообразованию заболеваниями, для которых необходимы улучшенные терапии, включают в себя лейкозы, такие как хронический лимфолейкоз (например, NHL, В-клеточная лимфома) и острый лимфолейкоз.
Хронический лимфолейкоз (CLL) является наиболее распространенным типом лейкоза. CLL является прежде всего болезнью взрослых людей, более 75% людей, у которых впервые диагностировано такое заболевание, находятся в возрасте старше 50 лет, но в редких случаях его можно также обнаружить у детей. Комбинированные химиотерапии являются распространенными лечениями, например, с применением флударабина с циклофосфамидом и/или ритуксимабом или более сложных комбинаций, таких как CHOP или R-CHOP.
Острый лимфолейкоз, также известный как острый лимфобластный лейкоз (ALL), является, в первую очередь, детской болезнью, некогда с практически нулевым выживанием, но теперь с выживанием вплоть до 75% вследствие комбинации химиотерапий, аналогичных химиотерапиям, указанным выше. Новые методы лечения по-прежнему необходимы, чтобы обеспечить дальнейшее улучшение коэффициентов выживаемости.
Современные химиотерапевтические агенты вызывают противоопухолевый ответ индуцированием апоптоза посредством различных механизмов. Тем не менее, многие опухоли, в конечном счете, становятся устойчивыми к этим агентам. Было показано, что Bc1-2 и Bc1-XL придают устойчивость к химиотерапии в кратковременных анализах выживаемости in vitro и совсем недавно in vivo. Это предполагает, что если можно было бы разработать улучшенные терапии, предназначенные для подавления функции Bc1-2 и Bc1-ХL, такую резистентность к химиотерапии можно было бы успешно преодолеть.
Вовлечение белков Bc1-2 в патологический процесс рака мочевого пузыря, рака головного мозга, рака молочной железы, рака костного мозга, рака шейки матки, CLL, колоректального рака, рака пищевода, гепатоклеточного рака, лимфолейкоза, фолликулярной лимфомы, лимфонеоплазий Т-клеточного или В-клеточного происхождения, меланомы, миелоидного лейкоза, миеломы, рака полости рта, рака яичников, немелкоклеточного рака легких, рака предстательной железы, мелкоклеточного рака легких, рака селезенки и тому подобного описаны в Международной патентной публикации №№ WO 2005/024636 и WO 2005/049593.
Вовлечение белков Bc1-2 в патологические процессы иммунных и аутоиммунных заболеваний описано, например, в публикациях Puck & Zhu (2003) Current Allergy and Asthma Reports 3:378-384; Shimazaki et al. (2000) British Journal of Haematology 110(3): 584-590; Rengan et al. (2000) Blood 95(4): 1283-1292; and Holzelova et al. (2004) New England Journal of Medicine 351(14): 1409-1418. Вовлечение белков Bc1-2 в процессы отторжения трансплантата костного мозга описано в публикации патентной заявки Соединенных Штатов № US 2008/0182845.
Известны соединения, которые занимают сайт связывания на белках Bc1-2. Чтобы быть терапевтически применимыми для перорального введения, желательно, чтобы такие соединения имели высокое сродство в отношении связывания, демонстрируя, например, Кi <1 нМ, предпочтительно <0,1 нМ, более предпочтительно <0,01 нМ для белков семейства Bc1-2, в частности, Bc1-2, Bc1-XL и Bc1-w. Кроме того, желательно, чтобы они были изготовлены в составе препарата таким образом, чтобы обеспечивалось их высокое системное воздействие после перорального введения. Типичным показателем системного воздействия после перорального введения соединения является площадь под кривой (AUC), являющейся результатом графического изображения зависимости концентрации соединения в плазме от времени перорального введения.
Индуцирующие апоптоз лекарственные средства, “мишенью” которых являются белки семейства Вс1-2, такие как Вс1-2 и Вс1-ХL, лучше всего вводят согласно схеме, которая обеспечивает непрерывное, например ежедневное, пополнение концентрации лекарственных средств в плазме в терапевтически эффективном диапазоне. Это можно достичь ежедневным парентеральным, например внутривенным (i.v.) или внутрибрюшинным (i.p.), введением. Тем не менее, ежедневное парентеральное введение часто не является удобным в клинических условиях, особенно для амбулаторных больных. Для повышения клинической применимости индуцирующего апоптоз агента, например, в качестве химиотерапевтического агента, у пациентов, больных раком, может быть очень желательна лекарственная форма с приемлемой пероральной биологической доступностью. Такая лекарственная форма и схема для ее перорального введения будут представлять собой огромный успех при лечении многих типов рака, включающих в себя NHL, CLL и ALL, и могут легче сделать возможным применение комбинированных терапий с другими химиотерапевтическими средствами.
Различные кристаллические формы индуцирующего апоптоз агента могут обеспечить различные свойства в отношении стабильности, растворимости, скорости растворения, твердости, прессуемости и температуры плавления среди других физических и механических свойств. Вследствие того, что легкость производства, технологии изготовления, хранения и транспортировки индуцирующего апоптоз агента зависит по меньшей мере от некоторых этих свойств, существует потребность в химической и терапевтической областях в идентификации новых солей и кристаллических форм индуцирующих апоптоз агентов и способах воспроизводимого получения таких солей и кристаллических форм.
Сущность изобретения
Настоящее изобретение относится к солям и кристаллическим формам индуцирующего апоптоз агента, называемого в контексте «соединением 1», которое имеет систематическое название 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)бензамид и которое можно изобразить формулой
После синтеза соединения 1, описываемого в контексте, продукт можно выделить в виде порошка в аморфном состоянии. Аморфная форма соединения 1 может не быть хорошо подходящей для применения в качестве активного фармацевтического ингредиента (API) для различных типов указанных ниже препаратов. Более конкретно, очистка аморфной формы соединения 1 может быть трудной и поэтому дорогой и может вызвать проблемы управления процессом.
Настоящее изобретение предоставляет ряд новых солей и кристаллических форм соединения 1, подходящих для использования в качестве API для большого разнообразия типов препаратов, включающих в себя препараты, в которых API присутствует в форме частиц вместе с наполнителями, например в форме перорально доставляемых таблеток или капсул. Соли и кристаллические формы соединения 1 могут быть также применимыми, когда кристаллическую форму превращают в не-кристаллическую форму (например, в форму раствора или аморфную форму) при изготовлении препарата. Кроме того, включены способы получения солей и кристаллических форм соединения 1. Соль и кристаллические формы соединения 1 можно применять для изменения и/или улучшения физико-химических свойств API, в том числе свойств в твердом состоянии (например, кристалличности, гигроскопичности, температуры плавления, потенциала гидратации, полиморфизма и т.д.), фармацевтических свойств (например, растворимости/скорости растворения, стабильности, совместимости и т.д.), и характеристик кристаллизации (например, чистоты, выхода, морфологии и т.д.) в качестве неограничивающих примеров.
В некоторых вариантах осуществления соль или кристаллическая форма соединения 1 включает в себя ангидрат (безводное) свободное основание соединения 1, имеющий порошковую рентгенограмму (PXRD) A, ангидрат свободного основания соединения 1, имеющий PXRD В, гидрат свободного основания соединения 1, имеющий PXRD С, гидрат свободного основания соединения 1, имеющий PXRD D, сольват дихлорметана свободного основания соединения 1, имеющий PXRD E, сольват этилацетата свободного основания соединения 1, имеющий PXRD F, сольват этилацетата свободного основания соединения 1, имеющий PXRD G, сольват ацетонитрила свободного основания соединения 1, имеющий PXRD Н, сольват ацетонитрила свободного основания соединения 1, имеющий PXRD I, сольват ацетона свободного основания соединения 1, имеющий PXRD J, гидрохлорид соединения 1, имеющий PXRD K, гидрат гидрохлорида соединения 1, имеющий PXRD L, сульфат соединения 1, имеющий PXRD M, и сольват тетрагидрофурана (ТГФ) свободного основания соединения 1, имеющий PXRD N, причем каждый имеет соответствующую порошковую рентгенограмму, описываемую в контексте.
В некоторых вариантах осуществления кристаллические формы сольвата дихлорметана свободного основания соединения 1, сольвата ацетонитрила свободного основания соединения 1, гидрохлорида соединения 1 и сольвата тетрагидрофурана свободного основания соединения 1 имеют соответствующие параметры кристаллической решетки, описываемые в контексте.
В другом варианте осуществления предложен гидрохлорид соединения 1.
В другом варианте осуществления предложен сульфат соединения 1.
В некоторых вариантах осуществления предложена композиция API, содержащая соединение 1 в качестве API, в которой по меньшей мере часть, например, по меньшей мере приблизительно 10% соединения 1 в композиции находится в форме соли или кристаллической формы. В некоторых вариантах осуществления более чем 95% или по существу 100% API в такой композиции является солью или кристаллической формой соединения 1.
В некоторых вариантах осуществления предложена фармацевтическая композиция, которая содержит соль или кристаллическую форму соединения 1, описываемого выше, и один или несколько фармацевтически приемлемых наполнителей.
В некоторых вариантах осуществления предложен способ получения фармацевтической композиции в виде раствора соединения 1, где способ содержит растворение соли или кристаллической формы Соединения 1, описываемой в контексте, в фармацевтически приемлемом растворителе или смеси растворителей.
В некоторых вариантах осуществления предложен способ лечения заболевания, характеризующегося апоптотической дисфункцией и/или избыточной экспрессией антиапоптотического белка семейства Bc1-2, где способ содержит введение субъекту, страдающему таким заболеванием, терапевтически эффективного количества (а) соли или кристаллической формы соединения 1, описываемого в контексте, или (б) фармацевтической композиции, содержащей соль или кристаллическую форму соединения 1, описываемого в контексте, и один или несколько фармацевтически приемлемых наполнителей.
В некоторых вариантах осуществления предложен способ лечения заболевания, характеризующегося апоптотической дисфункцией и/или избыточной экспрессией антиапоптотического белка семейства Bc1, где указанный способ включает в себя приготовление раствора или дисперсии соли или кристаллической формы соединения 1, описанного в контексте, в фармацевтически приемлемом растворителе или смеси растворителей и введение полученного раствора или дисперсии в терапевтически эффективном количестве субъекту, имеющему указанное заболевание.
Дополнительные варианты осуществления настоящего изобретения, в том числе отдельные аспекты вариантов осуществления, приведенных выше, можно найти в подробном описании, или они будут очевидны из подробного описания, представленного далее.
Краткое описание чертежей
Фиг. 1 представляет собой сканирование рентгенограммы PXRD ангидрата соединения 1, обозначенной рентгенограммой А.
Фиг. 2 представляет собой сканирование PXRD ангидрата соединения 1, обозначенное рентгенограммой В.
Фиг. 3 представляет собой сканирование PXRD гидрата соединения 1, обозначенное рентгенограммой С.
Фиг. 4 представляет собой сканирование PXRD гидрата соединения 1, обозначенное рентгенограммой D.
Фиг. 5 представляет собой вычисленную рентгенограмму PXRD сольвата дихлорметана соединения 1, обозначенную рентгенограммой E.
Фиг. 6 представляет собой сканирование PXRD сольвата этилацетата соединения 1, обозначенное рентгенограммой F.
Фиг. 7 представляет собой сканирование PXRD сольвата этилацетата соединения 1, обозначенное рентгенограммой G.
Фиг. 8 представляет собой вычисленную рентгенограмму PXRD сольвата ацетонитрила соединения 1, обозначенную рентгенограммой Н.
Фиг. 9 представляет собой сканирование PXRD сольвата ацетонитрила соединения 1, обозначенное рентгенограммой I.
Фиг. 10 представляет собой сканирование PXRD сольвата ацетона соединения 1, обозначенное рентгенограммой J.
Фиг. 11 представляет собой вычисленную рентгенограмму PXRD гидрохлорида соединения 1, обозначенную рентгенограммой К.
Фиг. 12 представляет собой сканирование PXRD гидрохлорида соединения 1, обозначенное рентгенограммой L.
Фиг. 13 представляет собой сканирование PXRD сульфата соединения 1, обозначенное рентгенограммой М.
Фиг. 14 представляет собой сканирование PXRD сольвата тетрагидрофурана соединения 1, обозначенное рентгенограммой N.
Подробное описание
Термин «свободное основание» применяют для удобства в контексте для указания на родоначальное (исходное) соединение, соединение 1, отличное от любой его соли, несмотря на это, считая, что родоначальное соединение, строго говоря, является цвиттерионным при нейтральных условиях и поэтому не всегда проявляет себя как истинное основание.
Индуцирующий апоптоз агент, называемый в контексте соединением 1, имеет систематическое название 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)бензамид и его можно изобразить формулой
В различных вариантах осуществления предложены соли и кристаллические формы соединения 1. Кристаллические формы включают в себя сольваты, гидраты, ангидраты и соли соединения 1.
В противоположность аморфной форме свободного основания соединения 1 и аморфной форме соли соединения 1, кристаллическая форма характеризуется присутствием наблюдаемых пиков в порошковой рентгенограмме (PXRD), получаемой для кристаллической формы. Для кристаллических форм, подготовленных для получения монокристаллов подходящего размера, кристаллическую форму можно дополнительно характеризовать путем экспериментального определения параметров элементарной ячейки, определения кристаллографической пространственной группы, к которой принадлежит монокристалл, или обоих из них. Если параметры элементарной ячейки являются известными, расположение пиков дифракции и, в частности, величин 2θ пиков порошковой рентгенограммы (PXRD) можно рассчитать для дальнейшей характеризации кристаллической формы. Порошковую рентгенограмму можно также, конечно, измерить экспериментально для таких кристаллических форм. Если известны не только параметры элементарной ячейки, но и трехмерная структура монокристалла, то не только положения, но также и интенсивность пиков на рентгенограмме можно вычислить при дальнейшей характеризации кристаллической формы.
Рентгенограммы PXRD, измеренные или рассчитанные для солей и кристаллических форм, указанные в контексте, представляют собой “отпечатки пальцев”, которые можно сравнить с другими экспериментально определенными рентгенограммами для нахождения совпадения. Идентичность соответствующих кристаллических форм устанавливают наложением или сравнением экспериментально определенной рентгенограммы PXRD с рентгенограммой PXRD кристаллических форм, указанных в контексте. В различных вариантах осуществления соли и кристаллические формы характеризуются присутствием по меньшей мере одного из пиков PXRD, указанных в контексте. Таким образом, в различных вариантах осуществления соль или кристаллическую форму характеризуют совпадением двух или более пиков, совпадением 3 или более пиков, 4 или более пиков или 5 или более пиков и так далее, из соответствующих рентгенограмм PXRD.
Вариант осуществления синтеза соединения 1 (свободного основания) и репрезентативных промежуточных соединений представлен ниже. Приведенные в качестве примеров соединения называются с применением ACD/ChemSketch Version 5.06 (05 June 2001, Advanced Chemistry Development Inc., Toronto, Ontario), ACD/ChemSketch Version 12.01 (13 May 2009), Advanced Chemistry Developmеnt Inc., Toronto, Ontario) или ChemDraw® Ver. 9.0.5 (CambridgeSoft, Cambridge, MA). Промежуточные соединения называют с применением ChemDraw® Ver. 9.0.5 (CambridgeSoft, Cambridge, MA).
Синтез соединения 1
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение А
3-Нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфонамид
Смесь 4-фтор-3-нитробензолсульфонамида (2,18 г), 1-(тетрагидропиран-4-ил)метиламина (1,14 г) и триэтиламина (1 г) в тетрагидрофуране (30 мл) перемешивали в течение ночи, нейтрализовали концентрированной НСl и концентрировали. Остаток суспендировали в этилацетате и осадки собирали, промывали водой и сушили, получая при этом указанное в заголовке соединение.
Соединение В
Метил-4,4-диметил-2-(трифторметилсульфонилокси)циклогекс-1-енкарбоксилат
К суспензии промытого гексаном NaH (17 г) в дихлорметане (700 мл) по каплям добавляли 5,5-диметил-2-метоксикарбонилциклогексанон (38,5 г) при 0°C. После перемешивания в течение 30 минут смесь охлаждали до -78°C и добавляли трифторуксусный ангидрид (40 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 24 часов. Органический слой промывали насыщенным раствором соли, сушили (Na2SO4)), фильтровали и концентрировали, получая при этом продукт.
Соединение C
Метил-2-(4-хлорфенил)-4,4-диметилциклогекс-1-енкарбоксилат
Соединение B (62,15 г), 4-хлорфенилбороновую кислоту (32,24 г), CsF (64 г) и тетракис(трифенилфосфин)палладий(0) (2 г) в смеси 2:1 диметоксиэтан/метанол (600 мл) нагревали до 70°C в течение 24 часов. Смесь концентрировали. Добавляли эфир (4×200 мл) и смесь фильтровали. Объединенный эфирный раствор концентрировали, получая при этом продукт.
Соединение D
(2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)метанол
К смеси LiBH4 (13 г) соединения С (53,8 г) и эфира (400 мл) медленно при помощи шприца добавляли метанол (25 мл). Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь гасили 1н НСl при охлаждении льдом. Смесь разбавляли водой и экстрагировали диэтиловым эфиром (3×100 мл). Экстракты сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт хроматографировали на силикагеле с использованием 0-30% раствора этилацетат/гексан.
Соединение Е
трет-Бутил-4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-карбоксилат
Мезилхлорид (7,5 мл) с помощью шприца добавляли к соединению D (29,3 г) и триэтиламину (30 мл) в CH2Cl2 (500 мл) при 0°C и смесь перемешивали в течение 1 минуты. Добавляли N-трет-бутоксикарбонилпиперазин (25 г) и смесь перемешивали при комнатной температуре в течение 24 часов. Суспензию промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт хроматографировали на силикагеле с использованием 10-20% раствора этилацетат/гексан.
Соединение F
1-((2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин
Соединение Е (200 мг) и триэтилсилан (1 мл) перемешивали в дихлорметане (15 мл) и трифторуксусной кислоте (15 мл) в течение 1 часа. Смесь концентрировали, растворяли в этилацетате, дважды промывали NaH2РО4 и насыщенным раствором соли и сушили (Na2SO4), фильтровали и концентрировали.
Соединение G
5-Бром-1-(триизопропилсилил)-1H-пирроло[2,3-b]пиридин
К смеси 5-бром-1H-пирроло[2,3-b]пиридина (15,4 г) в тетрагидрофуране (250 мл) добавляли 1М гексаметилдисилазид лития в тетрагидрофуране (86 мл) и спустя 10 минут добавляли TIPS-Cl (триизопропилхлорсилан) (18,2 мл). Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли эфиром и полученный раствор промывали дважды водой. Экстракты сушили (Na2SO4), фильтровали и концентрировали. Сырой продукт хроматографировали на силикагеле с применением 10% раствора этилацетат/гексан.
Соединение H
1-(Триизопропилсилил)-1H-пирроло[2,3-b]пиридин-5-ол
К смеси соединения G (24,3 г) в тетрагидрофуране (500 мл) при -78°C добавляли 2,5М BuLi (30,3 мл). Спустя 2 минуты добавляли триметилборат (11,5 мл) и смеси давали возможность нагреться до комнатной температуры на протяжении 1 часа. Реакционную смесь выливали в воду, экстрагировали три раза этилацетатом и объединенные экстракты промывали насыщенным раствором соли и концентрировали. Неочищенный продукт растворяли в тетрагидрофуране (200 мл) при 0°C и добавляли 1М NaOH (69 мл) с последующим добавлением 30% H2О2 (8,43 мл) и раствор перемешивали в течение 1 часа. Добавляли Na2S2О3 (10 г) и рН доводили до 4-5 концентрированной НС1 и твердым NaH2РО4. Раствор экстрагировали дважды этилацетатом и объединенные экстракты промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт хроматографировали на силикагеле с использованием 5-25% раствора этилацетат/гексан.
Соединение I
Метил-2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-фторбензоат
Смесь соединения H (8,5 г), метил-2,4-дифторбензоата (7,05 г) и K3РО4 (9,32 г) в диглиме (40 мл) при 115°C перемешивали в течение 24 часов. Реакционную смесь охлаждали, разбавляли эфиром (600 мл) и дважды промывали водой и насыщенным раствором соли и концентрировали. Неочищенный продукт хроматографировали на силикагеле с использованием 2-50% раствора этилацетат/гексан.
Соединение J
Метил-2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Смесь соединения I (1,55 г), соединения F (2,42 г) и HK2РО4 (1,42 г) в диметилсульфоксиде (20 мл) при 135°C перемешивали в течение 24 часов. Реакционную смесь охлаждали, разбавляли эфиром (400 мл) и промывали 3 раза 1М NaOH и насыщенным раствором соли и концентрировали. Неочищенный продукт хроматографировали на силикагеле с использованием 10-50% раствора этилацетат/гексан.
Соединение К
2-(1H-Пирроло[2,3-b]пиридин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение J (200 мг) в диоксане (10 мл) и 1М NaOH (6 мл) при 50°C перемешивали в течение 24 часов. Реакционную смесь охлаждали, добавляли к раствору NaH2РО4 и экстрагировали три раза этилацетатом. Объединенные экстракты промывали насыщенным раствором соли и концентрировали, получая при этом чистый продукт.
Соединение L (соединение 1 в виде свободного основания)
4-(4-{[2-(Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение K (3,39 г), соединение А (1,87 г), гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида (2,39 г) и 4-диметиламинопиридин (1,09 г) перемешивали в CH2Cl2 (40 мл) в течение 24 часов. Реакционную смесь охлаждали и хроматографировали на силикагеле с использованием 25-100% раствора этилацетат/гексан, затем 10% раствора метанол/этилацетат с 1% уксусной кислоты, получая при этом продукт (1,62 г, 32%) в виде твердого вещества. 1H ЯМР (300 МГц, диметилсульфоксид-d6) 11,65 (шир. С, 1H), 8,55 (шир. С, 1H), 8,04 (д, 1Н), 7,89 (дд, 1H), 7,51 (м, 3Н), 7,33 (д, 2H), 7,08 (м, 1H), 7,04 (д, 2H), 6,68 (дд, 1H), 6,39 (д, 1H), 6,19 (д, 1Н), 3,84 (м, 1Н), 3,30 (м, 4Н), 3,07 (м, 4Н), 2,73 (м, 2Н), 2,18 (м, 6Н), 1,95 (м, 2H), 1,61 (дд, 2H), 1,38 (м, 2Н), 1,24 (м, 4Н), 0,92 (с, 6Н).
Получение соединения 1 в виде свободного основания описано также в примере 5 заявки на патент США, серийный номер 12/787682 (опубликована как 2010/0305122 США) под названием «Индуцирующие апоптоз агенты для лечения рака и иммунных и аутоиммунных заболеваний», полное описание которой включено в контекст посредством ссылки. Твердое вещество можно получить из элюата хроматографии, например, с помощью способа сушки вымораживанием, осаждения или роторного испарения. Продукт этого способа может быть твердым веществом, которое является аморфным.
Соли и кристаллические формы соединения 1 получали, как описано в следующих примерах.
Ангидрат свободного основания соединения 1 (рентгенограмма А PXRD)
Данную кристаллическую форму можно получить следующими двумя путями, в которых сушка в условиях окружающей среды включает в себя выдерживание твердого вещества при комнатной температуре и воздействие на него воздуха на протяжении ночи. Растворитель можно удалить, например, испарением.
Пример 1: сольват дихлорметана свободного основания соединения 1, имеющего рентгенограмму Е (см. ниже), сушили в условиях окружающей среды.
Пример 2: сольват этилацетата свободного основания соединения 1, имеющего рентгенограмму F (см. ниже), сушили в условиях окружающей среды.
Порошковая рентгенограмма и перечень пиков показаны на фигуре 1 и в таблице 1, соответственно.
| Таблица 1 |
| Перечень пиков рентгенограммы А ангидрата свободного основания соединения 1 |
| Положение пика (° 2θ) |
| 6,3 |
| 7,1 |
| 9,0 |
| 9,5 |
| 12,5 |
| 14,5 |
| 14,7 |
| 15,9 |
| 16,9 |
| 18,9 |
Ангидрат свободного основания соединения 1 (рентгенограмма В PXRD)
Пример 3: сольват ацетонитрила свободного основания соединения 1, имеющего рентгенограмму Н, сушили в условиях окружающей среды.
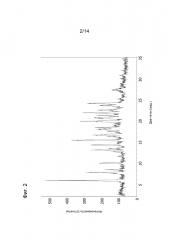
Порошковая рентгенограмма и перечень пиков показаны на фигуре 2 и в таблице 2, соответственно.
| Таблица 2 |
| Перечень пиков рентгенограммы В ангидрата свободного основания соединения 1 |
| Положение пика (° 2θ) |
| 5,8 |
| 7,7 |
| 8,3 |
| 9,9 |
| 13,0 |
| 13,3 |
| 14,2 |
| 15,3 |
| 16,6 |
| 17,9 |
| 18,3 |
| 19,8 |
| 20,7 |
| 21,2 |
| 21,9 |
| 22,5 |
| 23,6 |
| 24,1 |
Гидрат свободного основания соединения 1 (рентгенограмма С PXRD)
Гидрат свободного основания, характеризующийся рентгенограммой С, можно получить тремя путями.
Пример 4: сольват метанола свободного основания соединения 1 сушили в условиях окружающей среды.
Пример 5: сольват этанола свободного основания соединения 1 сушили в условиях окружающей среды.
Пример 6: сольват 2-пропанола свободного основания соединения 1 сушили в условиях окружающей среды.
Порошковая рентгенограмма и перечень пиков показаны на фигуре 3 и в таблице 3, соответственно.
| Таблица 3 |
| Перечень пиков рентгенограммы С гидрата свободного основания соединения 1 |
| Положение пика (° 2θ) |
| 5,8 |
| 7,6 |
| 7,9 |
| 10,7 |
| 11,7 |
| 14,0 |
| 15,3 |
| 15,8 |
| 17,4 |
| 18,3 |
| 19,9 |
| 20,4 |
| 20,7 |
| 22,5 |
| 24,9 |
| 25,8 |
| 26,7 |
Гидрат свободного основания соединения 1 (рентгенограмма D PXRD)
Пример 7: сольват ацетата свободного основания соединения 1, имеющего рентгенограмму G, сушили в условиях окружающей среды.
Порошковая рентгенограмма и перечень пиков показаны на фигуре 4 и в таблице 4, соответственно.
| Таблица 4 |
| Перечень пиков рентгенограммы D гидрата свободного основания соединения 1 |
| Положение пика (° 2θ) |
| 3,3 |
| 6,4 |
| 7,1 |
| 7,3 |
| 10,1 |
| 11,4 |
| 13,2 |
| 14,4 |
| 14,6 |
| 15,1 |
| 15,8 |
| 16,2 |
| 17,2 |
| 17,6 |
| 18,0 |
| 18,6 |
| 19,0 |
| 19,5 |
| 19,8 |
| 20,2 |
| 20,7 |
| 21,0 |
| 22,5 |
| 23,0 |
| 26,0 |
| 28,9 |
| 29,2 |
Сольват дихлорметана свободного основания соединения 1 (рентгенограмма Е PXRD)
Пример 8: свободное основание соединения 1 в виде твердого вещества суспендировали в дихлорметане при температурах окружающей среды до достижения его растворимости. После достижения равновесия твердые вещества выделяли при температуре окружающей среды.
Порошковая рентгенограмма и перечень пиков показаны на фигуре 5 и в таблице 5А, соответственно. Кристаллографическая информация представлена в таблице 5В.
| Таблица 5А |
| Перечень вычисленных пиков PXRD для рентгено |