Способ получения клеточного пласта из клеток пигментного эпителия сетчатки
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способу получения клеточного пласта из клеток пигментного эпителия сетчатки, что может быть использовано в медицине. Получают пласт из клеток пигментного эпителия сетчатки на геле за счет индуцирования дифференциации стволовых клеток и клеток-предшественников ex vivo и базальную мембрану, секретированную из клеток полученного пигментного эпителия сетчатки. Изобретение позволяет получать эффективный для трансплантации и скрининга пласт клеток пигментного эпителия сетчатки. 3 н. и 4 з.п. ф-лы, 1 ил., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения клеточного пласта, включающему высевание клеток пигментного эпителия сетчатки на коллагеновом геле. Настоящее изобретение также относится к клеточному пласту для трансплантации, содержащему слой клеток, сформированный из клеток пигментного эпителия сетчатки, и базальную мембрану.
Уровень техники
В настоящее время, возрастная дегенерация желтого пятна (AMD) представляет собой одно из главных заболеваний, вызывающих практическую слепоту в развитых странах, и наблюдается в основном у пожилых граждан в возрасте больше 50. Возрастная дегенерация желтого пятна вызывается возрастными изменениями в макуле, и разделятся в основном на экссудативную форму и атрофическую форму. Экссудативная возрастная дегенерация желтого пятна представляет собой заболевание, связанное с развитием новообразовавшихся сосудов из сосудистой оболочки глаза, в макуле пожилых граждан, затем с кровотечением и экссудативным повреждением под пигментным эпителием сетчатки или под сетчаткой, и наконец, с формированием рубцовой ткани. Атрофическая возрастная дегенерация желтого пятна представляет собой заболевание, сопровождаемое атрофией макулярной области и накоплением друзов. Предшествующее повреждение, приводящее к экссудативной и атрофической возрастной дегенерации желтого пятна, иногда упоминается, в частности, как ранняя возрастная дегенерация желтого пятна, и это повреждение также рассматривается как одна из патологий возрастной дегенерации желтого пятна.
Для лечения возрастной дегенерации желтого пятна, когда она находится в легкой экссудативной форме, может выбираться хирургическое лечение, такое как фотодинамическая терапия, лазерная фотокоагуляция, отслоение новообразовавшихся сосудов, и тому подобное, или способ лечения, имеющий целью регрессию и удаление новообразовавшихся сосудов с помощью лекарственной терапии, такой как введение ингибитора фактора роста сосудов эндотелия (VEGF), вовлеченного в ангиогенез, и тому подобное. Однако рассмотренные выше средства не могут обеспечить терапевтическую эффективность для экссудативной или атрофической формы, которая прогрессирует до запущенной атрофии или до отсутствия пигментного эпителия сетчатки (RPE). В таком случае, эффективный способ лечения представляет собой трансплантацию клеток пигментного эпителия сетчатки или самого пигментного эпителия сетчатки на место, где он отсутствует, под сетчаткой.
Опробованы разнообразные способы лечения посредством трансплантации клеток пигментного эпителия сетчатки. Сообщается, что трансплантация клеток пигментного эпителия сетчатки, полученных от эмбриона человека, в форме клеточной суспензии демонстрирует плохую приживаемость трансплантируемых клеток. В случаях, когда трансплантируется клеточный пласт из клеток пигментного эпителия сетчатки, содержащий также оболочку Бруха и сосудистую оболочку глаза, отсоединенную в виде пласта из глаза трупа, происходит постоперационное отторжение и не получается достаточное воздействие лечения (непатентный документ 1). В дополнение к этому, способ, использующий глаз трупа, как отмечено, включает этическую проблему. С другой стороны, сообщается о случае улучшения зрения у пациента с возрастной дегенерацией желтого пятна, когда используют способ, включающий отбор собственных нормальных клеток пигментного эпителия сетчатки пациента и сосудистой оболочки глаза и трансплантацию их в то место, где их нет, под макулой. Однако этот способ доставляет исключительно большое неудобство для пациентов и имеет исключительно высокий риск при операции. Хотя была сделана попытка использования собственных клеток пигментного эпителия радужной оболочки глаза пациента, отобранных у пациента с возрастной дегенерацией желтого пятна, для трансплантации вместо клеток пигментного эпителия сетчатки, верхний предел конечного зрения является низким и достаточное воздействие не получается, и кроме того, неудобства и риск использования собственных клеток пациента являются большими (непатентный документ 2). Таким образом, обычные способы лечения с использованием клеток, отобранных из глаза трупа, или собственных клеток пациента являются непрактичными с точки зрения этики, безопасности, воздействия, и тому подобное, и клетки пигментного эпителия сетчатки, действительно пригодные для использования при трансплантационном лечении, являются желательными.
В качестве одного из способов получения клеточного пласта из клеток пигментного эпителия сетчатки, может быть рассмотрен способ, включающий нанесение на субстрат клеточной культуры внеклеточного матрикса, и тому подобное, и культивирование клеток пигментного эпителия сетчатки на нем с формированием пласта. Например, клеточный пласт может быть сформирован посредством культивирования клеток пигментного эпителия сетчатки на материале, покрытом фибронектином, но о формировании базальной мембраны не сообщалось, и способ отбора пласта из контейнера, в котором формируется пласт, вообще не описывался (непатентный документ 3). При рассмотрении таких проблем, способ формирования заранее клеточного пласта из клеток пигментного эпителия сетчатки посредством использования искусственной мембраны вместо базальной мембраны разрабатывался многими лабораториями. Однако искусственная мембрана вызывает опасения относительно расстройства при приживлении во время трансплантации и функциональной поддержки организма. Хотя разработана также искусственная мембрана с меньшей биологической реакцией, она непригодна для трансплантации, поскольку она доставляет проблемы, вызывая воспаление и отторжение, связанные с ней, которые вызываются отличиями от базальной мембраны, производимой самими клетками, по композиции, свойствам, жесткости, и тому подобное. Однако повсеместно известен способ культивирования клеточного пласта из клеток пигментного эпителия сетчатки, имеющих полярность. Однако он предназначается только для использования на экспериментальных моделях, где клетки пигментного эпителия сетчатки и иммортализованная линия, полученная из живого организма, формируются в виде пласта в контейнере и используются непосредственно, и это еще не дает возможности реального извлечения клеточного пласта из клеток пигментного эпителия сетчатки, снабженного базальной мембраной, как в живых организмах, из контейнера (непатентный документ 4). Имеется способ получения клеточного пласта из клеток пигментного эпителия сетчатки посредством отслаивания клеток пигментного эпителия сетчатки, непосредственно культивируемых на чашке для культивирования, без использования внеклеточного матрикса, и тому подобное. Такой способ отсоединения клеток посредством отслаивания не может стабилизировать форму и размер пласта, базальной мембраны, и тому подобное, вызывает большие повреждения на клетках пигментного эпителия сетчатки при отслаивании и вызывает, в большинстве случаев, разрушение формы пласта и отдельных клеток из-за отслаивания, таким образом, он не может обеспечить клеточный пласт, пригодный для трансплантации, и тому подобное (непатентный документ 5). В дополнение к этому, хотя сообщалось о нанесении покрытия на субстрат культуры клеток покрытия из коллагена и культивирования клеток на коллагене, клетки пигментного эпителия сетчатки человека не использовали. Кроме того, для повышения прочности геля, должен отдельно добавляться агент для поперечной сшивки, что делает способ далеким от удобства и скорости (патентный документ 1). В соответствии с современной ситуацией, получение клеточного пласта из клеток пигментного эпителия сетчатки, который является терапевтически эффективным для заболеваний сетчатки, таких как возрастная дегенерация желтого пятна, и тому подобное, и удобным и стабильным с точки зрения приготовления, по-прежнему представляет собой проблему.
[Список документов]
[Патентный документ]
Патентный документ 1: JP-A-2005-261292
[Непатентные документы]
Непатентный документ 1: Ophthalmic Surg. 1991 Feb; 22(2): 102-8.
Непатентный документ 2: Tohoku J Exp Med. 1999 Dec; 189(4): 295-305.
Непатентный документ 3: Nat. Protoc., 4(5), 2009, 662-673.
Непатентный документ 4: Invest. Ophthalmol. Vis. Sci., 47, 2006, 3612-3624.
Непатентный документ 5: Invest. Ophthalmol. Vis. Sci., 36(2), 1995, 381-390.
Сущность изобретения
Проблемы, которые должны решаться изобретением
Задачей настоящего изобретения является разработка нового способа получения клеточного пласта из клеток пигментного эпителия сетчатки удобным и стабильным образом без использования искусственной мембраны и обеспечение пациентов с заболеванием, связанным с отсутствием пигментного эпителия сетчатки, таким как возрастная дегенерация желтого пятна, и тому подобное, клеточным пластом из клеток пигментного эпителия сетчатки для трансплантации, который демонстрирует высокую скорость приживления и является превосходным при функционировании.
Средства решения проблем
Авторы настоящего изобретения получают клеточный пласт посредством формирования слоя коллагенового геля на субстрате культуры клеток и высевания и культивирования на нем клеток пигментного эпителия сетчатки. Клеточный пласт, полученный с помощью такого способа, поддерживает базальную мембрану между коллагеновым гелем и клеточным пластом из клеток пигментного эпителия сетчатки, имеет способность секреции цитокинов и адгезивность между клетками, сходные со свойствами клеток пигментного эпителия сетчатки in vivo, и делает возможным легкое отсоединение клеточного пласта из клеток пигментного эпителия сетчатки от субстрата культуры клеток, в то же время, поддерживая базальную мембрану посредством разложения коллагенового геля с помощью коллагеназы. В дополнение к этому, клетки, составляющие клеточный пласт, поддерживают экспрессирование специфичного маркера клеток пигментного эпителия сетчатки. Авторы настоящего изобретения осуществили интенсивные исследования и завершили настоящее изобретение на основе этих данных. Соответственно, настоящее изобретение предлагает:
[1] способ получения клеточного пласта, включающий следующие стадии
(1) высевания и культивирования клеток пигментного эпителия сетчатки на коллагеновом геле с формированием клеточного пласта, состоящего из клеток пигментного эпителия сетчатки, и
(2) деградации коллагенового геля с помощью коллагеназы для отсоединения клеточного пласта, состоящего из клеток пигментного эпителия сетчатки;
[2] способ получения клеточного пласта из рассмотренного выше [1], где клетки пигментного эпителия сетчатки представляют собой клетки, полученные посредством индуцирования дифференциации стволовых клеток или клеток-предшественников;
[3] способ получения клеточного пласта из рассмотренного выше [2], где стволовые клетки представляют собой ES клетки или iPS клетки;
[4] способ получения клеточного пласта из рассмотренного выше [1], где концентрация коллагена в коллагеновом геле составляет 0,1%-0,5%;
[5] способ получения клеточного пласта по любому из рассмотренных выше [1]-[4], дополнительно включающий следующую далее стадию (3)
(3) подтверждение присутствия или отсутствия базальной мембраны на поверхности контакта между отсоединенным клеточным пластом и коллагеновым гелем;
[6] клеточный пласт, полученный с помощью способа по любому из рассмотренных выше [1]-[5];
[7] клеточный пласт для трансплантации, содержащий слой клеток, сформированный из клеток пигментного эпителия сетчатки, полученный посредством индуцирования дифференциации стволовых клеток или клеток-предшественников ex vivo, и базальную мембрану, секретированную из указанных клеток; и
[8] клеточный пласт для скрининга, содержащий слой клеток, сформированный из клеток пигментного эпителия сетчатки, полученных посредством индуцирования дифференциации стволовых клеток или клеток-предшественников ex vivo, и базальную мембрану, секретированную из указанных клеток.
Воздействие изобретения
В соответствии с настоящим изобретением, клеточный пласт из клеток пигментного эпителия сетчатки, имеющий конституцию, имеющую базальную мембрану, образующуюся на поверхности, может быть получен легким и стабильным образом. Поскольку клеточный пласт по настоящему изобретению является превосходным по скорости приживления и функциональности и исключительно пригодным для использования для трансплантации, пласт, состоящий из базальной мембраны и клеток пигментного эпителия сетчатки, может быть получен и применен на пациентах с офтальмологическими заболеваниями, такими как пациенты с возрастной дегенерацией желтого пятна, и тому подобное, посредством трансплантации. Конкретно, когда клетка, которая должна использоваться для культивирования, представляет собой клетку пигментного эпителия сетчатки, полученную из iPS клетки, отторжение при трансплантации может быть предотвращено посредством использования собственной клетки пациента в качестве источника.
Краткое описание чертежей
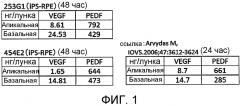
Фиг.1 показывает результаты исследования секреторной емкости цитокинов клеточного пласта из клеток пигментного эпителия сетчатки.
Описание вариантов осуществления
Настоящее изобретение поясняется подробно далее.
Настоящее изобретение предлагает способ получения клеточного пласта, включающий следующие стадии:
(1) высевания и культивирования клеток пигментного эпителия сетчатки на коллагеновом геле с формированием клеточного пласта, состоящего из клеток пигментного эпителия сетчатки, и
(2) деградации коллагенового геля с помощью коллагеназы для отсоединения клеточного пласта, состоящего из клеток пигментного эпителия сетчатки.
Хотя клетка пигментного эпителия сетчатки, которая должна высеваться на стадии (1), может представлять собой клетку, полученную от любого млекопитающего, постольку, поскольку она получается от млекопитающих (например, человека, обезьяны, мыши, крысы, собаки, коровы, лошади, свиньи, овцы, козы, кошки, кролика, хомяка, морской свинки, и тому подобное), предпочтительно, она представляет собой клетку, полученную от человека.
Клетка пигментного эпителия сетчатки, которая должна высеваться может представлять собой первичную клетку, непосредственно отобранную из глазного яблока, или клетку, полученную после нескольких пассажей. Первичные клетки пигментного эпителия сетчатки могут изолироваться с помощью известного способа. Например, в случае клеток пигментного эпителия сетчатки, полученных из глазного яблока, глазное яблоко трупа изолируют, быстро разделяют в экваториальной области, стекловидное тело и сетчатку удаляют и обрабатывают коллагеназой, гиалуронидазой, и тому подобное, по необходимости, клетки собирают посредством соскребывания с помощью лезвия для сбора клеток или обработки в растворе трипсина или EDTA для освобождения клеток от оболочки Бруха, выдерживают в культурной среде для индуцирования адгезии к чашке, для культивирования и роста, и клетки, выращенные в необходимом количестве, соответствующим образом пассажируют с помощью обработки трипсином, и тому подобное, для фиксации количества клеток.
Кроме того, эти клетки могут также представлять собой клетки, полученные посредством индуцирования дифференциации недифференцированных плюрипотентных стволовых клеток, таких как эмбриональная стволовая клетка (ES клетка), индуцированная плюрипотентная стволовая клетка (iPS клетка), и тому подобное, стволовые клетки, включая соматические стволовые клетки, такие как нейронная стволовая клетка, и тому подобное, или клетки-предшественники, включая нейронную клетку-предшественник и клетку-предшественник сетчатки. ES Клетка может также представлять собой ES клетку, полученную посредством перепрограммирования ядра соматической клетки. В дополнение к этому, в качестве стволовой клетки, целевая клетка может быть получена посредством индуцирования дифференциации индуцированной плюрипотентной стволовой клетки (iPS клетки), о котором сообщалось в последние годы. iPS Клетка представляет собой индуцированную стволовую клетку, полученную из соматической клетки, имеющую свойства, эквивалентные свойствам ES клетки, которая может быть получена посредством введения конкретного вещества, перепрограммирующего ядро (нуклеиновых кислот, белка, низкомолекулярного соединения, и тому подобное) в соматическую клетку [Takahashi, K. and Yamanaka, S., Cell, 126: 663-676 (2006); Takahashi, K. et al., Cell, 131: 861-872 (2007)]. Условия и среда, используемые для дифференциации рассмотренной выше стволовой клетки в целевую дифференцированную клетку, могут воспроизводить повсеместно известные условия и среду, или могут соответствующим образом определяться специалистами в данной области. В настоящем изобретении, клетка, полученная посредством индуцирования дифференциации стволовой клетки или клетки-предшественника, предпочтительно, плюрипотентной стволовой клетки, используется предпочтительно в качестве клетки пигментного эпителия сетчатки, которая должна использоваться для клеточного пласта, поскольку клетка пигментного эпителия сетчатки может быть получена на соответствующей стадии созревания, и в частности, могут быть получены сравнительно незрелые клетки пигментного эпителия сетчатки, и может быть преимущественно сформирован клеточный пласт. В дополнение к этому, когда клеточный пласт, который должен быть получен в соответствии с настоящим изобретением, предназначен для трансплантации, использование iPS клетки является предпочтительным, поскольку клеточный пласт, полученный с использованием соматической клетки субъекта, который принимает трансплантацию, в качестве источника iPS клетки, не имеет антигенности против субъекта. Когда стволовая клетка индуцируется для дифференциации, например, ES клетка человека или плюрипотентная стволовая клетка, такая как iPS клетка, и тому подобное, культивируется в среде для ES дифференциации, в которую добавляют антагонист Wnt, такой как Dkk-1, CKI-7, и тому подобное, и антагонист Nodal, такой как Lefty A, SB-431542, и тому подобное. Когда их культивируют в течение заданного периода, экспрессируются Rx, Pax6 и Mitf, которые представляют собой маркеры клеток-предшественников сетчатки, и клетки пигментного эпителия сетчатки человека могут быть получены посредством морфологического наблюдения с помощью оптического микроскопа посредством подтверждения присутствия клеток, имеющих многоугольную форму и пигмент [Neuroscience Letters 2009 Jul 24 458(3) 126-31, Journal of Cell Science 2009 Sep 1 122(Pt 17) 3169-79].
Клетки пигментного эпителия сетчатки по настоящему изобретению культивируют посредством высевания на коллагеновом геле. Коллаген, используемый для коллагенового геля, может быть любым постольку, поскольку его получают от млекопитающего (например, человека, обезьяны, мыши, крысы, собаки, коровы, лошади, свиньи, овцы, козы, кошки, кролика, хомяка, морской свинки, и тому подобное) и, например, используют коллаген, полученный от человека или свиньи. Примеры ткани, полученной из коллагена, включают сухожилие, кожу, и тому подобное. Хотя вид коллагена может быть любым, предпочтительным является коллаген иной, чем коллаген, составляющий базальную мембрану человека, и коллаген иной, чем коллаген типа IV является особенно предпочтительным. Среди них предпочтительно используют коллаген типа I. Хотя коллагеновый гель может быть получен с помощью, например, повсеместно известного способа получения, в настоящем изобретении, гель, состоящий из сетки коллагеновых волокон, получают посредством индуцирования фиброгенеза коллагена, как описано в рассмотренном ниже примере. Поскольку фиброзный коллаген имеет прочность и гибкость в сочетании, он является простым при манипулировании, показывает хорошую поддержку пролиферации клеток и дифференциации клеток, и является предпочтительным в качестве коллагенового геля для использования в настоящем изобретении. В дополнение к этому, коллаген, который используют в настоящем изобретении, требуется для поддержания клеток, которые высевают на коллагеновом геле, на поверхности геля, не позволяя им погружаться в слой геля. Следовательно, в качестве коллагена предпочтительным является коллаген, где гель имеет прочность, необходимую для пролиферации клеток, предпочтительным является, например, и коллаген, имеющий большую величину межмолекулярной поперечной сшивки. В качестве такого коллагена может рассматриваться коллаген, полученный из сухожилий.
Хотя концентрация коллагена у рассмотренного выше коллагенового геля может находиться в любом диапазоне постольку, поскольку она может давать гель, имеющий прочность, дающую возможность для приживления и роста клеток пигментного эпителия сетчатки, и удовлетворяющий требованиям к растворимости, облегчающим деградацию с помощью коллагеназы, к вязкости, делающей возможными простые манипуляции, и тому подобное, она предпочтительно составляет 0,1% (масс/объем) - 0,5% (масс/объем), более предпочтительно, 0,2% (масс/объем) - 0,3% (масс/объем). Когда концентрация коллагена коллагенового геля меньше чем 0,1% (масс/объем), прочность коллагенового геля становится недостаточной, и по этой причине, скорость образования колоний и скорость пролиферации клеток для клеток пигментного эпителия сетчатки уменьшаются. Когда концентрация коллагена коллагенового геля превышает 0,5% (масс/объем), время обработки коллагеназой для деградации коллагенового геля становится продолжительным, что вызывает опасения относительно оказания отрицательного воздействия на клетки.
Хотя объем смешанного раствора коллагенового геля, используемого для получения рассмотренного выше коллагенового геля, изменяется в зависимости от площади культивирования и формы субстрата культуры, который должен использоваться для клеточной культуры, предпочтительно, он составляет примерно 100 мкл - примерно 250 мкл, более предпочтительно, примерно 150 мкл - примерно 200 мкл, на единицу площади (см2). Когда количество смешанного раствора коллагенового геля является слишком малым, формируется слой коллагенового геля, имеющий тонкую центральную часть, из-за влияния поверхностного натяжения, прикладываемого к поверхности геля, и имеется тенденция к повреждению пласта во время вырезания клеточного пласта, поскольку клетки непосредственно вступают в контакт с субстратом культуры, когда культивируются клетки пигментного эпителия сетчатки. Когда количество смешанного раствора коллагенового геля является избыточным, формируется толстый слой коллагенового геля на субстрате культуры, что значительно сокращает количество среды для культивирования, и по этой причине, осуществление поддержания культуры не является легким, обработка коллагеназой занимает время, и имеются опасения относительно появления повреждений на клеточном пласте.
На стадии (1), клеточный пласт может быть получен посредством высевания и культивирования рассмотренных выше клеток пигментного эпителия сетчатки на коллагеновом геле субстрата клеточной культуры. Субстрат клеточной культуры по настоящему изобретению не является как-либо ограниченным постольку, поскольку он предназначен для культивирования клеток. Его примеры включают контейнеры для культур, имеющие пористую мембрану, такие как трансвел, и тому подобное, колба, колба для культур тканей, чашка, чашка Петри, чашка для культур тканей, многоцелевая чашка, микропланшет, рамка для микролунок, многоцелевой планшет, многолуночный планшет, предметное стекло с лункой и покровным стеклом, чашка Петри, пробирка, поддон, культуральный мешок и вращающийся флакон. Контейнеры для культур, имеющие пористую мембрану, являются предпочтительными, поскольку удобно осуществлять обработку коллагеназой и операцию отрезания клеточного пласта. Например, предпочтительно используют коммерчески доступный трансвел. Примеры материала субстрата клеточной культуры в настоящем описании включают, но, не ограничиваясь этим, неорганические материалы, такие как металл, стекло, керамика, силикон, и тому подобное, органические материалы, представленные эластомером, пластиком (например, полиэфирной смолой, полиэтиленовой смолой, полипропиленовой смолой, ABS смолой, нейлоном, акриловой смолой, фторкаучуком, поликарбонатной смолой, полиуретановой смолой, метилпентеновой смолой, фенольной смолой, меламиновой смолой, эпоксидной смолой, винилхлоридной смолой).
Количество клеток пигментного эпителия сетчатки, которые должны высеваться, может находиться в любом диапазоне постольку, поскольку оно соответствует плотности клеток, которые могут образовывать клеточный пласт. Однако когда плотность клеток является слишком низкой, форма клеток является плохой, время культивирования до достижения конфлюэнтности является продолжительным, и кроме того, время, необходимое для созревания и окрашивания клеток, является продолжительным. Когда плотность клеток является слишком высокой, подобным же образом, подавляется пролиферация клеток, время культивирования до достижения конфлюэнтности имеет тенденцию к увеличению и клетки могут погибать от перенаселенности. По этой причине, плотность клеток, которые должны высеваться, предпочтительно составляет примерно 4,5×104 клеток/см2 - примерно 8,5×105 клеток/см2, более предпочтительно, примерно 8,5×104 клеток/см2 - примерно 8,5×105 клеток/см2, наиболее предпочтительно, примерно 4,5×105 клеток/см2.
Однослойная популяция клеток (клеточный пласт), состоящий из клеток пигментного эпителия сетчатки, может формироваться посредством культивирования клеток пигментного эпителия сетчатки, высеваемых на коллагеновом геле, в среде для культивирования. Среда для культивирования может использоваться без какого-либо ограничения постольку, поскольку это среда для культивирования клеток, используемая, как правило, в данной области. Например, можно использовать базальные среды, описанные в “Japan tissue culture conference ed., Technique of Tissue Culture 3rd edition” page 581, опубликованной Asakura Shoten, такая как среда F-10, среда F12, MEM, среда BME, DMEM, αMEM, среда IMD, среда ES, среда DM-160, среда Фишера, среда WE, среда RPMI1640, и тому подобное. Кроме того, к базальной среде может добавляться сыворотка (фетальная сыворотка теленка и тому подобное), различные факторы роста (EGF, FGF, HGF, PDGF и тому подобное), антибиотик, аминокислота, и тому подобное. pH среды предпочтительно составляет примерно 6 - примерно 8. Относительно культуры, например, первичное культивирование осуществляют, как правило, примерно при 30 - примерно 40°C в течение примерно 15 - примерно 60 час, пока клетки пигментного эпителия сетчатки не станут конфлюэнтными. После этого осуществляют вторичное культивирование в течение примерно 1 недели - примерно 2 месяцев, заменяя при этом среду, после чего культивирование осуществляют, в то же время, аэрируя и перемешивая по необходимости, до образования клеточного пласта. Клетки, составляющие клеточный пласт, полученные с помощью такого культивирования, поддерживаются как клетки пигментного эпителия сетчатки. Поддерживание клеток в качестве клеток пигментного эпителия сетчатки может подтверждаться посредством детектирования BEST1, RPE65, MERTK, CRALBP или чего-либо подобного в качестве специфичного маркера дифференциации.
Поскольку клеточный пласт, сформированный на стадии (1), прилипает к коллагеновому гелю, например, когда его непосредственно используют для трансплантации, и тому подобное, имеется опасение, что коллагеновый гель будет мешать приживлению трансплантата у реципиента. Если коллагеновый гель может удаляться заранее, это является благоприятным для решения такой проблемы. На стадии (2) настоящего изобретения, коллагеновый гель, прилипший к клеточному пласту, сформированному на стадии (1), деградирует под действием коллагеназы. Специалисты в данной области могут выбрать соответствующую коллагеназу в соответствии с видом коллагена, используемого для получения коллагенового геля. Хотя коллагеназа, которая должна использоваться для деградации коллагенового геля, не является конкретно ограниченной постольку, поскольку она имеет активность переваривания коллагенового геля, предпочтительной является коллагеназа, которая не деградирует легко коллаген, составляющий базальную мембрану человека (например, коллаген Типа IV, и тому подобное). Например, можно использовать коллагеназу, полученную от микроорганизма, происходящего из Clostridium (Clostridium histolyticum) или Streptomyces (Streptomyces parvulus), которые являются доступными на коммерческом уровне, безопасны и имеют высокую ферментативную активность.
В качестве активности рассмотренной выше коллагеназы, важна удельная активность по отношению к массе коллагена в коллагеновом геле, а не активность на единицу массы коллагеназы и активность на единицу объема водного раствора коллагеназы. Удельная активность коллагеназы, которая должна использоваться для растворения коллагенового геля (активность коллагеназы/масса коллагена), предпочтительно не меньше чем 0,1 Ед./мг. Когда удельная активность коллагеназы меньше чем 0,1 Ед./мг, растворение коллагенового геля может быть нежелательно продолжительным или же гель может растворяться нежелательно недостаточно. Более предпочтительно, она находится в пределах 0,1-10000 Ед./мг, более предпочтительно, 1-3000 Ед./мг.
В способе получения клеточного пласта по настоящему изобретению, способ действия коллагеназы на коллагеновый гель не является конкретно ограниченным. Раствор коллагеназы, полученный с использованием, в качестве растворителя, среды или изотонического раствора, имеющего буферную емкость, может добавляться в среду, или же соединенный с клетками коллагеновый гель, отсоединенный от чашки для культивирования клеток, может быть погружен в рассмотренный выше раствор коллагеназы. Поскольку в настоящем изобретении используют трансвел в качестве субстрата культуры клеток, слой коллагенового геля может экспонироваться посредством извлечения вставки и удаления мембраны на дне вставки, и экспонируемый коллагеновый гель предпочтительно погружают непосредственно в рассмотренный выше раствор коллагеназы.
В способе получения клеточного пласта по настоящему изобретению, время растворения коллагенового геля с помощью коллагеназы не является конкретно ограниченным. Когда время действия коллагеназы является слишком большим, функции клеток, такие как способность к адгезии, способность к пролиферации, и тому подобное, могут деградироваться нежелательным образом. Хотя время растворения посредством коллагеназы может изменяться под действием изменения удельной активности коллагеназы, температуры, формы коллагенового геля, способа обработки коллагеназой, и тому подобное, как правило, оно составляет 15 мин - 60 мин. Обработка коллагеназой может представлять собой одну обработку или осуществляться множество раз.
Температура во время обработки коллагенового геля с помощью коллагеназы в способе получения клеточного пласта по настоящему изобретению предпочтительно устанавливается в пределах 10-42°C, более предпочтительно, 30-40°C, еще более предпочтительно, 36-38°C, поскольку текучесть цитоплазмы клетки, как правило, уменьшается и способность к метаболизму уменьшается, когда температура внутри живых организмов становится не выше чем 10°C (примерно 30°C у людей), белок денатурирует и функционирование клеток ухудшается, когда температура превышает 42°C, и оптимальная температура коллагеназы составляет в основном 37°C, а температура ниже этого уровня продлевает время растворения.
В способе получения клеточного пласта по настоящему изобретению, когда происходит растворение коллагенового геля, клеточный пласт постепенно отсоединяется от геля и, наконец, освобождается в растворе коллагеназы. Для извлечения клеточного пласта, клеточный пласт может механически отсоединяться от остального геля или может извлекаться после полного растворения геля. Хотя механическое отсоединение сокращает время до извлечения клеточного пласта, поскольку клеточный пласт может быть поврежден, его предпочтительно извлекают после полного растворения геля.
Хотя клеточный пласт, извлеченный, как рассмотрено выше, может непосредственно использоваться для различных применений, поскольку оставшаяся коллагеназа может ингибировать адгезивность между клеточными пластами или адгезивность по отношению к тканям, его предпочтительно промывают средой или изотоническим раствором, имеющим буферную емкость. Температура во время промывки может определяться в соответствии с видом обработки для растворения коллагенового геля с помощью коллагеназы. Для достаточного удаления оставшейся коллагеназы, пласт предпочтительно промывают один или несколько раз средой или изотоническим раствором, имеющим буферную емкость.
В клеточном пласте, полученном с помощью способа по настоящему изобретению, секретируется цитокин, специфичный для клеток пигментного эпителия сетчатки, с полярностью сходной с полярностью в живых организмах, и трансэпителиальное электрическое сопротивление (TER), которое должно быть показателем прочной адгезионной связи между клетками, повышается, как в живых организмах. По этой причине, он имеет барьерную функцию клеточного слоя, сходную с функцией в живых организмах. В соответствии со способом по настоящему изобретению, может быть получен клеточный пласт, имеющий функции, сходные с функциями в живых организмах.
В клеточном пласте, полученном с помощью способа по настоящему изобретению, образуется плотное соединение между клетками пигментного эпителия сетчатки и формируется базальная мембрана на стороне контакта с коллагеновым гелем. В настоящем описании, “базальная мембрана” представляет собой мембрану, сформированную из компонентов, продуцируемых клетками пигментного эпителия сетчатки, и означает мембрану, содержащую, по меньшей мере, часть компонентов базальной мембраны (ниже должна упоминаться как “базальная мембрана клеток пигментного эпителия сетчатки”). Базальная мембрана клеток пигментного эпителия сетчатки в живых организмах присутствует как тонкая пленка между слоем клеток пигментного эпителия сетчатки и внутренним слоем коллагена, составляющим оболочку Бруха, и представляет собой внеклеточный матрикс, имеющий коллаген Типа IV, ламинин, гепаран сульфат протеогликан (перлекан), нидоген, и тому подобное, в качестве репрезентативных компонентов. Оболочка Бруха представляет собой тонкую пленку между слоем клеток пигментного эпителия сетчатки и сосудистой оболочкой глаза и имеет 5-слойную структуру базальной мембраны клеток пигментного эпителия сетчатки, внутренний слой коллагена, слой эластина, наружный слой коллагена и базальную мембрану капиллярного слоя сосудистой оболочки глаза. Клеточный пласт по настоящему изобретению содержит часть (базальную мембрану клеток пигментного эпителия сетчатки) структуры оболочки Бруха. Образование плотного соединения может быть подтверждено посредством наблюдения формы плотно слипшихся клеток гексагональной формы и экспрессирования окклюдина, ZO-1, и тому подобное, между клетками с помощью иммунного окрашивания. Образование базальной мембраны может быть подтверждено посредством наблюдения экспрессирования маркеров базальной мембраны, таких как ламинин, гепаран сульфат протеогликан (перлекан), нидоген или коллаген Типа IV, и тому подобное, на поверхности клеток с помощью иммунного окрашивания или наблюдения с помощью сканирующего электронного микроскопа.
Как правило, клетки пигментного эпителия сетчатки, культивируемые в чашке для культивирования, продуцируют компоненты базальной мембраны, но является исключительно сложным отсоединение клеток в форме пригодного для использования клеточного пласта из клеток пигментного эпителия сетчатки, отсоединенного от чашки для культивирования (Invest. Ophthalmol. Vis. Sci., 36(2), 1995, 381-390). В соответствии со способом по настоящему изобретению, клетки пигментного эпителия сетчатки вместе с базальной мембраной, полученной из клеток пигментного эпителия сетчатки, могут извлекаться как пласт без использования искусственной мембраны. Поскольку клетки пигментного эпителия сетчатки образуют однослойную структуру, когда ими манипулируют по отдельности, структура пласта ра