Trail r2-специфические мультимерные скаффолды
Иллюстрации
Показать всеНастоящая группа объектов изобретения относится к области биотехнологии. Предложен рекомбинантный мультимерный скаффолд на основе 3 домена FnIII тенасцина (Tn3), который специфически связывается с рецептором 2 TRAIL (TRAIL R2). Кроме того, рассмотрена выделенная молекула нуклеиновой кислоты, кодирующая мультимерный скаффолд; вектор экспрессии; клетка-хозяин и способ получения рекомбинантного мультимерного скаффолда. Также описаны: фармацевтическая композиция; способ профилактики, лечения или снижения симптомов рака; способ индуцирования апоптоза в клетке и способ изменения активности TRAIL R2-экспрессирующей клетки. Мультимерный скаффолд по настоящему изобретению обладает повышенной аффинностью относительно TRAIL R2, повышенной стабильностью и пониженной иммуногенностью. В этой связи настоящее изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, связанных с TRAIL R2. 9 н. и 23 з.п. ф-лы, 25 табл., 28 ил., 22 пр.
Реферат
Ссылка на список последовательностей
[0001] Данная заявка включает посредством ссылки список последовательностей, предоставляемый вместе с данной заявкой с помощью EFS-Web в виде текстового файла под названием «2943.011PC02_sequence_listing.txt», созданного 12 апреля 2011 г. и имеющего размер 211 кБайт.
Область техники
[0002] Данное изобретение в целом относится к области миметиков антитела, в частности, мультимерные скаффолд-белки, основанные на домене фибронектина типа III (Fn3) и используемые, например, для получения продуктов с новейшими характеристиками связывания. В частности, изобретение описывает TRAIL R2-специфические мультимерные скаффолды, полученные из третьего домена FnIII Тенасцина С человека, а также их использование для определения рецептора TRAIL R2 и модуляции TRAIL R2-опосредованной функции, такой как лечение рака и других нарушений.
Известный уровень техники
[0003] Биомолекулы, способные специфически связываться с требуемой мишенью - антигенной детерминантой, играют важную роль в качестве лекарственных препаратов, инструментов для исследования и медицинской диагностики. Хорошо известным примером данного класса биомолекул является антитело. Могут быть выбраны антитела, которые связываются специфическим образом с аффинностью по существу к любой структурной антигенной детерминанте. Однако классические антитела представлены структурными сложными гетеротетрамерными молекулами, которые сложно экспрессировать в простых эукариотических системах. В результате этого большинство антител получают с использованием сложной и дорогостоящей системы экспрессии клеток млекопитающих.
[0004] Белки, имеющие относительно определенные трехмерные структуры, обычно называют скаффолд-белками, которые могут использоваться в качестве реагентов для конструирования продуктов рекомбинации. Одной из специфических областей применения, в которой используют такие белки-скаффолды, является разработка миметиков антитела. Миметики антитела, т.е. небольшие, не являющиеся антителом белковые лекарственные вещества, используют преимущества антител и фрагментов антитела, такие как высокая аффинность связывания с мишенями и низкая иммуногенность и токсичность, что позволяет избежать некоторых недостатков, таких как тенденция фрагментов антитела образовывать агрегаты и быть менее стабильными в сравнении с IgG полной длины.
[0005] Такие недостатки могут быть объяснены использованием фрагментов антител, созданных путем удаления частей антител нативной конформации. Однако воздействие растворителем на аминокислотные остатки, которые в обычном случае погружены в гидрофобную среду, такую как поверхность взаимодействия между вариабельным и константным доменом, часто приводит к агрегации. Одним из примеров миметика антитела на основе скаффолда является миметик антитела, основанный на структуре модуля фибронектина типа III (FnIII), домена, который широко представлен среди белков таких типов и классов, как белки крови млекопитающих и структурные белки.
[0006] TRAIL (ФНО-зависимый апоптоз-индуцирующий лиганд, также указываемый в литературе как Apo2L и TNFSF10) принадлежит к суперсемейству факторов некроза опухолей (ФНО) и был идентифицирован как активатор программируемой смерти клеток, или апоптоза, в опухолевых клетках. Как связанная с мембраной, так и растворимая форма TRAIL способна запускать апоптоз посредством взаимодействия с рецепторами TRAIL, расположенными на клетках-мишенях. У людей было идентифицировано пять рецепторов, обладающих способность связываться с TRAIL. После связывания TRAIL с TRAIL R1 или TRAIL R2, запускается каспаза-обусловленная гибель клеток. Относительно такой апоптозной активности клеток, изучаются способы лечения, основанные на TRAIL. Было разработано несколько терапевтических подходов, основанных на TRAIL или TRAIL R1 или R2 агонистических антителах человека, однако TRAIL имеет очень короткое время жизни, и связывается с рецептором-приманкой, а большой размер антител может ограничить их проникновение в опухоль. В соответствии с этим существует необходимость в создании новых молекул, которые могут связываться с рецепторами TRAIL, фармацевтических композиций, включающих такие молекулы, способов скрининга таких молекул и способов использования таких молекул в терапевтическом лечении целого ряда видов рака.
[0007] Цитирование или обсуждение представленной ссылки не должно толковаться как разрешение к раскрытию информации в данной заявке.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
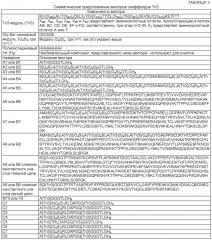
[0008] Изобретение описывает TRAIL R2-специфический рекомбинантный мультимерный скаффолд-белок, включающий два мономера-скаффолда Tn3, при этом (а) каждый мономер-скаффолд Tn3 включает семь бета-цепей, обозначаемых А, В, С, D, Е, F и G, и шесть участков-петель, обозначаемых АВ, ВС, CD, DE, EF и FG, (б) мономеры-скаффолды Tn3 соединены тандемно, и (в) рекомбинантный мультимерный скаффолд специфически связывается с TRAIL R2. В некоторых вариантах воплощения изобретения TRAIL R2-специфический рекомбинантный мультимерный скаффолд-белок включает 3, 4, 5, 6, 7 или 8 мономеров-скаффолдов. В некоторых других вариантах воплощения изобретения все мономеры-скаффолды Tn3 в TRAIL R2-специфическом мультимерном скаффолд-белке по изобретению представлены в тандеме.
[0009] В некоторых вариантах воплощения изобретения, по меньшей мере, один мономер-скаффолд Tn3 TRAIL R2-специфического мультимерного скаффолд-белка присоединен непосредственным образом, посредством линкера или гетерологичной молекулы к 1, 2, 3, 4, 5, 6 или 7 другим мономерам-скаффолдам Tn3. В определенных вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка присоединены непосредственным образом без линкера, расположенного между мономерами-скаффолдами Tn3. В некоторых вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка присоединены посредством линкера. В некоторых вариантах воплощения изобретения линкер включает пептидный линкер. В некоторых вариантах воплощения изобретения пептидный линкер представлен гибким пептидным линкером. В некоторых вариантах воплощения изобретения пептидный линкер включает последовательность (GxS)y, при этом x и y являются целыми числами, x=1, 2, 3 или 4, и y=1, 2, 3, 4, 5, 6 или 7.
[0010] В некоторых вариантах воплощения изобретения связывание TRAIL R2-специфического мультимерного скаффолд-белка по изобретению с TRAIL R2 улучшено в сравнении с TRAIL R2-специфическим мономером-скаффолдом Tn3. В некоторых вариантах воплощения изобретения связывание TRAIL R2-специфического мультимерного скаффолд-белка с TRAIL R2 улучшает действие мишени в сравнении с TRAIL R2-специфическим мономером-скаффолдом Tn3.
[0011] В некоторых вариантах воплощения изобретения улучшенное связывание TRAIL R2-специфического скаффолд-белка по изобретению с TRAIL R2 в сравнении с TRAIL R2-специфическим мономером-скаффолдом Tn3 представлено улучшением аффинности связывания и/или улучшением в авидности связывания. В других вариантах воплощения изобретения аффинность связывания TRAIL R2 и стабильность белка улучшены в сравнении с TRAIL R2-специфическим мономером-скаффолдом Tn3. В некоторых вариантах воплощения изобретения авидность связывания TRAIL R2 и стабильность белка улучшены в сравнении с TRAIL R2-специфическим мономером-скаффолдом Tn3.
[0012] В некоторых вариантах воплощения изобретения TRAIL R2-специфический мультимерный белок-скаффолд включает линкер, состоящий из функциональной молекулы. В некоторых вариантах воплощения изобретения функциональная молекула представлена иммуноглобулином или его фрагментом. В определенных вариантах воплощения изобретения иммуноглобулин или его фрагмент выбирают из группы, состоящей из: фрагмента Fab, фрагмента Fab’, фрагмента Fd, фрагмента Fd’, фрагмента Fv, фрагмента dAb, фрагмента F(ab’)2, scFv, диатела, линейного антитела, антитела полной длины, участка Fc и комбинации из двух или более указанных молекул. В определенных вариантах воплощения изобретения иммуноглобулин или его фрагмент включает домен Fc и шарнирный участок IgG. В других вариантах воплощения изобретения иммуноглобулин или его фрагмент включает домен СН1. В некоторых вариантах воплощения изобретения иммуноглобулин или его фрагмент включает домен Ckappa или домен Clambda IgG.
[0013] В некоторых вариантах воплощения изобретения, по меньшей мере, один мономер-скаффолд Tn3 TRAIL R2-специфического мультимерного скаффолд-белка соединен с гетерологичной молекулой. В некоторых вариантах воплощения изобретения, гетерологичная молекула включает композицию, выбираемую и группы, состоящей из: белка, пептида, белкового домена, линкера, лекарства, токсина, цитотоксического агента, агента для визуализации, радионуклида, радиоактивного соединения, органического полимера, неорганического полимера, полиэтиленгликоля (ПЭГ), биотина, человеческого сывороточного альбумина (ЧСА), связующего участка FcRn ЧСА, антитела, домена антитела, фрагмента антитела, одноцепочечного антитела, домена антитела, альбумин-связующего домена, фермента, лиганда, рецептора, связующего пептида, скаффолда, не принадлежащего FnIII, тэга антигенной детерминанты, рекомбинантного полипетпидного полимера, цитокина и комбинации из двух или более указанных молекул.
[0014] В некоторых специфических вариантах воплощения изобретения TRAIL R2-специфический мультимерный скаффолд-белок конъюгирован с ПЭГ. В других вариантах воплощения изобретения более двух мономеров-скаффолдов Tn3 присоединены линкерами, при этом, по меньшей мере, один линкер структурно и/или функционально отличается от других линкеров.
[0015] В некоторых вариантах воплощения изобретения мономеры-скаффолды Tn3 в TRAIL R2-специфическом мультимерном скаффолде присоединены в разветвленном виде. В других вариантах воплощения изобретения некоторые мономеры-скаффолды Tn3 в TRAIL R2-специфическом мультимерном скаффолде по изобретению присоединены линейным тандемным образом и некоторые мономерные скаффолды Tn3 присоединены в разветвленном виде. В некоторых вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка идентичны. В других вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка разные.
[0016] В некоторых вариантах воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению связывается, по меньшей мере, с дополнительной мишенью, которая может быть представлена Т-клеточным антигеном. В некоторых вариантах воплощения изобретения такой Т-клеточный антиген представлен CD40L.
[0017] В некоторых вариантах воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению представлен агонистом рецептора. В некоторых вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка по изобретению связываются с одной и той же самой антигенной детерминантой на TRAIL R2. В других вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка по изобретению связываются с разными антигенными детерминантами на TRAIL R2. В некоторых вариантах воплощения изобретения разные антигенные детерминанты TRAIL R2 представлены неперекрывающимися антигенными детерминантами. В других вариантах воплощения изобретения разные антигенные детерминанты TRAIL R2 представлены перекрывающимися антигенными детерминантами.
[0018] В некоторых вариантах воплощения изобретения бета-цепи, по меньшей мере, двух мономеров-скаффолдов Tn3 в TRAIL R2-специфическом мультимерном скаффолде по изобретению имеют последовательность, идентичную, по меньшей мере, на 90% последовательности бета-цепей SEQ ID NO: 1. В некоторых вариантах воплощения изобретения, по меньшей мере, два мономера-скаффолда Tn3 TRAIL R2-специфического мультимерного скаффолд-белка по изобретению включают следующую аминокислотную последовательность:
IEV(XAB)nALITW(XBC)nCELX1YGI(XCD)nTTIX2L(XDE)nYSI(XEF)nYEVSLIC(XFG)nKX3TFTT
при этом XAB, XBC, XCD, XDE, XEF и XFG представляют аминокислотные остатки, присутствующие в петлях АВ, ВС, CD, DE, EF и FG, соответственно, при этом X1 представляет аминокислотный остаток А или Т, при этом X2 представляет аминокислотный остаток D или G, при этом Х3 представляет аминокислоту Е или G, и при этом длина петли n представлена целым числом между 2 и 26. В некоторых вариантах воплощения изобретения петля АВ включает последовательность SEQ ID NO: 35, петля CD включает последовательность SEQ ID NO: 37, и петля EF включает последовательность SEQ ID NO: 39. В некоторых вариантах воплощения изобретения петля ВС включает последовательность, выбираемую из группы, включающей SEQ ID NO: 97, 98 или 168. В некоторых вариантах воплощения изобретения петля DE включает последовательность, выбираемую из группы, включающей SEQ ID NO; 102, 103 и 179. В некоторых вариантах воплощения изобретения петля FG включает последовательность, выбираемую из группы, включающей SEQ ID NO: 106, 108, 109, 169 и 170. В некоторых вариантах воплощения изобретения петля ВС включает последовательность SEQ ID NO: 97, петля DE включает последовательность SEQ ID NO: 179, и петля FG включает последовательность SEQ ID NO: 170. В некоторых вариантах воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению включает последовательность SEQ ID NO: 209 или 204.
[0019] В некоторых вариантах воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению связывается с рецептором TRAIL R2 с аффинностью (Kd) 1 мкМ или менее. В другом варианте воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению связывается с рецептором TRAIL R2 с аффинностью (Kd) 500 нМ или менее. В еще одном варианте воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению связывается с рецептором TRAIL R2 с аффинностью (Kd) 100 нМ или менее.
[0020] Изобретение также описывает выделенную молекулу нуклеиновой кислоты, кодирующей любые описанные выше мультимерные скаффолды. В некоторых вариантах воплощения изобретения вектор экспрессии включает нуклеиновую кислоту. В других вариантах воплощения изобретения клетка-хозяин может включать вектор.
[0021] Изобретение также описывает способ получения TRAIL R2-специфического мультимерного скаффолда по изобретению, включающий культивирование клетки-хозяина в условиях, при которых экспрессируется мультимерный скаффолд, кодируемый молекулой нуклеиновой кислоты. Изобретение также описывает композицию, включающую рекомбинантный TRAIL R2-специфический мультимерный скаффолд по изобретению в фармацевтически приемлемом вспомогательном веществе. Изобретение также описывает способ предотвращения, лечения, уменьшения степени тяжести или ведения рака у нуждающегося в этом пациента путем введения эффективного количества композиции, включающей TRAIL R2-специфический мультимерный скаффолд по изобретению. В некоторых вариантах воплощения изобретения рак выбирают из рака легкого, неходжкинской лимфомы, рака яичника, рака толстого кишечника, колоректального рака, рака поджелудочной железы и множественной миеломы.
[0022] Изобретение также описывает способ диагностики или визуализации заболевания у пациента с использованием композиции, включающей TRAIL R2-специфический мультимерный скаффолд по изобретению. Также описан способ индуцирования апоптоза в клетке, экспрессирующей TRAIL R2, и такой способ включает контакт клетки с TRAIL R2-специфическим мультимерным скаффолдом по изобретению. В некоторых вариантах воплощения изобретения способ предотвращения, лечения, уменьшения степени тяжести или ведения рака у нуждающегося в этом пациента дополнительно включает вспомогательную терапию, при этом указанная терапия представлена иммунотерапией, терапией биопрепаратами, химиотерапией, лучевой терапией или терапией низкомолекулярными препаратами.
[0023] В некоторых вариантах воплощения изобретения TRAIL R2-специцический мультимерный скаффолд специфически связывается с TRAIL R2 человека. В некоторых специфических вариантах воплощения изобретения TRAIL R2-специфический мультимерный скаффолд по изобретению связывается с TRAIL R2 и (а) оказывает агонистическое действие на рецептор TRAIL R2, (б) имитирует связывание TRAIL с рецептором TRAIL R2, (в) облегчает димеризацию или олигомеризацию рецептора TRAIL R2, (г) индуцирует апоптоз, (д) снижает или ингибирует жизнеспособность клеток, или (е) имеет комбинацию действия (а), (б), (в), (г) и (д).
[0024] В других вариантах воплощения изобретения описан способ изменения активности клетки, экспрессирующей TRAIL R2, включающий контакт клетки с TRAIL R2-специфическим мультимерным скаффолдом по любому из пп.1-47 формулы изобретения, при этом мультимерный скаффолд связывается с TRAIL R2 и (а) оказывает агонистическое действие на рецептор TRAIL R2, (б) имитирует связывание TRAIL с рецептором TRAIL R2, (в) облегчает димеризацию или олигомеризацию рецептора TRAIL R2, (г) индуцирует апоптоз, (д) снижает или ингибирует жизнеспособность клеток, или (е) имеет комбинацию действия (а), (б), (в), (г) и (д).
[0025] В некоторых специфических вариантах воплощения изобретения ПЭГ конъюгирован с TRAIL R2-специфическим мультимерным скаффолдом по изобретению на N-конце или С-конце.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0026] В целях иллюстрации изобретения, определенные варианты воплощения изобретения представлены в виде графических материалов. Однако изобретение не ограничено конкретными механизмами и способами для вариантов воплощения изобретения, указанными в графических материалах.
[0027] ФИГ.1 отображает линейный, антителоподобный формат и формат в виде слияния мультивалентных скаффолдов Tn3. Мультивалентные скаффолды Tn3 содержат два или более модулей Tn3, присоединенных спейсером (указано черным восьмиугольником), при этом спейсер может быть представлен, например, линкером.
[0028] ФИГ.2 отображает TRAIL R2-специфические мультивалентные скаффолды Tn3, обозначаемые от А2 до А9, при этом такие скаффолды были получены в соответствии с тремя различными молекулярными форматами, указанными на ФИГ.1 с валентностью (номер модулей Tn3), варьирующими от 2 до 8.
[0029] ФИГ.3 отображает анализ электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия в невосстанавливающихся условиях (SDS-PAGE) сырой бактериальной среды (гель с правой стороны) и очищенных образцов с надлежащей аффинностью (гель слева) в соответствии с линейными тандемными векторами, обозначаемыми А1-А5, при этом их валентность варьирует от 1 до 8 и они экспрессируются E.coli.
[0030] ФИГ.4 отображает конкурентный ИФА, измеряющий связывание одновалентных (А1) и поливалентных (А2, A3) скаффолдов Tn3 с TRAIL R2.
[0031] ФИГ.5 отображает гистограмму анализа проточной цитометрии TRAIL R2-специфического поливалентного скаффолда А9, связывающегося с клетками Н2122, в сравнении с когнатным контрольным скаффолдом (В9), который не связывается с TRAIL R2.
[0032] ФИГ.6А отображает влияние валентности на специфическую гибель клеток линии Н2122, экспрессирующих TRAIL R2, под действием поливалентных скаффолдов.
[0033] ФИГ.6В отображает специфичность гибели опухолевых клеток Н2122 под действием TRAIL R2-специфических поливалентных скаффолдов.
[0034] ФИГ.7А отображает влияние молекулярной формы на гибель клеток Н2122 под действием TRAIL R2-специфических поливалентных скаффолдов, включающих 4 модуля Tn3.
[0035] ФИГ.7В отображает влияние молекулярной формы на гибель клеток Н2122 под действием TRAIL R2-специфических поливалентных скаффолдов, включающих 8 модулей Tn3.
[0036] ФИГ.8А отображает специфическую гибель клеток линии колоректальной аденокарциномы Colo205, экспрессирующих TRAIL R2, под действием линейно слитых тетра-(АЗ) и восьмивалентных (А5) TRAIL R2-специфических скаффолдов Tn3.
[0037] ФИГ.8В отображает специфическую гибель лейкемических клеток линии Jurkat, экспрессирующих TRAIL R2, под действием линейно слитых тетра-(АЗ) и восьмивалентных (А5) TRAIL R2-специфических скаффолдов Tn3.
[0038] ФИГ.9А отображает схему мышиных CD40L-специфических тандемных двухвалентных скаффолдов Tn3 (векторы М13).
[0039] ФИГ.9В представляет анализ SDS-PAGE очищенного одновалентного вектора М13 (CD40L-специфический вектор Tn3) или тандемных двухвалентных скаффолдов с линкерами, содержащими 1, 3, 5 или 7 единиц Гли4Сер (обозначается как GS), соединяющих два модуля М13. Одновалентный вектор М13 был проанализирован и указан в полосе 2, вектор С1 в полосах 3 и 7, вектор С2 в полосах 4 и 8, вектор С3 в полосах 5 и 9, и вектор С4 в полосах 6 и 10. Образцы были проанализированы в невосстанавливающихся (полосы 2-6) или восстанавливающихся условиях (полосы 7-10).
[0040] ФИГ.9С отображает конкурентное ингибирование связывания MuCD40L с рецептором CD40 мыши, иммобилизированном на биосенсорном чипе с использованием MuCD40L-специфических одновалентных (М13) или двухвалентных тандемных скаффолдов. Указана половина максимальной ингибирующей концентрации (ИК50) для разных векторов.
[0041] ФИГ.9D отображает ингибирующее воздействие MuCD40L-специфического одновалентного (М13) Tn3, двухвалентных тандемных скаффолдов или антитела MR1 (антитело к MuCD40L) на В-клетки, экспрессирующие MuCD40L, под воздействием CD86.
[0042] ФИГ.10 отображает уровни экспрессии растворимых одновалентных и TRAIL R2/CD40L-биспецифических тандемных двухвалентных векторов скаффолдов Tn3, которые были рекомбинантным образом экспрессированы в Е.coli; анализ проведен с использованием SDS-PAGE в бактериальной питательной среде. Одновалентные скаффолды А1 и 79 представлены на полосах 2 и 3, соответственно. Векторы тандемных скаффолдов, включающие А1 и 79, соединены в тандеме аминокислотным линкером Гли4Сер с увеличенной длиной (когнатный относительно векторов С5, С6, С7 и С8) и представлены в полосах 4-7. Экспрессируемые векторы указаны на окрашенном геле звездочкой.
[0043] ФИГ.11А отображает связывание биспецифических скаффолдов Tn3 с TRAIL R2, как это оценено с использованием ИФА с захватом.
[0044] ФИГ.11В отображает связывание биспецифических скаффолдов Tn3 с CD40L человека, как это оценено с использованием ИФА с захватом.
[0045] ФИГ.12 отображает одновременное связывание биспецифических тандемных скаффолдов Tn3 С5, С6, С7 и С8 с TRAIL R2 и CD40L, как это оценено с использованием анализа AlphaScreen™.
[0046] ФИГ.13 отображает стабильность скаффолдов Tn3 в присутствии гуанидин-HCl. Указано Cm (значение медиана) для каждого исследуемого скаффолда.
[0047] ФИГ.14 отображает термостабильность трех разных скаффолдов Tn3 с разными последовательностями петель, но петлей FG одинаковой длины (девять аминокислот) в сравнении с исходным скаффолдом Tn3 с более длинной петлей FG, как это проанализировано с использованием дифференциально сканирующей калориметрии (ДСК).
[0048] ФИГ.15 отображает повышение стабильности в присутствии гуанидин-HCl скаффолдов Tn3 с петлей FG с девятью аминокислотами (Р1С01, А6 и 71) в сравнении с исходным скаффолдом Tn3 (WT).
[0049] ФИГ.16А отображает схему и экспрессию триспецифического/трехвалентного скаффолда Tn3. Скаффолд D1-1E11-79 включает домен связывания Synagis* (D1), за которым следует TRAIL R2-Fc связующий домен (1Е11) и С-терминальный домен Tn3, специфический относительно CD40L (79) человека. Гибкий линкер (Гли4Сер)3 разделяет каждый домен.
[0050] ФИГ.16В отображает гель SDS-PAGE (4-12% Бис-Трис) экспрессированного и очищенного скаффолда D1-1E11-79. Ожидаемый молекулярный вес такого вектора составляет примерно 34081 Дальтон.
[0051] ФИГ.17А отображает одновременное связывание триспецифического/трехвалентного скаффолда Tn3 D1-1E11-79 с huCD40L и TRAIL R2-Fc с использованием анализа связывания AlphaScreen. Сигнал AlphaScreen (ASS) указан как функция концентрации TrailR2-Fc.
[0052] ФИГ.17В отображает одновременное связывание триспецифического/трехвалентного скаффолда Tn3 D1-1E11-79 с huCD40L и Synagis' с использованием анализа связывания AlphaScreen. Сигнал AlphaScreen (ASS) указан как функция концентрации Synagis.
[0053] ФИГ.18 отображает одновременное связывание триспецифического/трехвалентного скаффолда Tn3 D1-1E11-79 с TRAIL R2-Fc и Synagis® с использованием ИФА.
[0054] ФИГ.19 отображает выравнивание последовательностей исходного связующего клона TRAIL R2 1С12 и аффинность его зрелых производных. Положение рекомбинантной дисульфидной связи выделено, стрелкой указано расположение одной мутации в шарнирном участке, а изменения в петлях, которые возникают во время созревания аффинности, представлены в выделенных блоках А, В, С и D.
[0055] ФИГ.20 отображает анализ жизнеспособности клеток CellTiter-Glo клона 1С12 и его производных с созревшей аффинностью.
[0056] ФИГ.21 отображает концентрации тандемов G6 как функцию времени в мышиной сыворотке.
[0057] ФИГ.22А отображает выравнивание последовательностей в соответствии с рекомбинантным повышением цино-перекрестной реакционной способности для клона F4. Общей чертой для всех этих клонов является мутация двух аминокислот от D к G перед петлей DE.
[0058] ФИГ.22В отображает измерения ИФА ингибирования связывания планшетов с TRAIL R2-Fc человека или яванского макака с F4mod1 под действием мономера F4 или F4mod1.
[0059] ФИГ.23А отображает выравнивание последовательностей в соответствии с гуманизированием клона F4mod1, в частности сравнение F4, F4mod1 и F4mod12 с гуманизированным TN3.
[0060] ФИГ.23В отображает измерения ИФА ингибирования связывания планшетов с TRAIL R2-Fc человека или яванского макака с F4mod1 под действием мономера F4, F4mod1 или F4mod12.
[0061] ФИГ.23С отображает анализ гибели клеток Colo205, сравнивающий тандем G6 6 с тандемом 6 F4mod12.
[0062] ФИГ.23D отображает анализ гибели клеток Colo205, сравнивающий тандем G6 8 с тандемом 8 F4mod12.
[0063] ФИГ.24 отображает анализ гибели клеток НТ29, сравнивающий активность тандема 8 G6 с тандемом 8 F4mod12 в TRAIL-резистентной линии клеток НТ29.
[0064] ФИГ.25 отображает выравнивание последовательностей в соответствии с клонами, исследуемыми в ходе анализов иммуногенности Antitope EpiScreen. Подчеркнуты различия относительно клона F4mod12.
[0065] ФИГ.26А отображает следы SEC очищенного и не являющегося SEC тандема 8 G6.
[0066] ФИГ.26В отображает следы SEC очищенного SEC тандема 8 G6.
[0067] ФИГ.27 отображает изменения в объеме опухоли в моделях ксенотрансплантата колоректального рака Colo205 в ответ на разные дозы агонистов Tn3 TRAIL R2 тандема 6 G6 и тандема 8 G6.
[0068] ФИГ.28 отображает изменения в массе тела в моделях ксенотрансплантата колоректального рака Colo205 в ответ на разные дозы агонистов Tn3 TRAIL R2 тандема 6 G6 и тандема 8 G6.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0069] Перед подробным описанием данного изобретения, следует понимать, что данное изобретение не ограничивается специфическими композициями или этапами процесса, которые могут варьировать. Следует отметить, что, как это используется в данной заявке и прилагаемой формуле изобретения, формы единственного числа включают и формы множественного числа, если контекст четко не указывает иное. Термины единственного числа, а также термины «один или несколько» и «по меньшей мере, один» могут использоваться взаимозаменяемым образом.
[0070] Кроме того, слова «и/или» при использовании в тексте данной заявки должны рассматриваться в качестве специфического описания каждой из двух указанных особенностей или компонентов с или без другой особенности или композиции. Следовательно, термин «и/или» при использовании в такой фразе, как «А и/или В» обозначает включение «А и В», «А или В» «А» (только) и «В» (только). Подобным образом, термин «и/или» при использовании в такой фразе, как «А, В и/или С» обозначает включение каждого из следующих вариантов воплощения изобретения: А, В и С; А, В или С; А или С; А или В; В или С; А и С; А и В; В и С; А (только); В (только); и С (только).
[0071] Если иное не определено, все используемые здесь технические и научные термины имеют такое же самое значение, что и используемое обычно значение специалистом в области науки, к которой принадлежит изобретение. Например, The Concise Dictionary of Biomedicine and Molecular Biology, Juo, Pei-Show, 2nd ed., 2002, CRC Press; The Dictionary of Cell and Molecular Biology, 3rd ed., 1999, Academic Press; и The Oxford Dictionary Of Biochemistry And Molecular Biology, Revised, 2000, Oxford University Press содержат словарь с множеством терминов, используемых в данном изобретении в помощь специалисту.
[0072] Единицы, префиксы и символы указаны в формате, принятом в международной системе единиц (СИ). Числовые диапазоны включают числа, определяющие интервал. Если иное не указано, аминокислотные последовательности пишутся слева направо в направлении от амино- до карбоксильного конца. Представленные здесь названия не являются ограничивающими различные аспекты или варианты воплощения изобретения, однако они могут использоваться как справочные для данной заявки в целом. В соответствии с этим, представленные ниже термины более полно определены в соответствии со своей спецификацией в полном объеме.
[0073] Следует понимать, что при описании в тексте данной заявки вариантов воплощения изобретения с термином «включать», также подразумеваются и другие аналогичные варианты воплощения изобретения в понятиях «состоять из» и/или «состоять по существу из».
[0074] Аминокислоты указаны в тексте данной заявки в виде широко используемого трехбуквенного обозначения или в виде одной буквы, как это рекомендовано Комитетом по биохимической номенклатуре IUPAC-IUB. Подобным образом, нуклеотиды указаны в виде однобуквенных общепринятых кодов.
[0075] В контексте данного изобретения термин «антигенная детерминанта» обозначает белковую детерминанту, способную связываться со скаффолдом по изобретению. Антигенные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как боковые цепи аминокислот или Сахаров, и обычно обладают тремя специфическими пространственными структурными характеристиками, а также специфическими характеристиками заряда. Конформационные или неконформационные антигенные детерминанты отличаются тем, что в отличие от некоформационных, связывание конформационные детерминант отсутствует при наличии денатурирующих растворителей.
[0076] Термины «домен фибронектина III типа (FnIII)» и «домен FnIII» обозначают полипептиды, гомологичные домену фибронектина человека III типа, имеющему, по меньшей мере, 7 бета-цепей, которые распределены между бета-складчатыми слоями, при этом такие слои группируются вокруг друг друга с образованием кора белка, и дополнительно содержат подвергаемые действию растворителя петли, соединяющие бета-цепи друг с другом. Существует, по меньшей мере, три такие петли на каждом конце сендвича бета-складчатого слоя, при этом конец является границей белка перпендикулярно направлению бета-цепей. В определенных вариантах воплощения изобретения домен FnIII включает 7 бета-цепей, обозначаемых А, В, С, D, Е, F и G, присоединенных к шести петлевым участкам, обозначенным АВ, ВС, CD, DE, EF и FG, при этом петлевой участок присоединяется к каждой бета-цепи.
[0077] Термин «ДНК» обозначает последовательность двух или более ковалентно присоединенных, встречающихся в природе или модифицированных дезоксирибонуклеотидов.
[0078] Термин «белок слияния» обозначает белок, который включает (i) один или более скаффолдов по изобретению, присоединенных к (ii) второму, другому белку (т.е. «гетерологичному» белку).
[0079] Термин «гетерологичная молекула» в контексте данного изобретения обозначает добавление композиции к скаффолду по изобретению, при этом композиция не является естественном образом частью домена FnIII. Типичные гетерологичные молекулы включают белки, пептиды, домены белков, линкеры, препараты, токсины, агенты визуализации, радиоактивные соединения, органические и неорганические полимеры, а также любые другие композиции, которые могут обеспечить активность, не свойственную домену FnIII, включая, но не ограничиваясь этим, полиэтиленгликоль (ПЭГ), цитотоксический агент, радионуклид, агент визуализации, биотин, домен димеризации (например, домен лейциновой молнии), человеческий сывороточный альбумин (ЧСА) или связующий участок FcRn, домен или фрагмент антитела (например, вариабельный домен антитела, домен СН1, домен Ckappa, домен Clambda, домен СН2 или домен СН3), одноцепочечное антитело, доменное антитело, белоксвязующий домен, молекулу IgG, фермент, лиганд, рецептор, связующий пептид, FnIII, не являющийся скаффолдом, тег антигенной детерминанты, рекомбинантный полипептидный полимер, цитокин и т.п.
[0080] В контексте данного изобретения термин «линкер» обозначает любую молекулярную структуру, которая соединяет или объединяет два или более скаффолдов. Линкер может быть представлен молекулой, чья функция состоит в действии в качестве «спейсера» между модулями в скаффолде, или он также может быть представлен молекулой с дополнительной функцией (т.е. «функциональной молекулой»). Молекула, включенная в определение «гетерологичной молекулы», также может функционировать как линкер.
[0100] Термины «присоединенный» и «слитый» используют взаимозаменяемым образом. Эти термины относятся к соединению вместе двух или более скаффолдов, гетерологичных молекул или линкеров любыми способами, включая химическую конъюгацию или рекомбинацию.
[0101] Термины «мультимер», «мультимерный скаффолд» и «поливалентный скаффолд» обозначают молекулу, которая включает, по меньшей мере, два объединенных скаффолда FnIII. Скаффолды, образующие мультимерный скаффолд, могут быть присоединены посредством линкера, что обеспечивает независимое функционирование каждого скаффолда. Термины «мультимерный» и «поливалентный» в тексте данной заявки могут использоваться взаимозаменяемым образом. Поливалентный скаффолд может быть моноспецифическим или биспецифическим.
[0102] Термины «домен» или «белковый домен» обозначают участок белка, который может скручиваться в стабильную трехмерную структуру, часто независимо от остальной части белка, и который выполняет определенную функцию. Такая структура несет специфическую функцию, связанную с функцией домена в оригинальном белке, например, ферментативную активность, создание мотива распознавания для другой молекулы или обеспечение необходимыми структурными компонентами для белка для его существования в отдельной среде белков. В рамках семейства белков и суперсемейств родственных белков домены белков могут быть представлены эволюционно консервативными участками. При описании компонента мультимерного скаффолда термины «домен», «мономерный скаффолд» и «модуль» могут использоваться взаимозаменяемым образом. Термин «нативный домен FnIII» обозначает любой не рекомбинантный домен FnIII, который кодируется живым организмом.
[0103] Термины «белковая последовательность» или «аминокислотная последовательность» обозначают линейное представление аминокислотных составляющих в полипептиде в направлении от амино- к карбоксильному концу таким образом, что остатки, расположенные по соседству, являются смежными в первичной структуре полипептида.
[0104] Термин «нуклеиновая кислота» обозначает любые два или более ковалентно присоединенных нуклеотида или аналога нуклеотидов, или производных. В контексте данного изобретения этот термин включает, без ограничения, ДНК, РНК и ПНК. Термины «нуклеиновая кислота» и «полинуклеотид» используются в тексте данной заявки взаимозаменяемым образом.
[0105] Термин «полинуклеотид» охватывает отдельную нуклеиновую кислоту, а также множество нуклеиновых кислот, и обозначает выделенную молекулу нуклеиновой кислоты или вектор, например, матричную РНК (мРНК) или плазмидную ДНК (пДНК). Термин «выделенная» нуклеиновая кислота или полинуклеотид обозначает молекулу нуклеиновой кислоты, ДНК или РНК, которая была выделена из своей естественной среды. Например, рекомбинантный полинуклеотид, кодирующий, например, скаффолд по изобретению, содержащийся в векторе, считается выделенным в целях данного изобретения. Дополнительные примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичных клетках-хозяевах, или очищенные (частично или по существу) полинуклеотиды в растворе. Выделенные молекулы РНК включают in vivo или in vitro транскрипты РНК полинуклеотидов по данному изобретению. Выделенные полинуклеотиды или нуклеиновые кислоты по данному изобретению дополнительно включают молекулы, полученные в ходе синтеза. Кроме того, полинуклеотид или нуклеиновая кислота может быть представлена или может включать контролирующий элемент, такой как промотор, сайт связывания рибосом или терминатор транскрипции.
[0106] Термин «фармацевтически приемлемый» относится к соедине