Олигопептиды металлопротеиназы-9 и их терапевтическое применение
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к композиции для лечения заболевания и способам лечения заболевания, сопровождающегося повышенной экспрессией матриксной металлопротеиназы MMP-9. Для приготовления указанной композиции используют олигопептиды с SEQ ID NO:7, 11, 12, 18 или 19. Указанные олигопептиды связываются с антителами для создания иммунного ответа у субъекта млекопитающего против матриксной металлопротеиназы MMP-9. Настоящее изобретение позволяет повысить эффективность блокирования расщепления внеклеточного матрикса молекулами металлопротеиназы MMP-9 и, таким образом, повысить эффективность лечения онкологических и других заболеваний. 3 н. и 13 з.п. ф-лы, 14 ил., 8 табл.
Реферат
Перекрестные ссылки на родственную заявку
Настоящая заявка является выделенной заявкой и частичным продолжением находящейся на рассмотрении заявки США 13/549329, поданной 13 июля 2012, и испрашивает приоритет по ней. Описание настоящим включено посредством ссылки во всей полноте. Данная заявка содержит список последовательностей, представленный как ASCII файл с наименованием RIPLLC018003CIP2_ST25, дата создания 5 июля 2012, а размер текстового файла ASCII в байтах составляет 5 кб.
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к конструированию и синтезу новых олигопептидных последовательностей матриксной металлопротеиназы-9 (ММП-9) для применения в качестве терапевтических агентов для лечения заболеваний, связанных с внеклеточным матриксом. В частности, данное изобретение относится к применению олигопептида металлопротеиназы из различных источников в качестве вакцины, фармацевтической композиции, терапевтической дозы для лечения заболеваний, связанных с внеклеточным матриксом, в которых участвуют ММП.
Предшествующий уровень техники
Матриксные металлопротеиназы являются семейством цинк-зависимых нейтральных эндопептидаз, играющих важную роль в ангиогенезе опухолей, ремоделировании тканей, и миграции клеток. При раке уровни некоторых ММП аномально повышены, позволяя раковым клеткам разрушать внеклеточный матрикс (ЭЦМ), поражать базальную мембрану сосудов, и метастазировать в отдаленные участки. Различные патологические состояния связаны с повышенной активностью металлопротеиназ (ММП), в частности, ММП-9. Эти протеазы способны расщеплять коллаген и другие белки внеклеточного матрикса (ЭЦМ) в качестве предпосылки для распространения заболевания. Таким образом, имеется потребность в терапевтическом агенте для эффективного блокирования расщепления ЭЦМ этими ММП, таким образом, останавливающем распространение онкологических и других заболеваний.
Профилактика и лечение метастазов является главной проблемой в современной терапии рака. Доступные на сегодняшний день способы лечения являются токсичными, неспецифическими и непредсказуемыми для заболеваний, связанных с белками ЭЦМ. Имеется потребность в терапевтическом агенте для эффективного блокирования расщепления ЭЦМ молекулами ММП, таким образом, останавливающем распространение онкологических и других заболеваний. Изложение сущности изобретения
Настоящее изобретение раскрывает последовательность и композицию из ММП-9 олигопептида, и способ применения ММП-9 олигопептида в качестве вакцины, фармацевтической композиции, терапевтической дозы и диагностического средства для лечения ЭЦМ-зависимых заболеваний.
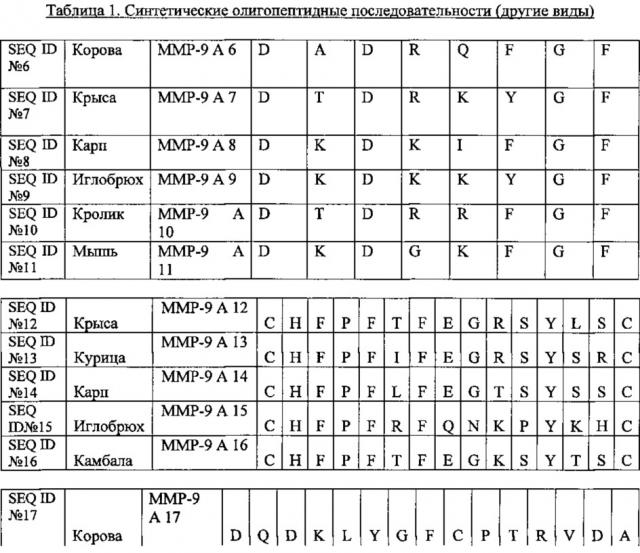
В одном варианте осуществления разработаны и синтезированы олигопептидные аналоги для ММП-9 последовательностей. В другом варианте осуществления эти олигопептиды тестировали на генерацию иммунного ответа у мыши с применением последовательностей ММП-9 мышей и крыс.
В одном варианте осуществления использовали следующие олигопептидные последовательности для получения вакцины. В другом варианте осуществления может быть получена лечебная доза для индивидуума, страдающего раком, включающая синтетические олигопептидные аналоги SEQ ID 7, 11, 12,18 и 19.
В одном варианте осуществления последовательность олигопептида может иметь мутации, делеции и замены, но не ограничивается ими. Эти последовательности в предложенном списке последовательностей соответствуют SEQ ID №№2-17 из перечня. SEQ ID №1 из текстового файла удалена, и не используется в настоящей заявке. Таким образом, SEQ ID №6 соответствует SEQ ID №1 из текстового файла, и так далее.
В одном варианте осуществления олигопептид ММП-9 можно применять в качестве вакцины, фармацевтической композиции, терапевтической дозы, и в качестве диагностического средства. В другом варианте осуществления все семнадцать олигопептидов могут быть объединены для получения вакцины.
Олигопептидные последовательности в одном варианте осуществления могут быть линейными или кольцевыми по конструкции. В другом варианте осуществления олигопептид может быть повторяющимися последовательностями.
В другом варианте осуществления олигопептид может содержать либо гаптены, либо полигликаны, присоединенные к нему для эффективной доставки.
В другом варианте осуществления описан способ иммунизации млекопитающего, такого как крыса и/или мышь, для стимулирования образования антител к конкретной ММП. В одном варианте осуществления описан выбор олигопептида, пригодного для стимулирования антигенности.
В одном варианте осуществления иммунизация млекопитающих может не ограничиваться лечением рака, но может также включать лечение всех заболеваний, связанных с деградацией ЭЦМ. В другом варианте осуществления вакцинацию можно проводить один раз или повторно, измеряя антитела, специфичные к вводимому олигопептиду. В одном варианте осуществления специфический вид может быть одним из млекопитающих и/или не млекопитающих.
В одном варианте осуществления композиция для олигопептида в качестве вакцины и лечебной дозы включает олигопептиды, содержащие SEQ ID №№7, 11, 12, 18 и 19 по отдельности или в комбинации.
В одном варианте осуществления терапевтически эффективное количество может быть обеспечено в виде инъекции, но не ограничивается ей. Другие варианты осуществления могут включать рецептуры для перорального, подкожного, местного, трансмукозального, ингаляционного, внутримышечного введения, направленной доставки и пролонгированного высвобождения. Лечебная доза может включать терапевтически эффективные или фармацевтически пригодные комбинации.
Композицию, способ и лечение, описанные в настоящей заявке, можно применять любым образом для достижения различных аспектов, и можно выполнять в любом виде, пригодном для млекопитающего. Другие характеристики станут понятными из сопроводительных чертежей и из следующего подробного описания.
Краткое описание чертежей
Примерные варианты осуществления приведены в качестве иллюстрации, и не ограничиваются теми, что изображены на фигурах на сопроводительных чертежах, на которых схожие ссылки указывают схожие элементы, и на которых:
Фиг. 1 иллюстрирует ММП из предшествующего уровня техники, расщепляющие ЭЦМ при патологическом состоянии.
Фиг. 2 показывает способ лечения млекопитающего с применением вакцины.
Фиг. 3 демонстрирует массу тела мышей-самцов C57BL/6, иммунизированных мышиными ММП-9 пептидами А11 и A19 перед трансплантацией клеток меланомы B16FO.
Фиг. 4 показывает влияние иммунизации мышиными ММП-9 пептидами А11 и A19 на ингибирование опухолевой нагрузки клетками ксенографта меланомы B16FO у мышей-самцов линии C57BL/6.
Фиг. 5 демонстрирует влияние иммунизации ММП-9 пептидами мыши А11 и А19 на ингибирование массы опухоли для ксенографта меланомы B16FO у мышей-самцов линии C57BL/6.
Фиг. 6 демонстрирует массу тела мышей-самцов C57BL/6, иммунизированных ММП-9 пептидами крысы А7, A12 и A18 до и после трансплантации клеток меланомы B16FO.
Фиг. 7 показывает влияние иммунизации ММП-9 пептидами мыши А7, А12 и A18 на ингибирование опухолевой нагрузки клетками ксенографта меланомы B16FO у мышей-самцов линии B16F0.
Фиг. 8 демонстрирует влияние иммунизации ММП-9 пептидами мыши А7, A12 и A18 на ингибирование массы опухоли для ксенографта меланомы B16FO у мышей-самцов линии B16F0.
Фиг. 9 демонстрирует фактические опухоли, индуцированные у контрольных животных после проведения лечения.
Фиг. 10 демонстрирует снижение размера опухоли мышей при лечении ММП-9 с пептидами SEQ ID №11.
Фиг. 11 демонстрирует снижение размера опухоли мышей при лечении ММП-9 с пептидами SEQ ID №19.
Фиг. 12 демонстрирует снижение размера опухоли крыс при лечении ММП-9 с пептидами SEQ ID №7.
Фиг. 13 демонстрирует снижение размера опухоли крыс при лечении ММП-9 с пептидами SEQ ID №12.
Фиг. 14 демонстрирует снижение размера опухоли крыс при лечении ММП-9 с пептидами SEQ ID №18.
Другие характеристики из представленных вариантов осуществления станут понятными из следующего подробного описания.
Подробное описание
Описаны некоторые последовательности и способы для иммунизации, лечения ЭКЦ-ММП зависимой патологии, и повышения иммунного ответа путем вакцинации. Хотя представленные варианты осуществления описаны со ссылкой на конкретные воплощения вариантов осуществления, очевидно, что различные модификации и изменения могут быть выполнены в этих вариантах осуществления, без отделения от более широкой сущности и объема различных вариантов осуществления.
Раковые клетки продуцируют высокие уровни матриксных металлопротеиназ (ММП), в частности, ММП-9. Эти ферменты способны расщеплять внеклеточный матрикс (ЭЦМ) соединительной ткани, окружающей раковые клетки. ММП связываются с ЭЦМ через специфические участки связывания. Блокирование этих участков связывания в ММП предотвращает связывание ММП с ЭЦМ. Ингибирование деструкции ЭЦМ предотвращает прогрессирование рака и приводит к снижению размера опухоли. В настоящем описании идентифицировано несколько потенциальных участков связывания в ММП-9. Фиг. 1 описывает раковые клетки 110, продуцирующие ММП 120 (этап 1). ММП 120 связываются со специфическими участками связывания на ЭЦМ 130 (этап 2). Этап 3 на фигуре 1 показывает ММП 120, расщепляющие ЭЦМ 140.
На Фиг. 2 представлено описание этапов получения вакцины и иммунизации 200. Идентификацию и конструирование ММП 210 проводили с применением ММП последовательностей. Олигопептиды синтезированы 220 и представлены синтетическими олигопептидами 240. Рецептура олигопептидов для вакцинации - 222. Антитела получали, как показано на 226. Мышь 242 иммунизировали 224 с применением вакцины со шприцем 240. Олигопептиды могут иметь определенную длину. Тестировали некоторые перестановки и комбинации последовательностей. Итоговое описание последовательностей показано ниже как ММП-9 SEQ ID №№6-21. Перед выбором этих семнадцати последовательностей в качестве потенциальных олигопептидов, идентифицировали несколько потенциальных участков связывания для ММП-9. Наконец, в целом семнадцать олигопептидов синтезировали и тестировали на мышах. SEQ ID №№6-21 для ММП-9 синтезировали в линейной и кольцевой форме. Многие модификации для этих последовательностей также выполнены в одном варианте осуществления. Модификациями были замены на одном или нескольких аминокислотных остатках на N-конце, С-конце и обоих С- и N-концах, замена аминокислотных остатках на основе схожего заряда и полярности, без учета заряда и полярности, пропуск аминокислот на С- и N-концах, пропуск только на С-конце и только на N-конце.
В другом варианте осуществления замена и делеция могут быть проведены одновременно. Олигопептиды могут быть дополнительно модифицированы путем повтора последовательностей и комбинации более чем одной последовательности из SEQ ID №№6-21 для получения и составления рецептуры вакцины. Пептидомиметики к ММП можно применять для блокирования участка связывания избыточно экспрессируемой ММП при специфическом заболевании.
В одном варианте осуществления олигопептиды можно применять в качестве регуляторов с обратной связью для специфического предотвращения или снижения скорости синтеза при продукции ММП-9 на клеточном уровне. В одном варианте осуществления процесс блокирования и ингибирования деструкции ЭЦМ осуществляется антигенами, полученными при вакцинации мышей и крыс.
Приготовление растворов пептидов для иммунизации
Дизайн эксперимента был построен так, чтобы пептиды растворяли при концентрации 1,1 мг/мл. Конъюгат стрептавидин-ПОХ (пероксидаза хрена) в качестве несущего белка растворяли в ФБР при концентрации 0,8 мг/мл. Раствор пептида смешивали с конъюгатом стрептавидин-ПОХ для достижения стандартных итоговых концентраций для пептидов и конъюгата.
Конъюгат стрептавидин-Поли-ПОХ20 (№ SP20C) в качестве несущего белка получали от SDT (Германия), диализные трубки из целлюлозной мембраны D9777-100FT от Sigma (Сент-Луис, Миссури), стеклянные пробирки ISO 8362-1 2R-CL-1 от Medical Glass (Братислава, Словакия) или микроцентрифужные ПП пробирки Costar (Кат. №3621) от Corning Inc. (США), мочевину и соли - от Fluka (Швейцария). Все используемые реагенты были аналитического качества. Все растворы готовили с применением апирогенной воды качества milliQ. В качестве контрольного пептида использовали SP-35 от gp41 env HIV-1 с биотином, имеющий следующую последовательность: H-Arg-Ile-Leu-Ala-Val-Glu-Arg-Tyr-Leu-Lys-Asp-Gln-Gln-Leu-Leu-Gly-Ile-Trp-Gly-Cys-Ser-Gly-Lys-Leu-Ile-Cys-Thr-Thr-Ala-Val-Pro-Trp-Asn-Ala-Ser-ОН.
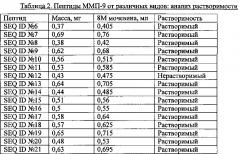
Тестирование растворимости пептида: данные по растворимости пептидов представлены в Таблицах 2 и 3. Пептиды SEQ ID №№6-21 растворяли в 8М мочевине до конечной концентрации 1,1 мг/мл.
Приготовление конъюгата стрептавидин-полиПОХ20 в качестве белка-носителя.
Обычно конъюгат стрептавидин-полиПОХ20 (Стр-ПОХ 1 мг/мл) поступает в виде раствора, содержащего 50 об.% глицерина. Для удаления глицерина Стр-ПОХ диализовали против фосфатного буферного раствора (ФБР). Объем конъюгата возрастает после диализа, и его нужно концентрировать до конечного объема с 1,25-кратной концентрацией (0,8 мг/мл).
Приготовление конъюгата пептида с белком-носителем
Пептиды растворяли в подходящем объеме 8М мочевины и дополнительного раствора. Итоговая концентрация раствора пептид-Стр-ПОХ составила 0,8 мг/мл и 0,6 мг/мл для пептида и Стр-ПОХ, соответственно. После растворения 4 аликвоты по 0,2 мл отбирали из каждого раствора пептида, смешивали с 0.6 мл Стр-ПОХ, и инкубировали в течение ночи при +4°C. Конъюгат пептида с белком-носителем (Стр-ПОХ) замораживали и хранили при -20°C до дальнейшего применения. Итоговая концентрация мочевины в растворе пептид-ПОХ составила 2М для всех пептидов.
Иммунизация
В качестве материалов использовали мышей-самок BALB/c, полный адъювант Фрейнда (Calbiochem, США), неполный адъювант Фрейнда (Calbiochem, США), 2 мл шприц 22G×1½''(BKMI, Р. Корея), ПП микроцентрифужные пробирки Costar (Кат. №3621, Corning Inc., США), Vortex Vibrofix VF1 (IKA-Werk, Германия), GP центрифугу (Beckman, США).
Режим иммунизации был следующим:
День 0: Иммунизация с полным адъювантом Фрейнда.
День 7: Бустерная иммунизация с неполным адъювантом Фрейнда.
День 14: Бустерная иммунизация с неполным адъювантом Фрейнда.
День 28: Бустерная иммунизация с неполным адъювантом Фрейнда.
День 38: Окончательный забор крови.
Способ иммунизации: Замороженные аликвоты по 0,8 мл конъюгата пептид-Стр-ПОХ оттаивали при комнатной температуре (КТ) и смешивали с 0,8 мл подходящего адъюванта. Добавляли адъювант и перемешивали с помощью вортекса непосредственно перед инъекцией. Иммунизацию проводили с применением интраперитонеальных инъекций со 100 мкг пептида на животное в итоговом объеме 250 мкл 1:1 (о:о) пептид + Стр + ПОХ : адъювант. Использовали шесть животных на пептид.
Приготовление сыворотки: на 38 день мышей обескровливали. Кровь собирали в 2 мл микроцентрифужную пробирку, и оставляли кровь для свертывания при комнатной температуре на 1 час. Проводили центрифугирование с применением микроцентрифужных пробирок со сгустком внутри в течение 15 минут при 2500 g, и собирали сыворотку. Объем каждого образца составил не менее 400 мкл. Сыворотку хранили при -20°C.
Тестирование иммунного ответа на индивидуальный пептид: проводили определение антител мышей к пептиду на основе непрямого твердофазного иммуноферментного анализа с авидином на твердой фазе.
Процедура анализа: пептиды для связывания на пластине, покрытой авидином, отбирали из анализируемого раствора для определения растворимости пептидов (Таблица 2 и 3), и растворяли до 2 мМ в разбавителях образцов непосредственно перед процедурой анализа, как показано в Таблице 4.
Планшеты для ИФА покрывали, добавляя в ячейку, содержащую 100 мкл авидина, растворенного до 10 мкг/мл в 50 мМ карбонатном буферном растворе, рН 9,5, и инкубировали в течение 20 часов при 20°C. Планшеты отмывали 4 раза раствором для промывания. Вносили пептиды 2 мМ, по 100 мкл на ячейку в разбавителе для образцов, и инкубировали 60 минут при 37°C. Контрольные ячейки содержали авидин. Планшеты промывали 4 раза с жидкостью для промывания. Сыворотку от каждой мыши и отрицательный контроль разбавляли 1:100, 1:1000 и 1:10000 в разбавителях для образцов, и добавляли в ячейки, покрытые соответствующим пептидом (100 мкл на ячейку) и инкубировали в течение 1 часа при 37°C. Планшеты промывали 4 раза раствором для промывания. Конъюгаты кроличьих антител к IgG мышей с ПОХ (разведение 1:3000 в разбавителе для конъюгата) добавляли в ячейки (100 мкл на ячейку). Пластины инкубировали в течение 0,5 часа при 37°C. Планшеты промывали 4 раза с раствором для промывания. 100 мкл свежеприготовленного раствора субстрата (1 объем раствора ТМБ+7 объемов буферного раствора для субстрата) добавляли в каждую ячейку, и планшеты оставляли при комнатной температуре на 15 минут в темноте. В ячейках, содержащих положительные образцы, должна была развиваться синяя окраска. Добавляли 100 мкл останавливающего раствора в каждую ячейку в той же самой последовательности, как при добавлении раствора субстрата. Это вызывает изменение синего цвета на желтый. Планшеты сканировали в течение 50 минут при 450 нм (А450) с применением ридера планшетов. Также определяли поглощение каждого планшета.
Оценивали результаты анализа иммунного ответа на индивидуальный пептид при иммуноферментном анализе индивидуальной антисыворотки, представленные в виде сигнала А450, и определяли градацию иммунного ответа (таблица 5).
Результаты анализа иммунного ответа на отдельные пептидные SEQ ID №№6-21 представлены в Таблице 5.
Заключение: все 16 тестируемых пептидов относились к трем группам. В группе с относительно сильной иммуногенностью значение А450 составило более 1,0 для разведения 1:1000 (SEQ ID №№7, 10, 13, 15). В группе с промежуточной иммуногенностью значение А450 составило более 2,0 для разведения 1:100, и меньше 1,0 для разведения 1:1000 (SEQ ID №№12, 14, 16, 17, 19, 21). В группе со слабой иммуногенностью значение А450 составило менее 2,0 для разбавления 1:100 для оставшихся 5 пептидов.
Способ индукции опухоли и лечения с ММП-9 олигопептидами. Для анализа эффективности избранных пептидов, направленных против ММП-9 при индукции опухоли у мышей, следующие олигопептиды были выбраны из SEQ ID №№6-21 (перечислены в Таблице 6): пептидные SEQ ID мыши №№11 и 19 и пептидные SEQ ID крысы 7, 12 и 18.
Синтезированные олигопептиды биотинилировали на N-конце с применением четырех углеродных спейсеров с помощью Genscript (Pitcataway, NJ 08554 США) и конъюгировали с KLH-белком (гемоцианином фиссуреллы). В эксперименте, проводимом на мышах, мышей-самцов C57BL/6 подготавливали, иммунизировали, индуцировали опухоль, и наблюдали эффективность лечения иммунотерапии, индуцированной олигопептидами.
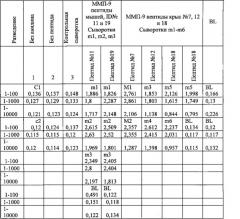
Инъекции готовили с применением 100 мкл конъюгированных с KLH биотинилированных пептидов и 100 мкл полного адъюванта Фрейнда (Sigma, Сент-Луис, Миссури). Мышей-самцов C57BL/6 в возрасте 6 недель при поступлении получали от Simonsen Laboratories, Гилрой, Калифорния, и содержали в клетке-микроизоляторе в апатогенных условиях с дневным циклом 12 часов света/12 часов темноты в течение недели. Всех животных содержали в соответствии с ведомственными инструкциями по содержанию и использованию экспериментальных животных. После адаптации в течение недели мышей (n=6 на группу) иммунизировали путем интраперитонеальной инъекции на 0 день, и введения неполного адъюванта Фрейнда (Sigma) на 7, 14 и 28 день. Образцы крови анализировали для определения иммунного ответа путем стандартного ИФА анализа с применением планшетов для микротитрования. Повторные инъекции синтетических пептидов у мышей вызывали иммунный ответ на конкретные индивидуальные пептиды. Исследовали различные разведения, и примерами разведения являются 1:100, 1:1000 и 1:10000. Результаты иммунного ответа на пептиды мышей №№11 и 19 и пептиды крыс №№7,12 и 18 представлены в Таблице 6.
Уровень иммунного ответа на все тестированные ММП-9 пептиды также оценивали у мышей-самцов B57BL/6 после развития меланомы B16FO. Результаты ИФА анализов сывороток, полученных от мышей-опухоленосителей, представлены для полученных от мышей пептидов №№11 и 19 в Таблице 7 и для пептидов крыс №№7, 12 и 18 в Таблице 8.
Результаты показали, что каждая из мышей - носителей B16FO опухоли сохраняла сильный иммунный ответ на пептиды мыши №№11 и 19, по сравнению с контрольными сыворотками. Не отмечалось существенных отличий между иммунным ответом у мышей, иммунизированных пептидом 11 и пептидом 19.
Результаты показывают, что каждая из мышей-носителей опухоли B16FO сохраняла сильный иммунный ответ на тестируемые пептиды крыс №№7, 12 и 18, по сравнению с контрольными сыворотками и сыворотками от соответствующих мышей перед инокуляцией клеток меланомы (Таблица 6). Наиболее сильный ответ на пептид №7 наблюдали у двух мышей (m4 и m6), на пептид №12 у трех мышей (m3, m4 и m6), и на пептид №18 у трех мышей (m2, m4 и m6). Но в целом не было существенной разницы между иммунным ответом у всех тестируемых мышей, иммунизированных пептидами №№7, 12 и 18.
В другом варианте осуществления замена и деления могут быть выполнены одновременно. Олигопептиды могут быть дополнительно модифицированы путем повторения последовательностей и объединения более одной ММП-9 от мыши и крысы для получения и составления рецептур вакцины. Пептидомиметики для ММП можно применять для блокирования участков связывания при избыточной экспрессии ММП при специфическом заболевании.
В одном варианте осуществления олигопептиды можно применять в качестве регуляторов обратной связи для специфической профилактики или снижения скорости синтеза ММП-9 на клеточном уровне. В одном варианте осуществления процесс блокирования или ингибирования деструкции ЭЦМ осуществляют антигенами, полученными при вакцинации мышей.
На Фиг. 3 показана масса тела мышей-самцов C57BL/6, иммунизированных ММП-9 пептидами мыши SEQ ID №№11 и 19 до и после пересадки клеток меланомы B16FO. Контрольные мыши прибавляли в весе со временем. ММП-9 пептиды мыши SEQ ID №№11 и 19 показывали схожие результаты даже после пересадки опухоли. Отмечается отрицательный эффект вакцины, и крысы прибавляют массу тела, что коррелирует с возрастом мышей.
На Фиг. 4 показано влияние иммунизации ММП-9 пептидами мышей SEQ ID №№11 и 19 на ингибирование опухолевой нагрузки клеток ксенографта меланомы B16FO у мышей-самцов C57BL/6. Имеется примерно 40% и 30% снижение опухолевой нагрузки в результате лечения ММП-9 пептидами мышей SEQ ID №11 и SEQ ID 19. Отмечается существенное снижение, и результаты являются очень обнадеживающими.
На Фиг. 5 показано влияние иммунизации ММП-9 пептидами мышей SEQ ID №№11 и 19 на ингибирование массы опухоли для клеток ксенографта меланомы B16FO у мышей-самцов C57BL/6. Снижение массы опухоли составило примерно 60% для SEQ ID №11 и 50% для SEQ ID №19. Отмечается существенное различие в ингибировании массы опухоли, демонстрирующее эффективность лечения ММП-9 последовательностью для уменьшения раковой опухоли.
На Фиг. 6 показана однородная прибавка в весе для мышей-самцов C57BL/6, иммунизированных ММП-9 пептидами крыс SEQ ID №№7, 12 и 18 до и после введения ксенографта клеток меланомы B16FO, по сравнению с контролем за тот же период. Отсутствие снижения массы тела у мышей-опухоленосителей после их лечения подобно отсутствию у контрольных крыс того же самого возраста в тот же период. Эти результаты являются очень обнадеживающими, показывая, что несмотря на рак, животные не демонстрируют существенного снижения массы тела, подтверждая благоприятный эффект вакцины. Хотя увеличение массы тела может также быть обусловлено опухолью, как можно видеть у крыс, имеющих меньшую массу тела перед лечением, чем после лечения, при этом контрольные крысы имеют почти равную прибавку массы тела.
На Фиг. 7 показано влияние иммунизации ММП-9 пептидами крыс SEQ ID №№7, 12 и 18. SEQ ID №№12 и 18 демонстрируют более чем 30% снижение опухолевой нагрузки, по сравнению с контрольными животными (мышами). SEQ ID №7 показывает 50% ингибирование. Эффективность SEQ ID №№12 и 18 больше, чем у №7, но все три из них оказывали ингибирующее влияние на опухолевую нагрузку.
На Фиг. 8 показано влияние иммунизации ММП-9 пептидами крыс SEQ ID №№7, 12 и 18 на ингибирование массы опухоли для клеток ксенографта меланомы B16FO у мышей-самцов C57BL/6. Отмечалось более чем 70% снижение массы опухоли при лечении SEQ ID №12, и 60% снижение размера опухоли при использовании SEQ ID №18. SEQ ID №7 демонстрирует существенное уменьшение примерно на 50%. Как показано на Фиг. 8, все ММП-9 олигопептиды в качестве вакцин являются очень эффективными для снижения массы опухоли, демонстрируя обнадеживающий способ лечения, композицию и применение ММП-9 олигопептидов для лечения рака в качестве вакцин у млекопитающих.
На Фиг. 9-14 показаны различные опухоли, такие как опухоль у контрольных мышей и при лечении SEQ ID №№7, 12, 18, 11 и 19. Отмечаются разные эффекты при лечении каждым пептидом крыс и мышей. Размер опухоли снижался по всех опытных группах, по сравнению с контролем.
Терапевтически эффективное количество олигопептида можно применять у млекопитающего разными способами, и оно может не ограничиваться инъекциями. Различные способы применения хорошо известны в данной области техники, и некоторые из этих способов описаны ниже.
«Специфические виды» для лечения способом из настоящего изобретения могут означать человека или не являющееся человеком животное, такое как мышь, сельскохозяйственные животные, приматы и позвоночные.
Специфическими заболеваниями, которые могут быть целевыми заболеваниями для лечения с применением ММП олигопептидных последовательностей и/или пептидомиметиков, являются неопластические заболевания, воспалительные заболевания, болезни коронарной артерии, окклюзионные сердечнососудистые заболевания, дегенеративные заболевания, и инфекционные заболевания. Некоторыми примерами неопластических заболеваний могут быть рак, лимфома, лейкемия, и опухоль головного мозга, но не ограничиваясь ими. Некоторыми примерами воспалительных заболеваний могут быть артрит, астма, атеросклероз, болезнь Крона, колит, дерматит, системная красная волчанка, и т.д., но не ограничиваясь ими. Некоторые примеры инфекционных заболеваний могут включать бактериальные, вирусные, грибковые, микроплазменные инфекции, некоторые генетические заболевания, и другие инфекции, но не ограничиваются ими. В настоящей заявке идентифицированы сигнальные олигопептиды в избранном ММП белке, опосредующие ключевую патологическую функцию ММП белка, а именно расщепление соединительной ткани, что является предпосылкой для миграции и метастазирования раковых клеток. Были синтезированы олигопептиды, их вводили животным, и повышался уровень антител. Размер опухоли значительно снижался при использовании этих вакцин на основе олигопептидов. Степень эффективности можно определить путем титрования уровня, вызванного ММП олигопептидной вакциной, что обеспечивает высокую эффективность вакцин.
Одним из обычных способов выбора для повышения натуральной антигенности олигопептидной последовательности(ей) определенного пептида является небольшое изменение аминокислотной последовательности в определенном олигопептиде, т.е. путем замен, делеций, вставок и т.д. отдельных аминокислот. Были идентифицированы SEQ ID №№6-21, и сконструированы так, чтобы соответствовать гидрофобности, гидрофильности и электрическому заряду аминокислотных олигопептидных последовательностей из SEQ ID A1-A3 (ММП), как показано в предыдущей заявке. Они также сохраняют сигнальные характеристики и функциональность эпитопа. SEQ ID №№7, 11, 12, 18 и 19 повышают терапевтическую эффективность для перекрестно-видовой иммунизации путем повышения натуральной антигенности, независимо от того, применяется ли адъювант.
Рецептуры лекарств, пригодные для этих способов применения, могут быть получены путем добавления одного или нескольких фармакологически пригодных носителей к агенту, с последующей обработкой смеси посредством рутинного способа, известного специалистам в данной области техники. Способ применения включает не-инвазивное пероральное, местное (например, трансдермальное), энтеральное, трансмукозальное введение, направленную доставку, доставку с замедленным высвобождением, пролонгированную доставку, прерывистое высвобождение, и парентеральные способы. При пероральном применении можно использовать жидкую и сухую форму.
Рецептуры, пригодные для перорального применения, могут быть в форме капсул, саше, пилюль, таблеток, пастилок (с применением ароматизированной основы, обычно сахарозы и аравийской камеди или трагаканта), порошков, гранул, или в виде раствора или суспензии в водной или неводной жидкости, или в виде жидкой эмульсии масло-вводе или вода-в-масле, или в виде эликсира или сиропа, или в виде пастилок (с применением инертной основы, такой как желатин и глицерин, или сахароза и аравийская камедь), содержащих определенное количество композиции в соответствии с настоящим изобретением в качестве активного ингредиента. Композиции из настоящего изобретения можно также применять в виде болюса, электуария, или пасты.
При приготовлении твердого лекарственного продукта для перорального применения олигопептидную последовательность ММП и/или пептидомиметик ММП смешивают со вспомогательным веществом (и если необходимо, одной или несколькими добавками, такими как связующий агент, дезинтегрант, любрикант, краситель, подсластитель и вкусоароматический агент), и полученную смесь обрабатывают рутинным способом для получения твердого лекарственного продукта для перорального применения, такого как таблетки, покрытые оболочкой таблетки, гранулы, порошки или капсулы. Добавки могут быть теми, которые, как правило, применяются в данной области техники. Примеры вспомогательных веществ включают лактат, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу, и кремниевую кислоту; примеры связующих агентов включают воду, этанол, пропанол, простой сироп, раствор глюкозы, раствор крахмала, разжиженный желатин, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилкрахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция, и поливинилпирролидон; примеры дезинтегранта включают сухой крахмал, альгинат натрия, порошковый агар, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерил стеарат, и лактозу; примеры любриканта включают очищенный тальк, соли стеариновой кислоты, буру, и полиэтиленгликоль; и примеры подсластителя включают сахарозу, апельсиновую кожуру, лимонную кислоту, и виннокаменную кислоту.
Когда готовят жидкий лекарственный продукт для перорального применения, олигопептидную последовательность ММП и/или пептидомиметик ММП смешивают с такой добавкой, как подсластитель, буферный агент, стабилизатор, или вкусоароматический агент, и полученную смесь обрабатывают рутинным способом, до получения жидкого лекарственного продукта для перорального применения, такого как раствор для внутреннего применения, сироп или эликсир. Примеры подсластителей включают ванилин; примеры буферных веществ включают цитрат натрия; а примеры стабилизатора включают трагакант, аравийскую камедь и желатин.
Для трансдермального (например, местного) применения, можно приготовить стерильные, водные или отчасти водные растворы (обычно с концентрацией примерно 0,1%-5%), в ином отношении подобные вышеуказанным растворам для парентерального применения.
Рецептуры для ректального или вагинального применения могут быть представлены в виде суппозитория, который можно приготовить путем смешивания композиции в соответствии с настоящим изобретением с одним или несколькими подходящими не раздражающими носителями, включая, например, масло какао, полиэтиленгликоль, воск для суппозиториев, или салицилат, которые являются твердыми при комнатной температуре, но жидкими при температуре тела, и таким образом, плавятся в подходящей полости организма и высвобождают инкапсулированное соединение(я) и композицию(и). Рецептуры, пригодные для вагинального применения, также включают пессарии, тампоны, кремы, гели, пасты, пены, или спреи, содержащие носители, известные как подходящие из данной области техники.
Часть для направленной доставки может быть добавлена к системе пролонгированного высвобождения посредством нанесения слоя немедленного высвобождения поверх сердцевины пролонгированного высвобождения; с применением процессов нанесения оболочки или прессования, или системы с множеством единиц, такой как капсула, содержащая гранулы пролонгированного и немедленного высвобождения.
При использовании в отношении фармацевтической композиции или другого материала термин «пролонгированное высвобождение» является термином, признанным в данной области техники. Например, терапевтическая композиция, высвобождающая вещество в течение времени, может обладать характеристиками пролонгированного высвобождения, в отличие от применения болюсного типа, при котором все количество вещества становится биологически доступным в одно время. Например, в частных вариантах осуществления при контакте с жидкостями организма, включая кровь, спинномозговую жидкость, слизистые секреты, лимфу или тому подобное, одно или несколько из фармацевтически пригодных вспомогательных веществ может подвергаться постепенной или замедленной деградации (например, посредством гидролиза) с сопутствующим высвобождением какого-либо материала, содержащегося в нем, например, терапевтически и/или биологически активной соли и/или композиции, в течение отсроченного или увеличенного периода (по сравнению с высвобождением из болюса). Это высвобождение может приводить к пролонгированной доставке терапевтически эффективных количеств любого из терапевтических агентов, раскрытых в настоящей заявке.
Современные попытки в области доставки лекарств включают разработку направленной доставки, при которой лекарство достигает только целевой области в организме (например, в раковой ткани), и рецептур замедленного высвобождения, в которых лекарство высвобождается в течение периода времени контролируемым образом из рецептуры. Типы рецептур замедленного высвобождения включают липосомы, загруженные лекарством биодеградируемые микросферы, и конъюгаты лекарств с полимерами.
Рецептуры лекарств для пролонгированного высвобождения создают путем нанесения на твердую лекарственную форму пленки из полимера, нерастворимого в кислой среде желудка, но растворимого в нейтральной среде тонкой кишки. Лекарственные формы пролонгированного высвобождения могут быть приготовлены, например, путем нанесения на лекарство или содержащую лекарство композицию избранного материала оболочки. Композиция, содержащая лекарство, может быть таблеткой для включения в капсулу, таблеткой для применения в качестве внутренней сердцевины в лекарственной форме, покрытой оболочкой, или множеством содержащих лекарство крупинок, частиц или гранул, для включения в таблетку или капсулу. Предпочтительные материалы оболочки включают биоэродируемые, постепенно гидролизуемые, постепенно растворяющиеся в воде, и/или ферментативно расщепляемые полимеры, и могут быть обычными «кишечнорастворимыми» полимерами. Кишечнорастворимые полимеры, как понятно специалистам в данной области техники, становятся растворимыми при более высоких значениях рН в нижних отделах желудочно-кишечного тракта, и медленно подвергаются эрозии, когда лекарстве