Способ стимуляции ангиогенеза в ишеминизированных тканях и комбинированное лекарственное средство для осуществления способа
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к способу стимуляции ангиогенеза в ишемизированных тканях и комбинированному лекарственному средству для его осуществления. Указанное лекарственное средство содержит невирусную плазмидную конструкцию, несущую ген, кодирующий фактор роста гепатоцитов (HGF), и невирусную плазмидную конструкцию, несущую ген, кодирующий ангиопоэтин-1 (Ang-1). Указанные плазмидные конструкции в составе лекарственного средства взяты в массовом соотношении от 2:1 до 1:2 и разведены в физиологическом растворе. Для осуществления способа стимуляции ангиогенеза в ишемизированных тканях указанное комбинированное лекарственное средство вводят внутримышечно непосредственно в зону ишемии. Настоящее изобретение позволяет повысить эффективность ангиогенеза в ишемизированных тканях за счёт синергетического эффекта от применения комбинации двух указанных выше конструкций. 2 н. и 13 з.п. ф-лы, 9 ил., 3 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к медицине и фармакологии и может быть использовано для стимуляции ангиогенеза, роста и ремоделирования сосудов, а также восстановления кровоснабжения в ишемизированных тканях, для лечения ряда заболеваний человека, обусловленных нарушением кровоснабжения тканей. Изобретение основано на использовании лекарственного средства, действующим началом которого является комбинация невирусных плазмидных конструкций, несущих гены фактора роста гепатоцитов (HGF) и ангиопоэтина-1 (Ang-1).
Уровень техники
Ишемическая болезнь сердца (ИБС) и критическая ишемия нижних конечностей (КИНК), наряду с ишемическими нарушениями мозгового кровообращения, в настоящее время относят к основным причинам инвалидизации населения.
Лечение КИНК включает целый ряд мер медикаментозного характера, изменение образа жизни, коррекцию сопутствующей патологии, хирургические методы восстановления нарушенного кровотока - шунтирование, ангиопластика, атерэктомия и т.д. Однако существует определенная группа больных с множественными критическими стенозами сосудов нижних конечностей, для которых описанные выше лечебные мероприятия являются неэффективными. То же относится и к лицам, которым уже было выполнено хирургическое вмешательство, в результате чего все последующие операции по восстановлению перфузии становятся крайне затруднительными или невозможными. В связи со сказанным возникает необходимость разработки альтернативных методов лечения КИНК, одним из которых является терапевтический ангиогенез - направление регенеративной медицины, активно развивающееся в последнее время. При лечении ишемических повреждений тканей и органов генная терапия на сегодняшний день общепризнанно считается одним из наиболее эффективных способов терапии.
В силу того, что в основе всех регенеративных процессов лежит ангиогенез, и полноценное восстановление структуры и функции органов и тканей без обеспечения кровотоком невозможно, поиск решений, позволяющих восстановить кровоснабжение в поврежденных тканях, является весьма актуальной задачей.
В основе терапевтического ангиогенеза лежит стимуляция роста и ремоделирования сосудов в ишемизированных тканях с помощью введения рекомбинантных ангиогенных факторов, их генов или прогениторных клеток, способных продуцировать ангиогенные факторы и факторы роста или дифференцироваться в клетки сосудов.
Было показано [Deveza L, Choi J, Yang F. Therapeutic Angiogenesis for Treating Cardiovascular Diseases. Theranostics. 2012; 2(8): 801-814], что введение рекомбинантных факторов в зону ишемии положительно влияет на процессы регенерации за счет индукции ангиогенеза. Однако использование генетических конструкций оказывается более эффективно, поскольку обеспечивает продолжительную экспрессию трансгена в ткани-мишени.
Среди наиболее изученных индукторов ангиогенеза сосудистый фактор роста эндотелия (VEGF), основной фактор роста фибробластов (bFGF), фактор роста гепатоцитов (HGF) и урокиназа (uPA). Было показано [Carmeliet P. VEGF gene therapy: stimulating angiogenesis or angioma-genesis. Nat. Med. 2000; 6: 1102-1113; Traktuev DO, Tsokolaeva ZI, Shevelev AA, Talitskiy KA, Stepanova VV, Johnstone BH, Rahmat-Zade TM, Kapustin AN, Tkachuk VA, March KL, Parfyonova YV. Urokinase gene transfer augments angiogenesis in ischemic skeletal and myocardial muscle. Mol Ther. 2007; 15(11): 1939-1946], что урокиназа эффективно стимулирует ангиогенез в ишемизированных тканях миокарда и скелетных мышцах. Однако вновь сформированные сосуды без стабилизации подвергаются быстрой регрессии; созревание сосудов и их стабилизация происходит за счет взаимодействия эндотелиальных клеток растущего сосуда с перицитами и за счет продукции последними ангиопоэтина-1 (Ang-1; AGP1), фактора роста тромбоцитов (PDGF-B) и трансформирующего фактора роста (TGF-β).
Из уровня техники известен способ стимуляции регенеративных процессов в ишемизированных тканях, включающий введение в организм больного среды культивирования стромальных клеток из жировой ткани человека, содержащей факторы роста VEGF, HGF, ангиопоэтин и ангиогенин (патент РФ №2497529).
Однако данный способ имеет множественные недостатки, так как, во-первых, использование клеток, выделенных от донора, требует высокой квалификации врача-специалиста, проводящего процедуру изъятия биологического материала у донора, долгой пробоподготовки, которая заключается в длительном культивировании клеток, а также наличие специализированного дорогого оборудования для ведения культуральных работ. Во-вторых, при культивировании клеток используются коммерческие среды, точный состав которых не известен и затрудняет стандартизацию конечного продукта, и кроме того, в составе таких сред могут содержаться продукты животного происхождения, что опасно переносом антигенов/белков животных в организм человека. И, в-третьих, введение прогениторных/стромальных клеток в организм человека может приводить к развитию злокачественных новообразований из этих клеток, а также к неконтролируемому запуску дифференцировки стромальных клеток в нежелательном направлении.
Наиболее близким к заявляемому решению является средство для стимуляции ангиогенеза в ишемизированной ткани, содержащее смесь в растворе 0,9%-ного NaCl плазмидных конструкций pC4W-hVEGFopt, несущую оптимизированный ген hVEGFopt фактора роста эндотелия сосудов, и pC4W-hHGFopt, несущую оптимизированный ген hHGFopt фактора роста гепатоцитов (патент РФ №2449799).
Однако из многочисленных зарубежных клинических испытаний следует, что эффективность терапии на основе плазмид или вирусов с геном VEGF оказалась невысокой. В частности, результаты фазы III клинических испытаний генно-терапевтического препарата на основе VEGF165 показали безопасность препарата, но статистически значимый терапевтический эффект при лечении ишемии миокарда отсутствовал [Duncan J Stewart, Michael JB Kutryk, David Fitchett, Michael Freeman, Nancy Camack, Yinghua Su, Anthony Delia Siega, Luc Bilodeau, Jeffrey R Burton, Guy Proulx, Sam Radhakrishnan, and for the NORTHERN Trial Investigators. VEGF Gene Therapy Fails to Improve Perfusion of Ischemic Myocardium in Patients With Advanced Coronary Disease: Results of the NORTHERN Trial. Mol. Therapy. 2009; 17(6): 1109-1115]. По всей вероятности, это обусловлено тем, что временное повышение в тканях продукции одного из факторов, инициирующих формирование кровеносных сосудов de novo, приводит к образованию незрелых сосудов, которые без стабилизации довольно быстро регрессируют [Makarevich Р, Tsokolaeva Z, Shevelev A, Rybalkin I, Shevchenko E, Beloglazova I, Vlasik T, Tkachuk V, Parfyonova Ye. Combined transfer of human VEGF165 and HGF genes renders potent angiogenic effect in ischemic skeletal muscle. PLoSOne. 2012; 7(6): e38776].
Раскрытие изобретения
Задачей настоящего изобретения является разработка эффективного способа стимуляции ангиогенеза в ишемизированных тканях, а также создание комбинированного лекарственного средства, которое обеспечивает эффективный терапевтический ангиогенез.
Поставленная задача решается тем, что способ стимуляции ангиогенеза в ишемизированных тканях включает внутримышечное введение непосредственно в зону ишемии терапевтически эффективного количества комбинированного лекарственного средства, включающего невирусную плазмидную конструкцию, несущую ген, кодирующий фактор роста гепатоцитов, и невирусную плазмидную конструкцию, несущую ген, кодирующий ангиопоэтин-1, взятых в массовом соотношении от 2:1 до 1:2, разведенных в физиологическом растворе.
Предпочтительно в качестве вектора, несущего гены, кодирующие фактор роста гепатоцитов и ангиопоэтина-1, использовать плазмиду pH-CMV1.
Предпочтительно в качестве гена, кодирующего фактор роста гепатоцитов, использовать ген, имеющий последовательность нуклеотидов, представленную на фиг. 1.
Предпочтительно в качестве гена, кодирующего ангиопоэтин-1, использовать ген, имеющий последовательность нуклеотидов, представленную на фиг. 2.
Предпочтительно в качестве физиологического раствора использовать стерильный изотонический раствор хлорида натрия.
Предпочтительно вводить комбинированное средство в количестве из расчета 50-55 мкг средства/1 кг веса.
Предпочтительно использовать суммарную концентрацию плазмид в физиологическом растворе составляющую от 1 до 5 мг/мл.
Предпочтительно вводить комбинированное средство однократно или многократно, но не чаще одного раза в неделю до достижения терапевтического эффекта.
Также поставленная задача решается тем, что комбинированное лекарственное средство на основе невирусных конструкций, содержит плазмидную конструкцию, несущую ген, кодирующий фактор роста гепатоцитов, и плазмидную конструкцию, несущую ген, кодирующий ангиопоэтин-1, взятых в массовом соотношении от 2:1 до 1:2 и разведенных в физиологическом растворе.
Предпочтительно использовать средство с суммарной концентрацией плазмид в физиологическом растворе от 1 до 5 мг/мл.
Предпочтительно использовать в плазмидной конструкции в качестве вектора, несущего гены, кодирующие фактор роста гепатоцитов и ангиопоэтина-1, плазмиду pH-CMV1.
Предпочтительно в качестве гена, кодирующего фактор роста гепатоцитов, использовать ген, имеющий последовательность нуклеотидов, представленную на фиг. 1.
Предпочтительно в качестве гена, кодирующего ангиопоэтин-1, использовать ген, имеющий последовательность нуклеотидов, представленную на фиг. 2.
Предпочтительно в качестве физиологического раствора использовать стерильный изотонический раствор хлорида натрия.
Предпочтительно использовать средство, содержащее плазмидную конструкцию, несущую ген, кодирующий фактор роста гепатоцитов, и плазмидную конструкцию, несущую ген, кодирующий ангиопоэтин-1, взятых в массовом соотношении 1:1.
Технический результат от использования предлагаемого способа лечения и комбинированного лекарственного средства, содержащего смесь плазмидных невирусных конструкций pH-CMV1-HGFopt и pH-CMV1-Ang-1opt, заключается в обеспечении эффективного ангиогенеза в ишемизированных тканях, а именно, в увеличении числа вновь образованных сосудов, их стабилизации и устойчивости к апоптозу, а также в уменьшении площади некроза в ишемизированных тканях. Данный результат был получен за счет синергического эффекта двух плазмидных конструкций, несущих гены фактора роста гепатоцитов (HGF) и ангиопоэтина-1 (Ang-1 или AGP1).
Монокомпонентная генная терапия не оказывает такого терапевтического эффекта, как комбинированная терапия с использованием нескольких плазмидных конструкций. В ряде модельных экспериментов in vivo нами ранее было показано, что введение одной плазмиды, содержащей ген ангиопоэтина, не вызывает восстановление кровотока на модели ишемии нижней конечности мыши. Использование же плазмиды с фактором HGF в этих целях оказывает необходимый терапевтический эффект, однако, этот эффект является непродолжительным вследствие нестабильности вновь образованных сосудов.
Таким образом, комбинированное генное лекарственное средство на основе невирусных конструкций, несущих гены фактора роста гепатоцитов и ангиопоэтина-1, обеспечивает комплексное воздействие на ключевые процессы, необходимые регенерации органов и тканей - оказывает антиапоптотическое действие, способствующее выживанию клеток, и индуцирует формирование стабильных и функционально зрелых сосудов.
Действующим началом предлагаемого лекарственного средства является комбинация невирусных плазмидных конструкций, несущих гены HGF и Ang-1. После введения в поврежденную ткань плазмидные конструкции экспрессируются в течение одной-двух недель, обеспечивая многократное повышение продукции HGF и Ang-1. Биомишенями этих белковых факторов являются специфичные рецепторы на поверхности клеток, белки c-met и Tie2.
HGF представляет собой гликопротеин, исходно идентифицированный как митоген для гепатоцитов, участвующий в регенерации печени. HGF также стимулирует пролиферацию эпителиоцитов (эпителия легких, почки, эпидермиса). Кроме этого, HGF является антиапоптотическим фактором и фактором роста, индуцирующим ангиогенез. Известно, что при связывании HGF с его рецептором c-met происходит активация тирозин-киназного сигнального каскада HGF, что приводит к активации пролиферации и миграции клеток эндотелиальных клеток с последующим формированием капилляроподобных структур. В органах и тканях HGF секретируется стромальными мезенхимальными клетками и действует на окружающие клетки как мультифункциональный цитокин, облегчая их миграцию, деградацию внеклеточного матрикса и морфогенез, что делает его центральным фактором роста, регулирующим процессы регенерации и ангиогенеза.
Ангипоэтин-1 представляет собой фактор стабилизации сосуда, который регулирует формирование полноценного зрелого сосуда, привлекая гладкомышечные клетки и уменьшая проницаемость сосудов. В норме Ang-1 также продуцируется перицитами и гладкомышечными клетками и оказывает стимулирующее действие на ангиогенез, но механизм его действия заключается в стабилизации вновь образованных сосудов. Известно, что вновь образованные сосуды подвергаются регрессии, если они не стабилизируются за счет контактного взаимодействия с перицитами. Экспериментальные данные свидетельствуют о том, что Tie2/Ang-1-зависимый каскад сигнализации стимулирует хемотаксис эндотелиальных клеток и потенцирует их взаимодействие с перицитами, тем самым способствуя стабилизации вновь сформированных сосудов. Кроме того, Ang-1 уменьшает проницаемость сосудов и обладает антивоспалительной активностью.
В основе предлагаемого изобретения лежит комбинация двух плазмидных конструкций, несущих гены, кодирующие HGF и Ang-1 и способ их применения. Эти конструкции представляют собой невирусные векторы для экспрессии HGF и Ang-1 человека в эукариотических клетках.
В качестве генов, кодирующих HGFopt и Ang-1opt, предлагается использовать запатентованные ранее оптимизированные нуклеотидные последовательности, где последовательность HGFopt представлена на фиг. 1 (патент РФ №2385936), а последовательность Ang-1opt - на фиг. 2 (патент РФ №2385938)
Для повышения уровня продукции HGF и Ang-1 в трансфицированных клетках была оптимизирована природная последовательность кДНК этих генов. Среди триплетов нуклеотидов, кодирующих аминокислоты белковых последовательностей природных генов HGF и Ang-1, были выявлены наиболее редко встречаемые последовательности в генах человека. Выявленные редкие триплеты, а также соседние с ними триплеты были заменены на триплеты, кодирующие ту же аминокислоту, но при этом наиболее часто встречающиеся в генах человека. Далее, из исходных генов в кодирующих белок областей теми же методами были удалены сигналы деградации мРНК и сигналы полиаденилирования, что привело к увеличению стабильности мРНК генов HGF и Ang-1. После модификации все аминокислоты природных генов HGF и Ang-1 остались неизмененными.
Кроме того, следует отметить, что плазмидные конструкции созданы на основе вектора pH-CMV1 (например, следующих компаний - производителей: Genlantis (http://www.genlantis.com), SnapGene (www.snapgene.com), amsbio (www.amsbio.com) и др.) в который встроены гены фактора роста гепатоцитов и ангиопоэтина-1, и представляют собой невирусные векторы для экспрессии лекарственных белков в эукариотических клетках под контролем высокоэффективных промоторов. Данные плазмиды содержат усиленный промотор для эффективной и высокой экспрессии трансгена в таргетных клетках и показывают достижение наилучшего результата. Оптимизация последовательности гена фактора рота гепатоцитов HGF (HGFopt) и ангиопоэтина-1 (AGP, AGPopt) привела к повышению продукции HGF и Ang-1 в системах in vitro и in vivo. Следует отметить, что реализация изобретения возможна также с использованием иных плазмидных конструкций, созданных на основе других векторов, содержащих усиленный промотор для эффективной и высокой экспрессии трансгена в таргетных клетках. Среди них векторы, созданные на основе pcDNA3.1 плазмиды, pVAX1 плазмиды, pIRES плазмиды, плазмиды нового поколения pH-CMV1, pC4W и т.д. На основании проведенного сравнительного анализа экспрессии трансгенов с использованием метода ELISA для оценки концентрации факторов HGF и Ang-1, экспрессируемых клетками после трансфекции плазмидами, был выбран наиболее эффективный вектор pH-CMV1.
Таким образом, предлагаемый комбинированный плазмидный генно-терапевтический препарат обеспечивает продукцию двух взаимодополняющих факторов HGF и Ang-1, является более эффективным препаратом следующего поколения, стимулирующим восстановление структуры и функции поврежденных тканей за счет стимуляции ангиогенеза, антиапоптотического эффекта и, как следствие, общей регенерации поврежденных тканей.
Краткое описание чертежей
Изобретение поясняется чертежами.
На фиг. 1 представлена нуклеотидная последовательность гена фактора роста гепатоцитов HGFopt. Показана последовательность нуклеотидов гена HGFopt (верхние строчки) в сравнении с последовательностью нуклеотидов природного гена фактора роста гепатоцитов человека (средние строчки). Показана также последовательность аминокислот кодируемого белкового продукта (нижние строчки). Жирным шрифтом выделена область, кодирующая белок. Подчеркнуты триплеты нуклеотидов, подвергшиеся оптимизации.
На фиг. 2 представлена нуклеотидная последовательность Ang-1opt. Показана последовательность нуклеотидов гена AGP1opt (верхние строчки) в сравнении с последовательностью нуклеотидов природного гена ангиопоэтина-1 человека (средние строчки). Показана также последовательность аминокислот кодируемого белкового продукта (нижние строчки). Жирным шрифтом выделена область, кодирующая белок. Подчеркнуты триплеты нуклеотидов, подвергшиеся оптимизации.
На фиг. 3 показана функциональная карта плазмиды pH-CMV1.
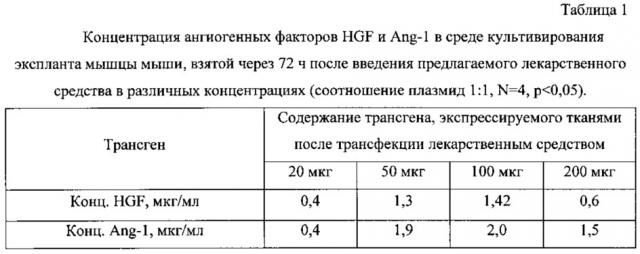
На фигуре 4 отображена динамика восстановления перфузии ишемизированной конечности в зависимости от концентрации вектора, содержащего кДНК для экспрессии ангиогенных факторов HGF и Ang-1 ( 5 мкг, 20 мкг, 50 мкг, 100 мкг и 200 мкг ДНК; N=5). betaGal () - контрольная плазмида, не вызывающая терапевтический эффект, содержащая кДНК бета-галактозидазы, и использованная для оценки эффективности трансфекции. Цифрой 1 отмечены эффективные дозировки, цифрой 2 - неэффективные.
На фигуре 5 показана динамика восстановления перфузии ишемизированной конечности в зависимости от соотношения плазмидных векторов (плазмида с кДНК HGF и плазмида с кДНК Ang-1) в предлагаемом лекарственном средстве (N=5). Цифрой 3 отмечен график динамики восстановления перфузии ишемизированной конечности при соотношении HGF+ Ang-1 - 1:1, цифрой 4 - 2:1, цифрой 5 - 1:2.
На фигуре 6 показано влияние комбинированного препарата на восстановление кровотока в ишемизированной задней конечности мыши. Верхняя панель - график восстановления кровотока в конечности, оцененного по величине перфузии тканей подошвы кровью. Цифрой 6 отмечен график контрольной группы (n=29), цифрой 7 - при использовании заявляемого средства (n=23). Различия между опытной и контрольной группами достоверны на 14-й и 21-й день (N=25, * p<0,05). Нижняя панель - пример лазерного доплеровского сканирования, где цифрой 8 отмечены задние конечности с нормальным уровнем кровотока.
На фигуре 7 отображено влияние комбинированного препарата на плотность капилляров и артериол в ишемизированной мышце задней конечности мыши. Верхняя панель - результаты обсчета плотности сосудов на срезах мышц, представленные как среднее количество сосудов в одном поле зрения. Результаты даны как среднее значение на группу + стандартное отклонение (цифрой 9 обозначены результаты при использовании контрольной плазмиды, 10 - комбинированного препарата). Нижняя панель - микрофотографии срезов мышц, окрашенных на маркеры капилляров (CD31) (серая область на выделенном фрагменте) и артериол (α-SMA) (светло-серые участки на выделенном фрагменте).
На фигуре 8 показано влияние комбинированного препарата на размер некроза ишемизированных мышц задней конечности мыши. Верхняя панель - средние значения площади некроза на срезах мышц (N=5, *p<0,05). Нижняя панель - репрезентативные фотографии срезов мышц, окрашенных гематоксилином и эозином. Под цифрой 11 приведены результаты при применении комбинированного препарата, 12 - результаты контрольной группы.
На фигуре 9 показано влияние комбинированного препарата на развитие некрозов и ампутаций конечности А и В. Макроскопическая картина сохранной конечности у животного из опытной группы (7 сутки); С - культя конечности с некрозом голени у животного из контрольной группы контрольной плазмиды (7-ые сутки, доплерография не выполнялась).
Осуществление изобретения
Приготовление заявляемого комбинированного средства осуществляли следующим образом.
Для трансформации и наработки плазмидной ДНК pH-CMV1-HGFopt, которая содержит ген фактора роста гепатоцитов, использовали штамм Е. coli XL1Blue-HGFopt, производный от штамма Е. coli XL1-Blue.
Для трансформации и наработки плазмидной ДНК pH-CMV1-AGPopt, которая содержит ген ангиопоэтина 1, использовали штамм Е. coli XL1-Blue-AGPopt, производный от штамма Е. coli XL1-Blue.
Исходный штамм Е. coli XL1-Blue является музейным и хранится во Всероссийской Коллекции Промышленных Микроорганизмов.
Трансформированные штаммы Е. coli XL1-Blue-AGPopt и E. coli XL1Blue-HGFopt отличаются от исходного штамма Е. coli XL1-Blue устойчивостью к антибиотику ампициллину, обеспечиваемой введенной в состав штамма плазмидой pH-CMV1-HGFopt или pH-CMV1-AGPopt.
Штаммы-продуценты XL1Blue-HGFopt и XL1Blue-AGP opt для наработки плазмидных ДНК получали трансформацией исходного штамма Е. coli XL1-Blue плазмидой, соответственно, pH-CMV1-HGFopt или pH-CMV1-AGPopt, с последующим отбором рекомбинантных клонов на среде LB с ампициллином при 37°С.
Технология получения штаммов-продуцентов трансформацией исходного штамма плазмидой не зависит от типа плазмиды (pH-CMV1-HGFopt или pH-CMV1-AGPopt), поэтому проводили два идентичных процесса получения трансформированного штамма, содержащего одну из плазмид pH-CMV1-HGFopt или pH-CMV1-AGPopt.
Для получения компетентных клеток бактерии исходного штамма Е. coli XL1-Blue высевали в стерильную пробирку емкостью 15 мл, содержащую 5 мл среды LB (1 л среды LB содержит 10 г триптона, 5 г дрожжевого экстракта, 10 г NaCl, pH среды доводили до 7,5 при помощи 1 М NaOH и стерилизовали автоклавированием). Пробирку инкубировали в течение ночи при 37°С в воздушном термостате. Культуру бактерий перенесли в коническую стеклянную колбу емкостью 2 л, содержащую 400 мл среды LB и инкубировали в шейкере-инкубаторе при 37°C с покачиванием (300 об/мин) до того момента, когда оптическая плотность суспензии бактерий, измеренная при 600 нм, не составила 0,5. Далее суспензию клеток перенесли в охлажденные до 4°C центрифужные стаканы емкостью 250 мл и центрифугировали в рефрижераторной центрифуге при 3000 g в течение 30 мин при 4°С. Осадок клеток суспендировали в 200 мл охлажденного до 4°С стерильного раствора 50 мМ CaCl2 и инкубировали суспензию при 0°С (во льду) в течение 30 мин, после чего суспензию клеток снова перенесли в охлажденные до 4°С центрифужные стаканы и центрифугировали в рефрижераторной центрифуге при 3000 g в течение 30 мин при 4°С. Осадок клеток суспендировали в 40 мл охлажденного до 4°С стерильного раствора 50 мМ CaCl2, добавляли 6 мл стерильного глицерина, аликвотировали по 1 мл в ампулы для замораживания клеточных культур и замораживали в жидком азоте. Ампулы хранили при температуре минус 70°С.
Трансформацию компетентных клеток E. coli плазмидой проводили следующим образом. Ампулу с суспензией компетентных клеток, хранящуюся при минус 70°С, помещали в лед, дожидались размораживания, и 100 мкл суспензии переносили в стерильную пробирку емкостью 1,5 мл, находящуюся во льду. К суспензии бактерий добавили 1 мкл стерильного раствора 1 мкг/мл плазмидной ДНК в буфере ТЕ (10 мМ Tris-HCl, 0,2 мМ EDTA) и инкубировали в течение 15 мин при 0°С (во льду). Далее пробирку помещали в водяную баню с температурой воды 43°С и инкубировали в течение 60 сек. После инкубации суспензию бактерий перенесли на чашку Петри с микробиологическим агаром, приготовленным на среде LB и дополнительно содержащим 0,3 мг/мл ампициллина, и инкубировали в течение ночи при 37°С.
Колонии переносили в стерильные стеклянные колбы объемом 100 мл, содержащие 50 мл среды ТВ с 0,3 мг/мл ампициллина и инкубировали в шейкере-инкубаторе при 37°C с покачиванием (300 об/мин) в течение ночи для получения биомассы и измерения выхода плазмиды.
Синтез генов и плазмид осуществляли с помощью стандартной технологии и оборудования, применяемых для решения подобных задач в генной инженерии.
Модификация последовательности гена HGF проводилась таким образом, чтобы при ее включении в состав эукариотического вектора обеспечивался более высокий уровень экспрессии HGF в трансфицированных клетках.
Данный результат достигался модификацией природной последовательности гена HGF, в основе которой лежала вырожденность генетического кода. Последовательность модифицировали таким образом, чтобы триплеты нуклеотидов, кодирующие аминокислоты белковой последовательности фактора роста гепатоцитов, встречались в генах человека наиболее часто. При этом использовали опубликованные в открытых источниках данные по частотам встречаемости ко донов.
Дизайн оптимизированной последовательности нуклеотидов, кодирующей фактор роста гепатоцитов человека HGF, производили следующим образом. Используя частоты встречаемости кодонов, приведенные на вэб-сайте http://del.mediaglyphs.org/mg/bf/nucs_aa.html, среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природного гена HGF, выявляли такие, которые встречаются в генах человека наиболее редко. Выявленные редкие триплеты, а также соседние с ними триплеты меняли на триплеты, кодирующие ту же аминокислоту, но при этом встречающиеся в генах человека наиболее часто. Кроме того, с целью повышения стабильности матричной РНК HGF такими же методами из кодирующей белок области природного гена HGF удаляли сигналы разрушения мРНК "АТТТА" и сигналы полиаденилирования "ААТААА" (Barreau C., Paillard L., Osborne В.Н. Nucleic Acids Research, 2005, Vol. 33, pp. 7138-7150). В результате благодаря вырожденности генетического кода все аминокислоты природного гена HGF остались неизмененными. Получена последовательность нуклеотидов гена фактора роста гепатоцитов HGFopt, представленная на фиг. 1.
кДНК фактора роста гепатоцитов человека HGF получали методом RT-PCR с использованием в качестве матрицы суммарной РНК из печени человека и клонировали в экспрессионный вектор pcDNA3 (Invitrogen, США) с получением плазмиды pcDNA3-hHGF и в экспрессионный вектор pH-CMV1 с получением плазмиды pH-CMV1-hHGF. Плазмиду pH-CMV1-HGFopt, несущую оптимизированный ген HGFopt, получали методом генно-инженерного конструирования как описано ниже.
На первой стадии:
- химически синтезированную пару олигонуклеотидов
VEC01 (AGCTTGGCATTCCGGTACTGTTGGTAAAGCCACCATG) и
VEC02 (GTACCATGGTGGCTTTACCAACAGTACCGGAATGCCA) отжигали, смешивали и клонировали в расщепленный рестриктазами HindIII и Асс65I вектор pUC19 с получением промежуточной плазмиды pUC-KNA;
- химически синтезированную пару олигонуклеотидов
VEC03 (GCCATGGAGATCTG) и VEC04 (AATTCAGATCTCCATGGCTGCA) отжигали, смешивали и клонировали в расщепленный рестриктазами PstI и EcoRI вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSKN.
На второй стадии проводили серию реакций амплификации с использованием плазмиды pcDNA3-hHGF в качестве матрицы и пар химически синтезированных олигонуклеотидов:
- HGF3F (GCGGATCCATGTGGGTGACCAAGCTGCTG) и
HGF4R (GGGCGGGGTCGATCTTGATCAGGGTGGTC),
- HGF5F (GATCAAGATCGACCCCGCCCTGAAGATCAAGACC) и
HGF6R (GTTCCTGGTACATCTATTGGCACACTGGTC),
- HGF7F (GCCAATAGATGTACCAGGAACAAGGGCCTGCCATTC) и
HGF8R (GCTGGGCCCTGCAGGTCCTTGCCCCGGTAGCTGGAAGGCAGAAAGC),
- HGF11F (CGGAGCTCATGCАТССAGGGCCAGGGCGAGGGCTAC) и
HGF12R (GGATTCCGGCAGTAGTTCTCCCGCAGGTCC),
- HGF13F (GGACCTGCGGGAGAACTACTGCCGGAATCC) и
HGF14R (GGCCAGATCTGGTCTGGGACAGGTTGCC),
- HGF15F (GACCAGATCTGGCCTGACCTGTTCАА) и
HGF16R (GATGTGCCGGTGCAGGTCCTCCATG),
- HGF17F (GGACCTGCACCGGCACATCTTCTGG) и
HGF18R (GCGCCCGGGTGGTCCAGGTTCACGATGGTAGG),
- HGF21F (GCGAGCTCGAAGACCAAGCAGCTGCGGGTGGTGAACGGGATCCCAAC) и HGF22R (GCCGCAGATGTGCTTGTTTCTGTATCTCAGACTAACC),
- HGF23F (GAAACAAGCACATCTGCGGCGGCTCCCTGATCAAGGAG) и
HGF26R (GTAGTTAGGCAGGTCGATGGTGCTCACAAA),
- HGF25F (GATCAGATCTGGTGCTGATGAAGCTGGCCAGG) и
HGF26R (GTAGTTAGGCAGGTCGATGGTGCTCACAAA),
- HGF27F (ATCGACCTGCCTAACTACGGATGC) и
HGF28R (GCCACCCGCAGCAGGCCGTCGTAGTTGATCAGTCCAG),
- HGF29F (GACGGCCTGCTGCGGGTGGCCCACCTGTACATCATGGG) и
HGF30R (GCGAGCTCGAAGACCTTGTAGGTCAGGATGATCTTGTGGATCC) в качестве прямого и обратного праймеров.
В результате получали фрагменты ДНК, соответственно, HGF3-4, HGF5-6, HGF7-8, HGF11-12, HGF13-14, HGF15-16, HGF17-18, HGF21-22, HGF23-26, HGF25-26, HGF27-28, HGF29-30, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На третьей стадии проводили серию реакций амплификации с использованием
- фрагментов ДНК HGF3-4 и HGF5-6 в качестве матрицы и олигонуклеотидов HGF3F и HGF6R в качестве праймеров;
- фрагментов ДНК HGF5-6 и HGF7-8 в качестве матрицы и олигонуклеотидов HGF5F и HGF8R в качестве праймеров,
- фрагментов ДНК HGF11-12 и HGF13-14 в качестве матрицы и олигонуклеотидов HGF11F и HGF14R в качестве праймеров;
- фрагментов ДНК HGF15-16 и HGF17-18 в качестве матрицы и олигонуклеотидов HGF15F и HGF18R в качестве праймеров;
- фрагментов ДНК HGF21-22 и HGF23-26 в качестве матрицы и олигонуклеотидов HGF21F и HGF26R в качестве праймеров;
- фрагментов ДНК HGF25-26 и HGF27-28 в качестве матрицы и олигонуклеотидов HGF25F и HGF28R в качестве праймеров;
- фрагментов ДНК HGF27-28 и HGF29-30 в качестве матрицы и олигонуклеотидов HGF27F и HGF30R в качестве праймеров.
В результате получали фрагменты ДНК, соответственно, HGF3-6, HGF5-8, HGF11-14, HGF15-18, HGF21-26, HGF25-28, HGF27-30, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На четвертой стадии проводили реакции амплификации с использованием
- фрагментов ДНК HGF3-6 и HGF5-8 в качестве матрицы и олигонуклеотидов HGF3F и HGF8R в качестве праймеров;
- фрагментов ДНК HGF25-28 и HGF27-30 в качестве матрицы и олигонуклеотидов HGF25F и HGF30R в качестве праймеров.
В результате получали фрагменты ДНК, соответственно, HGF3-8 и HGF25-30, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На пятой стадии фрагмент ДНК HGF3-8
- расщепляли рестриктазами BamHI и ApaI и клонировали в расщепленный теми же рестриктазами вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSK-HGF3-8;
- фрагмент ДНК HGF11-14 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGF11-14;
- фрагмент ДНК HGF15-18 расщепляли рестриктазами BglII и SmaI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGF15-18;
- фрагмент ДНК HGF21-24 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGF21-24;
- фрагмент ДНК HGF25-30 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKNc получением промежуточной плазмиды pBSKN-HGF25-30.
Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На шестой стадии
- химически синтезированную пару олигонуклеотидов HGF9S (GGAGAACTACTGCCGGAACCC) и HGF10A (TCGAGGGTTCCGGCAGTAGTTCTCCTGCA), BamHI-SbfI фрагмент плазмиды pBSK-HGF3-8 и XhoI-EcoRI фрагмент плазмиды pcDNA3-hHGF клонировали в вектор pBluescriptII-SK+, расщепленный рестриктазами BamHI и EcoRI, с получением промежуточной плазмиды pBSK-HGF3-10Z;
- SacI-BglII фрагмент плазмиды pBSKN-HGF11-14 и BglII-SmaI фрагмент плазмиды pBSKN-HGF15-18 клонировали в вектор pBluescriptII-SK+, расщепленный рестриктазами SacI и SmaI, с получением промежуточной плазмиды pBSK-HGF11-18;
- химически синтезированную пару олигонуклеотидов
HGF31S (TACAAGGTGCCACAGTCCTGATATCTGCAGT) и
HGF32A (CTAGACTGCAGATATCAGGACTGTGGCACCT), SacI-BglII фрагмент плазмиды pBSKN-HGF21-24 и BglII-BbsI фрагмент плазмиды pBSKN-HGF25-30 клонировали в вектор pBluescriptII-SK+, расщепленный рестриктазами SacI и XbaI, с получением промежуточной плазмиды pBSK-HGF21-32.
Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На седьмой стадии
- химически синтезированную пару олигонуклеотидов HGF1S (CATGTGG) и HGF2A (GTCACCCA) и BstEII-Асс65I фрагмент плазмиды pBSK-HGF3-10Z клонировали в плазмиду pUC-KNA, расщепленную рестриктазами NcoI и Acc65I, с получением промежуточной плазмиды pUC-KHGF1-10Z;
- химически синтезированную пару олигонуклеотидов HGF19S (CGTGATCTCTTGCGCCAAGACCA) и HGF20A (TGCTTGGTCTTGGCGCAAGAGATCACG) и SacI-SmaI фрагмент плазмиды pBSK-HGF11-18 клонировали в плазмиду pBSK-HGF21-32, расщепленную рестриктазами SacI и BbsI, c получением промежуточной плазмиды pBSK-HGF11-32.
Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На восьмой стадии NcoI-Zsp2I фрагмент плазмиды pBSKN-HGF3-10Z и Zsp2I-Асс65I фрагмент плазмиды pBSKN-HGF11-32 клонировали в плазмиду pUC-KHGF1-10Z, расщепленную рестриктазами NcoI и Асс65I, с получением промежуточной плазмиды pUC-HGFopt.
Встраивание соответствующих последовательностей ДНК подтверждали рестриктным анализом полученной плазмиды.
На девятой стадии HindIII-SbfI фрагмент и SbfI-XbaI фрагмент плазмиды pUC-HGFopt клонировали в экспрессионный вектор pH-CMV1, расщепленный рестриктазами HindIII и XbaI, с получением плазмиды pH-CMV1-HGFopt. Правильность встраивания оптимизированного гена HGFopt и соответствие дизайну его нуклеотидной последовательности подтверждали рестриктным анализом и секвенированием полученной плазмиды.
Модификация последовательности гена ангиопоэтина-1 проведена таким образом, чтобы при ее включении в состав эукариотического вектора обеспечивался более высокий уровень экспрессии целевого белка в клетках, трансфецированных сконструированным вектором.
Дизайн оптимизированной последовательности нуклеотидов, кодирующей ангиопоэтин-1 человека, производили следующим образом. Используя частоты встречаемости кодонов, приведенные на вэб-сайте http://de1.mediaglyphs.org/mg/bf/nucs_aa.html, среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природного гена ангиопоэтина-1, выявляли такие, которые встречаются в генах человека наиболее редко. Выявленные редкие триплеты, а также соседние с ними триплеты меняли на триплеты, кодирующие ту же аминокислоту, но при этом встречающиеся в генах человека наиболее часто. Кроме того, с целью повышения стабильности матричной РНК ангиопоэтина-1 такими же методами из кодирующей белок области природного гена ангиопоэтина-1 удаляли сигналы разрушения мРНК "АТТТА" и сигналы полиаденилирования "ААТААА". В результате благодаря вырожденности генетического кода все аминокислоты природного гена ангиопоэтина-1 остались неизмененными.
Получена следующая последовательность нуклеотидов гена AGPopt ангипоэтина 1, представленная на фиг. 2.
кДНК ангиопоэтина-1 получали методом RT-PCR с использованием в качестве матрицы суммарной РНК из печени человека и клонировали в экспрессионный вектор pcDNA3 (Invitrogen, США) с получением плазмиды pcDNA3-hAGP и в экспрессионный вектор pH-CMV1 с получением плазмиды pH-CMV1-hAGP. Плазмиду pH-CMV1-AGPopt, несущую оптимизированный ген AGPopt, получали методом генно-инженерного конструирования, как описано ниже.
На первой стадии
- химически синтезированную пару олигонуклеотидов
VEC01 (AGCTTGGCATTCCGGTACTGTTGGTAAAGCCACCATG) и
VEC02 (GTACCATGGTGGCTTTACCAACAGTACCGGAATGCCA) отжигали, смешивали и клонировали в расщепленный рестриктазами HindIII и Асс65I вектор
pUC19 с получением промежуточной плазмиды pUC-KNA;
- химически синтезированную пару олигонуклеотидов
VEC05 (AGCTTGGCATTCCGGTACTGTTGGTAAAGCCACCATGG) и
VEC06 (GATCCATGGTGGCTTTACCAACAGTACCGGAATGCCA) отжигали, смешивали и клонировали в расщепленный рестриктазами HindIII и BamHI вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSK-KNB.
На второй стадии проводили серию реакций амплификации с использованием плазмиды pcDNA3-hAGP в качестве матрицы и пар химически синтезированных олигонуклеотидов
- AGP1F (GCGGATCCATGACCGTGTTCCTGTCCTTTGCCTTCCTGGCCG) и
AGP2R (GTGAATTCTCCAGCAGCTGGATCTCCAGCCGGGAGGTCTGATTCAGCACC),
- AGP39F (GAGCCCGGGGCTGGAAGGAATATAAAATGG) и
AGP40R (CCATCAGCTCAATTCTCAGCATG),
- AGP41F (CATGCTGAGAATTGAGCTGATGG) и
AGP42R (GTGGCCCTTCAGGTACAGCCTGTAGTTCTGCTTTTC),
- AGP43F (CAGAACTACAGGCTGTACCTGAAGGGCCACACTGG) и
AGP44R (GCACCGTGCAGGATCAGGCTGC),
- AGP45F (GCAGCCTGATCCTGCACGGTGC) и
AGP46R (CATCCTCCGGTCAGCATGAGG),
- AGP47F (CCTCATGCTGACCGGAGGATG) и AGP48R (CGGATCCATGGTTCTGGCCGGCAGTATAGAACATTCCATTCAGATTG в качестве прямого и обратного праймеров.
В результате получали фрагменты ДНК, соответственно, AGP1-2, AGP39-40, AGP41-42, AGP43-44, AGP45-46, AGP47-48, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На третьей стадии проводили реакцию амплификации с использованием фрагментов ДНК AGP39-40 и AGP41-42 в качестве матрицы и олигонуклеотидов AGP39F и AGP42R в качестве праймеров; а также реакцию амплификации с использованием фрагментов ДНК AGP45-46 и AGP47-48 в качестве матрицы и олигонуклеотидов AGP45F и AGP48R в качестве праймеров. В результате получали фрагменты ДНК, соответственно, AGP39-42 и AGP45-48, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На четвертой стадии проводили реакцию амплификации с использованием фрагментов ДНК AGP39-42 и AGP43-44 в качестве матрицы и олигонуклеотидов AGP39F и AGP44R в качестве праймеров; а также реакцию амплификации с использованием фрагментов ДНК AGP43-44 и AGP45-4