Электролитический способ получения наноразмерных порошков силицидов лантана
Иллюстрации
Показать всеИзобретение относится к электролитическому способу получения наноразмерных порошков силицидов лантана, включающему синтез силицидов редкоземельного элемента из расплавленных сред в атмосфере очищенного и осушенного аргона. Способ характеризуется тем, что синтез проводят из галогенидного расплава, в качества источника лантана используют безводный хлорид лантана, в качестве источника кремния - фторсиликат натрия, в качестве растворителя - эквимольную смесь хлоридов калия и натрия, при следующем соотношении компонентов, мас.%: хлорид лантана 1,0÷4,0, фторсиликат натрия 1,0÷5,0; остальное - эквимольная смесь хлоридов калия и натрия, причем процесс ведут при температуре 700°С и потенциалах электролиза относительно стеклоуглеродного электрода сравнения от -2,6 до -2,8 В. Техническим результатом является: получение наноразмерных порошков силицидов лантана; получение целевого продукта в чистом виде, за счет хорошей растворимости эквимольного расплава хлорида калия и хлорида натрия в воде и растворимости образующегося фторида лантана фторидом калия. 3 пр., 6 ил.
Реферат
Изобретение относится к получению нанопорошков силицидов лантана. Полупроводниковые свойства силицидов лантана в сочетании с их химической стойкостью, определяют возможность использования этих силицидов в качестве высокотемпературных полупроводниковых материалов, а также полупроводниковых материалов, эксплуатирующихся в агрессивных средах.
Известны способы получения силицидов редкоземельных металлов:
1. Г.В. Самсонов. Химия силицидов редкоземельных металлов. Успехи химии, 1982, T. XXXI, Вып.12, стр. 1478-1495;
2. Непосредственное соединение редкоземельных металлов с кремнием [R. Vogel, Ztschr. anorg. Chem., 61, 46 (1909)];
3. Восстановление оксидов редкоземельных металлов с кремнием [B.C. Нешпор, Г.В. Самсонов, ЖПХ, 33, 993 (1960)];
4. Электролиз расплавленных сред, содержащих редкоземельные металлы и кремний [M. Dodero, С. r., 199, 566 (1934); Bull. Soc. Chim. France, 17, 545 (1950)].
Недостатками предложенных методов является высокая температура синтеза и загрязнение побочными продуктами, энергозатратность, длительность процесса осуществления.
Наиболее близким способом получения являются высокотемпературный электрохимический синтез из расплавленных сред, содержащих редкоземельные металлы и кремний [О.А. Шкода, О.Г. Терехова, Ю.М. Максимов. Способ получения кристаллического силицида ниобия // Патент РФ №2243854 от 10.01.2005 г.].
Изобретение относится к порошковой металлургии, в частности к получению силицидов в режиме СВС. Исходные порошки кремния 40-400 мкм и ниобия менее 63 мкм берут в соотношении 1,33-1,38:1 для получения однофазного продукта и 1,44-1,69:1 для получения многофазного продукта. Осуществляют механическую активацию в инертной среде в течение 0,5-2 минут. Отношение массы порошка к массе шаров равно 1:20. Полученный порошок прессуют и локально нагревают в атмосфере аргона, инициируя экзотермическую реакцию образования силицида ниобия в режиме самоподдерживающего горения. Техническим результатом является получение однофазного кристаллического силицида ниобия.
Недостатком вышеизложенного метода является высокая температура синтеза и загрязнение побочными продуктами, в частности силикатами, а также невозможность получения индивидуальных фаз силицидов.
Задачей настоящего изобретения является получение наноразмерных порошков силицидов лантана, повышение скорости синтеза целевого продукта из расплавленного электролита.
Сущность изобретения заключается в том, что осуществляют совместное электровыделение лантана и кремния из галогенидного расплава на катоде и последующее взаимодействие их на атомарном уровне с образованием наноразмерных порошков силицидов лантана. Процесс осуществляется в трехэлектродной кварцевой ячейке, где катодом служит вольфрамовый стержень; анодом и одновременно контейнером - стеклоуглеродный тигель; электродом сравнения - стеклоуглеродный стержень. Синтез силицидов лантана проводят посредством потенциостатического электролиза из эквимольного расплава KCl-NaCl, содержащего трихлорид лантана и фторсиликат натрия в атмосфере очищенного и осушенного аргона. В качества источника лантана используют безводный трихлорид лантана, в качестве источника кремния - фторсиликат натрия, в качестве растворителя - эквимольную смесь хлоридов калия и натрия. Потенциостатический электролиз проводят на вольфрамовом катоде при потенциалах от -2,6 до -2,8 В относительно стеклоуглеродного электрода сравнения при температуре 700°С. Оптимальная продолжительность ведения процесса электролиза составляет 30÷120 мин. Полученную катодно-солевую грушу, состоящую из силицидов лантана, отмывают от фторида лантана фторидом калия.
Выбор компонентов электролитической ванны произведен на основании термодинамического анализа и кинетических измерений совместного электровыделения лантана и кремния из галогенидных расплавов. Из соединений лантана и кремния, не содержащих кислород, хлорид лантана и фторсиликат натрия являются достаточно низкоплавкими и хорошо растворимыми в эквимольном расплаве KCl-NaCl. Растворитель (эквимольный расплав KCl-NaCl) выбран из следующих соображений: напряжение разложения расплавленной смеси KCl-NaCl больше таковых для расплавов LaCl3 и Na2SiF6; хорошая растворимость в воде.
Пример 1
В стеклоуглеродный тигель объемом 40 мл помещают солевую смесь массой 34,32 г содержащую 0,34 г LaCl3 (1,0 мас. %); 0,34 г Na2SiF6 (1,0 мас. %); 14,80 г KCl (43,1 мас. %); 18,84 г NaCl (54,9 мас. %). Тигель с солевой смесью помещают в кварцевую ячейку и в атмосфере сухого аргона выдерживают до температуры расплавления системы. По достижении рабочей температуры 700°С в расплав опускают вольфрамовый катод, электролиз проводят при потенциале -2,7 В относительно стеклоуглеродного электрода сравнения (плотность тока 1,0 А/см2). Катодно-солевую грушу, состоящую из силицидов лантана, отмывают от фторида лантана фторидом калия. Размер частиц полученных порошков до 100 нм.
Пример 2
В стеклоуглеродный тигель объемом 40 мл помещают солевую смесь массой 34,32 г, содержащую 0,69 г LaCl3 (2,0 мас. %); 1,03 г Na2SiF6 (3,0 мас. %); 18,27 г KCl (53,24 мас. %); 14,33 г NaCl (41,76 мас. %). Тигель с солевой смесью помещают в кварцевую ячейку и в атмосфере сухого аргона выдерживают до температуры расплавления системы. По достижении рабочей температуры 700°С в расплав опускают вольфрамовый катод, электролиз проводят при потенциале -2,8 В относительно стеклоуглеродного электрода сравнения (плотность тока 0,8 А/см2). Катодно-солевую грушу, состоящую из силицидов лантана, отмывают от фторида лантана фторидом калия. Размер частиц полученных порошков до 100 нм.
Пример 3
В стеклоуглеродный тигель объемом 40 мл помещают солевую смесь массой 34,32 г, содержащую 1,03 г LaCl3 (3,0 мас. %); 1,72 г Na2SiF6 (5,0 мас. %); 17,69 г KCl (51,53 мас. %); 13,88 г NaCl (40,47 мас. %). Тигель с солевой смесью помещают в кварцевую ячейку и в атмосфере сухого аргона выдерживают до температуры расплавления системы. По достижении рабочей температуры 700°С в расплав опускают вольфрамовый катод, электролиз проводят при потенциале -2,6 В относительно стеклоуглеродного электрода сравнения (плотность тока 1,5 А/см2). Катодно-солевую грушу, состоящую из силицидов лантана, отмывают от фторида лантана фторидом калия. Размер частиц полученных порошков до 100 нм.
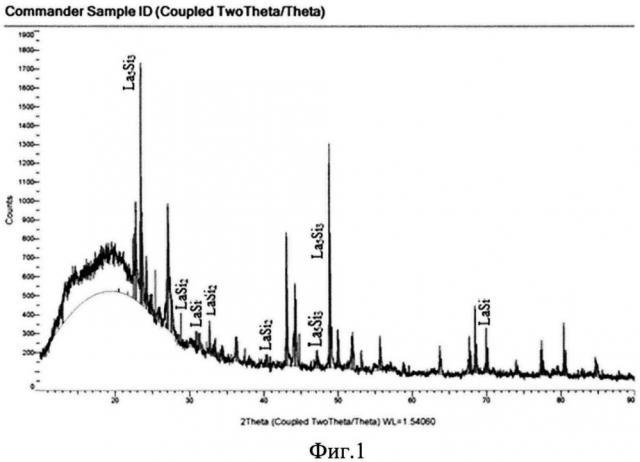
Фазовый состав идентифицирован методом рентгенофазового анализа на дифрактометре D2 Phaser, который показал наличие фаз La5Si3, LaSi2, LaSi, La5Si4 (изображение на фиг. 1, 3, 5).
Фиг. 1 - Рентгенограмма порошка силицидов лантана, полученного из расплава KCl-NaCl на вольфрамовом катоде при ϕ= -2,7 В.
Фиг. 3 - Рентгенограмма порошка силицидов лантана, полученного из расплава KCl-NaCl на вольфрамовом катоде при ϕ= -2,6 В.
Фиг. 5 - Рентгенограмма порошка силицидов лантана, полученного из расплава KCl-NaCl на вольфрамовом катоде при ϕ= -2,8 В.
Размер частиц определяли лазерным дифракционным анализатором Fritsch Analysette-22 (изображение на фиг. 2, 4, 6).
Фиг. 2 - Диаграмма распределения по размерам частиц, полученных при 700°С электрохимическим синтезом при i=1,0 А/см2.
Фиг. 4 - Диаграмма распределения по размерам частиц, полученных при 700°С электрохимическим синтезом при i=0,8 A/см2.
Фиг. 6 - Диаграмма распределения по размерам частиц, полученных при 700°С электрохимическим синтезом при i=1,5 А/см2.
Техническим результатом является:
- получение наноразмерных порошков силицидов лантана;
- получение целевого продукта в чистом виде, за счет хорошей растворимости эквимольного расплава хлорида калия и хлорида натрия в воде, а также растворимости образующегося фторида лантана фторидом калия.
Электролитический способ получения наноразмерных порошков силицидов лантана, включающий синтез силицидов редкоземельного элемента из расплавленных сред в атмосфере очищенного и осушенного аргона, отличающийся тем, что синтез проводят из галогенидного расплава, в качества источника лантана используют безводный хлорид лантана, в качестве источника кремния - фторсиликат натрия, в качестве растворителя - эквимольную смесь хлоридов калия и натрия, при следующем соотношении компонентов, мас.%:
хлорид лантана 1,0÷4,0
фторсиликат натрия 1,0÷5,0
остальное - эквимольная смесь хлоридов калия и натрия,
причем процесс ведут при температуре 700°С, и потенциалах электролиза относительно стеклоуглеродного электрода сравнения от -2,6 до -2,8 В.