Калибровочный реагент и способ
Иллюстрации
Показать всеГруппа изобретений относится к способу калибровки составного анализа, включающему: добавление калибровочного реагента, включающего по меньшей мере две различные связывающие молекулы, где каждая молекула обладает способностью специфичного связывания с агентом захвата и способностью связываться с детектирующей молекулой и где по меньшей мере две из связывающих молекул имеют различные специфичности и присутствуют в различных концентрациях, добавление детектирующей молекулы, детектирование связанной детектирующей молекулы, создание калибровочной кривой, включающей ряд калибровочных точек/интервалов. Также группа изобретений относится к набору реагентов и составной аналитической системе. Применение группы изобретений позволяет повысить точность результатов благодаря системной вариабельности систематических анализов в течение времени. 4 н. и 16 з.п. ф-лы, 7 ил., 4 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области составных анализов и, более конкретно, к составной аналитической системе, к способу калибровки составных анализов и к калибровочному реагенту.
Уровень техники
В однокомпонентных анализах аналит представляет собой химический компонент, измеренный в аналитической процедуре. В иммуноанализах аналит представляет собой либо антитело, либо антиген. Антитела представляют собой белки в крови, которые продуцируются иммунной системой для защиты против инородных тел, при этом инородные тела представляют собой антигены. Антитела связываются с антигенами. Антигены или антитела метят перед анализом для получения измеряемого сигнала. Эта метка может представлять собой фермент, радиоактивный изотоп или флуоресцеин. Сигналы, получаемые из иммуноанализа, могут представлять собой радиоактивность или эмиссию света. Эти сигналы обычно называют ответами. Иммуноанализ включает химические реакции между клиническими образцами, полученными от пациентов, и реагентами (т.е. химическими растворами), проводимыми в стандартных условиях. Результатом является ответ, который взаимосвязан с концентрацией аналита в образце. В конкурентном иммуноанализе аналит является немеченым и конкурирует с мечеными молекулами. Ответом является убывающая функция концентрации аналита. В неконкурентном иммуноанализе меченые молекулы связываются с аналитом, и ответом является возрастающая функция. В каждом случае точная взаимосвязь между ответом и концентрацией нуждается в оценке. Оценку называют калибровкой. Для калибровки требуются образцы с известными концентрациями. Эти специфичные образцы называют калибраторами или стандартами и, как правило, готовят их заранее. Например, один образец с известной высокой концентрацией может быть растворен в воде или в сыворотке животного с получением калибраторов с несколькими определенными более низкими концентрациями, перекрывающими интервал измерений. При обсуждении статистического расчета калибровки определенные концентрации калибратора называют расчетными точками. Так как калибраторы, но не образцы, готовят определенным образом, то калибраторы и клинические образцы могут реагировать немного различными путями. Обычно ряд известных образцов с неизвестными концентрациями анализируют вместе с калибраторами в процессе анализа. Калибровочную кривую строят относительно ответов калибраторов. Кривая может быть прямой линией или какой-либо другой линией монотонной функции. Ответы клинических образцов трансформируются в оценки концентрации с помощью построенной калибровочной кривой. Этот метод оценки концентраций образцов называют обратным прогнозом. Так как взаимосвязь между ответом и концентрацией может изменяться от анализа к анализу, то калибраторы часто включают в каждый процесс анализа для того, чтобы каждый раз проводить калибровку отдельно. Однако в некоторых системах предполагают, что связь является стабильной, в этом случае, калибровку проводят реже, например, только раз в месяц или при использовании новых партий реагентов (Forkman J., Doctoral Thesis, Swedish University of Agricultural Sciences, Uppsala, 2008, ISSN 1652-6880, ISBN 978-91-86195-13-7).
В данной области известны составные анализы, с помощью которых аналиты с множеством специфичностей детектируют в одном образце с использованием одной реакционной смеси реагентов. Важным компонентом этих анализов является калибровочная система, используемая для определения уровня реагента, т.е. антитела или биомаркера, который измеряют с помощью анализа. Классически эти уровни подтверждались с использованием ряда относительных единиц, в зависимости от степени количественной оценки, которая позволяется аналитической системой. В качественных анализах меченая молекула в образце сыворотки подтверждается как положительная или отрицательная на основе уровня измеренного ответного сигнала по сравнению с предварительно определенным положительным пороговым уровнем. В ряде полуколичественных анализов подтверждаются оба результата положительный/отрицательный, величина измеряемого сигнала (например, единицы люминесценции [ЛЕ], минивольты [мВ]), балльная оценка класса, приведенные или нормализованные сигналы (на основе систем балльной оценки), или процент контроля с самым низким сигналом (альтернативная система балльной оценки). Величина сигнала по упорядоченности относится к (но не прямо пропорционально) количеству молекулы, присутствующей в тестируемой сыворотке.
В данной работе авторы приводят в качестве примера три различных типа тестов составных анализов, известных в данной области:
1) анализ специфичного IgE;
2) анализ специфичного IgG; и
3) анализ неимуноглобулиновых биомаркеров (антигенов).
Характерные методы анализа специфичных иммуноглобулинов представляют собой 1) специфичный IgE-анализ с целью детектирования аллергии/гиперчувствительности, и 2) специфичный IgG-анализ с целью детектирования, например, аутоиммунных заболеваний или инфекционных заболеваний. Связанные с заболеванием антигены депонируются на микрочипе в определенных положениях. Эти антигены экспонируются с образцом пациента, содержащим иммуноглобулины, которые могут связываться с выбранным антигеном. Специфичный иммуноглобулин детектируют с помощью реагента, специфичного к иммуноглобулину (репортерная молекула), который взаимодействует со специфичным иммуноглобулином, и это взаимодействие может быть проанализировано посредством системы детектирования. Таким образом, возможно детектировать различные иммуноглобулины, специфичные к определенному антигену. Для теста типа 3), анализ неимуноглобулиновых биомаркеров (антигены), таких как сывороточные биомаркеры рака предстательной железы, молекулы, которые обладают способностью связываться с представляющими интерес баомаркерами, депонируются на микрочипе в определенных положениях. Депонированные молекулы могут, например, представлять собой биомаркер-специфичные антитела, ферменты или другие молекулы, которые комплементарны биомаркерам, представляющим интерес. Депонированные молекулы депонируют с образцом пациента, содержащим биомаркеры, которые могут связываться с выбранной депонированной молекулой. Специфичный биомаркер детектируют с помощью бимаркер-специфичного реагента (репортерная молекула), который взаимодействует со специфичным биомаркером, и это взаимодействие может быть проанализировано посредством системы детектирования.
Например, в области детектирования специфичного IgE, в документе WO 2002029415 A1 описан способ детектирования аллерген-специфичного иммуноглобулина в образце, и способ in vitro диагностики аллергий у индивидуума. Клинические проявления, такие как астма, поллиноз, атопическая экзема и желудочно-кишечные симптомы, развиваются после экспонирования со специфичными аллергенами. Определение профиля сенсибилизации к специфичному и/или перекрестно-реактивному аллергенному компоненту содействует более подробной оценке аллергического пациента.
Коммерчески доступное IgE-антитело может быть классифицировано в качественном, полуколичественном или в количественном анализе в зависимости от степени, до которой результаты анализа точно отражают количество IgE-антитела в тестируемом образце, и от требуемой точности анализа. Такие иммуноанализы традиционно измеряют либо суммарный сывороточный уровень IgE или уровень аллерген-специфичного IgE.
Однако в то время как различные технологические платформы выражают IgE-результаты практически в идентичных классах или единицах, при этом исследования показали различия между технологическими платформами в способности детектировать активность суммарного IgE и специфичного IgE (Wood R A et al, Ann Allergy Asthma Immunol. 2007, 99: 34-41).
В анализах количественной оценки IgE используют наиболее предпочтительные методы аналитической калибровки. Целью калибровочной части количественного анализа является определение взаимосвязи «доза-ответ» анализа, поэтому результаты ответа, полученные при тестировании сывороток пациентов, могут быть интерполированы в дозовые единицы, которые связаны с относительным количеством антитела IgE в сыворотке. Успешно использовались оба типа методов - гомологичной и гетерологичной интерполяции. Процедура гомологичной интерполяции стимулирует общий параллельный принцип анализов и максимизирует рабочий интервал анализа путем использования в процессе анализа одной и той же аллергенной твердой подложки, конструируя калибровочную кривую с IgE-антителом человека с такой же аллергенной специфичностью, какую хотят детектировать в тестируемой сыворотке. Как правило, пул эталонной сыворотки, содержащей IgE-антитело, разводят так же, как и тестируемый сывороточный IgE, обеспечивая, таким образом, параллельный принцип анализа. Основное ограничение данного способа заключается в требовании объемных количеств пулов сыворотки человека, которая содержит IgE-антитело, специфичное к каждой тестируемой аллергенной специфичности. Трудно поддерживать банк сыворотки, который может снабжать эти большие количества сыворотки человека с воспроизводимостью между лотами, особенно для менее распространенных аллергенных специфичностей. Благодаря ограничениям, которые имеет анализ, с использованием калибровки с гомологичной интерполяцией, получаемой в результате использования пулов лимитированной сыворотки человека, содержащей IgE-антитело, гетерологичная интерполяция калибровочной кривой суммарного IgE используется в качестве стратегии калибровки для современных количественных анализов IgE-антитела, которые включают сотни различных аллергенных специфичностей. Система гетерологичной интерполяции стала промышленным стандартом. В системе гетерологичной интерполяции построение калибровочной кривой суммарного сывороточного IgE проводится одновременно с этапом анализа определения аллерген-специфичного IgE с использованием IgE-калибратора, который доступен в WHO 75/502 стандарте (I/LA20-A2 Аналитические рабочие характеристики и клиническая применимость иммунологических анализов для антител иммуноглобулина E человека (IgE) и определенных аллергенных специфичностей; одобренное руководство, ISBN No. 1-56238-695-6).
ImmunoCAP ISAC® представляет собой in vitro диагностический тест с использованием технологии микрочипа. Тест обеспечивает одновременное измерение определенных молекул в одном тесте, с использованием всего нескольких микролитров жидкости, например, образца сыворотки или плазмы. Он может использоваться для анализа любого биомаркера, включая IgE, IgG и неимуноглобулиновых биомаркеров (антигены).
Например, в случае анализа специфичных IgE-антител путем применения ImmunoCAP ISAC® специфичный IgE (sIgE) чип обеспечивает результаты для более сотни компонентов более чем из 50 аллергенных источников. Аллергенные компоненты, которые иммобилизованы на твердом субстрате в формате микрочипа, реагируют со специфичным IgE в образце пациента. После промывки от не специфичного IgE добавляют флуоресцентно меченное антитело против IgE человека с образованием комплекса. После инкубации не связанные флуоресцентно меченные антитела против IgE человека удаляют путем промывки. За этой процедурой следует измерение флуоресценции с использованием соответствующего для микрочипа сканера. Чем более высокая величина ответа, тем больше специфичного IgE присутствует в образце.
Результаты теста анализируют с помощью программного обеспечения Phadia® Microarray Image Analysis (MIA) и рассчитывают стандартизированные единицы ISAC для специфичного IgE (ISU-E) (Protein microarrays for the diagnosis of allergic diseases: state-of-the-art and future development, Clinical Chemical Laboratory Medicine, Volume 43, Issue 12, Pages 1321-1326).
Результаты представлены в полуколичественном виде в четырех классах (0=не детектируется или очень низкий, 1=низкий, 2=от умеренного до высокого, 3=очень высокий). Программное обеспечение Phadia MIA Software автоматически осуществляет расчет.
Калибровку микрочипа ImmunoCAP ISAC® осуществляют против собственного эталонного препарата или калибровочного реагента, и измеренные концентрации IgE-антитела выражают в виде относительных единиц; стандартизованные единицы ISAC для IgE (ISU-E). Собственно эталонный препарат ImmunoCAP ISAC® калибруют против ImmunoCAP специфичного IgE (с концентрацией антитела, выраженной в виде кило-единиц IgE на литр; кЕдA/л), который стандартизируют против эталонного препарата WHO 75/502 для IgE (Hamilton R G, Assessment of human allergic diseases. In: Clinical Immunology, Principles and Practice, ed. Rich R R, 3rd ed, 2008, p. 1471-84; see page 1476).
ImmunoCAP ISAC® также может использоваться аналогичным образом для анализа специфичного IgG и/или других биомаркеров (антигены и антитела).
Настоящая система калибровки, как правило, включает независимую калибровку каждого антигена по отношению к соответствующему специфичному антителу. Это может быть проиллюстрировано с помощью скринингового анализа Biorad’s Bioplex ANA, который использует составной алгоритм иммуноанализа и который определяет присутствие клинически релевантных циркулирующих антител в сыворотке или в плазме. В то же время это является примером второго типа составных анализов, как указано выше, т.е. анализ специфичного IgG. Система Bioplex использует формат составного анализа на основе гранул, и калибровочный процесс описан ниже: «В то время как идентичность окрашенных гранул определяется с помощью флуоресценции красителей, количество антитела, захваченного антигеном, определяется с помощью флуоресценции прикрепленного PE» (т.е. фикоэритрин; флуоресцентная детектирующая молекула). «Исходные данные рассчитываются относительно интенсивности флуоресценции (RFI) и соотношения флуоресценции (FR). Три дополнительные окрашенные гранулы, гранула внутреннего стандарта (ISB), гранула подтверждения сыворотки (SVB) и гранула пустого контроля (BB) присутствуют в каждой реакционной смеси для подтверждения ответа детектора, добавления сыворотки или плазмы в реакционную камеру и отсутствия значительного неспецифичного связывания в сыворотке или плазме. См. Руководство по эксплуатации системы BioPlex 2200 для более подробной информации. Прибор калибруется с использованием набора из шести (6) различных калибровочных пробирок, поставляемых отдельно Bio-Rad Laboratories. Для дцДНК, шесть (6) пробирок, представляющих шесть (6) различных уровней концентраций антитела, используются для количественной калибровки, и результаты для образцов пациентов выражены в МЕд/мл. результаты sA МЕд/мл являются отрицательными, 5-9 МЕд/мл промежуточные, и результаты 10 МЕд/мл или выше предполагаются положительными для дцДНК антитела. Для других двенадцати (12) гранул, четыре (4) пробирки, представляющие четыре (4) различные концентрации антител, используются для полуколичественной калибровки. Результаты для каждого из этих антител выражаются в виде антительного коэффициента (АК). АК 1 указывает на пороговую концентрацию антитела, которая соответствует приблизительно 99 процентилю значений, полученных из здоровой популяции; результаты 1 или выше подтверждаются как положительные. Результаты <1 подтверждаются как отрицательные» (Biorad, Bioplex 2200 Ana Screen SIO(k) Summary, FDA 510(k), SIO(k) Number k041658).
Третий тип составных анализов включает анализ неимуноглобулиновых биомаркеров (антигенов), например, биомаркеров рака предстательной железы. Это является примером, в котором традиционный однокомпонентный иммуноанализ превращается в составной формат. Это приведено в качестве примера посредством нескольких анализов на основе гранул, а также ограниченного составного формата с использованием различных твердых чипов. Во всех этих анализах существенным является то, что каждый индивидуальный тест калибруется отдельно, что имеет тенденцию к повышению трудоемкости и громоздкости при проведении составных форматов.
Beckman Coulter описывает калибровку своего анализа Access Hybritech free PSA, который представляет собой анализ свободной формы биомаркера PSA рака предстательной железы, в виде набора из 5 различных стандартных точек и один негативный образец, суммарно состоящий из 6 различных калибровочных интервалов. Также очевидно, что концентрации свободного PSA зависят от стандарта, используемого для калибровки анализа (Beckman Coulter, Inc., 2010, A85087C, Access Hybritech free PSA).
В настоящее время, как описано выше, калибровка иммуноанализов для детектирования различных типов молекул, как правило, делает необходимым проведение калибровки с несколькими образцами для каждого теста, включая образцы для калибровки, содержащие различные калибровочные молекулы. Следовательно, такой метод калибровки является времязатратным и может быть неточным благодаря системной вариабельности систематических анализов в течение времени.
Задачей настоящего изобретения является предоставление эталонного препарата или калибровочного реагента, который исключает или по меньшей мере уменьшает указанные выше проблемы, связанные с известными в настоящее время методами.
Краткое описание фигур
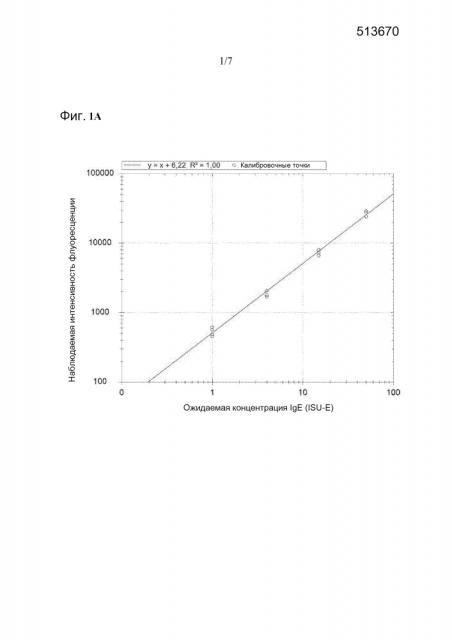
На фиг. 1A и B показаны калибровочные кривые, полученные путем осуществления анализа ImmunoCAP ISAC® sIgE на калибровочном реагенте, включающем 15 различных химерных антител согласно примеру 1 (ниже). Четыре калибровочные точки локализованы в 1, 4, 15 и 50 ISU-E. Калибровочные кривые дают корреляцию между наблюдаемой интенсивностью флуоресценции (ось y) и ISAC стандартизированными единицами для специфичного IgE (ISU-E), относительные единицы (ось x). Точки, изображенные на диаграмме, представляют собой калибровочные точки. На фиг. 1A используемое уравнения представляет собой y=x+6,22 R2=1. На фиг. 1B используемое уравнения представляет собой ln(FI)=5,87+1*ln(ISU-E) R2=0,99.
На фиг. 2A и B показаны графики корреляции для различных аллергенных компонентов, где калибровочный реагент согласно примеру 1 (ниже) использовался для расчета значений ISU-E. Прямая линия символизирует трансформированное приведение log к log. Черные точки на фигуре представляют IgE-антитело, специфичное к Phl p 5 (фиг. 2A) и к Bet v 1 (фиг. 2B), соответственно, детектированным в образцах пациента, проверяемых в анализе ImmunoCAP ISAC® sIgE, и по сравнению с эталонным методом, анализ ImmunoCAP sIgE. На фиг. 2A показан график корреляции для аллергенного компонента Phl p 5. Двумерное приведение ISU/chiplot с помощью kUA/l Phl p 5. Log(ISU/chiplot)=0,1735344+0,8732028*Log(kUA/l).
На фиг. 2В показан график корреляции для аллергенного компонента Bet v 1. Двумерное приведение ISU/chiplot с помощью kUA/l Bet v 1. Log(ISU/chiplot)=0,4851362+0,8967003*Log(kUA/l).
На фиг. 3 показаны калибровочные кривые, полученные путем осуществления анализа ImmunoCAP ISAC® sIgG пять раз на калибровочном реагенте, включающем пять суммарных сывороток человека от пациентов с ревматоидным артритом согласно примеру 2 (ниже). Калибровочные кривые дают корреляцию между наблюдаемой интенсивностью флуоресценции (ось y) и ISAC стандартизированными единицами для специфичного IgG, относительные единицы (ось x) в графике log/log. Стрелки на фигуре представляют выбранные намеченные калибровочные интервалы/точки.
На фиг. 4 показаны средние значения наблюдаемой интенсивности флуоресценции (ось y) и ISAC стандартизированных единиц для специфичного IgG, относительные единицы (ось x) на графике ln/ln, на основе результатов, представленных на фиг.3.
На фиг. 5 показаны пять калибровочных кривых, полученных путем проведения анализа ImmunoCAP ISAC® антигенных биомаркеров на калибровочном реагенте, включающем пять различных антигенных биомаркеров рака предстательной железы согласно примеру 3 (ниже). Калибровочные кривые дают корреляцию между наблюдаемой интенсивностью флуоресценции (ось y) и ISAC стандартизированными единицами для специфичных антигенных биомаркеров, относительные единицы (ось x). На фигуре изображены четыре различных интервала, разделенных тонкими пунктирными линиями. Диагональная жирная пунктирная стрелка представляет рассчитанное среднее значение на основе взаимосвязи между всеми 20 стандартными точками. Тонкие стрелки, протянувшиеся между калибровочными кривыми и жирная пунктирная стрелка иллюстрируют, что каждая калибровочная кривая независимо от динамического интервала и интервала концентраций может быть описана, в данном случае, в виде функции от всех 20 различных стандартных точек.
Термины
Подразумевается, что все термины, используемые в настоящем описании, имеют свои обычные значения. Для ясности некоторые термины будут дополнительно описаны ниже.
«Составной анализ» понимают как обозначение процедуры, с помощью которой детектируют аналиты с множеством специфичностей и в некоторых случаях оценивают количественно в одном образце сыворотки с использованием одной реакционной смеси реагентов. Например, составной анализ может представлять собой такой анализ, который измеряет IgE-антитело для множества аллергенных специфичностей с использованием одной реакционной стадии. Одна иллюстрация составного IgE-анализа представляет собой микрочип-тест на основе чипа, в котором индивидуальные очищенные аллергены (часто рекомбинантные по своей природе) адсорбированы в виде спотов в трех копиях на силиконовом микрочипе. Инкубация небольшого количества сыворотки с микрочипом экспонирует сыворотку пациента одновременно с множеством различных аллергенных специфичностей. После буферной промывки для удаления несвязанных сывороточных белков, связанный IgE затем детектируют с помощью конъюгата антитела против IgE человека и с последующим добавлением субстрата.
Термин «агент захвата» понимают как молекулу, способную прямо или косвенно связываться с представляющим интерес аналитом. Агент захвата может представлять собой антиген, такой как аллерген, в случае, когда аналит представляет собой IgE-антитела.
«Детектирующая молекула» определяется как структура с двумя существенными признаками, т.е. 1) обладает способностью специфичного связывания с агентом захвата, и 2) обладает характерным детектируемым признаком. Примеры детектирующих молекул представляют собой: антитело с вариабельным и константным участком, аптамер, состоящий из ДНК, но с определенной связывающей структурой, бактерия с поверхностным антигеном, который связывается и который содержит ДНК, которая может быть помечена и может детектироваться. Антитела, специфичные к IgE человека, как известно, используются в качестве детектирующих молекул в анализах на суммарные и на аллерген-специфичные IgE-антитела. Эти ключевые реагенты придают специфичность анализам, и, таким образом, они должны быть высокоспецифичными по отношению к уникальным детерминантам на тяжелых цепях эпсилон. После очистки поликлональные или моноклональные реагентные антитела против IgE человека либо используются непосредственно в виде растворенного антитела, либо подвергаются химической модификации в форме радиоактивного мечения или химической или физической иммобилизации на твердофазных матрицах.
Согласно настоящему изобретению под «связывающей молекулой» понимают обозначение молекулы, которая обладает двумя существенными признаками, т.е. 1) способностью специфично связываться с агентом захвата и 2) способностью связываться с детектирующей молекулой. Иммуноглобулины и их фрагменты представляют собой примеры таких связывающих молекул. Другие примеры включают клеточные рецепторы, растворимые рецепторы и их лиганды, и дополнительные пептидные биомаркеры и белковые биомаркеры, такие как антигенные биомаркеры.
Сущность изобретения
Настоящее изобретение решает приведенные выше проблемы, связанные с калибровкой составных анализов для детектирования связывающих молекул, таких как иммуноглобулины индивидуально и/или в комбинации с другими связывающими молекулами.
Настоящее изобретение относится к способу калибровки составного анализа, включающему:
добавление калибровочного реагента к твердой фазе, на которой иммобилизовано множество агентов захвата,
необязательно, промывку подложки для удаления несвязанного калибровочного реагента,
добавление детектирующей молекулы, которая имеет способность связываться с калибровочным агентом,
необязательно, промывку твердой подложки для удаления несвязанной детектирующей молекулы,
детектирование связанной детектирующей молекулы,
с созданием, таким образом, калибровочной кривой, включающей ряд калибровочных точек/интервалов,
отличающемуся тем, что калибровочный реагент включает по меньшей мере две различные связывающие молекулы, где каждая связывающая молекула обладает способностью специфичного связывания с агентом захвата, иммобилизованным на твердой подложке, и способностью связываться с детектирующей молекулой, и где по меньшей мере две из связывающих молекул присутствуют в различных концентрациях в калибровочном реагенте, представляя, таким образом, различные калибровочные точки/интервалы в калибровочной кривой.
В одном из вариантов осуществления агенты захвата иммобилизованы в ряде спотов на твердой подложке.
В другом варианте осуществления твердая подложка представлена в форме гранул, на которых иммобилизованы агенты захвата. Такие гранулы могут присутствовать в жидкой фазе.
В одном из вариантов осуществления способа связывающие молекулы представляют собой рекомбинантные антитела, нативные антитела, такие как аутоантитела, или пептидные/белковые биомаркеры, такие как антигенные биомаркеры.
В более конкретном варианте осуществления способа связывающие молекулы представляют собой химерные антитела, такие как химерные антитела мышь-человек, включающие вариабельный домен тяжелой цепи аллерген-специфичного моноклонального IgG мыши и тяжелую цепь IgЕ человека.
В одном из вариантов осуществления способа множество агентов захвата представляет собой по меньшей мере 5 различных агентов захвата, например, по меньшей мере 10, по меньше мере 50 или по меньше мере 100 различных агентов захвата.
В одном из вариантов осуществления способа агенты захвата представляют собой компоненты аллергена, такие как нативные или рекомбинантные компоненты аллергена, или связанные с заболеванием антигены, такие как антигенные компоненты, связанные с инфекционным заболеванием или с аутоиммунным заболеванием, или антитела, специфичные к пептидным/белковым биомаркерам.
В одном из вариантов осуществления способа детектирующая молекула представляет собой антииммуноглобулиновый конъюгат, такой как конъюгат антитела против IgE человека, или конъюгат антитела против IgG человека, или антитело, специфичное к пептидному/белковому биомаркеру.
В одном из вариантов осуществления способа связывающие молекулы представляют собой рекомбинантные антитела, предпочтительно химерные IgE-антитела, агенты захвата представляют собой аллергенные компоненты, такие как нативные или рекомбинантные аллергенные компоненты, и детектирующая молекула представляет собой конъюгат антитела против IgE человека.
В другом варианте осуществления связывающие молекулы представляют собой нативные антитела, предпочтительно аутоантитела IgG, агенты захвата представляют собой связанные с заболеваниями антигены, такие как антигенные компоненты, связанные с инфекционным или аутоиммунным заболеванием, предпочтительно с аутоиммунным заболеванием, и детектирующая молекула представляет собой конъюгат антитела против IgG человека.
Еще в одном из вариантов осуществления способа связывающие молекулы представляют собой пептидные/белковые биомаркеры, предпочтительно биомаркеры рака предстательной железы, агенты захвата представляют собой антитела, специфичные к указанным пептидным/белковым биомаркерам, и детектирующие молекулы представляют собой антитела против указанных пептидных/белковых биомаркеров.
В одном из вариантов осуществления способа калибровочный реагент включает по меньшей мере 5, например, по меньшей мере 10, например, по меньшей мере 15 различных связывающих молекул, таких как рекомбинантные антитела, нативные антитела, такие как аутоантитела или пептидные/белковые биомаркеры.
В более конкретном варианте осуществления способа, где калибровочный реагент включает по меньшей мере 5, например, по меньшей мере 10, например, по меньшей мере 15 различных химерных IgE-антител, где каждое химерное антитело обладает способностью специфично связываться с аллергенным компонентом, выбранным из группы, состоящей из Bet v 1, Der p 2, Ole e 1, Gal d 1, Art v 1, Fel d 1, Phl p 1, Amb a 1, Can f 1, Der p 1, Gal d 2, Can f 2, Can f 5, Phl p 5 и Pru p 3.
В одном из вариантов осуществления способа составной анализ осуществляют на микрочипе.
Согласно второму аспекту настоящего изобретения составная аналитическая система для детектирования представляющей интерес молекулы, такой как (a) иммуноглобулин или (b) пептидный/белковый биомаркер, присутствующий в биологическом образце, включающая:
реакционную камеру,
множество агентов захвата, иммобилизованных на твердой подложке,
детектирующую молекулу, такую как (a) детектирующая молекула в виде антитела против иммуноглобулина или (b) детектирующая молекула, связывающая пептидный/белковый биомаркер,
калибровочный реагент,
реакционный буфер,
отличающаяся тем, что калибровочный реагент включает по меньшей мере две различные связывающие молекулы, где каждая связывающая молекула обладает способностью специфичного связывания с агентом захвата, иммобилизованным на твердой подложке, и способностью связываться с детектирующей молекулой, и где по меньшей мере две из связывающих молекул присутствуют в различных концентрациях в калибровочном реагенте.
Реакционная камера может быть представлена в форме пластиковой (полиэтиленовой) или стеклянной пробирки, лунки пластикового микропланшета, пластиковой планки, полиэтиленовой крышки с внутренним губчатым матриксом и углеводного с филаментным покрытием силиконового чипа.
В одном из вариантов осуществления агенты захвата иммобилизованы в ряде спотов на твердой подложке. Альтернативно, твердая подложка представлена в форме гранул, на которых иммобилизованы агенты захвата. Такие гранулы могут присутствовать в жидкой фазе.
В одном из вариантов осуществления системы представляющая интерес молекула представляет собой (i) IgE-антитело или (ii) IgG-антитело, или (iii) пептидный/белковый биомаркер заболевания, такого как рак.
В одном из вариантов осуществления системы детектирующая молекула представляет собой (i) конъюгат антитела против IgE человека, (ii) конъюгат антитела против IgG человека или (iii) антитело, специфичное к пептидному/белковому биомаркеру.
В одном из вариантов осуществления системы биологический образец представляет собой образец сыворотки или плазмы.
В одном из вариантов осуществления системы калибровочный реагент включает по меньшей мере 5, например, по меньшей мере 10, например, по меньшей мере 15 различных связывающих молекул.
В одном из вариантов осуществления системы связывающие молекулы представляют собой рекомбинантные антитела, такие как химерные антитела, нативные антитела, такие как аутоантитела или пептидные/белковые биомаркеры.
В одном из вариантов осуществления системы агенты захвата представляют собой компоненты аллергена, такие как нативные или рекомбинантные компоненты аллергена, или связанные с заболеванием антигены, такие как антигенные компоненты, связанные с инфекционным заболеванием или с аутоиммунным заболеванием, или антитела, специфичные к пептидным/белковым биомаркерам.
В одном из вариантов осуществления системы связывающие молекулы представляют собой рекомбинантные антитела, предпочтительно химерные IgE-антитела, агенты захвата представляют собой аллергенные компоненты, такие как нативные или рекомбинантные аллергенные компоненты, и детектирующая молекула представляет собой конъюгат антитела против IgE человека.
В одном из вариантов осуществления системы связывающие молекулы представляют собой нативные антитела, предпочтительно аутоантитела IgG, агенты захвата представляют собой связанные с заболеваниями антигены, такие как антигенные компоненты, связанные с инфекционным или аутоиммунным заболеванием, предпочтительно с аутоиммунным заболеванием, и детектирующая молекула представляет собой конъюгат антитела против IgG человека.
Еще в одном из вариантов осуществления системы связывающие молекулы представляют собой пептидные/белковые биомаркеры, предпочтительно биомаркеры рака предстательной железы, агенты захвата представляют собой антитела, специфичные к указанным пептидным/белковым биомаркерам, и детектирующие молекулы представляют собой антитела против указанных пептидных/белковых биомаркеров.
В одном из вариантов осуществления системы калибровочный реагент включает по меньшей мере пятнадцать различных химерных IgE-антител, где каждое химерное антитело обладает способностью специфично связываться с аллергенным компонентом, выбранным из группы, состоящей из Bet v 1, Der p 2, Ole e 1, Gal d 1, Art v 1, Fel d 1, Phl p 1, Amb a 1, Can f 1, Der p 1, Gal d 2, Can f 2, Can f 5, Phl p 5 и Pru p 3.
Настоящее изобретение дополнительно относится к калибровочному реагенту, содержащему по меньшей мере два различных химерных антитела, где каждая связывающая молекула обладает способностью специфичного связывания по меньшей мере с одним из аллергенных компонентов, перечисленных в таблице 1.
В одном из вариантов осуществления калибровочный реагент содержит по меньшей мере 5, например, по меньшей мере 10, например, по меньшей мере 15 различных химерных IgE антител мышь-человек.
В другом варианте осуществления каждое химерное IgE-антитело мышь-человек обладает способностью специфично связываться с аллергенным компонентом, выбранным из группы, состоящей из Bet v 1, Der p 2, Ole e 1, Gal d 1, Art v 1, Fel d 1, Phl p 1, Amb a 1, Can f 1, Der p 1, Gal d 2, Can f 2, Can f 5, Phl p 5 и Pru p 3.
В одном из вариантов осуществления калибровочный реагент состоит из пятнадцати различных растворов химерных IgE-антител мышь-человек, где каждое химерное антитело обладает способностью специфично связываться с аллергенным компонентом, выбранным из группы, состоящей из Bet v 1, Der p 1, Ole e 2, Gal d 1, Art v 1, Fel d 1, Phl p 1, Amb a 1, Can f 1, Der p 1, Gal d 2, Can f 2, Can f 5, Phl p 5 и Pru p 3.
Калибровочный реагент по настоящему изобретению необязательно может включать консервант, такой как Kathon CG или азид натрия, или другие консерванты, известные специалистам в данной области.
В настоящем изобретении дополнительно предлагается набор реагентов, содержащий калибровочный реагент, описанный выше, который адаптирован для применения в способе калибровки, описанном выше.
Кроме того, настоящее изобретение относится к способу получения калибровочного реагента для составного анализа, включающему
предоставление по меньшей мере двух различных связывающих молекул, где каждая связывающая молекула обладает способностью специфичного связывания с агентом захвата, иммобилизованным на твердой аналитической подложке, и способностью связываться с детектирующей молекулой,
доведение концентрации указанных связывающих молекул до релевантного интервала измерения анализа,
приготовление смеси указанных молекул,
с получением, таким образом, калибровочного реагента.
Подробное описание изобретения
Настоящее изобретение относится к способу калибровки с наиболее эффективным использованием времени и калибровочному реагенту, содержащему смесь калибровочных молекул, включающих множество антигенов и/или биомаркер-связывающих сайтов в составной системе. Согласно настоящему изобретению калибровочные молекулы объединены в одном калибровочном образце и показано, что может применяться несколько связывающих молекул, присутствующих в одном растворе, включающем связывающие молекулы различной концентрации, а также с различной специфичностью.
В настоящее время в обычной ситуации с 6 различными иммуноанализами (калибровочные молекулы-мишени), требующими 5 калибровочных концентраций каждый, требуется проводить анализ 6×5=30 различных тестов. С помощью применения настоящего изобретения это уменьшается до минимума. Кроме того, анализ ряда объединенных калибровочных молекул, присутствующих при различных концентрациях, дает возможность установления относительной взаимосвязи между различными связывающими молекулами без потенциальной системной вариабельности системного анализа, что может быть результатом 30 различных индивидуальных анализов, которые необходимо проанализировать. Данное изобретение может таким образом уменьшать количес