Способ выявления возбудителей нозокомиальных оппортунистических инфекций и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей для оптимизации антибактериальной терапии
Иллюстрации
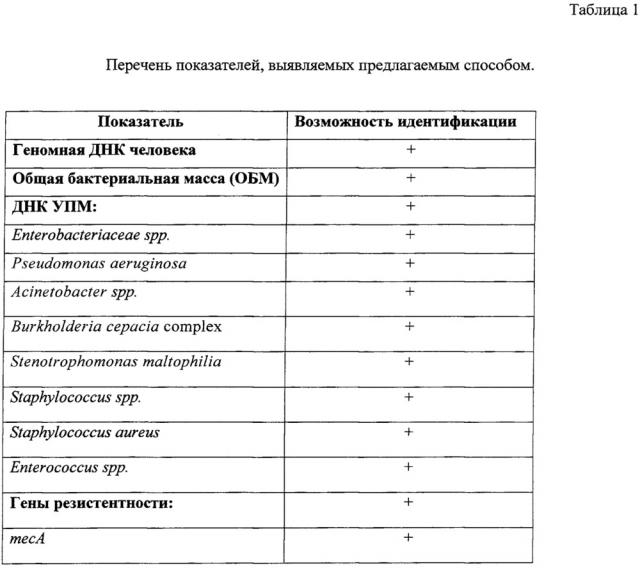
Показать всеИзобретение относится к области медицины, а именно к микробиологии, клинической лабораторной диагностике, молекулярной биологии, акушерству, гинекологии и неонатологии. Cпособ выявления возбудителей нозокомиальных оппортунистических инфекций и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей заключается в том, что выполняется ПЦР в режиме реального времени и определяются следующие показатели: наличие геномной ДНК человека, общая бактериальная масса, наличие ДНК УПМ, относящихся к восьми таксонам (семейство: Enterobacteriaceae, роды: Staphylococcus, Enterococcus, Acinetobacter, комплекс видов: Burkholderia cepacia, виды: Staphylococcus aureus, Pseudomonas aeruginosa, Stenotrophomonas maltophilia), а также 15 маркеров резистентности микроорганизмов к антибиотикам: mecA, vanA, vanB, blaTEM, blaSHV, blaCTX-M blaOXA23-подобные гены, blaOXA40-подобные гены, blaOXA48-подобные гены, blaOXA51-подобные гены, blaOXA58-подобные гены, blaNDM, blaVIM, blaKPC, blaIMP и по полученным данным осуществляют оптимальный выбор антибактериальных препаратов. 5 табл., 3 пр.
Реферат
Изобретение относится к области медицины, а именно к микробиологии, молекулярной генетике, клинической лабораторной диагностике, акушерству, гинекологии, неонатологии и педиатрии, может быть использовано для выявления основных возбудителей нозокомиальных оппортунистических инфекций и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам для выбора оптимальной стратегии лечения пациентов в медицинских учреждениях акушерского, гинекологического и неонатологического профиля. Кроме того, изобретение можно использовать в научно-исследовательской практике.
Резистентность микроорганизмов к антимикробным препаратам имеет огромное социально-экономическое значение и в развитых странах мира рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами, отличаются длительным течением, чаще требуют госпитализации, увеличивают продолжительность Пребывания больных в стационаре и ухудшают прогноз для пациентов. Это проблема в одинаковой степени касается как высокоразвитых и индустриальных, так и развивающихся стран. При неэффективности препаратов выбора приходится использовать средства второго или третьего ряда, которые, зачастую, более дороги, менее безопасны и не всегда доступны. Все это увеличивает прямые и непрямые экономические затраты, а также повышает риск распространения резистентных штаммов в обществе [1, 2]. В странах Европейского Союза ежегодно более 25 тыс. человек погибает от инфекций, вызванных устойчивыми бактериями, а финансовые затраты на лечение таких инфекций превосходят 1,5 млрд евро. В США ежегодное количество смертей приближается к 100 тыс., а экономический ущерб оценивается в еще более внушительную сумму: от 21 до 32 млрд долларов [1].
Эффективное лечение многих инфекционных заболеваний невозможно без данных о резистентности возбудителя. Наряду с этим, нередко при наличии in vitro чувствительности микроорганизма к антибиотику не удается получить клинический эффект от применения препарата. Это может быть связано как со свойствами данного микроорганизма, например, с формированием биопленок [3], так и с присутствием в ассоциации микроорганизмов, несущих гены резистентности. Таким образом, невозможность быстрого выявления устойчивых штаммов патогенных бактерий приводит к применению неадекватных схем противомикробной терапии и несет в себе риск распространения резистентных штаммов.
Условно-патогенные микроорганизмы (УПМ) - возбудители нозокомиальных оппортунистических инфекций - становятся основной причиной инфекционно- воспалительных заболеваний репродуктивной системы и приводят к тяжелым дисфункциям, акушерским инфекциям, послеродовым осложнениям. Нарушения репродуктивного здоровья населения являются одной из наиболее важных причин низкой рождаемости в нашей стране. Ключевыми составляющими репродуктивных неудач являются бесплодие, невынашивание беременности, преждевременные роды и, как следствие, патологии неонатального периода.
Получение данных о резистентности возбудителей нозокомиальных оппортунистических инфекций существенно повышает эффективность лечения подобных заболеваний. В эпоху нарастания лекарственной устойчивости ответственность за использование антибиотиков приобретает первостепенное значение. Одним из приоритетных направлений в диагностике инфекций является быстрота выявления возбудителя и определение его свойств.
Наиболее серьезную угрозу при этом представляют резистентные микроорганизмы, названные Американской ассоциацией по инфекционным заболеваниям как ESKAPE-патогены (от англ. «escape» - ускользать), поскольку они невосприимчивы к большинству антибактериальных препаратов и «ускользают» от их воздействия. К ним относят госпитальные штаммы Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa, Enterobacter spp., многие из которых обладают полирезистентностью к антибиотикам [4].
Многофакторность взаимодействия микроорганизмов с организмом человека и интенсивное развитие новых методических возможностей для микробиологических исследований диктует необходимость разработки инновационных комплексных диагностических инструментов, позволяющих оценить генетические свойства отдельно взятых клинически значимых штаммов УПМ, в частности, выявлять гены резистентности возбудителей нозокомиальных оппортунистических инфекций к антимикробным препаратам.
Классическим методом («золотым стандартом») выявления резистентных штаммов УПМ является культуральное исследование с определением видовой принадлежности микроорганизма и индикацией маркеров резистентности. Однако этот метод предполагает обязательное выделение чистой культуры и дополнительное тестирование антбиотикорезистентности по фенотипическим признакам, что пролонгирует получение конечного результата до 2-3-х суток в зависимости особенностей возбудителей и их состава.
Помимо культурального исследования существуют способы выявления резистентных штаммов с применением технологий молекулярной диагностики. В основе таких способов лежит метод полимеразной цепной реакции (ПЦР), суть которого состоит в том, что в исследуемый образец, предположительно содержащий тот или иной микроорганизм или ген, вносятся искусственно синтезированные нуклеотидные последовательности (праймеры), специфически комплементарные генетическому материалу искомого микроорганизма или гена. В процессе ПЦР при наличии искомого микроорганизма/гена нарастание концентрации специфических молекул ДНК происходит в геометрической прогрессии, и после 30-40 циклов она достигает значений, при которых становится возможной визуальная регистрация результатов реакции.
Способ позволяет в течение короткого времени (в течение несколько часов) идентифицировать любые микроорганизмы: аэробные и анаэробные; условно-патогенные и облигатно патогенные. Так, например, в соответствии с данными Европейских стандартов диагностики и лечения заболеваний, передаваемых половым путем (2004), чувствительность ПЦР в диагностике хламидийной инфекции составляет 70-95%, специфичность 97-99%. К достоинствам метода следует отнести возможность тестирования большого количества любых клинических образцов. Диагностическая ценность признана во всем мире и метод широко используется в лабораторной практике.
На рынке представлены диагностические продукты для выявления, как правило, отдельных возбудителей нозокомиальных и оппортунистических инфекций и генов, ассоциированных с резистентностью к антимикробным препаратам. При этом праймеры к генам резистентности чаще всего входят в состав отдельных тестов, каждый из которых позволяет определить резистентность к отдельным группам препаратов. Например, для идентификации генов металло-бета-лактамаз, принадлежащих к наиболее распространенным группам - VIM, IMP и основных подгрупп карбапенемаз OXA-типа, разработан ряд методов с использованием ПЦР [5-7].
Кроме того, существуют и комплексные способы выявления маркеров резистентности микроорганизмов к антимикробным препаратам. К примеру, существует метод мультиплексной ПЦР в режиме реального времени с последующим анализом кривых плавления полученных ампликонов для идентификации генов пяти групп металло-бета-лактамаз [8]. Но, как правило, метод мультиплексной ПЦР не позволяет одновременно детектировать большое количество генов [9]. Другая группа способов идентификации генов, обуславливающих резистентность микроорганизмов к антимикробным препаратам, основана на методе гибридизационного анализа на ДНК-микрочипах [9]. Существенную долю российского рынка диагностических продуктов для ПЦР-выявления генов, ассоциированных с резистентностью к антимикробным препаратам, занимают продукты трех компаний: ООО «Интерлабсервис» (Россия), НПФ «Литех» (Россия) и компании «Cepheid» (США). ООО «Интерлабсервис» предлагает отдельные наборы для ПНР-идентификации следующих генов: генов резистентности к метициллину и генов ряда карбапенемаз (VIM, IMP, NDM, KPC, ОХА-48). НПФ «Литех» предлагает наборы для определения генов бета-лактамаз классов ТЕМ, СТХ-М, SHV-5, SHV-12, VIM, NDM, ОХА-48, а также генов резистентности к метициллину (mecA) и ванкомицину (vanA, vanB). Компания «Cepheid» предлагает детектирующие амплификаторы серии «Gene Expert», которые работают с тест-наборами разных типов. Тест-наборы позволяют идентифицировать гены резистентности, относящиеся к следующим группам: бета-лактамазы (классов IMP-1, NDM, ОХА-48, VIM, КРС), гены резистентности к метициллину (mecA) и ванкомицину (vanA, vanB).
Все вышеперечисленные способы позиционируются как тесты для людей любого возраста, то есть не учитывают специфику выявления подобных заболеваний у женщин репродуктивного возраста и новорожденного ребенка. Поэтому представляется целесообразной и практически актуальной для использования в клинической практике разработка способа выявления маркеров резистентности возбудителей нозокомиальных и оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей.
Задачей изобретения является создание способа, предназначенного для выявления маркеров резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей путем анализа ДНК микроорганизмов, а также для выявления ДНК УПМ и избранных маркеров резистентности к бета-лактамным антибиотикам и гликопептидам. В качестве технологической основы выбран метод ПЦР с детекцией результатов в режиме реального времени, обладающий высокой специфичностью и чувствительностью. Кроме того, методы, основанные на ПЦР, позволяют получить результаты очень быстро, как, правило, в течение нескольких часов.
Представленный способ будет востребован сетью акушерских и гинекологических стационаров, перинатальными центрами, женскими консультациями, а также коммерческими медицинскими центрами и лабораториями. Кроме того, изобретение можно использовать в научно-исследовательской практике.
Использование изобретения позволяет получить следующий технический результат. Способ позволяет в короткие сроки (в течение двух часов) выполнить идентификацию основных возбудителей нозокомиальных оппортунистических инфекций и выявить маркеры их резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей. На основе полученных данных проводится оптимизация антибактериальной терапии.
Способ предназначен для выявления ДНК УПМ и избранных маркеров резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей методом ПЦР в режиме реального времени. Предлагается осуществлять идентификацию следующих показателей (табл. 1) в биоматериале: определение геномной ДНК человека (гена рецептора гормона роста) для контроля забора материала, общей бактериальной массы, специфической ДНК микроорганизмов, относящихся к восьми таксонам (семейство: Enterobacteriaceae, роды: Staphylococcus, Enter ococcus, Acinetobacter, комплекс видов: Burkholderia cepacia, виды: Staphylococcus aureus, Pseudomonas aeruginosa, Stenotrophomonas maltophilia) и пятнадцати маркерных локусов, позволяющих выявлять гены резистентности условно-патогенных микроорганизмов к бета-лактамным антибиотикам и гликопептидам.
Представляемый к патентованию способ отличается от других способов тем, что предлагает комплексное решение, учитывающее специфику выявления инфекционных заболеваний, вызванных УПМ у женщин репродуктивного возраста и новорожденных детей. Способ предполагает идентификацию как основных УПМ-возбудителей нозокомиальных оппортунистических инфекций, так и наиболее распространенных генов, обуславливающих резистентность УПМ к бета-лактамным антибиотикам и гликопептидам. Кроме того, изобретение отличается уникальным набором предоставляемых показателей. Предлагаемый способ включает в себя и аналитический компонент - алгоритм, позволяющий на основе результатов осуществить выбор оптимальной стратегии лечения для каждого отдельно взятого пациента.
Способ предусматривает идентификацию следующих таксонов бактерий:
1. Определение принадлежности бактерий к роду Staphylococcus.
2. Определение принадлежности бактерий к виду Staphylococcus aureus.
3. Определение принадлежности бактерий к роду Enterococcus.
4. Определение принадлежности бактерий к семейству Enterobacteriaceae.
5. Определение принадлежности бактерий к комплексу видов Burkholderia cepacia complex.
6. Определение принадлежности бактерий к роду Acinetobacter.
7. Определение принадлежности бактерий к виду Pseudomonas aeruginosa.
8. Определение принадлежности бактерий к виду Stenotrophomonas maltophilia.
В представленном способе предлагается идентификация следующих генов резистентности микроорганизмов к антибиотикам:
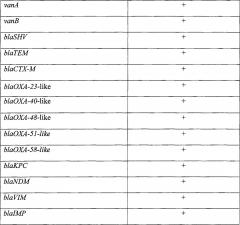
1. mecA. Ген, кодирующий бета-лактамазу у бактерий рода Staphylococcus. Среди всех антибактериальных препаратов бета-лактамы характеризуются наибольшим уровнем активности в отношении стафилококков и на настоящее время составляют основу терапии инфекций, вызванных стафилококками [10]. Ген mecA, входящий в состав мобильного генетического элемента «стафилококковая хромосомная кассета mec», кодирует дополнительный пенициллинсвязывающий белок ПСБ-2а, который обладает пониженной афинностью к бета-лактамным антибиотикам. В результате у стафилококков появляется устойчивость ко всему классу бета-лактамных антибиотиков (MRSA), маркером наличия которой и является ген mecA.
2. vanA и vanB. Опероны бактерий, относящихся к роду Enterococcus, состоящие как минимум из семи генов и обуславливающие резистентность бактерий к гликопептидным антибиотикам. Опероны vanA и vanB имеют сходную структуру, но степень гомологии генов, кодирующих регуляторные белки, у них довольно низкая и составляет всего 25-35%. Продукты двух генов, входящих в состав оперонов - vanS и vanR - кодируют систему регуляции экспрессии резистентности, продукты генов vanA, vanH и vanX - участвуют в процессе модификации концевого дипептида D-Ala-D-Ala на D-Ala-D-Lac, к которому аффинность гликопептидов резко снижена. Продукты экспрессии остальных генов, входящих в состав оперонов, не являются обязательными для приобретения устойчивости к гликопептидам. Гликопептидные антибиотики (ванкомицин и тейкопланин) широко используются при лечении энтерококковых инфекций, вызываемых штаммами микроорганизмов, устойчивых к бета-лактамным антибиотикам. Установление наличия резистентности к гликопептидным антибиотикам предполагает замену антибиотика для конкретного пациента. Выявление в геномах энтерококков оперонов vanA и/или vanB является маркером резистентности соответствующих штаммов бактерий к гликопептидам.
3. blaTEM. Группа генов, кодирующих бета-лактамазы грамотрицательных бактерий. Ферменты ТЕМ-1 и ТЕМ-2 наиболее эффективно гидролизуют различные пенициллины и значительно менее активны по отношению к цефалоспоринам. Другие разновидности бета-лактамаз, относящиеся к группе ТЕМ, наряду с пенициллинами, способны активно расщеплять и цефалоспорины I-IV поколений. При этом штаммы обладают фенотипом «бета-лактамазы расширенного спектра» (БЛРС). Для части ферментов, входящих в эту группу, их активность эффективно подавляется ингибиторами бета-лактамаз. Выявление в геномах грамотрицательных бактерий генов из группы blaTEM является маркером резистентности к пенициллинам и/или цефалоспоринам.
4. blaSHV. Группа генов, кодирующих бета-лактамазы грамотрицательных бактерий. По особенностям проявления резистентности ферменты этой группы бета-лактамаз сходны с ферментами группы blaTEM. Часть ферментов, относящихся к группе SHV, в том числе и SHV-1 способна расщеплять пенициллины, а ряд других разновидностей бета-лактамаз из группы SHV- и цефалоспорины I-IV поколений (фенотип БЛРС). Для большей части ферментов, входящих в эту группу, их активность эффективно подавляется ингибиторами бета-лактамаз. Выявление в геномах грамотрицательных бактерий генов из группы blaSHV является маркером резистентности к пенициллинам и/или цефалоспоринам.
5. blaCTX-M. Группа генов, кодирующих бета-лактамазы с плазмидной локализацией. Штаммы с генами из группы blaCTX-M так же проявляют фенотип БЛРС. Однако ферменты отличаются высокой скоростью гидролиза цефотаксима и низкой активностью по отношению к цефтазидиму. Выявление в геномах грамотрицательных бактерий генов из группы blaCTX-M является маркером резистентности к пенициллинам и цефотаксиму.
6. blaOXA-48-подобные гены (blaOXA-48-like). Группа генов, кодирующих бета- лактамазы у грамотрицательных бактерий. Гены бета-лактамаз, относящихся к группе OXA, в ряде случаев имеют низкий уровень гомологии нуклеотидной последовательности, поэтому бета-лактамазы OXA были выделены в отдельную группу скорее по фенотипическим, чем по генотипическим причинам. Часть OXA-ферментов обладает пенициллиназной активностью, часть - способна расщеплять также и цефалоспорины (фенотип штаммов - БЛРС) [11]. Бета-лактамазы, гомологичные ферменту OXA-48, нередко встречаются в грамотрицательных бактериях. Они не обладают способностью расщеплять цефалоспорины, но, как правило, обладают карбапенемазной активностью, то есть способны эффективно расщеплять карбапенемы. Выявление в геномах грамотрицательных бактерий генов из подгруппы blaOXA-48 является маркером резистентности к пенициллинам и карбапенемам.
7. blaOXA-40-подобв.ые гены (blaOXA-40-like). Аналогично описанной выше группе blaOXA-40-подобных генов, гены, относящиеся к группе blaOXA-40, кодируют карбапенемазы, но не обладают способностью расщеплять цефалоспорины. Выявление в геномах бактерий генов из подгруппы blaOXA-40 является маркером резистентности к пенициллинам и карбапенемам.
8. blaOXA-23-подобные гены (blaOXA-23-like). Аналогично группам blaOXA-48- и blaOXA-40-подобных генов, гены, относящиеся к группе blaOXA-23, также кодируют карбапенемазы, но не обладают способностью расщеплять цефалоспорины. Выявление в геномах бактерий генов из подгруппы blaOXA-23 является маркером резистентности к пенициллинам и карбапенемам.
9. blaOXA-51-подобные гены (blaOXA-51-like). Гены, относящиеся к группе blaOXA- 51, также кодируют карбапенемазы, но не обладают способностью расщеплять цефалоспорины. Выявление в геномах бактерий генов из подгруппы blaOXA-51 является маркером резистентности к пенициллинам и карбапенемам.
10. blaOXA-55-подобные гены (blaOXA-58-like). Гены, относящиеся к группе blaOXA- 58, также кодируют карбапенемазы, но не обладают способностью расщеплять цефалоспорины. Выявление в геномах бактерий генов из подгруппы blaOXA-58 является маркером резистентности к пенициллинам и карбапенемам.
11. blaNDM. Ген blaNDM-1 кодирует металло-бета-лактамазу, которая проявляет карбапенемазную активность. Ген имеет плазмидную локализацию и способен к быстрому переносу между бактериями. Выявление в геномах грамотрицательных бактерий гена blaNDM-1 является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
12. blaVIM. Кодирует металло-бета-лактамазу с карбапенемазной активностью. Выявление в геномах грамотрицательных бактерий гена blaVIM является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
13. blaKPC. Кодирует сериновую бета-лактамазу с карбапенемазной активностью. Выявление в геномах грамотрицательных бактерий гена blaKPC является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
14. blalMP. Группа генов, кодирующих металло-бета-лактамазы с карбапенемазной активностью. Гены имеют плазмидную локализацию, чаще всего встречаются у представителей семейства Enterobacteriaceae и у бактерий, относящихся к родам Pseudomonas и Acinetobacter. Выявление в геномах грамотрицательных бактерий генов из группы blaIMP является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
Идентификация специфических участков ДНК происходит с использованием метода ПЦР с детекцией результатов в режиме реального времени. Принцип метода полимеразной цепной реакции основан на использовании процесса амплификации ДНК, заключающегося в повторяющихся циклах температурной денатурации ДНК, отжига праймеров с комплементарными последовательностями и последующей достройке полинуклеотидных цепей с этих праймеров Taq-полимеразой.
Для повышения чувствительности и специфичности реакции предусмотрено применение «горячего» старта, который обеспечивается путем приготовления реакционной смеси, состоящей из двух слоев, разделенных прослойкой из парафина, что исключает неспецифический отжиг праймеров на ДНК-мишени при начальном прогреве пробирки.
В реакционную смесь для проведения ПЦР введены ДНК-зонды, каждый из которых несет флуоресцентную метку и гаситель флуоресценции. При образовании специфичного продукта ДНК-зонд разрушается, действие гасителя на флуоресцентную метку прекращается, что ведет к возрастанию уровня флуоресценции. Количество разрушенных зондов (а, следовательно, и уровень флуоресценции) возрастает пропорционально количеству образовавшихся специфических ампликонов и измеряется на каждом цикле амплификации.
Для проведения ПЦР используют детектирующие амплификаторы. После прохождения амплификации по показателю индикаторного цикла программное обеспечение прибора отмечает наличие общей бактериальной массы и присутствие в анализируемом образце ДНК избранных генов резистентности.
Способ лабораторной диагностики осуществляется следующим образом.
Для обследования у женщин используют соскобы эпителиальных клеток из влагалища (заднебоковые своды), цервикального канала, биоптат эндометрия, метроаспират, содержимое абсцесса, экссудат брюшной полости, кровь, мочу; у новорожденного - кровь, мочу, отделяемое глаз, содержимое везикулы, отделяемое пупочной ранки, содержимое венозного катетера. Биоматериал, взятый одноразовым стерильным зондом, помещают в одноразовую пластиковую пробирку с транспортной средой для реакции ПЦР. Из взятого биоматериала стандартными процедурами выделяют суммарные нуклеиновые кислоты.
В пробирки, каждая из которых содержит буфер для ПЦР, термостабильную ДНК- полимеразу, дезоксинуклеотидтрифосфаты, а также специфичные для каждого определяемого микроорганизма праймеры и флуоресцентные зонды, добавляют образец выделенных суммарных нуклеиновых кислот (ДНК). Реакция выполняется с наборами реагентов, обеспечивающими возможность исследования конкретных микроорганизмов: 1) реагенты для определения наличия общей массы бактериальной ДНК; 2) реагенты для определения бактерий, относящихся к восьми таксонам (семейство: Enterobacteriaceae, роды: Staphylococcus, Enterococcus, Acinetobacter, комплекс видов: Burkholderia cepacia, виды: Staphylococcus aureus, Pseudomonas aeruginosa, Stenotrophomonas maltophilia); 3) реагенты для определения генов резистентности; 4) реагенты для определения геномной ДНК человека (ген рецептора гормона роста).
Полимеразная цепная реакция выполняется на приборах, обеспечивающих техническую возможность постановки реакции ПЦР в режиме «реального времени». В результате исследования выдается отчет, в котором отражены результаты качественного определения каждого из показателей (табл. 1): наличие или отсутствие соответствующего показателя говорит о наличии/отсутствии соответствующего маркерного гена. Полученные результаты можно использовать при выборе оптимальной тактики лечения пациентов, а также в научно-исследовательских целях.
В результате сопоставления полученных данных с предлагаемыми критериями (таблица 2) можно определить чувствительность микроорганизмов к бета-лактамным антибиотикам и гликопептидам и выбрать оптимальную тактику лечения для конкретного пациента.
Примеры конкретного осуществления способа
Пример 1. Пациентка П., 32 лет, наблюдавшаяся в научно-консультативном отделении ФГБУ «НЦАГиП им. В.И. Кулакова» Минздрава России по поводу беременности, обратилась с жалобами на дизурию, учащенное мочеиспускание, боли в поясничной области, повышение температуры до 38°C. По данным анамнеза, у пациентки диагностирована осложненная форма инфекции мочевыводящих путей (ИМВП), ассоциированная с обструктивной уропатией, вызванной хронической мочекаменной болезнью, сопровождающаяся рецидивами. Ранее пациентке проводилась дистанционная ударно-волновая литотрипсия, стационарное лечение. По результатам клинического осмотра, наличию симптомов ИМВП на момент обращения и данных анамнеза, свидетельствующих об осложненной ИМВП, а также отягощенного акушерского анамнеза (замершая первая беременность в сроке 14 недель) пациентка госпитализирована в отделение патологии беременности. Назначено клиническое исследование мочи (общий анализ мочи, анализ мочи по Ничипоренко и микробиологический анализ мочи). Одновременно выполнено исследование мочи предлагаемым нами способом, позволившим провести индикацию ДНК возбудителя ИМВП, а также заявленных маркеров резистентности к антибиотикам методом ПЦР в режиме реального времени (таблица 3).
По данным ПЦР, выявлена ДНК микроорганизма, относящегося к семейству Enterobacteriaceae, также установлено, что выявленный возбудитель обладает генами антибиотикорезистентности из групп: blaSHV, blaTEM и blaCTX-М, указывающими на наличие БЛРС, т.е. устойчивость ко всем бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, азтреонаму), кроме карбапенемов. Параллельно выполнено культуральное исследование утренней средней порции мочи по стандартной методике с видовой идентификацией возбудителя и определением его чувствительности к антибиотикам. По данным микробиологического исследования, выявлена диагностически значимая (истинная) бактериурия: выделена Escherichia coli в титре более 51g КОЕ/мл мочи. Определение чувствительности к антибиотикам с использованием диско-диффузионного метода с учетом критериев интерпретации пограничных значений диаметров зон подавления роста (EUCAST, версия 5.0) показало, что выделенный штамм E. coli был полирезистентным, являясь продуцентом БЛРС (метод двойных дисков). Наличие БЛРС было подтверждено определением минимальных ингибирующих концентраций (МИК) при использовании карты AST N-101 для определения чувствительности к антибиотикам на бактериологическом анализаторе Vitek 2 (BioMerieux, Франция) в соответствии с критериями интерпретации CLSI. Пациентке назначено внутривенное введение меропенема: 0.5 г × 3 раза в сутки с положительным эффектом. Таким образом, получены идентичные результаты исследования бактериурии патентуемым методом и методом классической микробиологии, выступающим в роли референсного.
Пример №2. Ребенок 15-х суток жизни наблюдался в ОХРИН с диагнозом: врожденная диафрагмальная грыжа, 13-е сутки после оперативного вмешательства. На 10-е сутки после операции отмечались признаки системного воспалительного ответа (клинические и лабораторные). При культуральном исследовании крови выделен штамм Pseudomonas aeruginosa, чувствительный к карбапенемам. Была назначена эмпирическая терапия: тиенам + ванкомицин. Через 72 часа терапии клинического улучшения не отмечено. Кровь направлена на повторное культуральное исследование и ПЦР-исследование по предлагаемой методике. По данным ПЦР, выявлена ДНК Pseudomonas aeruginosa и Enterococcus spp., также обнаружены гены резистентности к антибиотикам: vanA и blaVIM, свидетельствующие об устойчивости Enterococcus spp. к гликопептидам, a Pseudomonas aeruginosa - ко всем бета-лактамным антибиотикам, включая карбапенемы (таблица 4).
Проведена коррекция антибиотикотерапии: к тиенаму добавлены линезолид и амикацин (до получения результатов культурального исследования). На фоне проводимой терапии отмечено клиническое улучшение состояния ребенка. Посев крови дал положительный результат: выделен штамм Pseudomonas aeruginosa, резистентный к карбапенемам, но чувствительный к амикацину, и Enterococcus faecalis, резистентный к ванкомицину. Проведена деэскалация антибиотикотерапии: отменен тиенам. Таким образом, результаты исследования крови методом ПЦР в режиме реального времени были подтверждены классическим микробиологическим методом. Более ранняя этиологическая диагностика с выявлением маркеров резистентности методом ПЦР позволила провести своевременную коррекцию антибактериальной терапии с положительным эффектом.
Пример №3. В ОРИТ новорожденных поступил ребенок 3-х суток жизни. Вес при рождении - 3251 г, оценка по шкале Апгар - 8-9 баллов, гестационный возраст - 39 недель. На 2-е сутки жизни появились клинические признаки конъюнктивита. Назначены глазные капли (гентамицин). На 3-й сутки отмечен подъем температуры до 38,5°C, брадикардия, тромбоцитопения (20 тысяч), нарастание уровня C-реактивного белка до 56 мг/мл. Ребенок переведен в ОРИТ, взята кровь на посев и на ПЦР-исследование. Начата антибиотикотерапия (комбинация ампициллина с гентамицином). По данным ПЦР крови, выявлен Staphylococcus aureus, содержащий ген резистентности mecA (таблица 5).
Проведена коррекция антибиотикотерапии с отменой комбинации ампициллина с гентамицином и назначением ванкомицина. Через сутки получена положительная гемокультура: выделен штамм Staphylococcus aureus, устойчивый к цефокситину. На 8-е сутки ребенок в удовлетворительном состоянии переведен в отделение патологии новорожденных. Таким образом, результаты исследования крови методом ПЦР в режиме реального времени были подтверждены культуральным методом. Более ранняя этиологическая диагностика с выявлением маркеров резистентности методом ПЦР позволила своевременно внести изменение в тактику антибактериальной терапии и достигнуть положительного эффекта.
Предложенный способ выявления основных возбудителей нозокомиальных оппортунистических инфекций и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам был изучен в ФГБУ «НЦАГиП им. В.И. Кулакова» Минздрава России. Проведенная работа состояла из двух этапов. На первом этапе на базе лаборатории была проведена видовая идентификация 752 штаммов УПМ, относящихся к 14 видам. Был произведен посев клинического материала, полученного в клинических отделениях, на соответствующие селективные питательные среды. Видовую идентификацию выделенных культур проводили методом MALDI-TOF-MS на масс-спектрометре Autoflex III с программным обеспечением MALDI-Biotyper, v. 3.0 (Bruker Daltonics, Германия). Идентификация УПМ предлагаемым способом проводилась из соответствующего клинического материала в лаборатории молекулярно-генетических методов исследования. Результаты сопоставления данных по идентификации УПМ, полученных культуральным методом и предлагаемым способом, представлены в таблице (таблица 6). По каждой позиции установлено полное соответствие полученных результатов.
На втором этапе была проведена идентификация генов резистентности предлагаемым способом у 28 референсных штаммов УПМ-штаммов, для которых набор генов резистентности был заранее известен. Результаты сопоставления данных по идентификации генов резистентности референсных штаммов УПМ предлагаемым способом представлены в таблице (таблица 7). Обнаруженные предлагаемым методом гены обозначены знаком «+», не обнаруженные - «-», если анализ не проводился - «н/п». При сравнении генов, обнаруженных предлагаемым способом, с генами, известными для референсных штаммов, установлено полное соответствие полученных результатов по каждой позиции.
Список литературы
1. Cocker R., Atun R., McKee M. Системы здравоохранения и проблемы инфекционных заболеваний. Опыт Европы и Латинской Америки. - Европейская обсерватория по системам и политике здравоохранения, 2009.
2. Руднов В.А., Вельский Д.В., Дехнич А.В. Инфекции в ОРИТ России: результаты национального многоцентрового исследования. Клиническая микробиология и антимикробная химиотерапия. 2011,13: 294-303.
3. Zhao G., Usui M.L. Biofilms and Iriflarnmation in Chronic Wounds. Adv Wound Care (New Rochelle). 2013, 2: 389-399.
4. Ионов O.B., Никитина И.В., Бурменская O.B., Непша О.С., Трофимов Д.Ю., Донников А.Е., Митрохин С.Д., Припутневич Т.В., Любасовская Л.А., Дегтярев Д.Н. Роль метода ПЦР в диагностике врожденных и нозокомиальных инфекций у новорожденных. Акушерство и гинекология. 2013, 11: 59-64.
5. Шевченко О.В., Эйделынтейн М.В., Степанова М.Н. Металло-β-лактамазы: значение и методы выявления у грамотрицательных неферментирующих бактерий. Клин, микробиол. антимикроб, химиотер. 2007, 9: 211-218.
6. Pitout J.D., Gregson D.B., Poirel L., et al. Detection of Pseudomonas aeruginosa producing metallo-beta-lactamases in a large centralized laboratory. J Clin Microbiol. 2005, 43: 3129-3135.
7. Woodford N., Ellington M. Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp. Int J Antimicrob Agents. 2006, 27: 351-353.
8. Mendes R.E., Kiyota K.A. Rapid detection and identification of metallo-beta-lactamase- encoding genes by multiplex real-time PCR assay and melt curve analysis. J Clin Microbiol, 2007, 45: 544-547.
9. Уляшова М.М., Халилова Ю.И., М.Ю. Рубцова и др. Олигонуклеотидный микрочип для идентификации генов карбапенемаз молекулярных классов А и D. Acta Naturae. 2010,2: 116-125.
10. Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам. Успехи биологической химии. 2004,44: 263-306.
11. Pfeifer Y., Cullik A., Witte W. Resistance to cephalosporins and carbapenems in Gram- negative bacterial pathogens. Int J Med Microbiol. 2010, 300: 371-379.
Способ выявления возбудителей нозокомиальных оппортунистических инфекций и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей для оптимизации антибактериальной терапии, отличающийся тем, что для выявления возбудителей и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам осуществляют постановку ПЦР в режиме реального времени и определяют следующие показатели: общая бактериальная масса, ДНК условно-патогенной флоры, относящейся к восьми таксонам: семейство Enterobacteriaceae, роды: Staphylococcus, Enterococcus, Acinetobacter, комплекс видов: Burkholderia cepacia, виды: Staphylococcus aureus, Pseudomonas aeruginosa, Stenotrophomonas maltophilia, а также 15 маркеров генов резистентности микроорганизмов к антибиотикам: mecA, vanA, vanB, blaTEM, blaSHV, blaCTX-М, blaOXA23-подобные гены, blaOXA40-подобные гены, blaOXA48-подобные гены, blaOXA51-подобные гены, blaOXA58-подобные гены, blaNDM, blaVIM, blaKPC, blaIMP и гена рецептора гормона роста, с помощью предлагаемого способа выявляют наличие/отсутствие маркерных генов резистентности к гликопептидным антибиотикам и бета-лактамным антибиотикам различных групп (антибиотикам пенициллинового ряда, цефалоспоринам, карбапенемам) и осуществляют оптимальный выбор антимикробных препаратов, применяемых для дальнейшего лечения пациентов.