Композиции и способы для β-глюкановой иммунотерапии
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения композиции для повышения иммунного ответа. Композиция для повышения иммунного ответа индивида на опухоль содержит: растворимый β-глюкановый компонент; антительный компонент, который специфично связывается с растворимым β-глюканом; и противоопухолевое антитело. В другом аспекте настоящее изобретение относится к способу повышения ответа индивида на β-глюкановую иммунотерапию. Использование данного изобретения позволяет повысить эффективность иммунотерапии у индивида на опухоль, увеличивая ответ индивида на терапию β-глюканом с противоопухолевым антителом, инициируя цитотоксичность нейтрофилов, макрофагов и естественных киллеров. 5 н. и 25 з.п. ф-лы, 11 ил., 3 пр., 1 табл.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки на патент США 61/640834, поданной 01 мая 2012 года, и предварительной заявки на патент США 61/640397, поданной 30 апреля 2012 года, каждая из которых включена в настоящую заявку в качестве ссылки.
Сущность изобретения
Настоящее изобретение в одном из аспектов относится к композиции, которая содержит β-глюкановый компонент и антительный компонент, который специфично связывается с β-глюканом. В некоторых вариантах осуществления изобретения β-глюкан может быть получен из дрожжей. В некоторых вариантах осуществления изобретения β-глюкан может включать β-1,3/1,6 глюкан, такой как β(1,6)-[поли-(1,3)-D-глюкопиранозил]-поли-β(1,3)-D-глюкопираноза.
В некоторых вариантах осуществления изобретения антительный компонент может включать моноклональное антитело, которое специфично связывается с β-глюканом. В некоторых вариантах осуществления изобретения моноклональное антитело может содержать BfD I, BfD II, BfD III или BfD IV.
В некоторых вариантах осуществления изобретения β-глюкановый компонент и антительный компонент могут находиться в одном препарате. В других вариантах осуществления изобретения β-глюкановый компонент и антительный компонент могут находиться в разных препаратах.
В другом аспекте настоящее изобретение относится к способу, который в основном включает совместное введение индивиду β-глюкана и препарата антител, который специфично связывается с β-глюканом. В некоторых вариантах осуществления изобретения способ дополнительно может включать введение индивиду противоопухолевого антитела.
В другом аспекте настоящее изобретение относится к способу повышения ответа индивида на β-глюкановую иммунотерапию. В основном, способ включает совместное введение индивиду композиции, содержащей β-глюкан и препарат антител, который специфично связывается с β-глюканом. В некоторых вариантах осуществления изобретения способ дополнительно может включать идентификацию индивида, как имеющего низкий уровень связывания, и введение индивиду композиции, содержащей β-глюкан и препарат антител, который специфично связывается с β-глюканом.
В некоторых вариантах осуществления любого из этих способов β-глюкан и препарат антител могут быть введены совместно одновременно. В других вариантах осуществления любого из этих способов препарат антител может быть введен совместно в разные моменты времени. В некоторых вариантах осуществления любого из этих способов β-глюкан и препарат антител могут быть введены совместно в различные области.
В некоторых вариантах осуществления способов β-глюкан может быть получен из дрожжей. В некоторых вариантах осуществления этих способов β-глюкан может содержать β-1,3/1,6 глюкан, такой как β(1,6)-[поли-(1,3)-D-глюкопиранозил]-поли-β(1,3)-D-глюкопираноза.
В некоторых вариантах осуществления способов антительный компонент может включать моноклональное антитело, которое специфично связывается с β-глюканом, такое как BfD I, BfD II, BfD III или BfD IV.
В другом аспекте настоящее изобретение относится к способу повышения ответа индивида на β-глюкановую иммунотерапию, с применением антитела. В основном способ включает введение индивиду композиции, которая содержит часть молекулы β-глюкана, конъюгированную с антителом. В некоторых вариантах осуществления изобретения часть молекулы β-глюкана может быть конъюгирована с терапевтическим антителом, таким как, например, противоопухолевое антитело. В некоторых вариантах осуществления изобретения способ дополнительно включает идентификацию индивида, как имеющего низкий уровень связывания β-глюкана.
В некоторых вариантах осуществления изобретения часть молекулы β-глюкана может быть получена из дрожжей. В некоторых вариантах осуществления изобретения часть молекулы β-глюкана может представлять собой или быть получена из β-1,3/1,6 глюкана, такого как β(1,6)-[поли-(1,3)-D-глюкопиранозил]-поли-β(1,3)-D-глюкопираноза.
В некоторых вариантах осуществления изобретения β-глюкановая терапия может включать введение индивиду β-глюкана, антитела, которое специфично связывается с β-глюканом, и терапевтического антитела. В некоторых случаях терапевтическое антитело может включать противоопухолевое антитело.
Изложенная выше сущность настоящего изобретения не предназначена для описания каждого раскрытого варианта осуществления или каждого варианта применения настоящего изобретения. Последующее описание более подробно раскрывает настоящее изобретение на примере иллюстративных вариантов осуществления изобретения. В некоторых местах текста данной заявки описание представлено списками примеров, эти примеры могут быть использованы в различных комбинациях. В каждом случае приведенный список служит только в качестве типичной группы и не должен рассматриваться как исчерпывающий список.
Краткое описание чертежей
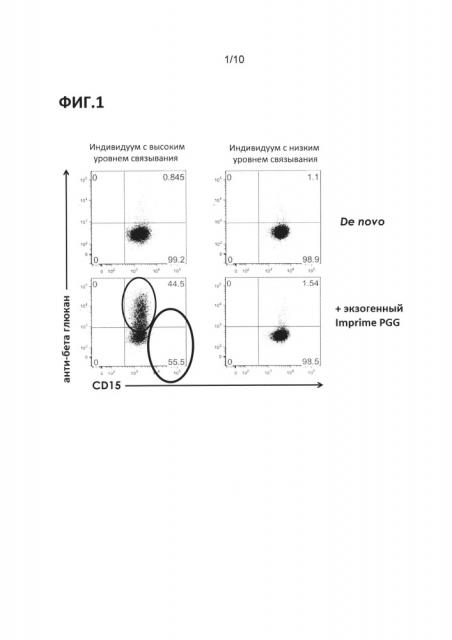
Фиг. 1. Данные проточной цитометрии, показывающие различное связывание β-глюкана (PGG) с полиморфоядерными лейкоцитами в цельной крови здорового человека.
Фиг. 2. Данные, показывающие различное связывание β-глюкана с нейтрофилами в цельной крови здорового человека.
Фиг. 3. Данные, показывающие различное связывание β-глюкана с моноцитами в цельной крови здорового человека.
Фиг. 4. Данные сравнения титров антител против β-глюкана у индивидов с низким уровнем связывания и высоким уровнем связывания.
Фиг. 5. Данные, показывающие, что сыворотка крови индивида с высоким уровнем связывания способна повысить связывание β-глюкана с ПМЛ, полученными от индивида с низким уровнем связывания.
Фиг. 6. Данные, показывающие, что антитела против β-глюкана способны повысить связывание β-глюкана с ПМЛ, полученными от индивида с низким уровнем связывания.
Фиг. 7. Данные, показывающие, что внутривенный иммуноглобулин способен повысить связывание β-глюкана с ПМЛ, полученными от индивида с низким уровнем связывания.
Фиг. 8. Данные, показывающие преобразование низкого уровня связывания у индивида в высокий уровень связывания путем лечения внутривенным иммуноглобулином, которое включает комбинацию β-глюкана и антител против β-глюкана.
Фиг. 9. Сравнение среднего числа дней терапии пациентов в контрольной и исследуемой группах двухгруппового, открытого, рандомизированного, многоцентрового клинического исследования.
Фиг. 10. Данные, показывающие связывание конъюгатов PGG-антитело с ПМЛ.
Фиг. 11. Данные, показывающие связывание конъюгатов PGG-ВВИГ с ПМЛ.
Подробное описание иллюстративных вариантов осуществления изобретения
В настоящем изобретении описаны способы, относящиеся к применению β-глюкана в качестве компонента иммунотерапии. Описанные в настоящем описании композиции и способы основаны на данных изучения различного связывания β-глюкана иммунными клетками в различных популяциях здоровых людей. Неожиданно было обнаружено, что индивиды с высоким уровнем связывания β-глюкана имеют более высокие титры антител против β-глюкана, по сравнению с индивидами с низким уровнем связывания. Таким образом, настоящее изобретение относится к композициям, которые включают β-глюкановый компонент и антительный компонент, который специфично связывается с β-глюканом. Настоящее изобретение также относится к способам, которые в основном включают совместное введение β-глюкана и антитела или антительного компонента, которые специфично связываются с β-глюканом, или части молекулы β-глюкана, конъюгированной с антителом или фрагментом антитела. Такие способы могут преобразовывать низкий уровень связывания у индивида в высокий уровень связывания, и таким образом увеличивать число лиц, для которых иммунотерапия, основанная на использовании β-глюкана, может оказаться эффективной.
β-Глюканы представляют собой полимеры глюкозы, полученные из различных микробиологических и растительных источников, включая, например, дрожжи, бактерии, микроскопические водоросли, водоросли, грибы, овес и ячмень. Из них β-глюканы дрожжей высоко ценятся за свои иммуномодулирующие свойства. Дрожжевые β-глюканы могут находиться в различных формах, таких как, например, дрожжи в неизменном виде, зимозан, очищенные частицы целого глюкана, солюбилизированный полисахарид зимозан или высокоочищенные растворимые β-глюканы различной молекулярной массы. Структурно дрожжевые β-глюканы состоят из глюкозных мономеров, организованных как основная цепь из молекул глюкопиранозы, связанных β-(1,3) связью, с периодическими β-(1,3) глюкопиранозными ответвлениями, связанными с основной цепью при помощи β-(1,6) гликозидных связей. Различные формы дрожжевых β-глюканов могут по-разному функционировать. На механизм, при помощи которого дрожжевые β-глюканы осуществляют свое иммуномодулирующее действие, могут оказывать влияние структурные различия между различными формами β-глюканов, такие как, например, их твердочастичная или растворимая природа, третичная структура, длина основной цепи, длина боковой цепи и частота боковых цепей. Иммуностимулирующие функции дрожжевых β-глюканов также зависят от участвующих во взаимодействии рецепторов в различных типах клеток у различных видов, которые опять же могут зависеть от структурных свойств β-глюканов.
В одном из аспектов настоящее изобретение относится к композиции, которая содержит в основном β-глюкановый компонент и антительный компонент, который специфично связывается с β-глюканом.
β-Глюкановый компонент может включать любую подходящую форму β-глюкана или любую комбинацию двух или более форм β-глюкана. Подходящие β-глюканы и получение подходящих β-глюканов из их природных источников описаны, например, в публикации заявки на патент США US 2008/0103112 A1. В некоторых вариантах осуществления изобретения β-глюкан может быть получен из дрожжей, таких как, например, Saccharomyces cerevisiae. В некоторых конкретных вариантах осуществления изобретения β-глюкан может представлять собой или быть получен из β(1,6)-[поли-(1,3)-D-глюкопиранозил]-поли-β(1,3)-D-глюкопиранозы, также именуемой в настоящем описании как PGG (IMPRIME PGG, Biothera, Inc., Eagan, MN), высокоочищенной и хорошо известной формы растворимого β-глюкана, полученного из дрожжей. Кроме того, β-глюкановый компонент может включать, например, модифицированный и/или дериватизированный β-глюкан, такой как те β-глюканы, которые описаны в Международной патентной заявке PCT/US 12/36795. В других случаях β-глюкановый компонент может включать, например, твердочастичный-растворимый β-глюкан или твердочастичный-растворимый препарат β-глюкана, каждый из которых описан, например, в патенте США 7981447.
Антительный компонент композиции может включать любой препарат антител, который специфично связывается с β-глюкановым компонентом композиции. Используемый в настоящем описании термин «специфично» и его варианты означает имеющий отличающуюся или не широкую (т.е. неспецифичную) аффинность в любой степени к конкретной мишени. Таким образом, антительный компонент может включать препарат поликлональных антител (например, полученных из сыворотки крови), препарат моноклональных антител или любой фрагмент антитела, такой как Fc-фрагмент. Примеры моноклональных антител, которые специфично связываются с β-глюканом, включают, например, моноклональные антитела, идентифицированные как BfD I, BfD II, BfD III и/или BfD IV (Biothera, Inc., Eagan, MN), каждое из которых описано в патенте США 6294321.
Антитело или фрагмент антитела (например, Fc-фрагмент), конъюгированное с β-глюкановым компонентом, может представлять собой любое подходящее антитело или фрагмент антитела, которое может связываться с β-глюкановым компонентом.
β-Глюкановый компонент, антительный компонент и/или комбинация обоих компонентов могут находиться в составе композиции вместе с носителем. Используемый в описании термин «носитель» включает любой растворитель, диспергирующую среду, наполнитель, оболочку, разбавитель, антибактериальное средство и/или противогрибковое средство, изотоническое средство, средство, замедляющее всасывание, буфер, раствор-носитель, суспензию, коллоидную систему и тому подобное. Использование таких сред и/или средств для фармацевтически активных веществ хорошо известно из уровня техники. За исключением случаев, когда любые стандартные среды или средства являются несовместимыми с β-глюканом или антителом, их использование в терапевтических композициях предполагается. Дополнительные активные ингредиенты также могут быть включены в состав этих композиций.
«Фармацевтически приемлемым» считается материал, который не является нежелательным с биологической или иной точки зрения, т.е. материал может вводиться индивиду вместе с β-глюканом и/или антителом, не вызывая нежелательных биологических эффектов, или без вредного взаимодействия с любым из других компонентов фармацевтической композиции, в которой он содержится.
β-Глюкановый компонент, антительный компонент и/или комбинация обоих компонентов могут находиться в составе фармацевтической композиции. В некоторых вариантах осуществления изобретения β-глюкановый компонент композиции и антительный компонент композиции могут находиться в составе одного препарата. В других вариантах осуществления изобретения β-глюкановый компонент и антительный компонент могут находиться в составе разных препаратов. Композиция может быть изготовлена в различных и/или многих формах, приспособленных к одному или нескольким предпочтительным способам введения. Таким образом, композиция может быть введена одним или несколькими известными способами, включая, например, пероральное, парентеральное (например, внутрикожное, чрескожное, подкожное, внутримышечное, внутривенное, внутрибрюшинное и т.д.) или местное (например, интраназальное, внутрилегочное, интрамаммарное, интравагинальное, внутриматочное, внутрикожное, чрескожное, ректальное и т.д.) введение. Композиция или ее часть может быть введена на поверхность слизистой оболочки, например, путем введения, например, на слизистую оболочку носа или дыхательных путей (например, в виде спрея или аэрозоля). Композиция или ее часть также может быть введена путем длительного или замедленного высвобождения.
В целях удобства препарат может быть получен в виде лекарственной формы с отдельными единицами дозы, и может быть получен способами, хорошо известными в области фармацевтики. Способы получения композиции с фармацевтически приемлемым носителем включают стадию приведения β-глюкана и/или антитела в контакт с носителем, который содержит один или более вспомогательных ингредиентов. В основном, препарат может быть получен путем равномерного и/или непосредственного приведения активного химического соединения в контакт с жидким носителем, тонко измельченным твердым носителем или им обоими, и затем, при необходимости, формования продукта в необходимые препараты.
β-Глюкановый компонент, антительный компонент и/или комбинация обоих компонентов могут находиться в любой подходящей форме, включая без ограничений раствор, суспензию, эмульсию, спрей, аэрозоль или любую форму смеси. Композиция может вводиться в рецептуру препарата с любым фармацевтически приемлемым вспомогательным веществом, носителем или наполнителем. Например, препарат может быть получен в виде стандартной лекарственной формы для местного применения, такой как, например, крем, мазь, аэрозольный препарат, неаэрозольный спрей, гель, лосьон и тому подобное. Препарат также может включать одну или несколько добавок, в том числе такие как, например, адъювант, средство, усиливающее проникновение через кожу, краситель, ароматизатор, вкусовая добавка, увлажнитель, загуститель и тому подобное.
В другом аспекте настоящее изобретение относится к способу, который в основном включает совместное введение индивиду в эффективных количествах друг с другом β-глюкана и препарата антител, который специфично связывается с β-глюканом. Используемый в настоящем описании термин «совместное введение» относится к двум или более компонентам комбинации, вводимым так, что терапевтическое или профилактическое действие этой комбинации может быть сильнее, чем терапевтическое или профилактическое действие каждого компонента, вводимого отдельно. Два компонента могут быть совместно введены одновременно или последовательно. Одновременно вводимые компоненты могут находиться в одной или нескольких фармацевтических композициях. Последовательное совместное введение двух или более компонентов включает случаи, в которых компоненты вводятся так, чтобы оба компонента оказались одновременно биодоступными после того, как они оба были введены. Независимо от того, является ли совместное введение компонентов одновременным или последовательным, компоненты могут быть совместно введены в одну область или в различные области. Также используемый в настоящем описании термин «эффективное количество» относится к количеству β-глюкана и антитела, которое специфично связывается с β-глюканом, эффективному для повышения связывания β-глюкана с иммунными клетками, например, полиморфоядерными лейкоцитами (ПМЛ), моноцитами или нейтрофилами, или для повышения синтеза цитокинов и/или хемокинов, имеющих отношение к связыванию с β-глюканом, например, синтеза IL-8.
β-Глюкан, подходящий для применения в способах, включает один или несколько из тех β-глюканов, которые описаны как подходящие для применения в качестве β-глюканового компонента композиций, описанного выше. Также препарат антител может включать одно или несколько антител, описанных как подходящих для применения в качестве антительного компонента композиций, описанного выше.
Количество β-глюкана и антитела, эффективное для того, чтобы вызывать один или несколько из желаемых эффектов, может варьировать в зависимости от различных факторов, включая без ограничений массу тела, физическое состояние и/или возраст индивида и/или способ введения. Таким образом, абсолютное количество β-глюкана и антитела, которое специфично связывается с β-глюканом, находящееся в данной лекарственной форме с отдельными единицами дозы, может колебаться в широком диапазоне и зависит от таких факторов, как вид, возраст, масса тела и физическое состояние индивида, а также способа введения. Соответственно, практически невозможно указать универсальное количество, которое представляет собой количество β-глюкана и антитела, эффективное для всех возможных применений. Однако специалисты в данной области техники легко могут определить надлежащее количество с учетом вышеуказанных факторов.
В некоторых вариантах осуществления изобретения способ может включать введение индивиду β-глюкана в количестве, достаточном для того, чтобы обеспечить дозу, например, от примерно 100 нг/кг до примерно 50 мг/кг, хотя в некоторых вариантах осуществления изобретения способы могут выполняться путем введения β-глюкана в дозе, находящейся за пределами этого диапазона. В некоторых вариантах осуществления изобретения способ включает введение индивиду β-глюкана в количестве, достаточном для того, чтобы обеспечить дозу от примерно 10 мкг/кг до примерно 10 мг/кг, такую как, например, доза примерно 1 мг/кг, примерно 2 мг/кг, примерно 3 мг/кг, примерно 4 мг/кг, примерно 5 мг/кг, примерно 6 мг/кг, примерно 7 мг/кг, примерно 8 мг/кг, примерно 9 мг/кг или примерно 10 мг/кг. В одном конкретном варианте осуществления изобретения способ включает введение β-глюкана в количестве, достаточном для того, чтобы обеспечить дозу примерно 4 мг/кг.
В альтернативном варианте доза может быть рассчитана с использованием значения фактической массы тела, измеренного непосредственно перед началом курса лечения. Для дозировок, рассчитанных таким образом, площадь поверхности тела (м2) вычисляют непосредственно перед началом курса лечения по методу Дюбуа: м2 = (масса в кг0,425 × рост в см0,725) × 0,007184. Таким образом, в некоторых вариантах осуществления изобретения способ может включать введение β-глюкана в количестве, достаточном для того, чтобы обеспечить дозу, например, от примерно 0,01 мг/м2 до примерно 10 мг/м2.
В некоторых вариантах осуществления изобретения способ может включать введение индивиду антитела, которое специфично связывается с β-глюканом, в количестве, достаточном для того, чтобы обеспечить дозу, например, от примерно 100 нг/кг до примерно 50 мг/кг, хотя в некоторых вариантах осуществления изобретения способы могут выполняться путем введения антитела в дозе, находящейся за пределами этого диапазона. В некоторых вариантах осуществления изобретения способ включает введение индивиду антитела в количестве, достаточном для того, чтобы обеспечить дозу от примерно 10 мкг/кг до примерно 5 мг/кг, например, дозу от примерно 100 мкг/кг до примерно 1 мг/кг. В некоторых вариантах осуществления изобретения антитело, которое специфично связывается с β-глюканом, может быть введено в виде внутривенного иммуноглобулина (ВВИГ), продукта крови, содержащего объединенный поливалентный IgG от многих доноров (как правило, многих сотен и даже тысяч доноров, и, таким образом, естественным образом содержащий антитела против β-глюкана). В таких вариантах осуществления изобретения ВВИГ может быть введен в дозе от примерно 0,1 г/кг до примерно 2,0 г/кг, такой как, например, 0,1 г/кг, 0,2 г/кг, 0,3 г/кг, 0,4 г/кг, 0,5 г/кг, 0,6 г/кг, 0,7 г/кг, 0,8 г/кг, 0,9 г/кг, 1,0 г/кг, 1,1 г/кг, 1,2 г/кг, 1,3 г/кг, 1,4 г/кг, 1,5 г/кг, 1,6 г/кг, 1,7 г/кг, 1,8 г/кг, 1,9 г/кг или 2,0 г/кг. В определенных вариантах осуществления изобретения ВВИГ может быть введен в дозе от примерно 0,4 г/кг до примерно 1,0 г/кг.
В альтернативном варианте доза может быть рассчитана с использованием значения фактической массы тела, измеренного непосредственно перед началом курса лечения. Для дозировок, рассчитанных таким образом, площадь поверхности тела (м2) вычисляют непосредственно перед началом курса лечения по методу Дюбуа: м2 = (масса в кг0,425 × рост в см0,725) × 0,007184. Таким образом, в некоторых вариантах осуществления изобретения способ может включать введение антитела в количестве, достаточном для того, чтобы обеспечить дозу, например, от примерно 0,01 мг/м2 до примерно 10 мг/м2.
В некоторых вариантах осуществления изобретения β-глюкан и антитело могут совместно вводиться, например, от одной дозы до нескольких доз в неделю, хотя в некоторых вариантах осуществления изобретения способ может быть выполнен путем совместного введения β-глюкана и антитела с частотой, находящейся за пределами этого диапазона. В определенных вариантах осуществления изобретения β-глюкан и антитело могут вводиться с частотой от примерно одного раза в год до одного раза в неделю.
Как отмечалось выше, дрожжевые β-глюканы высоко ценятся за свои иммуномодулирующие свойства. Однако авторы настоящего изобретения обнаружили, что существуют различные популяции индивидов: одна популяция обладает относительно высокой способностью связывания β-глюкана с первоначальными иммунными клетками в цельной крови; другая популяция обладает относительно низкой способностью связывания β-глюкана с первоначальными иммунными клетками в цельной крови. Это наблюдение оказалось полностью неожиданным с точки зрения данных, полученных на мышиных моделях иммунитета и в ходе исследований с использованием изолированных иммунных клеток человека. Многие индивиды изначально обладают некоторым уровнем связывания β-глюкана с иммунными клетками, низким уровнем подверженности воздействию β-глюканов (например, Фиг. 1, «De novo»). При введении экзогенного β-глюкана, у индивидов, имеющих низкий уровень связывания, имеет место умеренное увеличение процента первоначальных иммунных клеток, связывающих β-глюкан, в то время как у индивидов, имеющих высокий уровень связывания, имеет место значительное увеличение процента первоначальных иммунных клеток, связывающих β-глюкан (Фиг. 1, «+Экзогенный PGG»). На Фиг. 1 и Фиг. 2 приведены данные, отражающие связывание β-глюкана с полиморфоядерными лейкоцитами (ПМЛ), и на Фиг. 3 (моноциты) показано, что различное связывание также имеет место в случае других популяций иммунных клеток. Кроме того, у индивидов, имеющих высокий уровень связывания, также имеет место тенденция к синтезу большего количества цитокинов и/или хемокинов, таких как, например, IL-8, MCP, MIP-1 и т.д.
Используемый в настоящем описании термин «статус индивида, имеющего высокий уровень связывания» относится к индивиду, который обладает заранее определенным процентным содержанием популяции конкретных иммунных клеток, которая связывается с экзогенно введенным β-глюканом. Популяция иммунных клеток, используемая для определения того, обладает ли индивид высоким уровнем связывания или низким уровнем связывания, может представлять собой, например, полиморфоядерные лейкоциты (ПМЛ) или моноциты. Индивид может считаться обладающим высоким уровнем связывания, если по меньшей мере 10% ПМЛ или моноцитов в образце крови этого индивида связываются с экзогенно введенным β-глюканом. Таким образом, индивид может быть индивидом, имеющим высокий уровень связывания, если по меньшей мере 10%, по меньшей мере 12%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 15% или по меньшей мере 40% ПМЛ или моноцитов в образце крови этого индивида связываются с экзогенно введенным β-глюканом (см., например, Фиг. 2 и Фиг. 3). В некоторых случаях экзогенно введенный β-глюкан может включать PGG, находящийся в конченой концентрации от 10 мкг/мл до 100 мкг/мл. Термин «статус индивида, имеющего низкий уровень связывания» относится к индивиду, который не обладает статусом индивида, имеющего высокий уровень связывания.
Кроме того, индивиды, имеющие высокий уровень связывания, могут иметь более высокие титры антител против β-глюкана, по сравнению с индивидами с низким уровнем связывания (Фиг. 4). Как правило, титр антител против β-глюкана для индивида, имеющего высокий уровень связывания, может иметь значение по меньшей мере 25000, такое как, например, по меньшей мере 30000, по меньшей мере 35000, по меньшей мере 40000, по меньшей мере 45000, по меньшей мере 50000, по меньшей мере 55000 или по меньшей мере 60000 (см., например, Фиг. 4). Термин «титр антител против β-глюкана», как правило, относится к IgG. Однако в некоторых случаях присутствие IgM может компенсировать пониженный титр IgG, для присвоения статуса «индивид, имеющий высокий уровень связывания».
Известно, что β-глюкан связывается с лектинподобным доменом в COOH-концевой области CD11b субъединицы лейкоцитарного рецептора комплемента 3-го типа (CR3; CD11b/CD18, aMh2 интегрин, Mac-1; см. Thorton et al., J Immunol 156: 1235-46, Xia et al., J Immunol 162: 2281-90). β-Глюканы могут инициировать цитотоксичность CR3 нейтрофилов, макрофагов и естественных клеток-киллеров в отношении опухолей, опсонизированных iC3b. Двойное связывание лейкоцитарного CR3 через I-домен с лигандом iC3b и через лектинподобный домен с β-глюканом может приводить к дегрануляции и цитотоксическим ответам (Li et al., J Immunol 177: 1661-9; Tsikitis et al., J Immunol 173: 1284-91). Таким образом, можно было предположить, что индивиды с низким уровнем связывания могут иметь повышенные титры антител против β-глюкана, которые могут разрушать связь между β-глюканом и CR3.
Однако авторы настоящего изобретения обнаружили прямо противоположное. Индивиды с высоким уровнем связывания, имеют более высокие титры антител против β-глюкана, по сравнению с индивидами с низким уровнем связывания (Фиг. 4). Таким образом, повышенные титры антител против β-глюкана связаны с повышенным связыванием β-глюкана с CR3 на иммунных клетках.
Кроме того, эффект является передаваемым. Сыворотка крови индивида с высоким уровнем связывания способна повысить связывание β-глюкана с иммунными клетками (например, ПМЛ), полученными от индивида с низким уровнем связывания (Фиг. 5). Увеличение количества моноклональных антител против β-глюкана также способно повысить связывание β-глюкана с иммунными клетками (например, ПМЛ) в сыворотке крови, полученной от индивида с низким уровнем связывания (Фиг. 6). Кроме того, внутривенный иммуноглобулин (ВВИГ), продукт крови, содержащий объединенный поливалентный IgG от многих доноров (как правило, многих сотен и даже тысяч доноров) и имеющий высокий естественный титр антител против β-глюкана, также способен повысить связывание β-глюкана с иммунными клетками (например, ПМЛ) в сыворотке крови, полученной от индивида с низким уровнем связывания (Фиг. 7).
Эффект также был показан in vivo. У индивида с рецидивным метастатическим колоректальным раком имел место низкий уровень связывания после пяти циклов терапии, которая включала введение β-глюкана. Индивид имел связывание β-глюкана с ПМЛ и моноцитами <5% и титр антител против β-глюкана внизу 10% от кривой распределения для здоровых индивидов (от 1:1600 до 1:3200). Индивид несколько раз получал внутривенный иммуноглобулин (ВВИГ) в количестве от 0,4 г/кг до 1 г/кг. Образцы до и после лечения получали до и после второго введения. На Фиг. 8 показано, что индивид обладал низкой способностью связывания β-глюкана с ПМЛ и моноцитами по данным, полученным от образцов, взятых перед лечением (Фиг. 8, Перед введением Цикл 7), но имел значительное повышение способности связывания β-глюкана по данным, полученным от образцов, взятых после лечения ВВИГ (Фиг. 8, После введения Цикл 7). В образцах, полученных после лечения, титр антител против β-глюкана индивида также повысился до 1:25600, что свидетельствует о передаче антител против β-глюкана при лечении ВВИГ.
Кроме того, в двухгрупповом, открытом, рандомизированном, многоцентровом клиническом исследовании 795 индивидов с рецидивным/прогрессирующим колоректальным раком после по меньшей мере двух ранее полученных химиотерапевтических курсов лечения разделили на контрольную группу и исследуемую группу. Индивиды в контрольной группе получали лечение цетуксимабом. Индивиды в исследуемой группе получали лечение цетуксимабом + 4 мг/кг PGG β-глюкана. На Фиг. 9 показано, что индивиды, получавшие β-глюкан, как часть своей иммунотерапии, находились на лечении в течение более длительного среднего периода времени по сравнению с индивидами, получавшими только цетуксимаб, эффект был наиболее выражен у индивидов, имеющих высокий уровень связывания. В этом контексте продолжительность лечения является показателем успешности терапии, так как более длительное время лечения свидетельствует о положительном терапевтическом результате, в то время как более короткое время лечения свидетельствует о неблагоприятном исходе. Таким образом, существуют клинические последствия статуса индивида, имеющего высокий уровень связывания, по сравнению со статусом индивида, имеющего низкий уровень связывания.
Таким образом, в другом аспекте настоящее изобретение относится к иммунотерапии, которая включает введение индивиду β-глюкана, вводимого совместно с антителом, которое специфично связывается с β-глюканом, и дополнительно противоопухолевого антитела. Используемый в настоящем описании термин «противоопухолевое антитело» относится к антителу, которое специфично связывается с опухолевыми клетками, независимо от того образуют ли эти опухолевые клетки солидную опухоль или включают лейкемические клетки или клетки лимфомы. β-Глюкан и антитело, которое специфично связывается с β-глюканом, могут быть введены так, как подробно описано выше. Противоопухолевое антитело может представлять собой любое подходящее противоопухолевое антитело, вводимое в соответствии с указаниями производителя или медицинского работника. В этом контексте совместное введение β-глюкана и препарата антител может повысить эффективность иммунотерапии. Например, было показано, что PGG β-глюкан обладает преклинической активностью против различных типов злокачественных новообразований, когда вводится в комбинации с противоопухолевыми моноклональными антителами (mAb). Примеры типов злокачественных новообразований и связанных с ними противоопухолевых mAb включают, например, Т-клеточную лимфому (анти-MUC1, анти-GD2), неходжкинскую лимфому (ритуксимаб), хроническую лимфоцитарную лейкемию (ритуксимаб), карциному легкого (анти-MUC1), аденокарциному молочной железы (анти-MMTV), карциному яичника (бевацизумаб), немелкоклеточную карциному легкого (бевацизумаб, цетуксимаб), колоректальный рак (цетуксимаб) и карциному поджелудочной железы (цетуксимаб, анти-MUC1). У некоторых индивидов иммуностимулирующее действие PGG β-глюкана может быть усилено при помощи совместного введения антитела, которое специфично связывается с β-глюканом.
Аналогичное преобразование низкого уровня связывания у индивида в высокий уровень связывания может быть осуществлено путем введения индивиду композиции, которая содержит часть молекулы β-глюкана, конъюгированную с любым антителом или частью антитела. На Фиг. 10 приведены данные, иллюстрирующие, что относительно низкое связывание PGG с ПМЛ в цельной крови (Imp Ref, второе изображение) изменяется на высокое связывание путем конъюгации PGG или с BTH1704 (анти-MUC1, патент США 6204366, Biothera, Inc, Eagan, MN, третье изображение) или с ERBITUX (Eli Lilly and Co., Indianapolis, IN, четвертое изображение) противоопухолевыми антителами. На Фиг. 11 также показано, что относительно низкое связывание PGG с ПМЛ в цельной крови (Imp Ref, второе изображение) изменяется на высокое связывание путем конъюгации PGG с внутривенным иммуноглобулином (ВВИГ, Biolegend, San Diego, CA).
Таким образом, в другом аспекте настоящее изобретение относится к иммунотерапии, которая включает введение индивиду композиции, которая содержит часть молекулы β-глюкана, конъюгированную с антителом, терапевтическим антителом, противоопухолевым антителом или фрагментом антитела, таким как Fc-фрагмент антитела. Модифицированные и/или дериватизированные PGG, включая PGG конъюгаты части молекулы PGG и антитела, описаны в Международной патентной заявке PCT/US12/36795, которые также могут быть использованы в конъюгатах с фрагментами антител. Часть молекулы PGG может представлять собой или быть получена из β-1,3/1,6 глюкана. В этом контексте термин «получена из» означает, что конъюгат обязательно может быть получен путем создания ковалентной связи, которая замещает один или несколько атомов PGG β-глюкана. Используемый в настоящем описании термин «полученный из β-1,3/1,6 глюкана» относится к части PGG β-глюкана, которая остается частью конъюгата после замещения одного или нескольких атомов PGG с образованием ковалентной связи конъюгата.
Терапевтическое антитело может представлять собой любое терапевтическое антитело, способное объединяться с β-глюканом для иммунотерапии. Таким образом, терапевтическое антитело также может включать любое из противоопухолевых антител, описанных выше в связи с другими аспектами настоящего изобретения, для проведения иммунотерапии против различных форм злокачественных новообразований.
Используемый в настоящем описании термин «и/или» означает один или все из перечисленных элементов или комбинацию любых двух или более из перечисленных элементов; термин «содержит» и его варианты не имеет ограничивающего значения, когда эти термины появляются в описании и формуле изобретения; если не указано иное, то единственное число существительных и термин «по меньшей мере один» используются взаимозаменяемо и означают один или более чем один; и указание числовых диапазонов при помощи их крайних значений включает все числа, находящиеся в пределах этого диапазона (например, диапазон от 1 до 5 включает 1, 1,5, 2, 2,75, 3, 3,80, 4, 5 и т.д.).
В предшествующем описании конкретные варианты осуществления изобретения для ясности могут быть описаны по отдельности. Если иное явно не указано, то признаки конкретного варианта осуществления изобретения являются несовместимыми с признаками другого варианта осуществления изобретения, определенные варианты осуществления изобретения могут включать комбинацию совместимых признаков, описанных в настоящем описании в связи с одним или несколькими вариантами осуществления изобретения.
Для любого раскрытого в настоящем описании способа, включающего отдельные стадии, стадии могут быть выполнены в любой возможной последовательности, и, при необходимости, любая комбинация двух или более стадий может быть выполнена одновременно.
Настоящее изобретение иллюстрируется следующими примерами. Следует понимать, что конкретные примеры, материалы, количества и методики должны интерпретироваться в