Способ получения гексафторизопропанола и фторметилгексафторизопропилового эфира (севофлурана)
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения фторметилгексафторизопропилового эфира (севофлурана), применяемого в качестве ингаляционного анастетика, а также к способу получения гексафторизопропанола. Один из вариантов способа получения севофлурана включает следующие стадии: (a) очистка смеси, содержащей гексафторацетон и более 120 ppm 1,1,1-трифтор-2,2-дихлорэтана в качестве примеси, с получением очищенного гексафторацетона, содержащего 120 ppm или менее 1,1,1-трифтор-2,2-дихлорэтана; (b) приведение водорода (Н2) в контакт с очищенным гексафторацетоном в присутствии катализатора, посредством чего осуществляют гидрирование гексафторацетона с получением гексафторизопропанола, и (c) проведение реакции гексафторизопропанола, формальдегида и фторида водорода в присутствии кислоты Льюиса или кислоты Бренстеда. Настоящее изобретение позволяет получить целевые продукты за более короткий период времени. 3 н. и 20 з.п. ф-лы, 4 табл., 25 пр.
Реферат
Область техники
Настоящее изобретение относится к способу получения гексафторизопропанола и фторметилгексафторизопропилового эфира, известного как ингаляционный анестетик «севофлуран».
Уровень техники
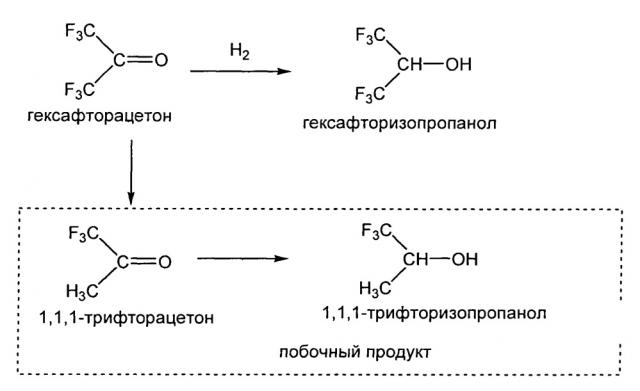
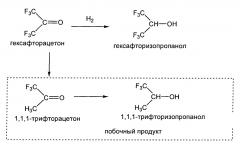
Гексафторизопропанол (далее в данном описании гексафторизопропанол может быть обозначен «ГФИП») получают в больших количествах в качестве растворителя, демонстрирующего особую способность к растворению полимеров, и в качестве промежуточного соединения для получения ингаляционного анестетика «севофлурана». ГФИП обычно получают посредством гидрирования гексафторацетона (далее в данном описании он может быть обозначен «ГФА»), и были предложены различные способы, в зависимости от сочетания формы исходного материала ГФА, режима проведения реакции, типов восстанавливающего агента и катализатора и т.д.
В качестве газофазного способа известен способ гидрирования ГФА водородом (H2) в присутствии нанесенного на оксид алюминия палладиевого катализатора (Pd/Al2O3) (US 3468964) или в присутствии нанесенного на активированный уголь палладиевого катализатора (Pd/C) (US 3702872) и способ гидрирования гидрата ГФА в присутствии никелевого катализатора или нанесенного на оксид алюминия палладиевого катализатора (JP S57-81424).
Что касается способа получения ГФИП с помощью газообразного водорода в жидкой фазе, известен способ с использованием гидрата ГФА и способ с использованием ангидрида ГФА. В качестве способа с использованием ангидрида, в US 3418337 описан способ, включающий проведение его реакции в течение 6 ч при температуре от 110 до 150°C при давлении от 20,0 до 90,0 МПа (от 200 до 900 атмосфер) с использованием оксида платины в качестве катализатора.
С другой стороны, способ гидрирования гидрата ГФА в жидкой фазе включает проведение его реакции в течение 3,5 ч при температуре от 70 до 75°C при давлении от 0,35 до 0,7 МПа (от 3,5 до 7 кг/см2) с использованием палладия/углерода в качестве катализатора (JP S59-204142) и способ проведения его реакции в течение 6 ч при температуре 100°C при давлении 0,5 МПа (5 кг/см2) с использованием палладия/Al2O3 в качестве катализатора (JP Н1-301631).
В качестве способа с использованием восстанавливающего агента, отличного от водорода (H2), в US 3418337 описан способ восстановления ангидрида ГФА с использованием боргидрида натрия в качестве восстанавливающего агента в растворителе метаноле, а также способ с использованием алюмогидрида лития, гидрида кальция, гидрида натрия или т.п. в качестве восстанавливающего агента в кислородсодержащем растворителе, таком как диэтиловый эфир, метанол, изопропанол, тетрагидрофуран или т.п.
В соответствии с JP Н6-184025, гидрирование гидрата ГФА посредством контакта с водородом в присутствии палладиевого катализатора дает чрезмерно гидрированный продукт, 1,1,1-трифторацетон (ТФА), помимо целевого продукта ГФИП. Указано, что ТФА трудно отделить путем перегонки, поскольку температура его кипения близка к температуре кипения целевого продукта ГФИП. Однако в JP Н6-184025 отмечено, что при использовании «комбинированного катализатора, состоящего из палладия и рутения» в качестве катализатора гидрирования, целевой продукт ГФИП может быть получен достаточно избирательно, что даже когда получают ТФА в небольшом количестве, данное соединение можно легко превратить в 1,1,1-трифторизопропанол (легко отделяемое соединение, далее может быть обозначено ТФИП) и что, соответственно, после реакции становится значительно легче получить гексафторизопропанол высокой чистоты (см. далее).
С другой стороны, в JP Н6-184026 указано, что когда неочищенный ГФИП, полученный посредством гидрирования ГФА в присутствии катализатора, обрабатывают органическим аминовым соединением, трудно отделяемый ТФА может быть удален из системы в форме «ассоциата с аминовым соединением» и посредством последующей перегонки может быть получен ГФИП, по существу не содержащий ТФА.
Кроме того, в JP 2009-051798 указано, что когда ГФА гидрируют посредством контакта с газообразным водородом при температуре от -20 до 60°C в присутствии металлического катализатора, такого как палладий, рутений или т.п., или несущего металл катализатора в растворителе фториде водорода, может быть получен ГФИП, по существу не содержащий избыточно гидрированного 1,1,1-трифторацетона.
Что касается получения гексафторацетона (ГФА), т.е. исходного материала для получения ГФИП, известен способ эпоксидирования гексафторпропена (US 3321515) с последующей изомеризацией полученного эпоксидного соединения в присутствии катализатора с получением ГФА (US 3213134). Также известен способ хлорирования ацетона с получением гексахлорацетона (JP S56-139436), который впоследствии подвергают заместительному фторированию фторидом водорода в присутствии хромового катализатора, нанесенного на активированный уголь, или т.п. (JP S39-13060).
Как описано выше, ГФИП является чрезвычайно важным в качестве исходного материала для получения ингаляционного анестетика севофлурана (химическое название фторметил-1,1,1,3,3,3-гексафторизопропиловый эфир). Более конкретно, как представлено в US 4250334, ингаляционный анестетик севофлуран может быть получен посредством добавления концентрированной серной кислоты и фторида водорода к параформальдегиду, последующего нагревания полученной смеси при определенной температуре и добавления в нее по капле ГФИП.
Краткое описание изобретения
В соответствии со способами, раскрытыми в US 3468964, US 3702872, JP S57-81424, JP S59-204142, JP H1-301631, JP H6-184025, JP H6-184026 и JP 2009-051798, ГФИП, который является важным органическим промежуточным соединением, можно производить в массовом масштабе посредством каталитической реакции с использованием ГФА в качестве исходного материала. Металлический катализатор, необходимый для реакции гидрирования, содержит благородный металл, такой как палладий, платина или т.п., в качестве активного компонента. Его важной характеристикой является то, что он имеет высокую каталитическую активность, и даже при его использовании в очень небольшом количестве по сравнению с исходным материалом ГФА, ГФА можно преобразовать ГФИП с высокой степенью превращения (другими словами, катализатор имеет высокий оборот).
Однако способ получения ГФИП посредством каталитического гидрирования имеет проблему, которой нельзя пренебречь и которая состоит в том, что «скорость реакции уменьшается по мере развития реакции». Более конкретно, в течение почти 3 часов после начала гидрирования гексафторацетона скорость реакции высока, но затем она постепенно снижается. Реакция не останавливается, и никакого воздействия на качество продукта не происходит, но скорость реакции несоразмерно снижается в середине реакции и далее, по сравнению со скоростью в начале реакции. В данном случае, гексафторацетон (ГФА) является дорогостоящим реагентом. Соответственно, желательно, чтобы степень превращения гексафторацетона посредством реакции гидрирования достигала от 80 до 100% (предпочтительно от 90 до 100%, особенно предпочтительно от 98 до 100%). Как описано выше, скорость реакции ближе к концу реакции является чрезвычайно низкой, и поэтому для достижения такой высокой степени превращения реакции требуется относительно большое время реакции (см. представленные далее сравнительные примеры) и существует потребность в усовершенствовании (в данном описании фраза «начиная со середины до конца реакции гидрирования» предназначена, хотя и не всегда этим ограничена, для указания стадии, на которой степень превращения ГФА достигает приблизительно 70% или более от начала реакции.)
Как описано ниже в разделе «стадия 4», при «гидрировании ГФА» кислотные компоненты, такие как хлорид водорода, фторид водорода и т.п., образуются по мере развития реакции, и pH реакционной системы постепенно снижается. В данном случае понятно, что когда в реакционную систему предварительно добавлено небольшое количество «акцептора кислоты (основного вещества)», кислотные вещества, образующиеся в качестве побочных продуктов в ходе реакции гидрирования, можно сразу же нейтрализовать. Известно, что в результате этого скорость реакции значительно увеличивается (например, см. JP H6-184025. Фактически, как показано в приведенных ниже примерах, когда реакцию гидрирования осуществляют с добавлением акцептора кислоты, реакция заканчивается за значительно более короткий период времени по сравнению со случаем без добавления акцептора кислоты.) Однако даже «в случае добавления акцептора кислоты» нельзя избежать того, что «скорость реакции уменьшается по мере развития реакции». Даже когда количество акцептора кислоты увеличивают, это явление нельзя предотвратить в достаточной степени (см. представленные ниже примеры и сравнительные примеры).
Целью настоящего изобретения является обеспечение нового способа получения гексафторизопропанола из гексафторацетона в качестве исходного материала, в котором предотвращают снижение скорости реакции от середины до конца реакции гидрирования.
В свете вышеуказанных проблем, были проведены тщательные исследования. В результате было обнаружено, что содержание 1,1,1-трифтор-2,2-дихлорэтана (CF3CHCl2; далее в данном описании может быть обозначен «HCFC-123») среди примесей, содержащихся в гексафторацетоне в момент начала гидрирования, имеет тесную взаимосвязь со «скоростью реакции в середине и после середины реакции» гидрирования.
Более конкретно, неожиданно было обнаружено, что когда реакцию гидрирования начинают с использованием гексафторацетона, в котором концентрация HCFC-123 снижена до 120 ppm (частей на млн) или менее, вышеуказанное «явление снижения скорости реакции с развитием реакции» может быть существенно подавлено. В результате, даже если количество катализатора гидрирования и количество акцептора кислоты являются такими же, реакция гидрирования достигает уровня требуемой степени превращения реакции за более короткий период времени.
Данный HCFC-123 представляет собой соединение, которое обнаруживают в количестве более 120 ppm в качестве побочного продукта при получении ГФА посредством взаимодействия гексафторацетона и фторида водорода (сразу после синтеза ГФА посредством фторирования гексахлорацетона соединение содержится в реакционной смеси в количестве нескольких тысяч ppm, и как показано далее в данном документе, соединение все еще содержится в количестве от 1000 до 2000 ppm или т.п. даже после его простой перегонки.) В общем, исходный материал ацетон не содержит такое соединение, содержащее «два атома углерода». Поэтому полагают, что в жестких условиях хлорирования или фторирования углерод-углеродная связь разрывается, отчасти с образованием «соединения с двумя атомами углерода» (даже когда ГФА синтезируют другим способом, этот способ обязательно должен включать стадию хлорирования и стадию фторирования, и поэтому можно предполагать образование побочного продукта HCFC-123.)
HCFC-123 имеет температуру кипения 28°C, которая отличается от температур кипения ГФА и тригидрата ГФА. Однако при простой перегонке тригидрата ГФА HCFC-123 не может быть полностью удален из тригидрата ГФА (см. сравнительные примеры, представленные далее в данном документе). Кроме того, HCFC-123 само по себе не содержит активной функциональной группы, способной реагировать с ГФА и ГФИП. После получения ГФИП в результате гидрирования соединение может быть успешно отделено и удалено из ГФИП посредством перегонки. Следовательно, до настоящего времени не делали попыток преднамеренного отделения и удаления HCFC-123 в высокой степени из ГФА или тригидрата ГФА.
Причина того, почему присутствие HCFC-123 в количестве более 120 ppm увеличивает время реакции неясна. Как очевидно из примера 1, представленного далее в данном документе, пик «HCFC-123» исчезает на относительно ранней стадии после начала гидрирования. С другой стороны, установлено, что «явление снижения скорости реакции» возникает значительно позднее. Исходя из этого, можно с хорошей вероятностью полагать, что сам по себе «HCFC-123» напрямую не препятствует гидрированию.
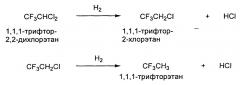
В связи с этим, в случае, когда HCFC-123 содержится в ГФА и когда HCFC-123 подвергается гидрированию, можно полагать, что образуется 1,1,1-трифтор-2-хлорэтан (CF3CH2Cl; далее в данном документе это соединение может быть обозначено «HCFC-133a»), и когда это соединение в свою очередь подвергается гидрированию, образуется 1,1,1-трифторэтан (CF3H3). Обе реакции сопровождаются образованием хлорида водорода (HCl) в качестве побочного продукта.
Может существовать возможность, что хлорид водорода, полученный в результате данной реакции, действует как каталитический яд, снижая активность металлического катализатора, что вызывает «увеличение времени реакции». Однако, как показано в примерах и сравнительных примерах, представленных далее в данном документе, в случае, когда HCFC-123 присутствует в количестве более 120 ppm, и когда реакцию начинают при увеличении количества акцептора кислоты, скорость реакции обычно возрастает, но «явление снижения скорости реакции в середине и после середины реакции» не исчезает. Исходя из этого предполагают, что существуют какие-то другие факторы, которые нельзя выявить на основании вышеизложенной гипотезы.
Было обнаружено, что явление, состоящее в том, что «снижение скорости реакции в середине и после середины реакции» может быть предотвращено посредством «регулирования содержания HCFC-123», не зависит от наличия или отсутствия акцептора кислоты (см. примеры и сравнительные примеры, представленные далее в данном документе).
Исходя из этого полагают, что эффект «снижения количества HCFC-123» в настоящем изобретении (предотвращение снижения скорости реакции в середине и после середины реакции) является отличным и не зависит от эффекта «добавления акцептора кислоты в ходе реакции гидрирования» (общее увеличение скорости реакции).
Вместе с тем было обнаружено, что гидрирование в настоящем изобретении можно осуществлять особенно благоприятным образом только в случае, когда соблюдены два требования, а именно «добавление акцептора кислоты» и «снижение содержания HCFC-123 до определенного количества или менее».
Так или иначе, «количество HCFC-123 в момент начала гидрирования» является важным показателем. Когда его доводят до величины, составляющей 120 ppm или менее, можно предотвратить снижение скорости реакции в середине и после середины реакции гидрирования, и это является неожиданным и полезным открытием. На основании этого открытия удалось получить ГФИП более экономично, чем когда-либо прежде.
В соответствии с настоящим изобретением, стало возможно синтезировать гексафторизопропанол за более короткий период времени. Соответственно, при синтезе севофлурана с применением гексафторизопропанола, полученного в настоящем изобретении, ингаляционный анестетик «севофлуран» получают с гораздо большими преимуществами, чем когда-либо ранее, с точки зрения широкой перспективы. Здесь можно сказать, что настоящее изобретения имеет большие преимущества.
Более конкретно, в настоящем изобретении предложен способ получения гексафторизопропанола и севофлурана, признаки которого изложены в пп. 1-12 формулы изобретения.
Стадии (a), (b) и (c), указанные в п. 1 формулы изобретения, соответствуют упоминаемым впоследствии стадиям 3, 4 и 5, соответственно. Стадии (m), (n), (o)-(q), (r) и (s), указанные в п. 12 формулы изобретения, соответствуют упоминаемым впоследствии стадиям 1, 2, 3a, 4a и 5, соответственно.
Согласно изобретению по п. 1, предложен способ получения фторметилгексафторизопропилового эфира (севофлурана), включающий следующие стадии:
(a) очистка смеси, содержащей гексафторацетон и более 120 ppm 1,1,1-трифтор-2,2-дихлорэтана в качестве примеси, с получением очищенного гексафторацетона, содержащего 120 ppm или менее 1,1,1-трифтор-2,2-дихлорэтана;
(b) приведение водорода (H2) в контакт с очищенным гексафторацетоном в присутствии катализатора, посредством чего осуществляют гидрирование гексафторацетона с получением гексафторизопропанола, и
(c) проведение реакции гексафторизопропанола, формальдегида и фторида водорода в присутствии кислоты Льюиса или кислоты Бренстеда.
Согласно изобретению по п. 2, предложен способ по п. 1, в котором стадию (а) осуществляют посредством перегонки.
Согласно изобретению по п. 3, предложен способ по п. 1 или 2, в котором стадия (а) включает следующие стадии:
(d) приведение воды в контакт со смесью, содержащей гексафторацетон и более 120 ppm 1,1,1-трифтор-2,2-дихлорэтана в качестве примеси, посредством чего гексафторацетон, содержащийся в смеси, превращают в тригидрат гексафторацетона, и
(e) перегонка смеси, полученной на стадии (d).
Согласно изобретению по п. 4, предложен способ по п. 3, в котором стадия (e) включает следующие стадии:
(f) подача смеси, полученной на стадии (d), в ректификационную колонну и
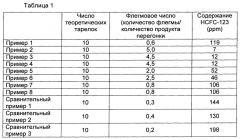
(g) проведение перегонки при числе теоретических тарелок от 2 до 50 и флегмовом числе 0,5-8,0.
Согласно изобретению по п. 5, предложен способ по любому из пп. 1-4, в котором стадия (a) включает стадию
(h) проведения количественного анализа гексафторацетона с использованием газовой хроматографии в ходе очистки, чтобы определить, составляет ли содержание 1,1,1-трифтор-2,2-дихлорэтана в смеси 120 ppm или менее.
Согласно изобретению по п. 6, предложен способ по любому из пп. 1-5, в котором катализатор, используемый на стадии (b), представляет собой первый катализатор, включающий по меньшей мере один металл, выбранный из группы, состоящей из палладия, платины, рутения, родия и никеля, или второй катализатор, включающий по меньшей мере один из указанных металлов, нанесенный на носитель.
Согласно изобретению по п. 7, предложен способ по любому из предшествующих пп. 1-5, в котором катализатор, используемый на стадии (b), представляет собой по меньшей мере один катализатор, выбранный из группы, состоящей из третьего катализатора, включающего палладий и рутений, которые нанесены на один и тот же носитель, и четвертого катализатора, включающего смесь катализатора, содержащего палладий, нанесенный на носитель, и катализатора, содержащего рутений, нанесенный на носитель.
Согласно изобретению по п. 8, предложен способ по любому из пп. 1-7, в котором гидрирование на стадии (b) осуществляют в присутствии акцептора кислоты в реакционной системе.
Согласно изобретению по п. 9, предложен способ по п. 8, в котором карбонат или гидрокарбонат щелочного металла и гидроксид металла 13 группы Периодической таблицы элементов используют совместно в качестве акцептора кислоты на стадии (b).
Согласно изобретению по п. 10, предложен способ по любому из пп. 1-9, в котором смесь, содержащую гексафторацетон и более 120 ppm 1,1,1-трифтор-2,2-дихлорэтана в качестве примеси, предназначенную для очистки на стадии (a), получают способом, включающим следующие стадии:
(i) хлорирование ацетона хлором (Cl2) с получением смеси, содержащей гексахлорацетон, и
(j) фторирование гексахлорацетона посредством приведения фторида водорода в контакт со смесью, полученной на стадии (i), с получением смеси, содержащей гексафторацетон и более 120 ppm 1,1,1-трифтор-2,2-дихлорэтана в качестве примеси.
Согласно изобретению по п. 11, предложен способ по любому из пп. 1-10, в котором гексафторизопропанол, полученный на стадии (b), отделяют способом, включающим следующие стадии:
(k) отделение катализатора стадии (b) от реакционной смеси, полученной на стадии (b), с получением жидкого компонента и
(l) перегонка жидкого компонента, в результате которой отделяют гексафторизопропанол.
Согласно изобретению по п. 12, предложен способ получения фторметилгексафторизопропилового эфира (севофлурана), включающий следующие стадии:
(m) хлорирование ацетона хлором (Cl2) с получением смеси, содержащей гексахлорацетон;
(n) фторирование гексахлорацетона посредством приведения фторида водорода в контакт со смесью, полученной на стадии (m), с получением смеси, содержащей гексафторацетон и более 120 ppm 1,1,1-трифтор-2,2-дихлорэтана в качестве примеси;
(o) приведение воды в контакт со смесью, полученной на стадии (n), посредством чего гексафторацетон, содержащийся в смеси, превращают в тригидрат гексафторацетона;
(p) подача смеси, полученной на стадии (o), в ректификационную колонну;
(q) проведение перегонки смеси, полученной на стадии (o), в ректификационной колонне при числе теоретических тарелок от 2 до 50 и флегмовом числе 0,5-8,0 до достижения содержания 1,1,1-трифтор-2,2-дихлорэтана в смеси 120 ppm или менее, посредством чего получают очищенный тригидрат гексафторацетона, содержащий 120 ppm или менее 1,1,1-трифтор-2,2-дихлорэтана;
(r) приведение водорода (H2) в контакт с очищенным тригидратом гексафторацетона в присутствии акцептора кислоты и в присутствии по меньшей мере одного катализатора, выбранного из группы, состоящей из первого катализатора, включающего палладий и рутений, которые нанесены на один и тот же носитель, и второго катализатора, включающего смесь катализатора, содержащего палладий, нанесенный на носитель, и катализатора, содержащего рутений, нанесенный на носитель, с получением гексафторизопропанола, и
(s) осуществление реакции гексафторизопропанола, полученного на стадии (r), с формальдегидом и фторидом водородом в присутствии кислоты Льюиса или кислоты Брэнстеда, с получением фторметилгексафторизопропилового эфира (севофлурана).
Способ получения гексафторизопропанола с использованием гексафторацетона в качестве исходного материала согласно настоящему изобретению позволяет предотвратить снижение скорости реакции от середины до конца реакции гидрирования. Соответственно, гексафторизопропанол можно синтезировать за более короткий период времени. Таким образом, другой эффект настоящего изобретения заключается в том, что когда севофлуран синтезируют с использованием этого гексафторизопропанола, севофлуран можно получить с большими преимуществами.
Подробное описание изобретения
Далее настоящее изобретение описано подробно. Объем защиты настоящего изобретения не ограничен этим описанием. Помимо примеров, представленных далее в данном документе, изобретение может быть подходящим образом изменено и модифицировано в пределах объема защиты без отступления от сущности изобретения с достижением его технического результата. Все публикации, перечисленные в данном описании, например, документы известного уровня техники и публикации патентных заявок, публикации патентов и другие патентные документы, включены в данное описание посредством ссылки.
В данном описании гидрат гексафторацетона относится к гидрату с неограниченным количеством молекул воды или его водному раствору и включает тригидрат гексафторацетона. В данном описании гексафторацетон тригидрат может быть обозначен «ГФА-3В».
Как раскрыто в публикациях известного уровня техники, гексафторацетон может быть представлен рядом химических веществ, как таковой. Например, в водном растворе соединение существует в форме «тригидрата гексафторацетона».
Гексафторацетон имеет температуру кипения -28°C (при атмосферном давлении) и находится в состоянии пара (газа) при комнатной температуре и нормальном давлении. Для удобства в обращении, тригидрат гексафторацетона, полученный в виде композиции с постоянной температурой кипения от 106 до 108°C, используют в качестве исходного материала во многих реакциях или для хранения. В настоящем изобретении, термин «гексафторацетон» включает тригидрат гексафторацетона.
Для более наглядного описания настоящего изобретения, далее приведены стадии, относящиеся к настоящему изобретению.
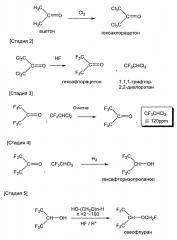
[Стадия 1]
Среди вышеуказанных, стадия 3 и стадия 4 являются обязательными стадиями настоящего изобретения. В соответствии с настоящим изобретением, к ним могут быть добавлены стадия 5 или стадии 1 и 2. Стадия 3 в одном особенно предпочтительном воплощении может быть обозначена как «стадия 3a». Стадия 4 в одном особенно предпочтительном воплощении может быть обозначена как «стадия 4а». Далее приведено описание стадий.
Стадия 1
Стадия 1 представляет собой стадию хлорирования ацетона хлором (Cl2) с получением смеси, содержащей гексахлорацетон.
Данная стадия и последующая стадия 2 являются традиционными стадиями, но очень важны для понимания настоящего изобретения и описаны далее.
Данную стадию осуществляют посредством приведения хлора (газообразного хлора) в контакт с ацетоном. Хлорирование на данной стадии предпочтительно осуществляют в присутствии катализатора. В качестве катализатора используют катализатор, известный как так называемый катализатор хлорирования. Более конкретно, возможно использовать радикальный инициатор, включая азосоединения, такие как азобисизобутиронитрил, азобисвалеронитрил и т.д., и пероксиды, такие как бензоилпероксид, додеканоилпероксид, дилаурилпероксид, трет-бутилпероксипивалат и т.д., и соединения фосфора, такие как красный фосфор, пентахлорид фосфора, трихлорид фосфора, трифенилфосфин, трифенилфосфит и т.д., гетероциклические ароматические соединения, такие как пиридин, хинолин и т.д., и триэтиламин и т.д. Кроме того, хлорирование протекает с помощью фотооблучения. Среди указанных катализаторов хинолин является особенно предпочтительным.
Количество катализатора может составлять приблизительно от 0,001 до 0,5 эквивалентов относительно исходного материала ацетона, но специалист в данной области техники может подходящим образом регулировать это количество.
По мере протекания хлорирования, постепенно образуются хлорацетоны, содержащие от одного до пяти атомов хлора, которые являются частично хлорированными ацетонами (монохлорацетон, дихлорацетон и т.д.; в данном описании они могут быть упомянуты как «хлорированные соединения низкого порядка»). Предпочтительно реакцию осуществляют при использовании нижеуказанных давления реакции, температуры реакции и других условий, до тех пор, пока все углеродные атомы ацетона не будут замещены атомами хлора, и с использованием аналитических средств газовой хроматографии или т.п. для проверки степени превращения ацетона и степени хлорирования в течение реакции. «Степень хлорирования» в данном описании показывает среднее количество атомов хлора, введенных на одну молекулу ацетона, рассчитанное исходя из состава реакционной смеси в определенный момент времени.
Более конкретно, на одну молекулу ацетона, теоретическое количество молей хлора (Cl2), необходимое для замены всех атомов водорода в ацетоне атомами хлора (то есть для превращения ацетона в гексахлорацетон) составляет 6. Соответственно, при продолжении хлорирования с поддержанием температуры в интервале приблизительно от 20 до 260°C, при контроле степени хлорирования методом газовой хроматографии, хлорсодержащие соединения низкого порядка постепенно хлорируются с получением гексахлорацетона с высокой селективностью.
На данной стадии избыточный хлор выводят из реакционной системы, тогда как он остался непрореагировавшим и, следовательно, может быть извлечен для повторного использования.
В общем, давление реакции предпочтительно составляет от 0,05 до 5,0 МПа (абсолютное давление, то же самое относится к другим величинам давления, указанным далее в данном описании). Диапазон от нормального давления (0,1 МПа) до слегка повышенного давления 0,3 МПа или т.п. является простым в эксплуатации и предпочтительным. Настоящее изобретение не исключает реакции под давлением свыше 5,0 МПа, но слишком избыточное давление будет оказывать нагрузку на оборудование. Следовательно, вышеуказанный диапазон является предпочтительным.
Температура реакции обычно составляет от 20 до 260°C. Температуру предпочтительно контролируют при отслеживании степени хлорирования с помощью газовой хроматографии. Когда температура реакции составляет менее 20°C, это в некоторой степени влияет на скорость реакции с увеличением доли хлорированных соединений низкого порядка, и время превращения в гексахлорацетон увеличивается. В результате, производительность может снижаться. С другой стороны, при температуре более 260°C гексахлорацетон испаряется, поскольку его температура кипения при комнатной температуре/нормальном давлении составляет 204°C. Таким образом, увеличатся расходы, связанные с его выведением из системы. В этом случае необходимо оборудование для предотвращения испарения, что промышленно и экономически невыгодно, и использование такой высокой температуры может не давать никаких преимуществ.
Что касается режима подачи для хлорирования, может быть использован любой способ в непрерывном режиме или в периодическом режиме, без ограничений.
Необходимо только, чтобы реактор был изготовлен из материала, обладающего термостойкостью и коррозионной стойкостью к воздействию хлора, хлорида водорода и т.д. Возможно использовать реакторы, достаточно стойкие для проведения реакции при нормальном давлении или повышенном давлении, такие как металлические контейнеры, изготовленные из нержавеющей стали, Hastelloy™, Monel™, никеля, платины или т.п., и реакторы, облицованные тетрафторэтиленовой смолой, хлортрифторэтиленовой смолой, винилиденфторидной смолой, ПФА смолой, полипропиленовой смолой, полиэтиленовой смолой, стеклом и т.п.
Реакционная смесь, содержащая гексахлорацетон, который получают на данной стадии, может содержать хлорацетоны, содержащие от одного до пяти атомов хлора, хлорид водорода, хлор и др., помимо гексахлорацетона. Таким образом, для получения гексахлорацетона высокой чистоты предпочтительно используют средства очистки перегонкой или т.п. Перед началом перегонки предпочтительно заранее отделяют хлор и хлорид водорода для снижения нагрузки, такой как коррозия или т.п., на устройство в целом.
В соответствии с данным способом, можно получить гексахлорацетон высокой чистоты и его можно использовать в качестве исходного материала на последующей стадии фторирования. Хлорацетоны, содержащие от одного до пяти атомов хлора, которые отделяют и извлекают в качестве начальной фракции при перегонке, можно снова использовать в качестве исходных материалов для хлорирования.
Устройство для перегонки не ограничено особым образом, при условии, что оно изготовлено из материала, стойкого к хлору и хлориду водорода.
Стадия 2
Далее описана стадия 2. Стадия 2 представляет собой стадию фторирования смеси, содержащей гексахлорацетон, полученной на стадии 1, фтористым водородом с получением смеси, содержащей гексафторацетон и 1,1,1-трифтор-2,2-дихлорэтан (HCFC-123), количество которого превосходит 120 ppm.
Фторирование включает два режима, парофазный способ и жидкофазный способ. Как описано далее, данная реакция благоприятно протекает при относительно высокой температуре. Таким образом, предпочтительно использовать парофазный способ, который легко осуществлять при высокой температуре.
Предпочтительно стадию 2 осуществляют в присутствии так называемого «катализатора фторирования». Катализатором фторирования, используемым на данной стадии, является оксид, фторид, хлорид, фторхлорид, оксифторид, оксихлорид или оксифторхлорид металла. Более конкретно, металл представляет собой по меньшей мере один металл, выбранный из группы, состоящей из хрома, титана, алюминия, марганца, никеля, кобальта и циркония. Фторид алюминия, оксид алюминия, вторичный хлорид хрома и т.п. являются особенно предпочтительными катализаторами фторирования. Также возможно использование их сочетаний.
Количество катализатора составляет приблизительно от 0,001 до 0,5 молей на 1 моль гексахлорацетона, и специалист в данной области техники может подходящим образом его регулировать.
Температура реакции при фторировании составляет от 250 до 450°C, предпочтительно от 260 до 400°C, более предпочтительно от 260 до 350°C. Когда температура составляет менее 250°C, скорость реакции гексахлорацетона может быть низкой. Когда температура составляет более 450°C, может увеличиваться количество избыточно фторированных продуктов, и возрастает нагрузка на оборудование Таким образом, эти два условия не являются предпочтительными.
В качестве реактора, используемого на данной стадии, предпочтительно используют реактор, достаточно стойкий для проведения реакции при нормальном давлении или повышенном давлении, например, металлический контейнер, изготовленный из нержавеющей стали, Hastelloy™, Monel™, никеля или т.п., и такой реактор, который облицован тетрафторэтиленовой смолой, хлортрифторэтиленовой смолой, винилиденфторидной смолой, ПФА смолой, полипропиленовой смолой, полиэтиленовой смолой.
На данной стадии стехиометрическое молярное отношение фторида водорода к гексахлорацетону составляет 6, но для эффективного получения гексафторацетона при высокой степени превращения и с высоким выходом предпочтительно использовать фторид водорода в количестве, превышающем стехиометрическое количество. Соответственно, обычно реакцию осуществляют с использованием 8 молей или более, предпочтительно 10 молей или более, более предпочтительно 12 молей или более фторида водорода на 1 моль гексахлорацетона. Не существует верхнего предела количества фторида водорода. Хотя, если его используют в количестве 50 молей или более, скорость фторирования в общем не может быть увеличена еще больше. Кроме того, возрастают трудозатраты для извлечения непрореагировавшего фторида водорода. Соответственно, использование слишком большого количества фторида водорода является неблагоприятным. После реакции непрореагировавший фторид водорода отделяют от органического слоя, и его можно подавать рециклом в реакционную систему.
Давление реакции на данной стадии обычно составляет от 0,05 до 10 МПа и более предпочтительно от 0,08 до 1 МПа, что является близким к нормальному давлению.
В случае, когда стадию 2 осуществляют посредством парофазной реакции, время контакта реакции обычно составляет от 1 до 300 с, предпочтительно от 10 до 60 с. Однако оптимальное время контакта изменяют в зависимости от количества фторида водорода и условий реакции, таких как температура реакции, количество катализатора, давление реакции и т.д. Таким образом, специалист в данной области техники может регулировать его подходящим образом.
Также на стадии фторирования, аналогично вышеуказанной стадии хлорирования, гексахлорацетон постепенно превращается в гексафторацетон. Поэтому предпочтительно осуществлять реакцию при отслеживании степени превращения гексахлорацетона и степени протекания фторирования с использованием аналитических средств газовой хроматографии и т.д.
Как описано выше, реакционная смесь, полученная на стадии 2, содержит побочный продукт HCFC-123 в количестве более 120 ppm (обычно несколько тысяч ppm), помимо целевого продукта ГФА. Даже после простой перегонки смеси соединение все еще может оставаться в ГФА в количестве от 1000 до 2000 ppm.
Стадия 3
Далее описана стадия 3. Стадия 3 представляет собой стадию получения «очищенного гексафторацетона» посредством очистки «смеси, содержащей гексафторацетон и 1,1,1-трифтор-2,2-дихлорэтан в количестве более 120 ppm», полученной на стадии 2, в результате которой снижают содержание 1,1,1-трифтор-2,2-дихлорэтана, содержащегося в смеси, до не более 120 ppm. Средство очистки не ограничено особым образом, но перегонка (прецизионная перегонка) является особенно предпочтительной.
Гексафторацетон, полученный на стадии 2, обычно содержит остаточный фторид водорода и хлорид водорода. ГФА даже после простой перегонки все еще может содержать HCFC-123, который является проблемой в настоящем изобретении, обычно в количестве от 1000 до 2000 ppm, и образуется смесь из этих соединений. Стадия 3 представляет собой стадию снижения количества HCFC-123 до 120 ppm или менее. После данной стадии 3 можно существенно предотвратить явление «снижения скорости реакции в середине и после середины реакции» на стадии 4 (стадия гидрирования).
В конкретном воплощении стадии 3 операцию перегонки (прецизионной перегонки) предпочтительно осуществляют после того, как гексафторацетон поглощен водой с превращением его в гидрат (тригидрат ГФА с температурой кипения 106°C), так как с этим соединением л