Нестероидное противовоспалительное средство на основе напроксена, обладающее низкой гастротоксичностью
Иллюстрации
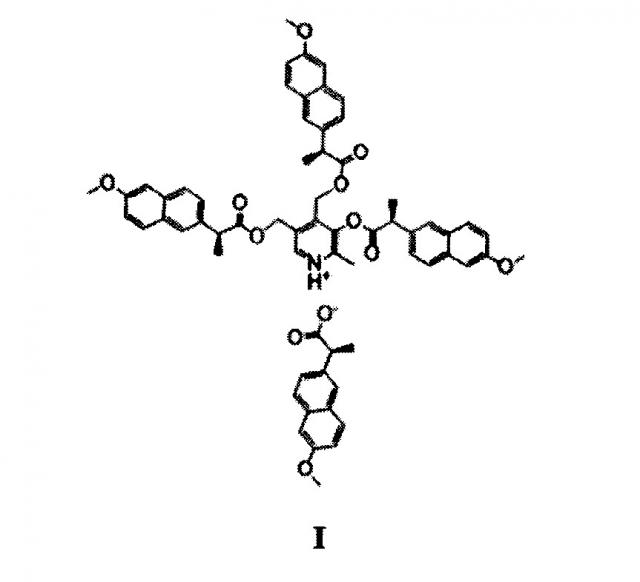
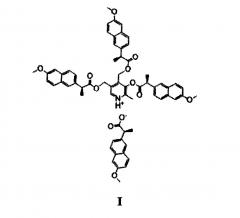
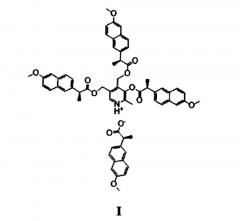
Показать всеИзобретение относится к новому производному напроксена формулы (I)
3-((S)-2-(6-метоксинафт-2-ил)пропаноилокси)-4,5-бис (((S)-2-(6-метоксинафт-2-ил)пропаноилокси)-метил)-2-метилпиридиний (S)-2-(6-метоксинафт-2-ил)пропаноату, обладающему высокой противовоспалительной, обезболивающей и жаропонижающей активностью, а также низкой острой токсичностью и гастротоксичностью. 7 табл., 2 пр.
Реферат
Изобретение относится к новому производному напроксена формулы I, обладающему высокой противовоспалительной, обезболивающей и жаропонижающей активностью, а также низкой острой токсичностью и гастротоксичностью, которое может найти применение в фармацевтической промышленности, медицине и ветеринарии.
Основными показаниями для назначения нестероидных противовоспалительных средств (далее НПВС) являются воспалительные процессы различной природы и локализации, боль, лихорадка. НПВС являются одной из наиболее широко применяемых групп лекарственных средств. Например, НПВС назначают примерно 20% стационарных больных с различными заболеваниями внутренних органов [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова. - М: Гриф и К, 2012. - 944 с.].
Главным элементом механизма действия НПВС является угнетение синтеза воспалительных медиаторов - простагландинов. В процессе альтерации (первой стадии воспаления) из клеточной мембраны высвобождаются фосфолипиды, которые под действием фермента фосфолипазы А2 метаболизируются до арахидоновой кислоты. Арахидоновая кислота, в свою очередь, метаболизируется двумя путями: циклооксигеназным (ЦОГ) и липооксигеназным (ЛОГ). НПВС подавляют только ЦОГ, поэтому они блокируют развитие только второй стадии воспаления [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с.].
Существует 2 изофермента ЦОГ: ЦОГ-1 (конститутивный, существующий в норме) - контролирует выработку простаноидов, регулирующих физиологические функции желудка, сосудов и почек; ЦОГ-2 (индуцированный) - участвует в синтезе простагландинов при воспалении. ЦОГ-2 в норме отсутствует и образуется под действием тканевых факторов, индуцирующих воспалительную реакцию (цитокины и др.). Считается, что противовоспалительное действие НПВС обусловлено ингибированием ЦОГ-2, а побочные эффекты возникают в результате ингибирования ЦОГ-1 [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с.].
Наиболее известными НПВС являются кетопрофен (3-бензоил-альфа-метилбензолуксусная кислота), ибупрофен ((RS)-2-(4-изобутилфенил)пропионовая кислота), диклофенак (2-[(2,6-дихлорфенил)амино]бензол уксусная кислота), индометацин (1-(4-хлорбензоил)-5-метокси-2-метил-1H-индол-3-уксусная кислота) и напроксен ((S)-6-метокси-α-метил-2-нафталинуксусная кислота). В настоящее время напроксен занимает одну из лидирующих позиций в группе НПВС, поскольку оказывает более продолжительное действие, чем другие НПВС и хорошо переносится [Машковский М.Д. Лекарственные средства. 16-е изд., перераб., испр. и доп. - М.: Новая Волна, 2012. - 1216 с.].
Недостатком известных на сегодняшний день НПВС, а именно неселективных ингибиторов циклооксигеназы, является их выраженная гастротоксичность [Handa, О. The impact of non-steroidal anti-inflammatory drugs on the small intestinal epithelium / O. Handa, Y. Naito, A. Fukui, T. Omatsu, T. Yoshikawa // J. Clin. Biochem. Nutr. - 2014. - V. 54, N. 1. - P. 2-6.]. Селективные ингибиторы ЦОГ-2 менее гастротоксичны, однако известно их негативное влияние на сердечно-сосудистую систему [Singh, В.К. Assessment of nonsteroidal anti-inflammatory drug-induced cardiotoxicity / B.K. Singh, S.E. Haque, K.K. Pillai // Expert. Opin. Drug Metab. Toxicol. - 2014. - V. 10, N. 2. - P. 143-156.]. Таким образом, на дату представления заявочных материалов проблема снижения побочных эффектов НПВС обоих типов - селективных и неселективных ингибиторов циклооксигеназы, - остается неразрешенной.
Таким образом, разработка безопасных и эффективных НПВС является одной из важнейших задач фармакотерапии и здравоохранения в целом.
По мнению заявителя, основанному на анализе уровня техники, наиболее перспективным направлением разработки противовоспалительных средств является поиск неселективных НПВС. При этом, как отмечено выше, перед разработчиками стоит задача снижения побочных эффектов, основным из которых является гастротоксичность.
Защита карбоксильной группы неселективных ингибиторов ЦОГ является одним из основных способов снижения токсичности этой группы НПВС.Наиболее часто для этого применяют сложноэфирную защиту [Liu, W. Synthesis and biological evaluation of curcumin derivatives containing NSAIDs for their anti-inflammatory activity [Text] / W. Liu, Y. Li, Y. Yue, et al. // Bioorg. Med. Chem. Lett. - 2015. - V. 25, N. 15. - P. 3044-3051.]. Сложные эфиры НПВС являются типичными пролекарствами, которые в желудочно-кишечном тракте (далее - ЖКТ) подвергаются ферментативному гидролизу с постепенным высвобождением НПВС, обеспечивающим пролонгированный эффект лекарственного препарата. Помимо этого, пролекарства на основе сложных эфиров лучше проникают через цитоплазматические мембраны клеток, благодаря чему оказывают меньшее раздражающее действие на слизистую оболочку ЖКТ. Известны эфиры аскорбиновой кислоты с НПВС, являющимися производными арилуксусной или арилпропионовой кислот, такими как ибупрофен, кетопрофен, напроксен и их соли [ЕР 2431361, опубл. 21.03.2012]. Для лечения артритов, болей и воспалительных процессов предложен 2-метансульфонатэтиловый эфир напроксена совместно с антагонистом Н2 рецепторов [WO 200810106441, опубл. 21.08.2008]. Такая модификация НПВС приводит к снижению гастротоксичности, однако при этом значительно уменьшается и терапевтический эффект. По этой причине соединения такого рода не вошли в клиническую практику.
Наиболее близким по совокупности совпадающих признаков и достигаемому техническому результату к заявленному изобретению является техническое решение, описанное в изобретении по патенту RU 2513089 «Нестероидные противовоспалительные средства на основе производных пиридоксина», сущностью которого являются производные пиридоксина общей формулы (I)
где
при R2+R3=-С(СН3)2- или -CH(СН3)-;
при R1=H; R3=H;
, обладающие противовоспалительной активностью. Вариант прототипа, содержащий три фрагмента напроксена, является эффективным противовоспалительным соединением. В частности, он обладает выраженным противовоспалительным эффектом на модели подострого (формалинового) отека in vivo.
Однако на модели острого (каррагенинового) отека in vivo этот прототип оказался недостаточно эффективным. Важно отметить, что прототип не обладает одновременно совокупностью свойств, присущих заявленному техническому решению, а именно -высокой противовоспалительной (на модели острого (каррагенинового) отека in vivo), обезболивающей и жаропонижающей активностью в сочетании с низкой токсичностью, в том числе гастротоксичностью. По этой причине заявителем данный прототип не рассматривается в качестве препарата сравнения, вместо него с этой целью используется современное нестероидное противовоспалительное средство напроксен, и его аналоги (таблица 3).
Заявленное техническое решение в отношении заявленного состава отличается от описанного в прототипе наличием дополнительного фрагмента напроксена, который, по мнению заявителя, обоснованному экспериментально, обуславливает появление фармакологически значимых положительных эффектов. Так, сочетание в заявленной молекуле расщепляемых в физиологических условиях ковалентных сложноэфирных связей и нековалентной ионной связи, связывающих фрагменты напроксена и пиридоксина, обуславливает возникновение неочевидных для специалиста синергетических эффектов. Эти эффекты выражаются в повышенной противовоспалительной, обезболивающей и жаропонижающей активности, а также существенно пониженной гастротоксичности и острой токсичности. В частности, заявленное соединение формулы I на фоне пониженной гастротоксичности и острой токсичности обеспечивает быстрое наступление ярко выраженного противовоспалительного эффекта на модели как острого, так и подострого отека in vivo, в силу чего заявителю удалость разрешить, казалось бы, непреодолимую проблему, характерную как для прототипа, так и для многих других НПВС, включая напроксен (последний также является прототипом заявленного технического решения).
Задача заявленного технического решения состоит в создании фармацевтического средства на основе напроксена, обладающего высокой противовоспалительной, обезболивающей и жаропонижающей активностью в сочетании с низкой токсичностью, в том числе гастротоксичностью, значительно расширяющего арсенал известных средств указанного назначения.
Техническим результатом предлагаемого изобретения является новое нестероидное противовоспалительное средство на основе пиридоксина и напроксена, проявляющее высокую противовоспалительную, обезболивающую и жаропонижающую активность на фоне значительно меньшей токсичности, в том числе гастротоксичности, по сравнению с известными НПВС, в том числе с прототипом.
Поставленная задача решается, и заявленный технический результат достигается путем синтеза соединения формулы I и применением его в качестве противовоспалительного, обезболивающего и жаропонижающего средства с пониженной гастротоксичностью:
Заявленное техническое решение иллюстрируется следующими материалами:
Схема - химическая схема синтеза соединения формулы I;
Табл. 1 - Параметры режима градиентного элюирования при аналитической ВЭЖХ;
Табл. 2 - Острая токсичность соединения формулы I при внутрижелудочном введении;
Табл. 3 - Сравнительные характеристики соединения формулы I и некоторых известных НПВС;
Табл. 4 - Гастротоксичность соединения формулы I при однократном введении в дозе 2000 мг/кг;
Табл. 5 - Влияние соединения формулы I на острое экссудативное воспаление при внутрижелудочном введении;
Табл. 6 - Обезболивающий эффект соединения формулы I на крысах;
Табл. 7 - Жаропонижающий эффект соединения формулы I на крысах.
Сведения, подтверждающие состав и структуру заявленного соединения, приведены в примерах конкретного выполнения. Структура полученного соединения подтверждена методами 1Н и 13С ЯМР-спектроскопии, УФ-спектроскопии, хромато-масс-спектрометрии.
Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определяли относительно сигналов остаточных протонов дейтерированных растворителей (1Н и 13С). Температуры плавления продуктов определяли с помощью прибора Stanford Research Systems MP А-100 OptiMelt при скорости нагрева 1°С/мин. Для изучения спектральных характеристик растворов соединения формулы I был использован УФ-спектрофотометр Evolution 300 (Thermo scientific). Удельное вращение определяли на поляриметре автоматическом ADP440+(B&S) (Англия) при использовании кварцевой калибровочной кюветы 100° Z. Масс-спектры высокого разрешения (МСВР) регистрировали с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 эВ.
Определение чистоты соединения формулы I проводили методом обращеннофазной ВЭЖХ с использованием значений режима градиентного элюирования по таблице 1, при этом использовали высокоэффективный жидкостной хроматограф LCMS-2010EV, Shimadzu (Япония), снабженный диодноматричным детектором на колонке XBridge С18, (размер 4.6×50 мм, 3.5 мкм). Температура термостата колонки - плюс 40°С, скорость потока 1 мл/мин, объем вводимой пробы 1 мг/мл. УФ-детектирование осуществляли при аналитической длине волны 220 нм, а также 254 и 330 нм для определения примесей. В качестве подвижной фазы использовали: канал А - 0.1% по объему муравьиная кислота в воде, канал В - ацетонитрил. Режим работы насоса - градиентное элюирование, время анализа 22 минуты.
Примеры конкретного выполнения заявленного технического решения
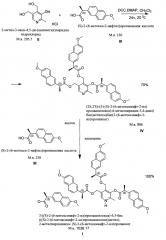
Получение заявленного соединения формулы I, содержащего фрагменты пиридоксина (витамина В6) и напроксена, осуществляют в две стадии с использованием коммерчески доступных субстратов, реагентов и растворителей по нижеприведенной схеме.
Пример 1. Получение (2S,2'S)-(5-((S)-2-(6-метоксинафт-2-ил)пропаноилокси)-6-метилпиридин-3,4-диил)бис(метилен)бис(2-(6-метоксинафт-2-ил)пропаноата) (соединение IV).
В круглодонную колбу загружают 28.35 г пиридоксина гидрохлорида II, 95.23 г напроксена III, 50.52 г 4-N,N-диметиламинопиридина и 123.73 г дициклогексилкарбодиимида в 5 л ацетона. Перемешивают реакционную смесь до прекращения образования осадка дициклогексилмочевины, после чего осадок отфильтровывают, промывают его 200 мл ацетона, а объединенный фильтрат упаривают в вакууме. Продукт очищают при помощи колоночной хроматографии на силикагеле (элюент этилацетат-петролейный эфир 1:1). Получают продукт IV в виде белого кристаллического вещества (выход 82.0 г, 74%). Более детально получение указанного соединения и его свойства описаны в изобретении по патенту RU 2513098.
Пример 2. Получение 3-((S)-2-(6-метоксинафт-2-ил)пропаноилокси)-4,5-бис (((S)-2-(6-метоксинафт-2-ил)пропаноилокси)метил)-2-метилпиридиний (S)-2-(6-метоксинафт-2-ил)пропаноата (соединение I).
Помещают 82.0 г соединения IV в круглодонную колбу, добавляют 1 л ацетона и перемешивают смесь в течение 10 минут. К полученному раствору добавляют 18.22 г (S)-2-(6-метокси-2-нафтил)пропионовой кислоты (напроксена) III и перемешивают до полного растворения осадка. Ацетон удаляют в вакууме на роторном испарителе (90 об/мин, остаточное давление 10 мбар, температура 40°С). Осадок собирают и сушат в вакууме на роторном испарителе (90 об/мин, остаточное давление 10 мбар, температура 80°С). Выход заявленного соединения I 100.1 г (99,9%).
Т. пл. 145°С. [a]24D=+22.8° (с=3.01, СН2Сl2). Спектры поглощения растворов соединения формулы I снимают в ацетонитриле и метиленхлориде в диапазоне длин волн от 200 до 450 нм, при этом они содержат максимумы поглощения при 262, 272, 317 и 332 нм. Отклонения положения максимумов составляют ±2 нм. Концентрация растворов 40 мкг/мл. В спектре ЯМР 1Н наблюдаются следующие сигналы (400 МГц, CDCl3, δ, м.д., J/Гц): 1.33 (уш д, 3 Н, СН3,3J=3.7); 1.40 (д, 3 Н, СН3, 3J=7.1); 1.50 (д, 6 Н, 2СН3, 3J=7.1); 1.90 (уш с, 3 Н, СН3); 3.47 (уш с, 1 Н,); 3.65 (к, 1 Н, СН, 3J=7.1); 3.74 - 3.87 (м, 13 Н); 4.50 (уш с, 1 Н); 4.80 (уш с, 1 Н); 4.95 и 5.04 (АВ, 2 Н, СН2, 2J=-12.8); 6.95-7.66 (м, 20 Н), 8.19 (с, 1 Н, СН). В спектре ЯМР 13С наблюдаются следующие сигналы (100 МГц, CDCl3, δ, м.д.): 17.96; 18.42; 18.52; 18.92; 45.02; 45.34; 45.38; 55.40; 57.13; 61.65; 105.66; 105.73; 119.09; 119.13; 119.18; 119.38; 125.96; 126.09; 126.16; 126.20; 126.38; 126.57; 127.30; 127.36; 127.49; 128.96; 129.01; 129.39; 129.64; 133.78; 133.81; 133.86; 134.05; 134.13; 135.18; 135.21; 135.42; 136.16; 144.78; 147.16; 152.75; 157.74; 157.79; 157.96; 171.95; 174.02; 179.30.
Целевое вещество I представляет собой соль соединения IV с напроксеном. В связи с этим в условиях обращеннофазной ВЭЖХ (таблица 1) оно проявляется на хроматограмме в виде двух пиков, соответствующих соединению IV и напроксену, масс-спектры которых соответствуют расчетным и литературным данным (806.3324 и 229.0870, соответственно).
Исследование острой токсичности соединения формулы I
Эксперимент проводили по методу фиксированной дозы на крысах линии Wistar обоего пола, по 6 голов в группе. Начальная доза для исследования при внутрижелудочном введении составляла 5000 мг/кг. В качестве растворителя использовали 0.5% раствор Твин-80 (Твин 80 - полиоксиэтилен, производное сорбитана и олеиновой кислоты, коммерчески доступный полимер), который готовили растворением 0.5 г Твин-80 в 100 мл дистиллированной воды.
Для приготовления дозы 5000 мг/кг взвешивали навеску 25 г исследуемого соединения в полистирольных лодочках на весах Vibra (Shinko Denshi, Япония, кат. №AF225DRCE), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5% водным раствором Твин-80 и суспензию препарата размешивали при помощи диспергатора SilentCrusher (Heidolph, Германия, P/N 595-06000-00-3) до однородной консистенции.
Введение осуществляли животным, лишенным корма (на промежуток времени не менее 8 часов) со свободным доступом к воде. Объем введения рассчитывали индивидуально для каждого животного, основываясь на массе тела, зарегистрированной непосредственно перед введением вещества. Доступ к корму возобновляли через час после введения. Животных наблюдали индивидуально после введения на протяжении 30 минут, затем не реже раза в час на протяжении 4-х часов, далее ежедневно 1 раз в день в течение 14 дней. Массу тела регистрировали непосредственно перед введением препарата для расчета объема введения, далее 1 раз в два дня. Если животное умирало в течение исследования, устанавливали и документировали время гибели с максимально возможной точностью. Животное взвешивали и вскрывали, как можно раньше. Умирающих животных взвешивали, подвергали эвтаназии и вскрывали. Животных подвергали эвтаназии методом ингаляции углекислым газом. Расчет токсических доз ЛД10, ЛД16, ЛД50 и ЛД84 производили с использованием пробит-анализа в программном обеспечении IBM SPSS Statistics.
При внутрижелудочном введении в дозе 5000 мг/кг наблюдалось небольшое угнетение активности животного. Через 20-30 минут данный симптом исчезал. Через 1.5-2 часа животные начинали принимать корм и воду. Через трое суток пала 1 крыса (самка). Далее на протяжении исследования падежа не наблюдалось.
На протяжении всего эксперимента все основные показатели жизнедеятельности у подопытных животных соответствовали норме и не отличались от контрольных. У животных отмечался хороший аппетит, блестящая шерсть, видимые слизистые оболочки были бледно-розового цвета, поведение соответствовало данному виду животного, никаких отклонений при наблюдении выявлено не было. Масса тела крыс через 2 и 4 дня после начала эксперимента увеличивалась на (1-4) % и (2-6) %, соответственно, что приблизительно соответствует приросту массы у крыс контрольной группы. На восьмые сутки исследования масса животных увеличивалась на (2-8) %. На конец эксперимента повышение массы составило (5-13) %. Параметры острой токсичности представлены в таблице 2.
В конце эксперимента проводили эвтаназию и патоморфологическое вскрытие контрольных и подопытных животных. При вскрытии крыс никаких изменений не наблюдалось. Трупы животных правильного телосложения, средней или выше средней упитанности. Естественные отверстия: рот - закрыт, язык находится в ротовой полости, слизистая оболочка губ, десен бледно-розовые гладкие, блестящие. Носовые отверстия - слизистая бледно-розовая, сухая, истечений нет, проходимость хорошая. Ушные раковины без изменений, наружный слуховой проход чистый. Анус - закрыт, слизистая оболочка бледно-розовая. Шерсть удерживается хорошо, шерстный покров блестящий. Кожа эластичная, подкожная клетчатка хорошо выражена, желтоватого цвета, эластичная. Мышцы красноватого цвета, хорошо развиты, сухожилия и связки белого цвета, эластичные, прочные. Конфигурация костей и суставов не нарушена. Положение органов грудной и брюшной полостей анатомически правильное. Жидкости в грудной и брюшной полостях нет. Проходимость глотки и пищевода не нарушена. Сердце в объеме не изменено. В полостях сердца содержится незначительное количество несвернувшейся крови, эндокард гладкий, блестящий. Легкие бледно-розового цвета, равномерно окрашенные, без признаков отечности, дольчатость выражена хорошо. Селезенка не увеличена в объеме, края острые, продолговатой формы, упругой консистенции, красно-коричневого цвета. Печень не увеличена в размере, края острые, форма не изменена, консистенция плотная, цвет красно-коричневый. Желудок содержит кормовую массу серого цвета, однородной консистенции. Слизистая оболочка желудка бледно-серого цвета. Слизистая оболочка тонкого и толстого отделов кишечника бледно-розового или бледно-серого цвета. Почки бобовидной формы, темно-коричневого цвета, в околопочечной клетчатке содержится умеренное количество жира, капсула отделяется легко, граница между корковой и мозговой зонами выражена. Мочевой пузырь пустой или переполнен мочой светло-желтого цвета, слизистая оболочка бледно-розового цвета. Половые органы без отклонений. У самцов семенники упругой консистенции, находятся в полости мошонки, имеют эллиптическую форму. У самок яичники и матка в норме. Головной мозг не отечен, мозговое вещество упругой консистенции, без кровоизлияний.
Таким образом, проведенные исследования показали, что заявленное соединение формулы I при внутрижелудочном введении относится к 4 классу опасности, т.е. к малоопасным веществам (ГОСТ 12.1.007-76 "Вредные вещества. Классификация и общие требования безопасности") и по безопасности, выраженной значением летальной дозы ЛД50, превосходит большинство известных на сегодняшний день НПВС (таблица 3). Например, заявленное соединение в 8 раз менее токсично в сравнении с напроксеном.
Гастротоксичность соединения формулы I
При исследовании гастротоксичности использовали самок и самцов крыс линии Wistar в возрасте 6-7 недель, с массой тела 180-220 г. Количество животных в каждой группе составляло 10 голов.
Соединение формулы I вводили однократно внутрижелудочно крысам, лишенным пищи за 16 ч до исследования. Через 3 ч после введения суспензии исследуемого вещества в дозе 2000 мг/кг (в 0.5% водном растворе Твин-80) животных подвергали эвтаназии, извлекали желудки, рассекали их по малой кривизне и промывали в физиологическом растворе для удаления содержимого.
Оценку гастротоксичности проводили по 4-балльной шкале:
0 - отсутствие повреждений; 0.5 - гиперемия;
1 - единичные незначительные повреждения (1 или 2 точечных кровоизлияния);
2 - множественные повреждения (эрозии, точечные кровоизлияния);
3 - значительные и множественные повреждения слизистой (эрозии, кровоизлияния);
4 - грубые повреждения, охватывающие всю поверхность слизистой (массивные кровоизлияния, эрозии, перфорации).
По результатам оценки определяли УД50 - дозу исследуемого вещества, вызывающую гастротоксический (ульцерогенный) эффект, соответствующий 2 баллам.
Для приготовления дозы 2000 мг/кг взвешивают навеску 32.0 г соединения формулы I в полистирольных лодочках на весах Vibra (Shinko Denshi, Япония, кат. № AF225DRCE), переносят в мерную колбу объемом 400 мл класса точности А, доводят до метки 400 мл 0.5 %-ным водным раствором Твин-80 и суспензию препарата размешивают при помощи диспергатора SilentCrusher (Heidolph, Германия, P/N 595-06000-00-3) до однородной консистенции. Введение крысам осуществляют в объеме не более 5 мл/200 г.
Животные подвергались эвтаназии методом ингаляции углекислым газом.
При однократном введении соединения формулы I в дозе 2000 мг/кг гастротоксическое действие соответствовало в среднем 0.6 баллам у самцов крыс и 0.4 баллам у самок (таблица 4).
Таким образом, для соединения формулы I значение УД50>2000 мг/кг, что превосходит аналогичный параметр для большинства НПВС (таблица 3). Например, заявленное соединение в 40 раз менее гастротоксично в сравнении с напроксеном.
Противовоспалительная активность соединения формулы I in vitro
Структурный фермент циклооксигеназа 1 (ЦОГ 1) экспрессируется в различных типах клеток и участвует в обеспечении их нормальной (физиологической) функциональной активности. Циклооксигеназа 2 (ЦОГ 2) ответственна за синтез простагландинов в условиях сильного воспаления.
Анализ активности ЦОГ заключался в измерении пероксидазной активности циклооксигеназы. В ходе реакции PGG2 (простагландин G2) с ADHP (10-ацетил-3,7-дигидрофеноксазин), представленном в используемом наборе («Cyclooxygenase (СОХ) Activity Assay Kit (Fluorometric)» (Biovision, кат № К 549-100) в виде СОХ probe, образуется флуоресцентный компонент резоруфин, длина волны поглощения которого составляет 530-540 нм, длина волны испускания - (585-595) нм. Интенсивность флуоресценции прямо пропорциональна остаточной активности ЦОГ в образце. В качестве источника фермента циклооксигеназы были выбраны клетки фибробластов кожи (HSF). Было показано, что клеточный лизат фибробластов обладает активностью ЦОГ, равной 2.131 μU/mg.
Приготовление клеточного лизата. Клетки фибробласты кожи (2-6×106) промывают единожды 10 мл фосфатного буфера. Ресуспендируют в 5 мл буфера и переносят клетки в 15 мл пробирку. Центрифугируют при 1500g в течение 4-х минут. Далее сливают супернатант, ресуспендируют клеточный осадок в 0.5-1 мл холодного лизирующего буфера с протеазным коктейлем (примерно 0.4 мл буфера на 100 мкл клеточного осадка), и центрифугируют при 4°С в течение 15 мин при 10000g. Отделяют супернатант и используют его в качестве источника ЦОГ.
Приготовление реагентов. Растворяют СОХ кофакторы в 200 раз, добавляя 2 мкл кофакторов к 398 мкл буфера сразу перед использованием. Смешивают 65 мкл арахидоновой кислоты и 65 мкл NaOH, затем разбавляют в 10 раз, добавив 1170 мкл дистиллированной воды. Раствор стабилен в течение 1 часа.
Готовят реакционную смесь (для 2-х параллельных лунок), смешав следующие реагенты, указанные ниже:
- СОХ probe - 2 мкл;
- растворенный кофактор - 4 мкл (стабилен в течение 1 часа);
- клеточный лизат - 20 мкл;
- с помощью СОХ буфера доводят объем до 172 мкл.
Приготовление тестируемых веществ:
Используют стоковые растворы напроксена и вещества формулы I в диметилсульфоксиде (ДМСО) концентрацией 1000 мкМ для приготовления предварительных разведений с шагом в 2 раза. Получают соответственно 5 концентраций от 62.5 до 1000 мкМ.
Используя мультиканальную пипетку, добавляют реагенты в соответствующие лунки планшета: сначала реакционную смесь, затем растворы тестируемых веществ в ДМСО в ряду концентраций и контрольных веществ (ингибитор ЦОГ 1 SC560 и ингибитор ЦОГ 2 Celecoxib), чистый растворитель ДМСО (для лунок с высшей активностью). Используют две повторности. Инкубируют в течение 5 минут.
Инициирование реакции. До начала реакции проводят однократное измерение флуоресценции во всех лунках планшета для учета собственного сигнала тестируемых и контрольных веществ. Затем во все лунки планшета с помощью мультиканальной пипетки добавляют 10 мкл раствора арахидоновой кислоты для инициирования реакции. После добавления арахидоновой кислоты немедленно начинают измерять флуоресценцию (Ex/Em=535/587 нм) в кинетическом режиме каждые 15 секунд в течение 30 мин.
Параметр флуоресценции образов с контрольными и тестируемыми веществами вычисляют по формуле:
Average Net RFU=Average RFU - Average Blank RFU
Процент ингибирования ЦОГ вычисляют по формуле:
Далее по имеющимся точкам данных для исследуемого вещества и вещества сравнения (напроксена) строят наиболее подходящую сигмоидную кривую ингибирования. Исходя из этой кривой, вычисляют IC50 тест-препарата для ЦОГ.
Согласно рекомендациям производителя используемого набора, ингибитор ЦОГ-1 SC560 и ингибитор ЦОГ-2 целекоксиб добавляют в реакционную смесь в объеме по 2 мкл (этого количества достаточно для полного ингибирования соответствующей изоформы). Остаточная активность ЦОГ, содержащейся в клеточном лизате после обработки SC560 и целекоксибом, составляет соответственно 72.8% и 32.0%.
При исследовании ингибирующей активности концентрация напроксена и исследуемого вещества в лунке составляет от 1.25 до 20 мкМ.
Для определения доли ингибирования препаратом каждой из изоформ тестируют исследуемые вещества в раскладке концентраций в присутствии селективного ингибитора ЦОГ 1 SC560, а также в присутствие селективного ингибитора ЦОГ 2 целекоксиб. Ингибитор добавляют в количестве, достаточном для полного ингибирования соответствующей изоформы фермента, при этом другая изоформа сохраняет активность.
Условно приняв активность в присутствие только тестового препарата за 100%, рассчитывают остаточную активность ЦОГ 1 и ЦОГ 2 и процент ингибирования каждой изоформы препаратом. Соединение формулы I проявляет преимущественную ингибирующую активность по отношению к изоформе ЦОГ-2.
Таким образом, IC50 напроксена (прототип) составляет 9.56 мкМ, что в 1.25 раз больше IC50 соединения формулы I, равной 7.7 мкМ. Из вышесказанного можно сделать вывод, что заявленное соединение формулы I более эффективно в качестве ингибитора циклооксигеназы, поскольку действует при более низкой концентрации.
Противовоспалительная активность соединения формулы I in vivo
Эксперимент проводили с использованием самок и самцов крыс линии Wistar в возрасте 6-7 недель с массой тела 180-220 г. Количество животных в каждой группе составляет 10 голов.
Острую воспалительную реакцию (отек) воспроизводили субплантарным (под подошвенный или плантарный апоневроз) введением 0.1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха). Выраженность воспалительной реакции оценивали через 3 ч после индукции воспаления по изменению объема лапы (онкометрически). Вещество формулы I вводили зондом в желудок за 1 ч до введения 1% раствора каррагенина. В качестве негативного контроля использовали 0.5% раствор Твин-80. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах к контролю. По результатам действия четырех доз исследуемого вещества проводили расчет ЭД50.
Для приготовления дозы 50 мг/кг взвешивали навеску 1000 мг соединения формулы I в полистирольных лодочках на весах Vibra (Shinko Denshi, Япония, кат. №AF225DRCE), переносили в мерную колбу объемом 200 мл класса точности А, доводили до метки 200 мл 0.5%-ным водным раствором Твин-80 и суспензию препарата размешивали при помощи диспергатора SilentCrusher (Heidolph, Германия, P/N 595-06000-00-3) до однородной консистенции. Введение крысам осуществляли в объеме не более 1 мл/100 г. Концентрация полученного раствора 5 мг/мл.
Для приготовления дозы 20 мг/кг брали 40 мл раствора с концентрацией 5 мг/мл (50 мг/кг), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5%-ным водным раствором Твин-80 и суспензию препарата размешивали при помощи диспергатора до однородной консистенции.
Для приготовления дозы 10 мг/кг брали 20 мл раствора с концентрацией 5 мг/мл (50 мг/кг), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5%-ным водным раствором Твин-80 и суспензию препарата размешивали при помощи магнитной мешалки MR Hei-Standard (Heidolph, Германия) до однородной консистенции.
Для приготовления дозы 5 мг/кг брали 4 мл раствора с концентрацией 5 мг/мл (50 мг/кг), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5%-ным водным раствором Твин-80 и суспензию препарата размешивали при помощи магнитной мешалки до однородной консистенции.
Животных наблюдали индивидуально после введения на протяжении 30 минут, затем не реже раза в час на протяжении 4-х часов. Массу тела регистрировали непосредственно перед введением препарата для расчета объема введения.
Животных подвергали эвтаназии методом ингаляции углекислым газом.
При введении дозы 50, 20, 10 и 5 мг/кг соединения формулы I самцам крыс наблюдалось снижение воспалительного отека на 62.34, 51.25, 23.57 и 12.39%, соответственно, в отличие от контрольной группы. У самок крыс при введении дозы 50, 20, 10 и 5 мг/кг соединения формулы I отек снижался на 65.47, 67.89, 38.64 и 13.37%, соответственно. Результаты представлены в таблице 5.
По результатам статистической обработки полученных данных ЭД50 соединения формулы I на самцах составляет 23 мг/кг, на самках 14 мг/кг. Среднее значение ЭД50 без деления на пол составляет 18.5(~19) мг/кг.
Согласно литературным данным, ЭД50 напроксена составляет 15 мг/кг, ибупрофена - 48 мг/кг, диклофенака натрия - 8 мг/кг, пироксикама - 20 мг/кг, фенилбутазона - 56 мг/кг, индометацина - 10 мг/кг, ацетилсалициловой кислоты - 98 мг/кг [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с.]. Таким образом, заявителем экспериментально доказано наличие высокой противовоспалительной активности соединения формулы I, которая по своему значению превосходит (в четырех случаях из семи) или сопоставима с противовоспалительной активностью современных НПВС.
Обезболивающее действие соединения формулы I
При исследовании обезболивающих свойств соединения формулы I использовали самок и самцов крыс линии Wistar в возрасте 6-7 недель, с массой тела 180-220 г. Количество животных в каждой группе составляло 10 голов.
Хроническое иммунное воспаление моделировали у крыс субплантарным введением в правую заднюю лапу 0.1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха). Вещество вводили внутрижелудочно с применением желудочного зонда. В качестве препарата сравнения использовали напроксен, в качестве негативного контроля использовали 0.5% раствор Твин-80. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах по отношению к контролю; по результатам действия четырех доз исследуемого вещества проводили расчет ЭД50.
Воспалительную гиперальгезию (повышенную болевую чувствительность воспаленных тканей у крысы) вызывали каррагенином и оценивали по снижению порога болевой чувствительности - ПБЧ (по разности ПБЧ) на механическое раздражение (сдавливание) тканей лапы животного до введения каррагенина и через 3 ч после него. Измерение проводили на воспаленной лапе. Используемый анальгезиметр Ugo Basile S.R.L. (Италия) обеспечивает плавное увеличение нагрузки на воспаленную лапу крысы до появления болевой реакции (оцениваемой по писку животного или отдергиванию лапы). Исследуемые вещества вводили через 2 ч после введения каррагенина. Обезболивающий эффект с определением ЭД50 оценивали по снижению гиперальгезии через 1 ч после внутрижелудочного введения испытуемых веществ. Увеличение порога болевой реакции под влиянием исследуемых веществ выражался в повышении силы сдавливания конечности и характеризовал выраженность обезболивающего действия препарата. После эксперимента животные подвергались эвтаназии методом ингаляции углекислым газом.
Для приготовления дозы 50 мг/кг взвешивали навеску 1000 мг соединения формулы I в полистирольных лодочках на весах Vibra (Shinko Denshi, Япония, кат. №AF225DRCE), переносили в мерную колбу объемом 200 мл класса точности А, доводили до метки 200 мл 0.5%-ным водным раствором Твин-80 и суспензию диспергировали при помощи диспергатора SilentCrusher (Heidolph, Германия, P/N 595-06000-00-3) до однородной консистенции. Введение крысам осуществляли в объеме не более 1 мл/ 100 г. Концентрация полученного раствора составляла 5 мг/мл.
Для приготовления дозы 20 мг/кг брали 40 мл раствора с концентрацией 5 мг/мл (50 мг/кг), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5%-ным водным раствором Твин-80 и суспензию диспергировали при помощи диспергатора до однородной консистенции.
Для приготовления дозы 10 мг/кг брали 20 мл раствора с концентрацией 5 мг/мл (50 мг/кг), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5%-ным водным раствором Твин-80 и суспензию перемешивали при помощи магнитной мешалки MR Hei-Standard (Heidolph, Германия) до однородной консистенции.
Для приготовления дозы 5 мг/кг брали 4 мл раствора с концентрацией 5 мг/мл (50 мг/кг), переносили в мерную колбу объемом 100 мл класса точности А, доводили до метки 100 мл 0.5%-ным водным раствором Твин-80 и суспензию перемешивали при помощи магнитной мешалки до однородной консистенции.
Результаты эксперимента представлены в таблице 6.
Из представленных результатов следует, что заявленное соединение формулы I проявляет выраженный обезболивающий эффект уже в дозе 5 мг/кг, в то время как напроксен (прототип) оказывает аналогичное воздействие лишь в дозе 15 мг/кг, что является доказательным фактом его более высокой эффективности. Таким образом, терапевтический индекс (ЛД50/ЭД50) заявленного соединения в плане его обезболивающей активности составляет более 1000 против 42 у напроксена, а индекс безопасности (УД50/ЭД50) - более 400 против 3.2 у напроксена.
Жаропонижающий эффект соединения формулы I на крысах
При исследовании жаропонижающих свойств соединения формулы I использовали