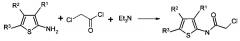Четвертичные аммонийные производные 2-аминотиофен-3-карбоксилатов, обладающие противотуберкулезной активностью
Иллюстрации
Показать всеИзобретение относится к новым четвертичным аммонийным солям производных 2-аминотиофен-3-карбоновых кислот, обладающих противотуберкулезной активностью, общей формулы I и формулы II:
где X отсутствует или представляет собой -СН2-, -(СН2)2-, СН3СН-, -N(R4)-; R1 представляет собой CN, C(O)OR5, C(O)NHR6; R4 представляет собой алифатические насыщенные, неразветвленные или разветвленные С1-С5 углеводороды, бензил; R5 представляет собой алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды; R6 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, циклические углеводороды С3-С7. 2 н.п. ф-лы, 2 табл., 12 пр.
Реферат
Изобретение относится к области медицины и непосредственно касается синтеза новых химических соединений - четвертичных аммонийных производных 4,5-замещенных 2-аминотиофен-3-карбоксилатов - потенциальных противотуберкулезных препаратов.
На протяжении многих десятилетий одним из важнейших направлений мировой медицины оставался поиск наиболее эффективных препаратов, обладающих противотуберкулезной активностью. Данная тематика остается актуальной и в настоящее время. Во всем мире, по некоторым оценкам, два миллиарда людей являются носителями латентного туберкулеза (World Health Organization Global Tuberculosis Report 2015. October 22, 2015 http://www.who.int/tb/publications/global_report/en/). Поиск лекарств с конца 20-го века во многом был сосредоточен на мишень-ориентированных методах, которые имеют место и оправдывают себя и в случае борьбы с туберкулезом. Определение полной последовательности генома микобактерий туберкулеза H37Rv сыграло решающую роль в выявлении новых мишеней для воздействия новых противотуберкулезных препаратов. Идентификация белков привела исследователей к мишень-направленным подходам для скрининга соединений. Тем не менее, у этого подхода существует ряд основных ограничений. Концепция разработки антибактериальных препаратов (в том числе противотуберкулезных), основанная на биохимическом мишень-направленном отборе соединений, ингибирующих жизненно важные ферменты in vitro, оказалась относительно ограниченной применительно к М. tuberculosis. Подавляющее большинство отобранных таким способом соединений не оказывает действия на бактериальную клетку в силу разных причин, одной из которых является непроницаемость бактериальной клеточной стенки для этих соединений. К сегодняшнему дню идентифицирован ряд белковых мишеней для МТБ: например PknG, PanC, FtsZ, FadD32, DprE1, EthR, Pks13 и др.
В качестве противотуберкулезных средств с 1960 года используются такие препараты, как рифампицин, изониазид, пиразинамид, этамбутол и их различные комбинации. При лечении туберкулеза данными препаратами используют так называемый режим «краткосрочного курса химиотерапии». Бедаквилин, недавно одобренный FDA, относится к группе диарилхинолинов - новому классу противотуберкулезных соединений. Бактерицидное действие препарата обусловлено специфическим ингибированием протонной помпы АТФ-синтазы микобактерий (аденозин 5'трифосфат-синтазы) - фермента, играющего основную роль в процессе клеточного дыхания Mycobacterium tuberculosis. Угнетение синтеза АТФ приводит к нарушению выработки энергии и, как результат, к гибели микробной клетки.
Основным недостатком известных препаратов является их недостаточная эффективность, объясняемая возникновением множественной лекарственной устойчивости (МЛУ) у возбудителя туберкулеза к данным препаратам. Распространение частично и полностью устойчивых к лекарственным средствам штаммов (туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ), с широкой лекарственной устойчивостью (ШЛУ-ТБ)) приводит к необходимости разработки новых противотуберкулезных препаратов, которые могут быть одинаково эффективны против М. tuberculosis (МТБ).
Выявлено, что противотуберкулезной активностью обладает ряд химических соединений, содержащих тиофеновое ядро, которое присутствует в структуре большого числа природных и синтетических соединений с широким спектром фармакологических свойств, включая антитуберкулезную активность (A. Kleemann, J. Engel, В. Kutscher, D. Reichert, Pharmaceutical Substances. Syntheses, Patents, Applications, fourth ed., vols. 1-2, Thieme, 2001). Тиофеновый фрагмент, например, содержащий аналог витамина - тиамина (3-деазатиамин дифосфат), который рассматривается как селективный ингибитор микобактериального фермента 2-гидрокси-3-оксоадипатсинтазы (HOAS) (Zhao Н., de Carvalho L.P.S., Nathan C. A protecting group-free synthesis of deazathiamine: a step toward inhibitor design // Bioorg Med Chem Lett. 2010; 20(22): 6472-6474), a производные тиофенкарбоксамидов рассматриваются как ингибиторы цитидин трифосфатсинтазы (Mori G., Chiarelli L.R., Esposito М. Thiophenecarboxamide Derivatives Activated by EthA Kill Mycobacterium tuberculosis by Inhibiting the CTP Synthetase PyrG. Chem Biol. 2015; 22(7):917-927).
Противотуберкулезной активностью обладают замещенные производные 2-аминотиофена. Они нашли широкое применение в комбинаторной и медицинской химии в основном как ингибиторы с низкой молекулярной массой (Huang Y., A. The Gewald multicomponent reaction. Mol. Divers. 2011, 15(1): 3-33). К этой группе соединений относится препарат АХ20017, обладающий противотуберкулезными свойствами, идентифицированный в качестве специфического ингибитора протеинкиназы G (PknG), ингибирование которой приводит к лизосомальной локализации и гибели микобактериальных клеток в инфицированных макрофагах (Walburger A., Koul A., Ferrari G. еt al. Protein kinase G from pathogenicmycobacteria promotes survival within macrophages. Science (2004), 304:1800-1804). Противотуберкулезными свойствами обладают также производные 2-амино-5-(4-(бензилокси)фенил)тиофен-3-карбоновой кислоты в отношении микромолярных МИК против МТБ, которые вместе с этим имеют низкую токсичность против клеток VERO (Lu X., Wan В., Franzblau S.G., You Q. Design, synthesis and anti-tubercular evaluation of new 2-acylated and 2-alkylated amino-5-(4-(benzyloxy)phenyl)thiophene-3-carboxylic acid derivatives. Part 1. European J. Med. Chem. 46 (2011) 3551-3563). Другие производные 2-аминотиофена, а именно 2-аминотиофен-3-карбоновой кислоты, выявлены как ингибиторы поликитидсинтазы (Pks13) - фермента, играющего важную роль в биосинтезе миколовых кислот в МТБ. Блокирование действия Pks13 нарушает синтез слоя миколовых кислот клеточной стенки бактерий (R. Wilson, P. Kumar, V. Parashar et al. Nat. Chem. Biol., 2013, 9, aminothiophenes against Mycobacterium tuberculosis. Org Biomol Chem. 2016; 14(25):6119-33).
Производные тиофенкарбоксамида TCA1 идентифицированы как ингибиторы DprE1, предотвращающие образование биопленок микобактерий, и показывающие активность против штамма дикого типа МТБ, активного штамма МТБ МЛУ-ТБ и латентного МЛУ-ТБ in vivo (Wang F., Sambandan D., Halder R. Identification of a small molecule with activity against drug-resistant and persistent tuberculosis, Proc. Natl. Acad. Sci. 110 (2013) E2510-E2517).
Высокой активностью обладают и два производных 2-ациламинотиофен-3-карбоксамида с высокой активностью (IC90 0,5 и 3.2 мкг/мл) и индексом селективности SI > 10 (Reynolds R.С., Ananthan S., Faaleolea Е. еt al. Tuberculosis, 92 (2012) 72-83), а также модифицированные 2-аминотиофен-3-карбоксамиды, показавшие активность против МТБ в микромолярном диапазоне (Nallangi R., Samala G., Sridevi J.P. et al. European J. Med. Chem. 76 (2014) 110-117) и производные 2-амимнотиофен-3-карбонитрилов подавляют рост МТБ и (MDR- МТБ) и являются ингибиторами антигена Ag85A (Scheich С., Puetter V., Schade М. Novel Small Molecule Inhibitors of MDR Mycobacterium tuberculosis by NMR Fragment Screening of Antigen 85C. J. Med. Chem. 2010, 53, 8362-8367).
Для лечения туберкулеза также применяются тетрагидробензотиофен-3-карбоновые кислоты и их производные, которые проявляют активность против МТБ, (US 2009018149, C07D 333/66, 2009); US 2009298842, A61K 31/38, 2009); US 2007275962, C07D 209/42, 2007)). Как известно, в состав большинства современных дезинфекционных и антисептических средств входят четвертичные аммонийные соединения (ЧАС). Они обладают широким спектром антимикробной активности в отношении грамположительных и некоторых грамотрицательных бактерий, грибов, липофильных вирусов. Из них наиболее известные и эффективные представители хлорид бензалкония, цетавлон и цетримид. Действие известных ЧАС на микобактерии ограничивается ингибированием их роста. Механизм высокой резистентности микобактерий связан с повышенным содержанием арабиногалактана, липидов и восков, придающих выраженную гидрофобность клеточной стенке (Broadley S.J., Jenkins Р.А., Furr J.R., Pussell A.D. J. Med. Microbiol. - 1995. - № 43. - P. 18-122). Вследствие этого гидрофильные молекулы дезинфектантов не способны проникать через клеточную стенку микобактерий в количествах, необходимых для достижения бактерицидного эффекта. Показано, что уровень активности ЧАС в отношении микобактерий может быть значительно увеличен путем изменений в составе формул и создания новых препаратов (Khunkitti W., Lloyd D., Furr J.R., Russell A.D. J. Appl. Microbiol. - 1996. - № 81. - P. 73-77).
С целью создания новых противотуберкулезных средств, активных в отношении штаммов МТБ (M. Tuberculosis), обладающих множественной лекарственной устойчивостью, предлагаются новые четвертичные аммонийные соли производных 2-аминотиофен-3-карбоновых кислот, обладающие противотуберкулезной активностью, общей формулы I:
где X отсутствует или представляет собой -СН2-, -(СН2)2-, СН3СН-, -N(R4)-;
R1 представляет собой CN, C(O)OR5, C(O)NHR6;
R4 представляет собой алифатические насыщенные, неразветвленные или разветвленные С1-С5 углеводороды, бензил;
R5 представляет собой алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды;
R6 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, циклические углеводороды С3-С7;
а также предлагаются Четвертичные аммонийные соли производных 2-аминотиофен-3-карбоновых кислот, обладающие противотуберкулезной активностью, общей формулы II:
где R1 представляет собой CN, C(O)OR5, C(O)NHR6;
R2 представляет собой Н или алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды
R3 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, фенил;
R5 представляет собой алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды;
R6 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, циклические углеводороды С3-С7.
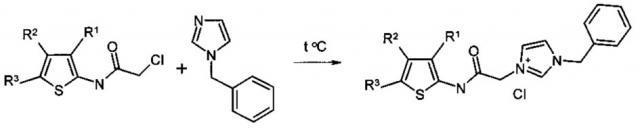
Предлагаемые соединения обладают противотуберкулезной активностью. К предлагаемым соединениям общей формулы I, например, относятся: 1-бензил-3-(2-(3-(метоксикарбонил)-5,6-дигидро-4Н-циклопента[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 1)
1-бензил-3-(2-(3-циано-5,6,7,8-тетрагидро-4Н-гиклогепта[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 2)
1-бензил-3-(2-(3-(этоксикарбонил)-5,6,7,8-тетрагидро-4Н-гиклогепта[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 3)
1-бензил-3-(2-(3-(метоксикарбонил)-4,5,6,7-тетрагидробензо[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 4)
1-бензил-3-(2-(3-циано-4,5,6,7-тетрагидробензо[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 5)
1-бензил-3-(2-(6-метил-3-(этоксикарбонил)-4,5,6,7-тетрагидробензо[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 6)
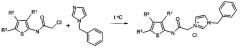
К предлагаемым соединениям общей формулы II, например, относятся: 1-бензил-3-(2-(3-(диметилкарбамоил)-3-(пропоксисарбонил)тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 7)
1-бензил-3-(2-(4,5-диметил-3-цианотиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 8)
1-бензил-3-(2-(3,5-бис(метоксикарбонил)-4-метилтиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 9)
1-бензил-3-(2-(5-фенил-3-(этоксикарбонил)тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 10)
1-бензил-3-(2-(5-метил-3-(циклогексилкарбамоил)-4-этилтиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 11)
1-бензил-3-(2-(4,5-диметил-3-(метоксикарбонил)тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 12)
Заявляемые производные 2-аминотиофен-3-карбоновых кислот представляют собой четвертичные аммониевые соли и их получают взаимодействием соответствующих хлорацетамидов с N-бензилимидазолом в органическом растворителе при нагревании.
Исходные алкилхлориды получают ацилированием хлорацетилхлоридом производных 2-аминотиофен-3-карбоновых кислот, получаемых известным методом по реакции Гевальда из карбонилных соединений (алифатических альдегидов и кетонов), активированных нитрилов и серы в присутствии вторичного амина (Huang Y., A. The Gewald multicomponent reaction. Mol. Divers. 2011, 15(1): 3-33) согласно представленному ниже механизму реакции:
1-Бензил-1H-имидазол получают по известной методике (Синтезы гетероциклических соединений. Выпуск 8. Изд-во АН АрмССР, Ереван, 1969, стр. 20).
Данный способ получения относится ко всем заявляемым соединениям и описано ниже в конкретных примерах.
Определение антимикобактериальной активности четвертичных аммонийных солей производных 2-аминотиофен-3-карбоновых кислот проводилось на культуре микобактерий М. smegmatis mc2 155 диско-диффузионным методом (по Keurby-Bauer).
Активность четвертичных аммонийных солей производных 2-аминотиофен-3-карбоновых кислот в качестве потенциальных ингибиторов серин/треониновых протеинкиназ эукариотического типа (СТПК) микобактерий осуществлялась на культуре М. smegmatis APHVIII+ диско-диффузионным методом.
Ниже изобретение иллюстрируется примерами, которые не ограничивают объем притязаний в рамках заявленной формулы изобретения.
Пример 1
Получение 1-бензил-3-(2-(3-(метоксикарбонил)-5,6-дигидро-4Н-циклопента[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорида (Соединение 1).
Смесь 158 мг (1 ммоль) N-бензилимидазола и 287 мг (1.05 ммоль) 3-(метоксикарбонил)-5,6-дигидро-4Н-циклопента[b]тиофен-2-иламино-2-оксоэтил-3-хлорида в 10 мл сухого диоксана перемешивают при слабом кипении в течение 8-16 часов (контроль протекания реакции по ТСХ), охлаждают до комнатной температуры и оставляют на 12 часов. Выпавший осадок отфильтровывают, промывают горячим гексаном, перекристаллизовывают из изопропанола и сушат в вакуумном шкафу при 10 мм рт.ст. Получают 320 мг белых кристаллов. Выход 74%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 12.26 (br. s, 1Н, NH), 9.31 (s, 1Н, HIm), 7.85 (s, 1Н, HIm), 7.78 (s, 1H, HIm), 7.43 (s, 5H, Ph), 5.51 (s, 2H, CH2N+), 5.39 (s, 2H, PhCH2N), 2.58 (s, 2H, цикл-СН2), 2.50 (s, 4H, цикл-СН2 + DMSO), 1.75 (s, 5H, цикл-СН2).
Пример 2
1-Бензил-3-(2-(3-циано-5,6,7,8-тетрагидро-4Н-циклогепта[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 2)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 82%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 12.15 (s, 1Н, NH), 9.28 (s, 1Н, HIm), 7.85 (t, J = 1.7, 1Н, HIm), 7.77 (t, J = 1.6, 1H, HIm), 7.47-7.38 (m, 5H, Ph), 5.51 (s, 2H, CH2N+), 5.37 (s, 2H, CH2Ph), 2.68 (dd, J = 10.4, 5.7, 4H, ц-СН2), 1.81 (br. s, 2H, ц-СН2), 1.59 (br. s, 4H)
Пример 3
1-Бензил-3-(2-(3-(этоксикарбонил)-5,6,7,8-тетрагидро-4Н-циклогепта[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 3)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 78%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.11 (s, 1Н, NH), 9.33 (s, 1Н, HIm), 7.86 (t, J = 1.7, 1H, HIm), 7.79 (t, J = 1.7, 1Н, HIm), 7.47-7.42 (m, 5Н, Ph), 5.51 (s, 2Н, CH2N+), 5.41 (s, 2H, CH2Ph), 4.31 (q, J = 7.1, 2H, ОСН2СН3), 2.97-2.88 (m, 2Н, ц-СН2), 2.74-2.64 (m, 2Н, ц-СН2), 1.80 (s, 2Н, ц-СН2), 1.64-1.47 (m, 4Н, ц-СН2), 1.32 (t, J = 7.1, 3Н, ОСН2СН3).
Пример 4
1-Бензил-3-(2-(3-(метоксикарбонил)-4,5,6,7-тетрагидробензо[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 4)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 80%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.25 (s, 1Н, NH), 9.37 (s, 1H, HIm), 7.87 (t, J = 1.6, 1H, HIm), 7.81 (t, J = 1.6, 1H, HIm), 7.50-7.37 (m, 5H, Ph), 5.52 (s, 2H, CH2N+), 5.48 (s, 2H, CH2Ph), 3.83 (s, 3H, OCH3), 2.69 (s, 2H, цикл-СН2), 2.60 (s, 2H, цикл-СН2), 1.72 (s, 4H, цикл-СН2).
Пример 5
1-Бензил-3-(2-(3-циано-4,5,6,7-тетрагидробензо[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 5)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 61%. Спектр 1H NMR (300 MHz, HMCO-d6) δ, м.д. (J/Гц): 12.26 (br. s, 1Н, NH), 9.31 (s, 1H, HIm), 7.85 (s, 1H, HIm), 7.78 (s, 1H, HIm), 7.43 (s, 5H, Ph), 5.51 (s, 2H, CH2N+), 5.39 (s, 2H, PhCH2N), 2.58 (s, 2H, цикл-СН2), 2.50 (s, 4H, цикл-СН2 + DMSO), 1.75 (s, 5H, цикл-СН2).
Пример 6
1-Бензил-3-(2-(6-метил-3-(этоксикарбонил)-4,5,6,7-тетрагидробензо[b]тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 6)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 41%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.31 (s, 1Н, NH), 9.35 (s, 1Н, HIm), 7.87 (t, J = 1.7, 1Н, HIm), 7.80 (t, J = 1.7, 1H, HIm), 7.48-7.40 (m, 5H, Ph), 5.52 (s, 2H, CH2N+), 5.47 (s, 2H, PhCH2), 4.30 (q, J = 7.1, 2H, OCH2CH3), 2.88 (d, J = 16.9, 1H), 2.70 (dd, J = 16.4, 5.0, 2H), 2.65-2.54 (m, 1H), 2.20 (dd, J = 16.0, 9.5, 1H), 1.90-1.75 (m, J = 6.5, 2H), 1.32 (t, J = 7.1, 3H, OCH2CH3), 1.02 (d, J = 6.4, 3Н, CHCH3).
Пример 7
1-Бензил-3-(2-(3-(диметилкарбамоил)-3-(пропоксисарбонил)тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 7)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 65%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.50 (s, 1Н, NH), 9.36 (s, 1Н, HIm), 7.87 (t, J = 1.8, 1Н, HIm), 7.81 (t, J = 1.8, 1Н, HIm), 7.44 (s, 5Н, Ph), 5.52 (s, 2Н, CH2N+), 5.51 (s, 2Н, CH2Ph), 4.27 (t, 2Н, J = 6.5, OCH2CH2CH3), 2.94 (s, 6Н, N(CH3)2), 1.84-1.67 (m, 2H, OCH2CH2CH3), 0.98 (t, J = 7.4, 3Н, ОСН2СН2СН3).
Пример 8
1-Бензил-3-(2-(4,5-диметил-3-цианотиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 8)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 63%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 12.24 (s, 1Н, NH), 9.32 (s, 1H, HIm), 7.86 (s, 1H, HIm), 7.79 (s, 1H, HIm), 7.44 (s, 5H, Ph), 5.52 (s, 2H, CH2N+), 5.39 (s, 2H, PhCH2N), 2.23 (s, 3H, α-CH3), 2.11 (s, 3H, β-CH3).
Пример 9
1-Бензил-3-(2-(3,5-бис(метоксикарбонил)-4-метилтиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 9)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 61%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.59 (s, 1Н, NH), 9.35 (s, 1Н, HIm), 7.88 (t, J = 1.8, 1Н, HIm), 7.81 (t, J = 1.7, 1Н, HIm), 7.47-7.41 (m, 5Н, Ph), 5.53 (br. s, 4H, PhCH2, CH2N+), 3.89 (s, 3Н, OCH3), 3.78 (s, 3Н, ОСН3), 2.65 (s, 3Н, СН3).
Пример 10
1-Бензил-3-(2-(5-фенил-3-(этоксикарбонил)тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 10)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 42%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.37 (s, 1Н, NH), 9.38 (s, 1Н, HIm), 7.89 (t, J = 1.6, 1H, HIm), 7.83 (t, J = 1.6, 1H, HIm), 7.64 (d, J = 7.2, 2Н, HPh), 7.58 (s, 1Н), 7.48-7.46 (m, 1H, HTh), 7.46-7.43 (m, 5H, CH2Ph), 7.40 (d, J = 7.8, 2H, HPh), 7.33 (d, J = 7.3, 1H, HPh), 5.54 (s, 2H, CH2N+), 5.53 (s, 2H, PhCH2), 4.37 (q, J = 7.1, 2H, OCH2CH3), 1.36 (t, J = 7.1, 3Н, ОСН2СН3).
Пример 11
1-Бензил-3-(2-(5-метил-3-(циклогексилкарбамоил)-4-этилтиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 11)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 31%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 10.88 (s, 1Н, NH), 9.32 (s, 1H, HIm), 8.00 (d, J = 8.0, 1Н, NH), 7.85 (s, 1H, HIm), 7.76 (s, 1H, HIm), 7.41 (d, J = 11.2, 5H, Ph), 5.51 (s, 2H, CH2N+), 5.26 (s, 2H, PhCH2N), 3.74 (s, 1H, ипсо-СННех), 2.59-2.51 (m, 2H, CH3CH2), 2.23 (s, 3H, CH3), 1.86 (m, 2H, CH2(Hex)), 1.70 (m, 2H, CH2(Hex)), 1.58 (d, J = 11.7, 1H, CH2(Hex)), 1.26 (m, 4H, CH2(Hex)), 1.15 (m, 1H, CH2(Hex)), 0.97 (t, J = 7.4, 3H, CH3CH2).
Пример 12
1-Бензил-3-(2-(4,5-диметил-3-(метоксикарбонил)тиофен-2-иламино)-2-оксоэтил)-1Н-имидазол-3-иум хлорид (Соединение 11)
Получают аналогично Примеру 1 из соответствующего алкилхлорида. Выход 74%. Спектр 1Н NMR (300 MHz, ДМСО-d6) δ, м.д. (J/Гц): 11.22 (s, 1Н, NH), 9.38 (s, 1Н, HIm), 7.88 (s, 1Н, HIm), 7.81 (s, 1H, HIm), 7.44 (s, 5H, Ph), 5.52 (s, 2H, CH2N+), 5.47 (s, 2H, PhCH2N), 3.85 (s, 3H, OCH3), 2.22 (s, 3H, CH3), 2.19 (s, 3H, CH3).
Ниже описываются дополнительные исследования, подтверждающие противотуберкулезную активность новых соединений.
Антимикобактериальная активность соединений определялась в тест-системе М. smegmatis mc2 155.
Определение антимикобактериальной активности четвертичных аммонийных солей производных 2-аминотиофен-3-карбоновых кислот проводилось на культуре микобактерий М. smegmatis mc2 155 диско-диффузионным методом (по Keurby-Bauer).
На первой стадии скрининга потенциальных противотуберкулезных средств используется K М. smegmatis - модельная тест-система (K.Е.А. Lougheed, S.A. Osborne, В. Saxty, et al. Effective inhibitors of the essential kinase PknB and their potential as anti-mycobacterial agents. Tuberculosis (Edinb). 2011 July; 91(4): 277-286; S.R. , C. Ng, H. Anderson, J.D. Chao, X. Zheng, T. Pfeifer, Y. Av-Gay, M. Roberge, C.J. Thompson. Synergistic Drug Combinations for Tuberculosis Therapy Identified by a Novel High-Throughput Screen. Antimicrobial Agents and Chemotherapy, Aug. 2011, p. 3861-3869 Vol. 55, No. 8; Bekker O.B., Sokolov D.N., Luzina O.A., Komarova N.I., Gatilov Y.V., Andreevskaya S.N., Smirnova T.G., Maslov D.A., Chernousova L.N., Salakhutdinov N.F., Danilenko V.N. Synthesis and activity of (+)-usnic acid and (-)-usnic acid derivatives containing 1,3-thiazole cycle against Mycobacterium tuberculosis // Med.l Chem. Research, 2015, Vol. 24, P. 2926-2938).
Методика тестирования заключается в определении величины зоны подавления роста штамма, засеянного газоном на агаризованной среде триптон-соевый агар (Himedia, India), вокруг бумажных дисков, содержащих вещество в различных концентрациях. Диаметр бумажного диска 6 мм.
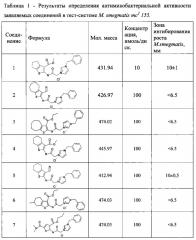
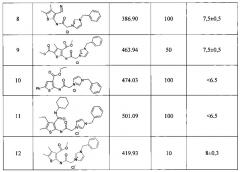
Критерии отбора: концентрация потенциальных антимикобактериальных агентов 0,1-100 нмоль/диск, зона ингибирования роста веществом - более 6.5 мм. Результаты определения антимикобактериальной активности заявляемых соединений в тест-системе М smegmatis mc2 155. приведены в Таблице 1.
Активность потенциальных ингибиторов серин/треониновых протеинкиназ эукариотического типа (СТПК) микобактерий определялась в тест-системе М. smegmatis APHVIII+.
Четвертичные аммонийные соли производных 2-аминотиофен-3-карбоновых кислот, показавшие активность на культуре микобактерий Mycobacterim smegmatis mc2 155, были протестированы в качестве потенциальных ингибиторов серин/треониновых протеинкиназ эукариотического типа (СТПК) микобактерий на культуре М. smegmatis APHVIII+ диско-диффузионным методом (по Keurby-Bauer). Три соединения (1, 8, 9) проявили активность, как потенциальные ингибиторы микобактериальных СТПК (Таблица 2).
Применяемая в исследованиях Тест-система М. smegmatis APHVIII+ применяется для отбора потенциальных противотуберкулезных средств - ингибиторов микобактериальных протеинкиназ. Ключевым элементом тест-системы М. smegmatis APHVIII+ является фермент аминогликозид-3-фосфотрансфераза тип VIII (AphVIII) штамма Streptomyces rimosus АТСС 10970, обеспечивающий устойчивость актинобактерий к аминогликозидным антибиотикам. Важной особенностью APHVIII S. rimosus АТСС 10970 является зависимость активности фермента от уровня его фосфорилирования серин-треониновыми протеинкиназами (СТПК). (Елизаров С.М., Сергиенко О.В., Сизова И.А., Даниленко В.Н. Молекулярная биология, 2005. т. 39. №2. с. 1-19). Сравнительный анализ канамицинкиназной активности нефосфорилированной и фосфорилированной форм исходного и мутантных вариантов белка APHVIII показал, что фосфорилированная форма APHVIII в 6-7 активнее нефосфорилированной. (Елизаров С.М., Алексеева М.Г., Новиков Ф.Н., Чилов Г.Г., Маслов Д.А., Даниленко В.Н. Биохимия, 2012, том 77, вып. 11, с. 1504-1512). Культура М. smegmatis APHVIII+ включает в себя генетическую конструкцию: вектор, содержащий гены устойчивости к антибиотикам: канамицину - (APHVIII) под тетрациклиновым промотором и гигромицину - (Hg-phosphotransferase) под собственным промотором.
Критерии отбора: концентрация потенциальных антимикобактериальных агентов 0,1-100 нмоль/диск, диаметр зоны ингибирования роста веществом совместно с канамицином не менее чем на 1.0 мм больше, чем диаметр зоны ингибирования роста культуры канамицином.
По результатам определения антимикобактериальной активности четвертичных аммонийных солей производных 2-аминотиофен-3-карбоновых кислот выявлено, что наиболее активным является соединение 1 (таблицы 1, 2).
Указанные соединения могут быть использованы в качестве веществ, активных в отношении возбудителя туберкулеза - Mycobacterium tuberculosis.
Указанные соединения могут быть использованы в качестве веществ, активных в отношении возбудителя туберкулеза - Mycobacterium tuberculosis.
1. Четвертичные аммонийные соли производных 2-аминотиофен-3-карбоновых кислот, обладающие противотуберкулезной активностью, общей формулы I:
где X отсутствует или представляет собой -СН2-, -(СН2)2-, СН3СН-, -N(R4)-;
R1 представляет собой CN, C(O)OR5, C(O)NHR6;
R4 представляет собой алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, бензил;
R5 представляет собой алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды;
R6 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, циклические углеводороды С3-С7.
2. Четвертичные аммонийные соли производных 2-аминотиофен-3-карбоновых кислот, обладающие противотуберкулезной активностью, общей формулы II:
где R1 представляет собой CN, C(O)OR5, C(O)NHR6;
R2 представляет собой H или алифатические насыщенные, неразветвленные или разветвленные С1-С5 углеводороды;
R3 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные С1-С5 углеводороды, фенил;
R5 представляет собой алифатические насыщенные, неразветвленные или разветвленные С1-С5 углеводороды;
R6 представляет собой Н, алифатические насыщенные, неразветвленные или разветвленные C1-С5 углеводороды, циклические углеводороды С3-С7.