Способ оценки резистентности организма к воздействию прооксидантных факторов
Иллюстрации
Показать всеИзобретение относится к медицине и раскрывает способ оценки резистентности организма к воздействию прооксидантных факторов. Способ характеризуется тем, что определяют значение соотношения легкодоступных и труднодоступных тиоловых групп плазмы крови, окисляемость их пероксидом водорода, по интегральному коэффициенту (ИК) оценивают дисбаланс функционирования тиолового звена антиоксидантной системы плазмы крови и при значении ИК равном или менее 1,5 относительных единиц определяют нормальную резистентность организма к действию прооксидантных факторов, при значении ИК выше 1,5 относительных единиц определяют наличие конформационных изменений белков и соотношение небелковых/белковых тиолсодержащих соединений плазмы крови и нарушение функционирования тиолового звена антирадикальной защиты, сопровождающееся сниженной резистентностью организма при развитии окислительного повреждения. Изобретение может быть использовано в диагностике заболеваний, сопровождающихся окислительным стрессом, а также для мониторинга антиоксидантной терапии при дисбалансе тиолового звена антирадикальной защиты. 2 пр., 3 ил.
Реферат
Предлагаемое изобретение относится к медицине и может быть использовано в диагностике заболеваний, сопровождающихся окислительным стрессом, а также для мониторинга антиоксидантной терапии при дисбалансе тиолового звена антирадикальной защиты.
Окислительный стресс является распространенным патобиохимическим состоянием, широко встречающимся при различных экстремальных физиологических и патологических состояниях [Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс: патологические состояния и заболевания. Новосибирск.: Издательство АРТА. 2008. 284 с.].
Нарушение функционирования тиолового звена антиоксидантной защиты является одним из значимых показателей диагностики окислительного стресса и контроля за лечением антиоксидантными средствами при многих заболеваниях - сахарный диабет, астма, стенокардия, инфаркт миокарда, катаракта, злокачественные новообразования, ревматоидный артрит и другие. При этом нередко ключевым механизмом, способствующим формированию окислительного стресса, является развитие дисбаланса в работе тиоловых антиоксидантов, что приводит к нарушению процессов нейтрализации свободных радикалов, а также к нарушению регенерации других классов веществ с антиоксидантной активностью. Более того, тиоловое звено является наиболее чувствительным компонентом антиоксидантной системы, которое способно не только нейтрализовать свободные радикалы, но также регенерировать другие антиоксиданты.
Своевременная диагностика и коррекция нарушений в работе антиоксидантной системы требует четко сформулированных критериев, разграничивающих адаптивную напряженность тиолового звена антиоксидантной системы, его регуляторные разнонаправленные изменения и наличие дисбаланса в работе этих соединений, приводящее к формированию окислительного стресса.
Известен метод определения антиоксидантного состояния организма, который в том числе может быть использован для оценки реакции организма на внешнее воздействие [Горшков Э.С., Иванов В.В., Соколовский В.В. Пат. 2431839 RU, МПК G01N 33/493. Способ определения антиоксидантного состояния организма. - №2010122592/15; - заявл. 02.06.2010; опубл. 20.10.2011. - Бюл. №29]. Сущность способа: в период внешнего воздействия на организм многократно (7-8 раз) в течение суток отбирают пробы мочи. В каждой пробе определяют концентрации тиолов, с помощью реактива Эллмана [Ellman G.L. Tissue sulfhydryl groups // Arch, bioch. biophys. - 1959. - Vol. 82. - P. 70-77], и урохрома, затем рассчитывают тиолурохромный коэффициент (ТУК) как отношение концентраций тиолов и урохрома. При значении ТУК 1,46±0,2 состояние организма оценивают как удовлетворительное. При значении ТУК больше 1,66 или меньше 1,26 - как вышедшее за границы удовлетворительного.
Недостатки:
1) биохимический состав мочи отражает в первую очередь функциональное состояние выделительной системы, но не организма в целом, что существенно ограничивает возможности использования мочи в неинвазивной лабораторной диагностике;
2) изменение биохимических показателей в моче широко вариабельно и зависит, кроме состояния мочевыделительной системы, от времени суток, взятой порции мочи, характера питания и потребления воды, температуры окружающей среды, что вносит недостоверность за счет терморегуляторных эффектов;
3) определение тиолсодержащих соединений в моче, особенно с использованием реактива Эллмана не находит широкого применения, за счет большого содержания в моче соединений серы в виде неорганических сульфидов и других соединений с промежуточными значениями степени окисления серы, которые в свою очередь сами активно реагируют с реактивом Эллмана, таким образом получается явно завышенный результат. Тем более что описанные соединения не отражают состояние функциональных резервов организма, а являются конечными продуктами метаболизма серосодержащих соединений;
4) использование урохрома в качестве вещества, отражающего интенсивность окислительного метаболизма, также не находит широкого применения, поскольку его содержание как, прежде всего, конечного продукта обмена гема зависит от интенсивности белкового обмена, эритропоэза и др.
Известен способ (принятый за ближайший аналог), позволяющий определить коэффициент, характеризующий содержание восстановленных и окисленных тиоловых групп - тиолдисульфидное соотношение [Соколовский В.В. Тиолдисульфидное соотношение крови как показатель состояния неспецифической резистентности организма: Учебное пособие. - СПб., 1996. - 30 С.], согласно которому определяют содержание тиоловых (-SH) и дисульфидных (-SS-) групп в исследуемом субстрате крови и рассчитывают показатель их количественного соотношения. Для его осуществления проводят определение содержания SH-гр. и -S-S-связей с помощью реактива Эллмана [Веревкина И.В., Точилкин А.И., Попова Н.А. // Колориметрическое определение SH-гр. и -S-S-связей в белках при помощи 5,5/- дитиобис (2-нитробензойной) кислоты. Современные методы в биохимии, под редакцией академика АМН СССР Ореховича В.Н. - Москва, «Медицина» - 1977. - С. 223-231.] или амперометрически [Соколовский В.В. Тиоловые антиоксиданты в молекулярных механизмах неспецифической реакции организма на экстремальные воздействия (обзор) // Вопросы медицинской химии. - 1988 - т. 34 - вып. 6 - С. 2-11.] и определяют их соотношение. Считается, что тиолдисульфидное соотношение характеризует состояние антиоксидантной защиты и окислительно-восстановительных процессов организма. К функциям данной системы относят регуляцию ферментативной и антиоксидантной активности, иммунных реакций, клеточного роста и проницаемости биомембран и др.
Недостатками аналога являются:
1) большие колебания тиолдисульфидного соотношения в течение незначительного промежутка времени;
2) большой разброс в показателях тиолдисульфидного соотношения при использовании различных лабораторных методов исследования: спектрофотометрический метод с реактивом Эллмана или другими реактивами, амперометрическое титрование с применением различных селективных электродов (ртутный, серебряный и др.);
3) при расчете данного коэффициента не учитывают возможность разнонаправленного изменения содержания тиоловых соединений при тех или иных патологиях в силу различных причин, концентрация может изменяться как в сторону повышения, так и в сторону понижения содержания как небелковых тиолов, так и белковых SH-групп, при одновременном повышении содержания дисульфидных групп. Так, например, показана возможность возрастания содержания восстановленных тиолов в крови за счет вымывания их из поврежденных клеток.
4) не учитывается то, что далеко не всегда окисление SH-групп ведет к образованию дисульфидных групп, также могут образовываться сульфиновые или сульфеновые кислоты. При этом может снижаться пул свободных тиоловых групп как на фоне сохранности содержания дисульфидных, так и на фоне сниженной их концентрации. Не все имеющиеся -SS-группы могут быть легко определены распространенными аналитическими методами, часть из общего пула дисульфидных групп «спрятана» внутри молекулы белка и не определяется. При окислении тиоловых групп практически наверняка происходит конформационная перестройка белковой молекулы с изменением соотношения доступных и недоступных для реагентов функциональных групп.
Ввиду этого становится затруднительно интерпретировать результаты расчета тиолдисульфидного соотношения.
Задачи изобретения - создание достоверного и однозначно трактуемого способа интегральной оценки функционирования тиолового звена антиоксидантной защиты в условиях окислительного стресса, основанного на использовании минимального количества дополнительных специальных лабораторных методов диагностики, позволяющего определять выраженность дисбаланса тиолсодержащих соединений в условиях окислительного стресса, своевременно назначать рациональную антиоксидантную терапию в должном объеме и контролировать ее эффективность в процессе лечения.
Основным преимуществом предложенной технологии по диагностике нарушений тиолового метаболизма у больных является то, что, помимо количественного колориметрического определения тиоловых групп в плазме крови, она позволяет определять соотношение быстрореагирующих (легкодоступных, то есть реагирующих с реактивом Эллмана в первые 3 минуты) и медленнореагирующих (труднодоступных, реагирующих с реактивом Эллмана в течение 3-30 минут) тиоловых групп, а также способности нативных тиолов взаимодействовать in vitro с пероксидом водорода, что помогает проводить дифференциальную диагностику нарушений метаболизма серосодержащих соединений.
Соотношение быстро реагирующих (легкодоступных) и медленно реагирующих (труднодоступных) тиоловых групп определяют по формуле:
где
SHл - содержание легкодоступных тиоловых групп, единиц оптической плотности;
SHт - содержание труднодоступных тиоловых групп, единиц оптической плотности;
Затем рассчитывают процент окисления тиоловых групп пероксидом водорода (О%), отражающий способность плазмы крови нейтрализовать пероксид водорода, поддерживая сохранным пул восстановленных тиоловых групп, по формуле:
где
SH1 - суммарные тиоловые группы интактной плазмы крови, единиц оптической плотности;
SH2 - суммарные тиоловые группы плазмы крови после воздействия пероксидом водорода, единиц оптической плотности.
После чего рассчитывают интегральный коэффициент (ИК), учитывающий и антиокислительные свойства плазмы крови и, следовательно, резистентность к воздействию прооксидантных факторов на организм:
где 0,35 и 17,01 - коэффициенты, соответствующие средним значениям соответственно К1 и О% здоровых обследованных.
Использование множителя О% в степени 2 объясняется тем, что степень тяжести патологии находится в большей зависимости от антиокислительных свойств плазмы крови.
Сущностью изобретения является способ оценки резистентности организма к воздействию прооксидантных факторов, предусматривающий то, что в комплексе с помощью реактива Эллмана определяют значение соотношения легкодоступных и труднодоступных тиоловых групп плазмы крови, окисляемость их пероксидом водорода и по интегральному коэффициенту (ИК) оценивают дисбаланс функционирования тиолового звена антиоксидантной системы плазмы крови по формуле:
ИК=(К1/0,35)×(О%/17,01)2, где
К1 - соотношение легко- и труднодоступных тиоловых групп, определяемое по формуле:
K1=SHл/SHт, где
SHл - содержание легкодоступных тиоловых групп, единиц оптической плотности;
SHт - содержание труднодоступных тиоловых групп, единиц оптической плотности;
О% - процент окисленных тиоловых групп пероксидом водорода, определяемый по формуле:
О%=((SH1-SH2)/SH1)×100, где
SH1 - суммарные тиоловые группы интактной плазмы крови, единиц оптической плотности;
SH2 - суммарные тиоловые группы плазмы крови после воздействия пероксидом водорода, единиц оптической плотности,
и при значении интегрального коэффициента равном или менее 1,5 относительных единиц определяют нормальную резистентность организма к действию прооксидантных факторов, при значении ИК выше 1,5 относительных единиц, определяют наличие конформационных изменений белков и соотношения небелковых/белковых тиолсодержащих соединений плазмы крови и нарушение функционирования тиолового звена антирадикальной защиты, сопровождающееся сниженной резистентностью организма при развитии окислительного повреждения.
Техническим результатом изобретения является:
1) интегральная оценка функционирования наиболее чувствительного звена антиоксидантной защиты - тиолсодержащих соединений (белковые и небелковые SH-группы), с одновременным определением их роли в развитии и формировании окислительного стресса в организме обследуемого;
2) определение дисбаланса тиолового звена антиоксидатной системы без учета суммарного содержания SH-групп плазмы крови обследуемого, что позволяет нивелировать эффект повышения или снижения содержания тиоловых групп и определить дисбаланс независимо, а значит более объективно;
3) все это позволяет отказаться от определения концентрации белков плазмы крови, так как нет необходимости приводить содержание тиоловых групп на 1 грамм белка ввиду использования соотношений разных фракций у одного и того же обследуемого.
4) для определения данного интегрального показателя используют доступный биоматериал - плазму крови, в которой в достаточном количестве содержатся как белковые, так и небелковые SH-группы, что повышает универсальность определения и использования данного показателя для клинических исследований при различных заболеваниях;
5) применяют подход в дифференцированной оценке вклада каждой из составляющих уравнения в получаемый результат при расчете интегрального показателя функционирования тиолового звена антиоксидантной системы путем произведения отношения легкодоступных/труднодоступных тиоловых групп на процент окисленных тиоловых групп при действии пероксида водорода, что позволяет как повысить чувствительность способа, то есть увеличить процент истинно положительных результатов у лиц, страдающих заболеваниями с явлениями окислительного стресса, так и повысить специфичность, то есть уменьшить частоту ложноположительных результатов у здоровых обследуемых, таким образом достигается максимально возможная диагностическая эффективность для данного способа.
Способ осуществляют следующим образом.
Для оценки устойчивости организма к окислительным повреждениям используют интегральный показатель, основанный на определении функционирования тиолового звена антирадикальной защиты. Объектом исследования служит плазма крови обследуемых, стабилизированная гепарином натрия, в которой определяют содержание суммарных, легкодоступных и труднодоступных SH-групп с помощью реактива Эллмана без предварительного воздействия пероксида водорода, а также после воздействия пероксида водорода.
Содержание SH-групп определяют в плазме крови колориметрическим методом с использованием реактива Эллмана [Веревкина И.В., Точилкин А.И., Попова Н.А. // Колориметрическое определение SH-гр. и -S-S-связей в белках при помощи 5,5/- дитиобис (2-нитробензойной) кислоты]. Современные методы в биохимии, под редакцией академика АМН СССР Ореховича В.Н. - Москва, «Медицина» - 1977. - С. 223-231]. Методика основана на способности SH-групп реагировать с 5,5'-дитиобис (2-нитробензойной) кислотой с образованием тионитрофенильного аниона. Количество образовавшегося тионитрофенильного аниона прямо пропорционально количеству свободных SH-групп. Ход определения: в кювету вносят 1,5 мл 0,1 М фосфатного буфера (рН=7,4; необходимость проведения реакции при физиологических значениях рН обусловлена необходимостью сохранности нативной конформации белковых молекул), добавляют 150 мкл плазмы крови и 10 мкл бидистиллированной воды, через 5 минут инкубации при 25°С выводят спектрофотометр по приготовленной пробе опытного раствора в кювете, после чего вносят 25 мкл этанольного реактива Эллмана. Через 3 и 30 минут оптическую плотность проб измеряют на спектрофотометре при 412 нм (максимум поглощения ТНФА), не останавливая реакцию. Аналогично выполняют определение экстинкции контрольного раствора 1 (без добавления реактива Эллмана) и контрольного раствора 2 (без добавления плазмы, но с реактивом Эллмана) относительно 0,1 М фосфатного буфера. Результат, выраженный в единицах оптической плотности, за вычетом оптических плотностей контрольных растворов 1 и 2, полученный через 3 минуты от начала реакции, соответствует содержанию легкодоступных (быстрореагирующих) SH-групп, а через 30 минут, за вычетом единиц оптической плотности полученных через 3 минуты соответствует содержанию труднодоступных (медленнореагирующих) SH-групп.
Результат, полученный через 30 минут инкубации, за вычетом контрольных растворов 1 и 2, соответствует сумме SH-групп.
Полученный результат оставляют выраженным в единицах оптической плотности, так как для дальнейших расчетов будут непринципиальны единицы выражения содержания тиоловых групп. Пересчитывать содержание SH-групп в плазме крови на грамм белка не требуется, так как все расчеты будут проводиться с отношениями разных фракций тиоловых групп плазмы крови одного пациента, без сравнения суммарного содержания SH-групп разных пациентов.
Затем рассчитывают показатель соотношения легко- и труднодоступных тиоловых групп по формуле: К1=SHл/SHт.
Определение тиоловых групп проводят с интактной плазмой крови и с образцами плазмы крови тех же пациентов, но после воздействия раствором пероксида водорода. Для этого вносят в кювету 150 мкл плазмы крови, затем добавляют 10 мкл 0,03% раствора Н2О2. Через 5 минут инкубации при 25°С в ту же кювету вносят 1,5 мл 0,1 М фосфатного буфера (рН=7,4) и проводят определение легко- и труднодоступных и суммы тиоловых групп, аналогично методу описанному выше.
После чего определяют процент окисленных пероксидом водорода SH-групп по формуле: О%=((SH1-SH2)/SH1)×100. И определяют интегральный коэффициент по формуле: ИК=(К1/0,35)×(О%/17,01)2.
Полученные результаты трактуют следующим образом: при значении интегрального показателя равном или менее 1,5 относительных единиц определяют отсутствие дисбаланса функционирования тиолового звена антиоксидантной защиты, при значении соотношения выше 1,5 относительных единиц определяют наличие конформационных изменений белков и соотношения небелковых/белковых тиолсодержащих соединений плазмы крови и нарушение функционирования тиолового звена антирадикальной защиты, сопровождающееся сниженным потенциалом ответа на окислительный стресс.
Обоснование достигнутых результатов.
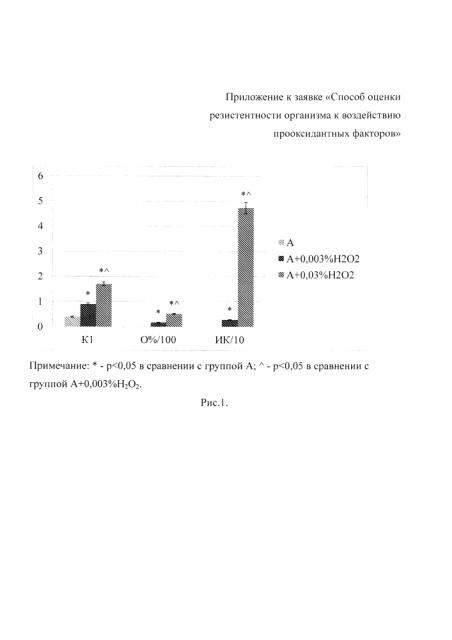
Особенность предлагаемого способа заключается в оценке конформационных изменений белков, происходящих при окислительной модификации, в том числе за счет окисления SH-групп белков, а также других функциональных групп, при этом происходит частичное «выворачивание» белковой глобулы, в результате которого, труднодоступные тиоловые группы оказываются снаружи молекулы, при этом соответственно расходуется пул труднодоступных SH-групп, за счет которых частично восполняется пул легкодоступных, более реакционноспособных, функционально активных, что возможно является резервным адаптационным механизмом при окислительном стрессе. Этим объясняется повышение соотношения легкодоступных SH-групп к труднодоступным. Также повышение соотношения легко- и труднодоступных SH-групп частично может быть обусловлено выбросом в плазму крови низкомолекулярных небелковых тиолов из поврежденных клеток. Кроме того, при патологии наблюдается возрастание количества окисляемых пероксидом водорода тиоловых групп, что связано со снижением антиоксидантного потенциала плазмы крови. Такая трактовка происходящих изменений согласуется с модельными экспериментами in vitro на растворе человеческого сывороточного альбумина (см. Прилож., - Рис. 1. Изменение показателей соотношения легко- и труднодоступных тиоловых групп, окисляемости тиоловых групп и интегрального показателя при моделировании окислительного повреждения белков на растворе альбумина). В ходе определения соотношения легко- и труднодоступных SH-групп в интактном растворе альбумина в тех же условиях, при которых проводим исследования плазмы крови было установлено, что коэффициент К1 (по формуле 1) составлял 0,4; а после воздействия 0,003% пероксида водорода повышался до значений 0,8-1,0 и до 1,8 при воздействии 0,03% Н2O2, что указывает на правильность предлагаемого подхода. Кроме того, при оценке окисляемости тиоловых групп альбумина было установлено, что эффект, аналогичный действию Н2O2 на плазму крови, пероксид водорода оказывает на растворе альбумина при концентрации в 10 раз меньшей, что указывает на правильность суждений об антиокислительных свойствах плазмы крови. Так, при введении в модельную систему, содержащую 60 мкл 20% раствора альбумина и 1,5 мл натрий-калий фоосфатного буферного раствора (рН=7,4) 10 мкл 0,003% (группа А+0,003% Н2О2) раствора пероксида водорода, суммарное содержание тиоловых групп снижалось на 18%, а при внесении 10 мкл 0,03% пероксида водорода в аналогичную систему (группа А+0,03% Н2O2) суммарное содержание SH-групп снижалось на 52%. Интегральный коэффициент при действии 0,003% Н2O2 составил 2,88 относительных единиц, а при действии 0,03% Н2O2 - 47,26 относительных единиц. Но стоит заметить, что столь высокая концентрация пероксида водорода модельным раствором альбумина полностью не нейтрализовалась, и оставшийся в растворе Н2O2 окислял образующийся при взаимодействии тиоловых групп белков с реактивом Эллмана тионитрофенильный анион, что искажало результат. Однако данный эксперимент наглядно демонстрирует, что введенный пероксид водорода в плазму крови нейтрализуется не только за счет SH-групп белков, но и за счет других компонентов антиоксидантной системы, поэтому предлагаемая схема эксперимента достаточно адекватно отражает антиперекисную активность плазмы крови.
Проведены исследования состояния тиолового обмена в плазме крови у различных категорий больных (n=120).
Анализируя соотношение легко- и труднодоступных тиоловых групп у пациенток с хроническим эндометритом и у здоровых женщин, можно отметить наличие существенного между ними различия. Определение содержания суммы SH-групп показало, что достоверных различий между больными и здоровыми женщинами не было. Так в плазме крови здоровых женщин было определено 0,69 единиц оптической плотности/100 г. белка, а у больных хроническим эндометритом - 0,66 единиц оптической плотности/100 г. белка. С целью увеличения информативности у данных категорий пациентов был рассчитан ИК. У здоровых женщин он составил 1,33 относительных единиц, а у больных хроническим эндометритом - 26,29 относительных единиц, что свидетельствует об имеющемся на самом деле существенном дисбалансе в функционировании тиолового звена системы неспецифической резистентности и снижении устойчивости организма к окислительным повреждениям.
Таким образом, использование ИК в сравнении только лишь с оценкой суммарного содержания SH-групп плазмы крови позволяет с большей точностью и эффективностью определять состояние тиолового звена антиоксидантной системы, что может иметь значение при выборе оптимального метода лечения пациента и при контроле за эффективностью терапии.
Исследование было выполнено при поддержке государственного задания Министерства здравоохранения Российской Федерации (от 28.01.2015 г. ч. 1, раздел 1) «Осуществление прикладных научных исследований, в том числе проведение доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов».
Примеры конкретного выполнения.
Пример №1. В гинекологическое отделение Базовой акушерско-гинекологической клиники ФГБОУ ВО КубГМУ Минздрава России 10 июня 2016 года поступила пациентка Ф., возраст 36 лет. Диагноз: «Хронический эндометрит, двусторонний сальпингоофорит». Проведено обследование с целью диагностирования возможного наличия дисбаланса тиолового звена системы антиоксидантной защиты (см. Прилож., - Рис. 2. Изменение коэффициентов тиолсодержащих соединений у пациентки с хроническим эндометритом и двусторонним сальпингоофоритом в процессе лечения в сравнении со значениями контрольной группы): суммарное содержание SH1-групп плазмы крови составило 0,49 единиц оптической плотности (е.о.п.), SHл - 0,18 е.о.п., SHт - 0,31 е.о.п., был рассчитан показатель соотношения легко- и труднодоступных тиоловых групп:
К1=0,18/0,31=0,58;
что существенно превышало контрольные значения. Содержание SH2-групп плазмы крови (после воздействия пероксида водорода) составило 0,21 е.о.п. Окисляемость тиоловых групп составила 57,1%:
О%=((0,49-0,21)/0,49)×100=57,1;
что также значительно превышает показатель группы здоровых женщин. Рассчитанный ИК составил 18,71 относительных единиц:
ИК=(0,58/0,35)×(57,1/17,01)2=18,71 относительных единиц;
таким образом, резистентность к действию прооксидантных факторов у пациентки Ф. была нарушена.
В течение 10 дней было проведено традиционное медикаментозное лечение с дополнительным введением средств антиоксидантной направленности (тиосульфат натрия, витамин Е и С в стандартных суточных дозировках). После завершения лечения проведено повторное обследование с целью определения динамики изменений вышеуказанных показателей. После лечения суммарное содержание SH1-групп плазмы крови составило 0,50 е.о.п., SHл - 0,16 е.о.п., SHт - 0,34 е.о.п., был рассчитан показатель соотношения легко- и труднодоступных тиоловых групп:
К1=0,16/0,34=0,47;
Содержание SH2-групп плазмы крови (после воздействия пероксида водорода) составило 0,36 е.о.п. Окисляемость тиоловых групп составила 57,1%:
О%=((0,50-0,36)/0,50)×100=28,0;
что значительно превышает показатель группы здоровых женщин. Рассчитанный ИК составил 3,63 относительных единиц:
ИК=(0,47/0,35)×(28,0/17,01)2=3,63 относительные единицы. Такие результаты можно трактовать как восстановление нативной конформации белков и функционирования антиоксидантной системы организма, а проведенное лечение оценивать как эффективное и адекватное.
Пример №2. В гинекологическое отделение Базовой акушерско-гинекологической клиники ФГБОУ ВО КубГМУ Минздрава России 10 июня 2016 года поступила пациентка И., возраст 35 лет. Диагноз: «Хронический эндометрит». Проведено обследование с целью диагностирования возможного наличия дисбаланса тиолового звена системы антиоксидантной защиты (см. Прилож., - Рис. 3. Изменение коэффициентов тиолсодержащих соединений у пациентки с хроническим эндометритом в процессе лечения в сравнении со значениями контрольной группы): суммарное содержание SH1-групп плазмы крови составило 0,55 е.о.п., SHл - 0,19 е.о.п., SHт - 0,36 е.о.п., был рассчитан показатель соотношения легко- и труднодоступных тиоловых групп:
К1=0,19/0,36=0,53;
что существенно превышало контрольные значения. Содержание SH2-групп плазмы крови (после воздействия пероксида водорода) составило 0,35 е.о.п. Окисляемость тиоловых групп составила:
О%=((0,55-0,35)/0,55)×100=36,4;
что также значительно превышает показатель группы здоровых женщин. Рассчитанный ИК составил:
ИК=(0,53/0,35)×(36,4/17,01)2=6,91 относительных единиц;
т.е. резистентность у пациентки И. к воздействию прооксидантных факторов была существенно снижена.
В течение 10 дней было проведено традиционное медикаментозное лечение. После завершения лечения проведено повторное обследование с целью определения динамики изменений вышеуказанных показателей. После лечения суммарное содержание SH1-групп плазмы крови составило 0,55 е.о.п., SHл - 0,15 е.о.п., SHт - 0,30 е.о.п., был рассчитан показатель соотношения легко- и труднодоступных тиоловых групп:
К1=0,15/0,30=0,50.
Содержание SH2-групп плазмы крови (после воздействия пероксида водорода) составило 0,41 е.о.п. Окисляемость тиоловых групп составила:
О%=((0,55-0,41)/0,55)×100=25,5;
что значительно превышает показатель группы здоровых женщин. Рассчитанный ИК составил:
ИК=(0,50/0,35)×(25,5/17,01)2=3,21 относительные единицы; Такие результаты также говорят об эффективности и адекватности проведенной терапии.
Предлагаемый способ позволяет следующее.
- Оценить баланс легкодоступных и труднодоступных тиоловых групп как показателя, демонстрирующего нарушение функционирования антиоксидантной защиты организма, а также отражающего конформационные нарушения белковых молекул, что позволит своевременно провести необходимые мероприятия по их медикаментозной коррекции.
- Провести более глубокую оценку патобиохимической значимости дисбаланса тиолового звена антирадикальной защиты за счет дополнительной оценки чувствительности этого звена к моделированию окислительного стресса в плазме крови исследуемых больных путем внесения раствора пероксида водорода с оценкой окисляемости тиоловых групп, что позволит определять индивидуальные показания к назначению медикаментозной антиоксидантной терапии и сократить дозировки используемых лекарственных препаратов с антиоксидантной активностью, в том числе содержащих тиоловые группы, например липоевой кислоты, глутатиона, уменьшая тем самым количество возможных побочных эффектов, а также снизить расходы на указанные препараты.
- Данный показатель позволяет достоверно оценивать эффективность по восстановлению баланса функционирования тиолового звена антирадикальной защиты в процессе лечения с целью прогнозирования возможных осложнений и выполнения своевременной коррекции проводимой терапии.
Практическим результатом предложения является определение дисбаланса тиолового звена антирадикальной защиты у обследуемых больных и оценка устойчивости организма к окислительным повреждениям, что позволяет определять индивидуальные показания к медикаментозной коррекции, а значит сократить время пребывания больных в стационарах и оптимизировать количество необходимых для лечения медикаментов.
Способ оценки резистентности организма к воздействию прооксидантных факторов, включающий анализ тиоловых групп в плазме крови больного, отличающийся тем, что в комплексе с помощью реактива Эллмана определяют значение соотношения легкодоступных и труднодоступных тиоловых групп плазмы крови, окисляемость их пероксидом водорода и по интегральному коэффициенту (ИК) оценивают дисбаланс функционирования тиолового звена антиоксидантной системы плазмы крови по формуле:
ИК=(К1/0,35)×(О%/17,01)2,
где К1 - соотношение легко- и труднодоступных тиоловых групп, определяемое по формуле
К1=SHл/SHт,
где SHл - содержание легкодоступных тиоловых групп, единиц оптической плотности;
SHт - содержание труднодоступных тиоловых групп, единиц оптической плотности;
О% - процент окисленных тиоловых групп пероксидом водорода, определяемый по формуле
О%=((SH1-SH2)/SH1)×100,
где SH1 - суммарные тиоловые группы интактной плазмы крови, единиц оптической плотности;
SH2 - суммарные тиоловые группы плазмы крови после воздействия пероксидом водорода, единиц оптической плотности,
и при значении интегрального коэффициента равном или менее 1,5 относительных единиц определяют нормальную резистентность организма к действию прооксидантных факторов, при значении ИК выше 1,5 относительных единиц определяют наличие конформационных изменений белков и соотношение небелковых/белковых тиолсодержащих соединений плазмы крови и нарушение функционирования тиолового звена антирадикальной защиты, сопровождающееся сниженной резистентностью организма при развитии окислительного повреждения.