Противоопухолевый химиопрепарат
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к противоопухолевому химиопрепарату, представляющему собой стабильные наночастицы в виде сферических глобул размером 250-400 нм. Химиопрепарат содержит в качестве цитостатика доксорубицин в количестве 20,5-25,3 мас.% и в качестве биодеградируемого полимера - декстран-сульфат натрия в количестве - остальное. Изобретение обеспечивает повышение противоопухолевой активности химиопрепарата. 3 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к области фармакологии и медицины и может быть использовано для создания препаратов для лечения злокачественных новообразований, в том числе при некоторых амилазопродуцирующих опухолях (в частности, при некоторых формах рака легкого и яичника).
В настоящее время главной проблемой онкофармакологии является низкая избирательность химиотерапии и высокая токсичность противоопухолевых препаратов. Поскольку большинство биохимических процессов, на которые действуют химиопрепараты, идентичны в нормальной и опухолевой клетке, многие противоопухолевые средства оказывают значимое повреждающее действие на здоровые ткани. Это ограничивает возможности проведения эффективного лечения заболевания, а иногда провоцирует самостоятельные жизнеугрожающие осложнения.
Одним из способов повышения избирательности химиотерапии является конъюгация химиопрепаратов с различными наночастицами, которые, обладая специфическими свойствами, могут накапливаться в опухолевой ткани либо могут концентрироваться в ней путем внешних управляющих стимулов. В качестве таких частиц наиболее часто рассматриваются липосомы и полимерные носители - мицеллы и микрокапсулы. Механизм нацеливания этих носителей связан с так называемым EPR-эффектом или эффектом повышенной проницаемости и ретенции. Как известно, капилляры в опухолевой ткани имеют больший размер межклеточных пор (до 400 нм), чем в нормальных тканях (20-40 нм), а система лимфодренажа в них практически отсутствует. Эти факторы способствуют выходу наночастиц из кровотока и задержке их в опухолевом интерстиции.
Возможны также иные механизмы направленного транспорта «нанопрепаратов», например, с помощью использования определенных особенностей рецепторной системы опухолевых клеток или специфических особенностей их метаболизма. Известно, что при ряде опухолей отмечается избыточная продукция амилазы клетками опухоли [1-3]. Введение препарата в комплексе с полимером, разрушающимся в опухолевой ткани, будет способствовать его накоплению в патологическом очаге.
Известна фармацевтическая композиция для лечения онкологических заболеваний, заключающаяся в применении пептида формулы QMTOVNOG, являющегося аналогом фрагмента - фетопротеина с 472-й по 479-ю аминокислоту, способного избирательно захватываться опухолевыми клетками и выполнять функцию векторной молекулы для направленной доставки противоопухолевых препаратов в опухолевые клетки, конъюгата указанного пептида с доксорубицином, в котором доксорубицин ковалентно присоединен к пептиду через тиоэфирную связь, а также фармацевтической композиции для лечения онкологических заболеваний, содержащей конъюгат доксорубицина с пептидом QMTOVNOG в качестве векторной молекулы в эффективном количестве и подходящий для внутривенного введения фармацевтический носитель (RU 2317102, МПК A61K 38/08, C07K 7/06, A61P 35/00, опубл. 20.02.2008).
Недостатками известной фармацевтической композиции является техническая сложность ее получения и высокая стоимость, а также отсутствие избирательности в отношении амилазопродуцирующих опухолей [4].
Наиболее близким по технологической сущности к предлагаемому техническому решению является гидрогелевый противоопухолевый препарат, содержащий цитостатик - проспидин, биодеградируемый полимер и воду. В качестве полимера препарат содержит фосфаты декстрана или крахмала (RU 2442586, МПК A61K 31/499, A61K 47/36, A61K 9/00, A61P 35/00, опубл. 20.02.2012).
Недостатком гидрогелевого противоопухолевого препарата является невозможность внутривенного введения (так как препарат имеет консистенцию геля), а также относительно недостаточно широкий спектр противоопухолевой активности.
Технический результат заключается в повышении противоопухолевой активности химиопрепарата в тканях за счет применения биодеградируемого полимера, разрушающегося ферментом амилазой - декстран-сульфата натрия.
Сущность изобретения заключается в том, что противоопухолевый химиопрепарат, представляющий собой стабильные наночастицы в виде сферических глобул размером 250-400 нм, включает цитостатик - доксорубицин и биодеградируемый полимер - декстран-сульфат натрия, при следующем соотношении компонентов, мас.%:
| Доксорубицин | 20,5-25,3 |
| Декстран-сульфат натрия | остальное |
Доксорубицин - это противоопухолевое средство из группы антрациклиновых антибиотиков. Представляет собой кристаллический или аморфный порошок оранжево-красного или красного цвета, CAS-код 25316-40-9, брут-то-формула C27H29NO11HCl, молекулярная масса 580,0. Растворим в воде, трудно растворим в метаноле, практически нерастворим в ацетоне. рН водного раствора 4,0-5,5 (в концентрации 5 мг/мл).
Декстран-сульфат натрия - это представитель гомополимеров целлюлозы с преимущественным содержанием α-(1-6) связей. Декстран-сульфата натрия - белый или бледно-желтый порошок со слабовыраженным запахом. Хорошо растворим в воде и в 20%-ном растворе этилового спирта.
Способ получения противоопухолевого химиопрепарата осуществляют путем синтеза компонентов. Противоопухолевый препарат получают методом замены растворителя [5]. Навеску декстран-сульфата натрия 30 мг растворяют в 2 мл 0,15 М раствора хлорида натрия. Навеску доксорубицина 10 мг растворяют в 4 мл диметилсульфоксида. 4 мл раствора доксорубицина в диметилсульфоксиде быстро приливают к 2 мл полученного раствора декстран-сульфата натрия при интенсивном перемешивании, после чего перемешивание на магнитной мешалке продолжают еще в течение 10 мин при комнатной температуре. В результате образовывается суспензия сферических наночастиц, состоящих из биодеградируемого полимера - декстран-сульфата натрия и цитостатика - доксорубицина.
Полученную суспензию наночастиц очищают от невключившегося доксорубицина методом диализа (целлюлозная мембрана с диаметром пор 12-14 кДа, элюент - 0,15 М раствор хлорида натрия, объемное соотношение суспензия наночастиц/элюент = 1/50, продолжительность процедуры - 24 ч).
Размерные характеристики полученных полимерных наночастиц в виде сферических глобул оценивают методом динамического светорассеяния (анализатор NANO-flex, Microtrac Inc.). Средний размер полученных наночастиц составил 250-400 нм. На фиг. 1 представлена кривая распределения наночастиц по размерам сферических глобул с доксорубицином.
Степень включения противоопухолевого химиопрепарата в комплекс рассчитывают по формуле
ω=(m0-m)/m0⋅100%;
где m0 - исходное количество доксорубицина, m - количество невключившегося доксорубицина.
Количество невключившегося доксорубицина рассчитывают по его концентрации в диализате. Концентрацию химиопрепарата в диализате определяют фотоколориметрическим методом на спектрофотометре UV-2600 Shimadsu (Япония) при длине волны 490 нм по предварительно построенному калибровочному графику.
Степень ассоциации доксорубицина с декстран-сульфатом натрия равна 89%. Массовое соотношение между декстран-сульфатом натрия и доксорубицином составило 3,4:1.
Пример 1. Исследование высвобождения доксорубицина из наночастиц.
Исследовано влияние температуры и наличия активной амилазы во внешней среде на кинетику высвобождения доксорубицина из наночастиц. Кинетику высвобождения оценивали по нарастанию концентрации доксорубицина в диализующем растворе при диализе наночастиц с доксорубицином в различных условиях. Выполняли три серии экспериментов. В первой серии наночастицы с доксорубицином диализировали фосфатным буфером с pH=7,2 при комнатной температуре в течение 72 ч (целлюлозная мембрана с диаметром пор 12-14 кДа, объемное соотношение суспензия наночастиц/буфер=1/10). Во второй и третьей сериях условия аналогичны первой серии, однако в данных сериях диализ проводили при 37°C, а в третьей серии в среду с наночастицами добавляли амилазу до получения конечной концентрации 2 ед/мл.
На фиг. 2. представлены кинетические кривые высвобождения доксорубицина из комплекса с декстран-сульфатом натрия в выбранных условиях. Видно, что с повышением температуры до 37°C количество высвободившегося доксорубицина через 24 ч превышает таковое в серии с комнатной температурой инкубации в 1,4 раза, а через 48 и 72 ч - в 1,6 и 1,5 раз соответственно. Добавление в среду инкубации амилазы - фермента, разрушающего полимерную основу наночастиц, приводит к увеличению релиза доксорубицина (через 72 ч - на 53 и 32% по сравнению с первой и второй сериями соответственно). Таким образом, результаты данного эксперимента демонстрируют, что синтезированные наночастицы способны высвобождать доксорубицин в условиях повышения амилолитической активности во внешней среде.
Пример 2. Исследование противоопухолевой активности химиопрепарата у крыс с трансплантированной асцитной гепатомой Зайдела.
Апробация противоопухолевого химиопрепарата проведена на 32 белых лабораторных крысах массой 190-230 г, полученных из питомника «Рапполово». Животные содержались в условиях вивария, получали стандартный полнорационный брикетированный комбикорм производства компании «Лабораторкорм» (г. Москва) и питьевую воду без ограничений. Все исследования проводились после рассмотрения и одобрения протокола локальным этическим комитетом при ФГБОУ ВО «МГУ им. Н.П. Огарева». Противоопухолевую активность исследовали на модели асцитной гепатомы Зайдела (штамм из коллекции института цитологии РАН). Выбор модели обусловлен тем, что при данной опухоли асцитическая жидкость имеет повышенную амилазную активность. Опухоль перевивали путем внутрибрюшинной инъекции 0,5 мл нативной асцитической жидкости, полученной от животного-опухоленосителя. Содержание опухолевых клеток в трансплантате составляло 8,5×109/мл.
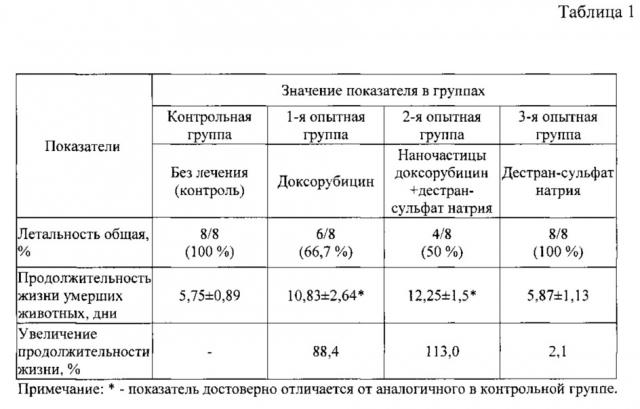
В зависимости от характера терапии животные были разделены на четыре группы: одна контрольная (8 особей) и три опытных (по 8 особей). В контрольной группе животные лечения не получали (в сроки, соответствовавшие инъекции химиопрепарата, внутрибрюшинно вводился изотонический раствор хлорида натрия в объеме 1,0 мл). В 1-й опытной группе вводили доксорубицин в дозе 4 мг/кг, во 2-й - наночастицы декстран-сульфата натрия с доксорубицином (4 мг/кг в пересчете на доксорубицин), в 3-й - декстран-сульфат натрия в дозе 14 мг/кг. Данная доза соответствует дозе декстран-сульфата натрия во 2-й группе. Препараты вводили внутрибрюшинно однократно на 4-е сутки после перевивки опухоли.
Для оценки противоопухолевой активности оценивали общую летальность и увеличение продолжительности жизни (УПЖ) павших животных. УПЖ рассчитывали по формуле
УПЖ=(CПЖo-СПЖк)/СПЖк*100;
где СПЖо и СПЖк - соответственно средняя продолжительность жизни крыс опытной и контрольной групп.
Данные о противоопухолевой активности исследуемых химиопрепаратов представлены в табл. 1. В контрольной группе животных частота успешной трансплантации опухоли составила 100%, все животные погибли при явлениях опухолевой интоксикации на 5-7 сутки после перевивки опухоли. Доксорубицин, вводимый внутрибрюшинно в виде водного раствора в дозе 4 мг/кг, проявил определенный эффект у всех животных, причем у 2 крыс (в 25% случаев) произошла полная редукция опухоли, 6 животных (75%) погибло на 8-12 сутки после трансплантации. У умерших животных зарегистрировано УПЖ до момента гибели на 88,4%. Причиной смерти во всех случаях явилось прогрессирование опухолевого процесса. Доксорубицин, ассоцированный с декстран-сульфатом натрия (2-я опытная группа), в аналогичной дозе обладал более выраженным противоопухолевым эффектом. Частота излечения составила 50%, продолжительность жизни животных с неизлеченной гепатомой была на 113% больше, чем в контрольной группе. В группе животных, получавших декстран-сульфат натрия, отмечалась 100%-ная летальность, продолжительность жизни достоверно не отличалась от контрольной группы. На фиг. 3 представлены кривые выживаемости животных на фоне исследованных схем химиотерапии.
По сравнению с известным решением, предлагаемое позволяет повысить противоопухолевую активность химиопрепарата в тканях за счет применения биодеградируемого полимера, разрушающегося ферментом амилазой - декстрана сульфат натрия в виде стабильных наночастиц. Полученный противоопухолевый препарат представляет собой сферические глобулы размером от 250 до 400 нм.
Источники информации
1. Naohiro Tornita, Nariaki Matsuura, Akira Horii, Mitsuru Emi, Takahiro Nishide, Michio Ogawa, Takesada Mori, Osamu Doi, and Kenichi Matsubara. Expression of a-Amylase in Human Lung Cancers // Cancer Research. 1988, no. 48 (1), pp. 3292-6.
2. Zakrezewska I., Pietrynczak M. The activity of alpha-amylase and its salivary isoenzymes in serum and urine of patients with neoplastic diseases of female reproductive organs // Rocz. Akad. Med. Bialymst. 1996, no. 41, pp. 492-8.
3. Jie Zhang, Lixia Zhang, Shiyang Pan, Bing Gu, Yuping Zhen, Jiabin Yan, Yiqin Zhou. Amylase: sensitive tumor marker for amylase-producing lung adenocarcinoma // Journal of Thoracic Disease. 2013, no. 5 (4), pp. 167-169.
4. Yanagitani N., Kaira K., Sunaga N. et al. Serum amylase is a sensitive tumor marker for amylase-producing small cell lung cancer? // Int. Journal Clin Oncol. 2007, no. 12, pp. 231-3.
5. Swiech O., Mieczkowska A., Chmurski K., Bilewicz R. Intermolecular Interactions between Doxorubicin and |3-Cyclodextrin 4-Methoxyphenol Conjugates // Journal Phys. Chem. B. 2012. no. 116, pp. 1765-1771.
Противоопухолевый химиопрепарат, представляющий собой стабильные наночастицы в виде сферических глобул размером 250-400 нм, включающий цитостатик и биодеградируемый полимер, отличающийся тем, что в качестве цитостатика используют доксорубицин, в качестве биодеградируемого полимера - декстран-сульфат натрия, при следующем соотношении компонентов, мас.%:
| Доксорубицин | 20,5-25,3 |
| Декстран-сульфат натрия | остальное |