Новые диспиро-индолиноны, ингибиторы mdm2/p53 взаимодействия, способ получения и применения
Иллюстрации
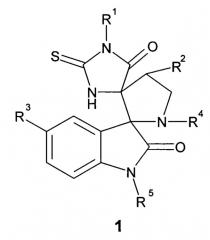
Показать всеИзобретение относится к области органической химии, а именно к новым производным диспиро-индолинонам формулы 1 или к их фармацевтически приемлемым солям, или оптическим изомерам, где R1 выбран из группы, включающей фенил, возможно замещенный 1-2 заместителями, выбранными из атома галогена, низшей алкокси-группы; R2 выбран из группы, включающей атом водорода, незамещенный пиридил или фенил, возможно замещенный заместителем, выбранным из атома галогена, низшей алкокси-группы, C1-С6алкила или -O-С5циклоалкила; R3 выбран из группы, включающей атом галогена или водорода; R4 представляет собой C1-С5алкил; R5 выбран из группы, включающей атом водорода, метил или пропаргил НС≡С-СН2-. Также изобретение относится к активному компоненту на основе соединения формулы 1, фармацевтической композиции на основе указанного активного компонента, лекарственному средству на основе указанного активного компонента или фармацевтической композиции, способу ингибирования белок-белкового взаимодействия MDM2/p53. Технический результат: получены новые производные диспиро-индолинона, полезные при лечении онкологического заболевания. 5 н. и 5 з.п. ф-лы, 1 табл., 15 пр.
Реферат
Настоящее изобретение относится к области органической и медицинской химии, а также молекулярной биологии и касается способа получения нового класса биологически активных веществ - ингибиторов белок-белкового взаимодействия MDM2/p53, которые могут быть использованы в качестве активных компонентов для фармацевтических композиций и лекарственных средств для лечения онкологических заболеваний.
Последние несколько лет наблюдается повышенный интерес к поиску непептидных низкомолекулярных соединений способных препятствовать взаимодействию клеточных белков p53-MDM2. Белок р53 является опухолевым супрессором, играющим важную роль в жизненном цикле клетки и апоптозе, a MDM2 d - его эндогенный ингибитор [Wu X., Bayle J.Н., Olson D., Levine A.J., Genes DeW., 1993, 7, 1126; Vogelstein В., Lane D., Levine A.J., Nature, 2000, 408, 307]. Если блокировать взаимодействие этих белков, то высвобождающийся р53 активирует процесс разрушения опухоли, что является новым направлением в терапии раковых заболеваний.
Путем рентгеноструктурного анализа [Hussie P.Н., Gorina S., Marechal V., Elenbaas B., Moreau J., Levine A.J., PavletichN. P., Science, 1996,274, 948] установлена структурная основа взаимодействия белков p53-MDM2, осуществляющаяся в первую очередь за счет трех гидрофобных остатков из R-спирали в Р53 и небольшого, но глубокого кармана в MDM2, являющегося, по-видимому, наиболее важным участком для связывания. На основе in silico рассчитанного строения мишени произведена разработка соединений, ингибирующих MDM2.
Алкалоиды спиро-оксиндольного типа были впервые выделенные из растений семейств Аросупасеае и Rubiacae [Galliford, С.V.; Scheidt, К.A. Angew. Chem. Int. Ed. 2007, 46, 8748]. Ключевой особенностью этих соединений является наличие индолинонового спиросодержащего фрагмента с различными заместителями в фрагментах пирролидина и индолинона.
Так, известны соединения A1 (Sanofi), RD-37 (University of California) со значением IC50=124 нМ на клетках LNCaP, А2 (University of Debrecen) со значением IC50<1 мМ на клетках Hep G2, A3 (Johnson & Johnson).
Известные биологически активные производные 2-тиогидантоинов являются гетероциклическими соединениями с многообещающей противоопухолевой активностью [Jung, М.Е.; Ouk, S.; Yoo, D.; Sawyers, С.L.; Chen, С; Tran, С; Wongvipat, J.J. Med. Chem. 2010, 53, 2779], [Sawyers, C.L. U.S. Patent 8658681B2, 2014]. Эти соединения также могут быть использованы в качестве удобных отправных точек или промежуточных продуктов в синтезе широкого спектра структурно различных природных продуктов [Lanman, В.А.; Overman, L.Е.; Paulini, R.; White, N.S. J. Am. Chem. Soc. 2007, 129, 12896].
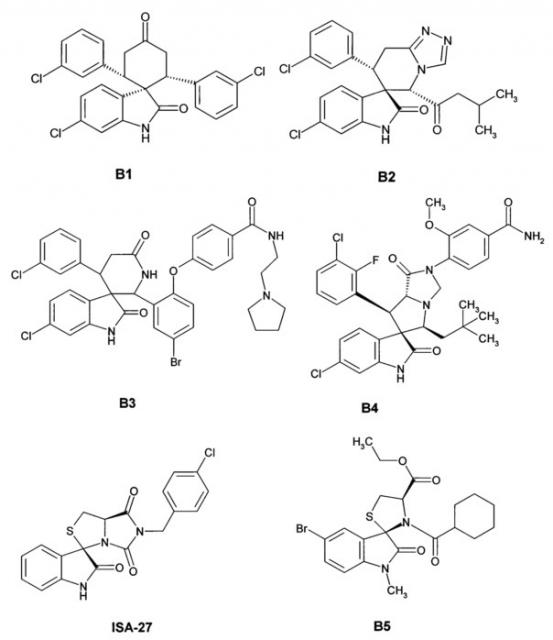
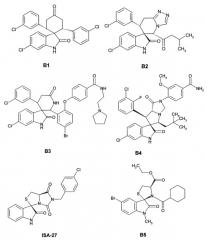
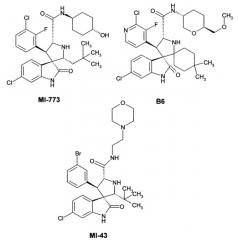
Наиболее близкими аналогами изобретения являются ряд спиро-индолинонов с перспективной противоопухолевой активностью (например, B1-В6). Эти соединения были представлены как высокоактивные ингибиторы белок-белкового взаимодействия (PPI) MDM2/p53. Некоторые из них, например, MI-43 или ISA-27, в настоящее время проходят доклинические испытания [Gomez-Monterrey, I.; Bertamino, A.; Porta, A.; et al. J. Med. Chem. 2010, 53, 8319]. MI-773 в настоящее время находится в Фазе I клинических испытаний против рака [http://clinicaltrials.gov/show/NCT01636479].
Также, Daiichi Sankyo сообщает о высоко активных ингибиторах белок-белкового взаимодействия MDM2/p53 со значениями IC50 в диапазоне от 24.1 нМ до 181 мкМ [Zhao, Y.; Liu, L.; Sun, W.; et al. J. Am. Chem. Soc. 2013,135, 7223]. Диспиро аналоги среди данных соединений описаны более слабо и включают арил-замещенный (3"R)-4,4-диметилдиспиро[циклогексан-1,2'-пирролидин-3',3ʺ-индол]-2ʺ(1ʺH)-он В6 [Sugimoto, Y. U.S. 20130165424A9, 2012]. Эти агенты ингибируют белок-белковое взаимодействие MDM2/p53 со значениями IC50 в диапазоне 0.001-0.05 мкМ и являются наиболее близкими структурными аналогами.
Основными недостатками имеющихся в литературе аналогов соединений являются трудоемкий путь синтеза данных соединений, и как следствие, дороговизна препаратов, а также отсутствие систематических исследований их биологической активности и данных по соотношению "структура-свойство".
Авторами данного изобретения был проведен синтез разнообразных гетероциклических диспиро соединений [Yan A. Ivanenkov, et al. Bioorganic & Medicinal Chemistry Letters, Vol. 25, Issue 2, 15 January 2015, Pages 404-409], а также биологические испытания этих соединений в экспериментах с клеточными линиями HepG2, Hek, MCF-7, SiHa, HCT p53(+,+) и HCT р53(-,-).
В результате была обнаружена серия новых веществ, обладающих выраженной активностью по отношению к клеточным линиям, экспрессирующим р53. Были найдены новые производные 2-тиоксо-тетрагидро-4Н-имидазол-4-онов в виде оснований и фармакологически приемлемых солей и гидратов, обладающие свойствами низкомолекулярных ингибиторов белок-белкового взаимодействия MDM2/p53.
Целью настоящего изобретения является создание новых низкомолекулярных ингибиторов белок-белкового взаимодействия MDM2/p53.
Известно, что применяемые ингибиторы белок-белкового взаимодействия р53-MDM2 в экспериментах на аналогичных клеточных линиях показывают худшую активность [Zhao, Y.; Liu, L.; Sun, W.; Lu, J.; McEachern, D.; Li, X.; Yu, S.; Bernard, D.; Ochsenbein, P.; Ferey, V.; Carry, J.-C; Deschamps, J.R.; Sun, D.; Wang, S. Diastereomeric spirooxindoles as highly potent and efficacious MDM2 inhibitors. J. Am. Chem. Soc. 2013, 135, 7223-7734], однако в настоящее время они проходят дальнейшие клинические испытания в терапии онкологических заболеваний, что свидетельствует о перспективности исследуемых в настоящей заявке ингибиторов.
Техническим результатом является улучшенный способ получения новых соединений, их выраженная активность ингибиторов белок-белкового взаимодействия MDM2/p53, низкая токсичность и улучшенная биодоступность.
Поставленная цель и технический результат достигаются новыми диспиро-индолинонами общей формулы 1, или их фармацевтически приемлемыми солями, или оптическими изомерами.
Предметом настоящего изобретения является соединение, представляющее собой диспиро-индолинон общей формулы 1, или его фармацевтически приемлемая соль, или оптический изомер,
где
R1 выбран из группы, включающей фенил, возможно замещенный 1-2 заместителями, выбранными из атома галогена, низшей алкокси-группы;
R2 выбран из группы, включающей атом водорода, незамещенный пиридил или фенил, возможно замещенный заместителем, выбранным из атома галогена, низшей алкокси-группы, C1-С6алкила или -О-С5циклоалкила;
R3 выбран из группы, включающей атом галогена или водорода;
R4 представляет собой С1-С5алкил;
R5 выбран из группы, включающей атом водорода, метил или пропаргил НС≡С-СН2-.
Более предпочтительным является соединение, отличающееся тем, что заместитель R1 выбран из группы, включающей фенил С6Н5-, 4-этоксифенил 4-С2Н5О-С6Н4-, 2-хлорфенил 2-Cl-С6Н4-, 4-хлорфенил 4-Cl-С6Н4-, 4-фторфенил 4-F-C6H4-, 4-метоксифенил 4-СН3О-C6H4-.
Более предпочтительным является соединение, отличающееся тем, что заместитель R2 выбран из группы, включающей фенил C6H5-, 4-этоксифенил 4-С2Н5О-С6Н4-, 2-хлорфенил 2-Cl-C6H4-, 4-хлорфенил 4-Cl-C6H4-, 4-этилфенил 4-С2Н5-С6Н4-, 4-метоксифенил 4-СН3О-С6Н4-, 4-фторфенил 4-F-C6H4-, 4-бромфенил 4-Br-С6Н4-, 4-изопропилоксифенил 4-(iC3H7)O-С6Н4-, пиридил, 3-хлорфенил 3-Cl-С6Н4-, 2-бромфенил 2-Br-С6Н4-.
Более предпочтительным является соединение, отличающееся тем, что заместитель R3 выбран из группы включающей атом фтора, хлора, брома или водорода.
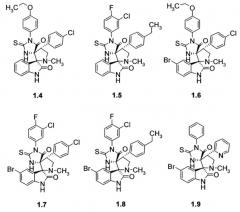
Более предпочтительным является соединение, выбранное из группы, включающей
(2ʺS,4R,4'R)-1-(3-хлор-4-фторфенил)-4'-(4-изопропилоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.1), (2ʺS,4R,4'R)-1-(3-хлор-4-фторфенил)-4'-(4-хлорфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.2), (2ʺS,4R,4'R)-5ʺ-бром-1-(3-хлор-4-фторфенил)-4'-(4-изопропилоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.3), (2ʺS,4R,4'R)-4'-(4-хлорфенил)-1-(4-этоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.4), (2ʺS,4R,4'R)-1-(3-хлор-4-фторфенил)-4'-(4-этилфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.5), (2ʺS,4R,4'R)-5ʺ-бром-4'-(4-хлорфенил)-1-(4-этоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.6), (2ʺS,4R,4'R)-5ʺ-бром-1-(3-хлор-4-фторфенил)-4'-(4-хлорфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.7), (2ʺS,4R,4'R)-5ʺ-бром-1-(3-хлор-4-фторфенил)-4'-(4-этилфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.8) и (2ʺS,4R,4'R)-5ʺ-бром-1'-метил-1-фенил-4'-пиридин-2-ил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-дион (1.9).
Предметом данного изобретения является активный компонент, обладающий свойством ингибитора белок-белкового взаимодействия MDM2/p53, представляющее собой соединение общей формулы 1.
Предметом данного изобретения также является фармацевтическая композиция для профилактики и лечения онкологического заболевания, связанного с белок-белковым взаимодействием MDM2/p53, включающая в качестве лекарственного начала соединения общей формулы 1, или их фармацевтически приемлемые соли и/или гидраты, в терапевтически эффективном количестве или содержащая в эффективном количестве активный компонент по настоящему изобретению.
Более предпочтительной является фармацевтическая композиция, где онкологическое заболевание представляет собой рак простаты.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемым эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с соединением общей формулы 1, или его фармацевтически приемлемой солью и/или гидратом по настоящему изобретению, может включать и другие активные субстанции, в том числе обладающие противоопухолевой активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтических композиций по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом данного изобретения является лекарственное средство для профилактики и лечения пролиферативных заболеваний, связанных с белок-белковым взаимодействием MDM2/p53, в виде таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащее в эффективном количестве активный компонент или фармацевтическую композицию по настоящему изобретению.
В соответствии с данным изобретением способ профилактики или лечения пролиферативных заболеваний, связанных с белок-белковым взаимодействием MDM2/p53 у животных и людей заключается во введении пациенту нового лекарственного средства или новой фармацевтической композиции.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка средства, содержащего соединение общей формулы общей формулы 1, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно - 50~300 мг. Поэтому во время приготовления из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг средства общей формулы 1 предпочтительно - 50~300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Предметом данного изобретения является также способ ингибирования белок-белкового взаимодействия MDM2/p53, включающий стадию введения в клетку соединения общей формулы 1 по настоящему изобретению.
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«IC50» (ПК50) - концентрация соединения, при которой наблюдается 50% ингибирование ферментативной активности
«Алифатический заместитель» (алкил, алкенил, алкинил) означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи, необязательно содержащий двойную или тройную связь. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Алкил, алкенил, алкинил могут иметь один или несколько одинаковых или различных заместителей («алкильных заместителей») включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбнил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или , , где и независимо друг от друга представляют собой «заместители аминогруппы», например, атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или и вместе с атомом N, с которым они связаны, образуют через и 4-7 членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил метоксикарбонилметил и пиридилметилоксикарбнилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или , аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
Предпочтительными алкильными группами в данном изобретении являются аллил, циклопропил, циклогексил и 4-этилморфолин.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с ароматической и неароматической циклической системой или гетероциклом, включая арил, ароил, аралкокси, арилгидрокси, арилокси, арилоксикарбонил, аралкилтио, арилсульфонил, арилгалоген, гетероарил гетероциклил, гетероаралкилокси, гетероарилтио, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или , , где и независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе.
Предпочтительными арильными группами в данном изобретении являются фенил C6H5-, 3-хлор-4-фторфенил 3-Cl-4-F-C6H3-, 4-этоксифенил 4-С2Н5О-С6Н4-, 3-хлор-4-этоксифенил 3-Cl-4-C2H5O-C6H3-, 2-хлорфенил 2-Cl-C6H4-, 4-хлорфенил 4-Cl-C6H4-, 4-этилфенил 4-С2Н5-С6Н4-, 3,4-диметоксифенил 3,4-ОМе-C6H3-,4-метоксифенил 4-СН3О-C6H4-, 4-фторфенил 4-F-C6H4-, 4-бромфенил 4-Br-C6H4-, 4-пропилоксифенил 4-0(iC3H7)C6H4, циклопентоксибензил.
«Белок-белковое взаимодействие» означает установление связей между белками р53 и MDM2 в результате их взаимодействий за счет электростатических, гидрофобных или гидрофильных контактов.
«Галоген» означает фтор, хлор, бром и йод. Предпочтительными являются фтор, хлор и бром.
«Гетероциклил» (гетероциклический заместитель) означает ароматическую или неароматическую насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 5 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера. Приставка «аза», «окса» или «тиа» перед гетероциклилом означает наличие в циклической системе, атома азота, атома кислорода или атома серы, соответственно. Гетероциклил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидин, пирролидин, пиперазин, морфолин, тиоморфолин, тиазолидин, 1,4-диоксан, тетрагидрофуран, тетрагидротиофен, гетероаралкил, гетероциклил или гетероарил, или и вместе с атомом N, с которым они связаны, образуют через и 4-7 членный гетероцикл.
Предпочтительной гетероциклической группой в данном изобретении является пиридин.
«Гидрат» означает сольват, в котором вода является молекулой или молекулами растворителя.
«Заместитель» означает химический радикал который присоединяется к скэффолду (фрагменту), например, «заместитель алкильный», «заместитель амино группы», «заместитель карбамоильный», «заместитель циклической системы», значения которых определен в данном разделе.
«Лекарственное начало» (активный компонент, лекарственная субстанция лекарственное вещество, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции), в виде таблеток, капсул, инъекций, мазей и др. готовых форм предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя соединение формулы 1 и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлимых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как, холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
«Циклоалкил» означает неароматическую моно- или полициклическую систему, включающую от 3 до 10 атомов углерода. Циклоалкил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями циклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклогексил, декалин, адамант-1-ил и т.п. Циклоалкил может быть аннелирован с ароматическим циклом или гетероциклом.
Представленные ниже примеры иллюстрируют, но не ограничивают настоящее изобретение.
Соединения 1.1-1.9 по настоящему изобретению в Примерах 1-9 получают по способу, приведенному авторами настоящего изобретения в статье [Yan A. Ivanenkov, et al. Bioorganic & Medicinal Chemistry Letters, Vol. 25, Issue 2, 15 January 2015, Pages 404-409].
Пример 1. Получение (2ʺS,4R,4'R)-1-(3-хлор-4-фторфенил)-4'-(4-изопропилоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.1).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,092 г (0,6 ммоль) изотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 39.8%. Тпл=271°C.
1Н NMR (400 MHz, DMSO-d6), δ, ppm (J, Hz): 1.25 (s, 3H, CH3,i-C3H7), 1.27 (s, 3H, CH3,i-C3H7), 2.14 (s, 3H, NCH3), 3.43 (t, J=8.7 Hz, 1H, CH-H), 3.95 (t, J=9.4 Hz, 1H, CH), 4.27 (t, J=9.3 Hz, 1H, CH-H), 4.61 (m, 1H, CH, i-C3H7), 6.68 (m, 1H, ArH), 6.78 (m, 1H, ArH), 6.87 (m, 3H, ArH), 7.01 (t, J=7.6 Hz, 1H, ArH), 7.31-7.37 (m, 4H, ArH), 7.46 (t, J=8.9 Hz, 1H, ArH), 10.34 (s, 1H, NH), 10.66 (s, 1H, NH). Найдено, %: С 60.93; H 4.23; N 9.34. C29H26ClFN4O3S. Вычислено, %: С 61.64; Н 4.64; N 9.92.
Пример 2. Получение (2ʺS,4R,4'R)-1-(3-хлор-4-фторфенил)-4'-(4-хлорфенил)-1’-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.2).
Смесь 0,25 г (0,6 ммоль) соответствующего тиогидантоина, 0,092 г (0,6 ммоль) изотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 48.6%. Тпл=197°C.
1Н NMR (400 MHz, DMSO-d6), δ, ppm {J, Hz): 2.14 (s, 3H, NCH3), 3.48 (t, J=8.6 Hz, 1H, CH-H), 3.99 (t, J=9.0 Hz, 1H, CH), 4.31 (t, J=9.0 Hz, 1H, CH-H), 6.68 (m, 1H, ArH), 6.86 (m, 2H, ArH), 7.0 (t, J=7.7 Hz, 1H, ArH), 7.26 (d, J=7.3 Hz, 1H, ArH), 7.32 (t, J=7.7 Hz, 1H, ArH), 7.41-7.52 (m, 5H, ArH), 10.44 (s, 1H, NH), 10.70 (s, 1H, NH). Найдено, %: С 58.11; H 3.24; N 10.95. C26H19BCl2FN4O2S. Рассчитано, %: С 57.68; Н 3.54; N 10.35.
Пример 3. Получение (2ʺS,4R,4'R)-5ʺ-бром-1-(3-хлор-4-фторфенил)-4'-(4-изопропилоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.3).
Смесь 0,25 г (0,7 ммоль) соответствующего тиогидантоина, 0,16 г (0,6 ммоль) 5-бромизотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов Т.к. на ТСХ оставалось пятно исходного тиогидантоина, был добавлен еще один эквивалент изотина и аминокислоты. Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 46.5% Тпл=267°C.
1Н NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 1.25 (s, 6H, 2CH3,i-C3H7), 2.16 (s, 3H, NCH3), 3.46 (t, J=8.7 Hz, 1H, CH-H), 3.91 (t, J=9.4 Hz, 1H, CH), 4.25 (t, J=9.2 Hz, 1H, CH-H), 4.60 (m, 1H, CH, i-C3H7), 6.72-6.93 (m, 5H, ArH), 7.28-7.61 (m, 5H, ArH), 10.57 (s,lH, NH), 10.79 (s, 1H, NH). Найдено, %: С 54.73; H 3.21; N 8.38. C29H25BrClFN4O3S. Рассчитано, %: С 54.09; Н 3.91; N 8.70.
Пример 4. Получение (2ʺS,4R,4'R)-4'-(4-хлорфенил)-1-(4-этоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.4).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,092 г (0,6 ммоль) изотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 61.9%. Тпл=210°C.
1Н NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 1.31 (t, 3H, CH3), 2.14 (s, 3H, NCH3), 3.46 (t, J=8.6 Hz, 1H, CH-H), 3.94-4.05 (m, 3H(1H, CH, 2H, OCH2)), 4.31 (t, J=9.0 Hz, 1H, CH-H), 6.52 (d,J=8.8 Hz, 2H, ArH), 6.84-6.90 (m, 3H, ArH), 7.01 (t, J=7.6 Hz, 1H, ArH), 7.29-7.33 (m, 2H, ArH), 7.41-7.49 (dd, J=8.6 Hz, 4H, ArH) 10.12 (s, 1H, NH), 10.68 (s, 1H, NH). Найдено, %: С 62.41; H 4.82; N 9.96. C28H25ClN4O3S. Рассчитано, %: С 63.09; Н 4.73; N 10.51.
Пример 5. Получение (2ʺS,4R,4'R)-1-(3-хлор-4-фторфенил)-4'-(4-этилфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.5).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,092 г (0,6 ммоль) изотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 41.1% Тпл=315°C.
1Н NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 1.18 (t, 3H, СН3), 2.14 (s, 3H, NCH3), 2.58-2.63 (q, 2H, CH2), 3.44 (t, J=8.8 Hz, 1H, CH-H), 3.99 (t, J=9.4 Hz, 1H, CH), 4.29 (t, J=9.2 Hz, 1H, CH-H), 6.6-7.1 (m, 4H, ArH), 7.19-7.51 (m, 7H, ArH), 10.35 (s, 1H, NH), 10.68 (s, 1H, NH). Найдено, %: С 63.02; H 4.47; N 9.82. C28H24ClFN4O2S. Рассчитано, %: С 62.86; Н 4.52; N 10.47.
Пример 6. Получение (2ʺS,4R,4'R)-5ʺ-бром-4'-(4-хлорфенил)-1-(4-этоксифенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2 м,5(1ʺН)-диона (1.6).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,16 г (0,6 ммоль) 5-бромизотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Т.к. на ТСХ оставалось пятно исходного тиогидантоина, был добавлен еще один эквивалент изотина и аминокислоты. Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 89.4%. Тпл=301°C.
1H NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 1.31 (t, 3H, CH3), 2.16 (s, 3H, NCH3), 3.49 (t, J=8.7 Hz, 1H, CH-H), 3.94 (t, J=9.2 Hz, 1H, CH), 4.0-4.05 (q, J=6.9 Hz, 2H, OCH2), 4.31 (t, J=9.0 Hz, 1H, CH-H), 6.56 (d, J=8.6 Hz, 2H, ArH), 6.81 (d, J=8.3 Hz, 1H, ArH), 6.90 (d, J=8.6 Hz, 2H, ArH), 7.38-7.54 (m, 6H, ArH), 10.38 (s,lH, NH), 10.82 (s, 1H, NH). Найдено, %: С 54.47; H 3.89; N 9.27. C28H24BrClN4O3S. Вычислено, %: С 54.96; Н 3.95; N 9.16.
Пример 7. Получение (2ʺS,4R,4'R)-5ʺ-бром-1-(3-хлор-4-фторфенил)-4'-(4-хлорфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.7).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,16 г (0,6 ммоль) 5-бромизотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Т.к. на ТСХ оставалось пятно исходного тиогидантоина, был добавлен еще один эквивалент изотина и аминокислоты. Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 62.5%. Тпл=197°C.
1Н NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 2.16 (s, 3H, NCH3), 3.51 (t, J=8.7 Hz, 1H, CH-H), 3.95 (t, J=9.5 Hz, 1H, CH), 4.31 (t, J=9.0 Hz, 1H, CH-H), 6.74-6.9 (m, 3H, ArH), 7.36-7.58 (m, 7H, ArH), 10.65 (s, 1H, NH), 10.84 (s, 1H, NH). Найдено, %: С 50.21; H 3.01; N 8.96. C26H18BrCl2FN4O2S. Рассчитано, %: С 50.34; Н 2.92; N 9.03.
Пример 8. Получение (2ʺS,4R,4'R)-5ʺ-бром-1-(3-хлор-4-фторфенил)-4'-(4-этилфенил)-1'-метил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.8).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,16 г (0,6 ммоль) 5-бромизотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Т.к. на ТСХ оставалось пятно исходного тиогидантоина, был добавлен еще один эквивалент изотина и аминокислоты. Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 47.3%. Тпл=210°C.
1Н NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 1.18 (t, 3H, CH3), 2.17 (s, 3H, NCH3), 2.58-2.63 (q, J=7.6 Hz, 2H, CH2), 3.47 (t, J=8.7 Hz, 1H, CH-H), 3.96 (t, J=9.4 Hz, 1H, CH), 4.27 (t, J=9.2 Hz, 1H, CH-H), 6.72-6.8 (m, 2H, ArH), 6.84 (d, J=8.3 Hz, 1H, ArH), 7.20 (d, J=8.0 Hz, 2H, ArH), 7.38 (d, J=8.0 Hz, 2H, ArH), 7.42-7.54 (m, 3H, ArH), 10.56 (s, 1H, NH), 10.81 (s, 1Н, NH). Найдено, %: С 54.63; H 3.91; N 9.28. C28H23BrClFN4O2S. Расчитано, %: С 54.78; Н 3.78; N 9.13.
Пример 9. Получение (2ʺS,4R,4'R)-5ʺ-бром-1'-метил-1-фенил-4'-пиридин-2-ил-2-тиоксо-5Н-диспиро[имидазолидин-4,3'-пирролидин-2',3ʺ-индол]-2ʺ,5(1ʺН)-диона (1.9).
Смесь 0,24 г (0,6 ммоль) соответствующего тиогидантоина, 0,16 г (0,6 ммоль) 5-бромизотина и 0,056 г (0,6 ммоль) саркозина в метаноле кипятят в течение 5 часов (окончание реакции определяют по ТСХ). Т.к. на ТСХ оставалось пятно исходного тиогидантоина, был добавлен еще один эквивалент изотина и аминокислоты. Затем реакционную смесь ставят в холодильник, а выпавший осадок отфильтровывают и промывают небольшим количеством холодного метанола. Выход составил 34.9% Тпл=343°C.
1Н NMR (400 MHz, DMSO-d6) δ, ppm (J, Hz): 2.2 (s, 3H, NCH3), 3.61 (t, J=8.7 Hz, 1H, CH-H), 4.06 (t, J=9.4 Hz, 1H, CH), 4.55 (t, J=9.3 Hz, 1H, CH-H), 6.81 (d, J=8.3 Hz, 1H, ArH), 6.91 (d, J=6.9 Hz, 2H, ArH), 7.31 (m, 1H, ArH), 7.38-7.47 (m, 5H, ArH), 7.55 (d, J=1.8 Hz, 1H, ArH), 7.83 (t, J1=1.7, Hz, J2=1.1, Hz, 1H, ArH), 8.50 (d, J=4.2 Hz, 1H, ArH), 10.19 (s, 1H, NH), 10.72 (s, 1H, NH). Найдено, %: С 56.83; H 3.47; N 12.94. C25H20BrN5O2S. Рассчитано, %: С 56.19; Н 3.77; N 13.10.
Пример 10. Получение солей (в виде гидрохлоридов).
Для получения солей диспиро-индолинонов формулы 1 полученные соединения 1.1-1.9 растворяют в спирте, добавляют к ним насыщенный спиртовой раствор хлороводорода. После окончания реакции выпавший осадок отфильтровывают. Получают кристаллы гидрохлоридов соединений 1.1-1.9.
Пример 11. Биологические испытания.
Все представленные диспиро-индолиноны формулы 1 были протестированы на их способность блокировать клеточный рост и вызывать апоптоз на различных штаммах опухолевых клеточных линий.
Эти модели включают дифференцированные клетки гепатоцеллюлярной карциномы человека (НерС2), эмбриональные клетки почек (НЕК293), линию раковых клеток молочной железы (MCF-7), шейки матки (SiHa) и клетки рака толстой кишки (НСТ116 р53-/- и НСТ116 р53+/+), а также РСЗ и LNCap. Цитотоксичность этих вещества оценивали с помощью стандартного МТТ-теста с (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолий бромидом. Результаты биологических испытаний представлены в Таблице 1.
Как видно из данных Таблицы 1, соединение 1.2 обладает более мощным цитотоксическим действием, поскольку значения IC50 находятся в диапазоне 4.88-10.46 мкМ, однако оно не показало селективности на клеточных линиях НСТ116 р53-/- и НСТ116 р53+/+. Тем не менее, для трех соединений 1.1,1.3 и 1.6 была обнаружена избирательность и селективность действия по отношению к клеточным линиям HepG2, Hek и MCF-7, однако явились неактивными в отношении клеток SiHa.
Также, интересные результаты наблюдаются для клеточных линий РС3 и LNCap, которые способны к экспрессии р53. Для двух соединений 1.4 и 1.8, наблюдается явная селективность к этим клеточным линиям, на несколько порядков превышающая токсичность схожих аналогов. Это свидетельствует о том, что данные соединения способны ингибировать р53, содержащийся в клеточных ли